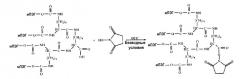
Дендример-пэг с четырьмя ветками для конъюгирования с белками и пептидами
Иллюстрации
Показать всеПолимерная дендример-подобная структура с четырьмя ветвями из монометоксиполиэтиленгликоля, которая может быть представлена как:
и использоваться для получения конъюгатов, представляющих фармацевтический интерес. Молекулярная масса каждой ПЭГ-цепи находится между 11000 и 13500 Д, а общая молекулярная масса находится между 44000 и 54000 Д. Карбоксильную группу указанной структуры можно функционально активировать для получения конъюгатов, представляющих интерес в фармацевтике. Нуклеофильная группа содержится в биомолекуле, выбранной из группы, состоящей из белков, пептидов и полипептидов. Белок выбран из группы, состоящей из интерферона альфа 2-b, стрептокиназы, гранулоцитарного колониестимулирующего фактора, эритропоэтина и эпидермального ростового фактора. Связывание этого дендример-подобного полиэтиленгликоля с терапевтическими белками улучшает их стабильность in vitro и in vivo. 2 н. и 3 з.п. ф-лы, 2 ил., 3 табл.
Реферат
Область техники
Настоящее изобретение относится к дендример-подобной полимерной структуре с четырьмя ветками из полиэтиленгликоля (ПЭГ) для получения конъюгатов, представляющих фармацевтический интерес.
Предпосылки изобретения
Хорошо известны благоприятные эффекты конъюгирования терапевтических белков с полиэтиленгликолем в отношении некоторых фармакологических свойств. Например, увеличивается время полужизни в крови благодаря различным причинам, среди которых: полимерный остаток может предотвращать атаки протеаз и распознавание лекарства иммунной системой, а существенно больший гидродинамический объем конъюгата по отношению к исходному белку значительно снижает фильтрацию через почки. Хотя во многих случаях модификация молекулами ПЭГ (ПЭГилирование) влияет на биологическую активность белка in vitro, существенное увеличение времени жизни в крови делает более эффективным его терапевтическое действие (Harris J. M. y Chess R. B. (2003) Effect of pegylation on pharmaceuticals. Nat. Rev. Drug Discov. 2:214-21).
ПЭГилирование также стерически блокирует пути деградации, вызываемые гидрофобными взаимодействиями и образует стерические неспецифические препятствия, которые уменьшают внутримолекулярные взаимодействия, вовлеченные в термическую нестабильность белков. В результате всего этого модифицированные ПЭГ белки имеют более высокую физическую стабильность, чем немодифицированные молекулы, - очень полезное свойство для разработки конечного фармацевтического препарата (Harris J. M. y Chess R. B. (2003) Effect of pegylation on pharmaceuticals. Nat. Rev. Drug Discov. 2:214-21).
Реагент, обычно используемый для конъюгирования белков, представляет собой полиэтиленгликоль, метилированный по одному из своих концов, известный как монометоксиполиэтиленгликоль (мПЭГ). То что метильная группа защищает один из концов ПЭГ-цепи, позволяет ее активацию только по одному другому концу, давая монофункциональный реагент. Это является очень важным для конъюгирования терапевтических белков, поскольку их конъюгирование с бифункциональными реагентами обычно приводит к перекрестной сшивке, которая влияет на биологическую активность белка. Молекулы мПЭГ всегда имеют небольшую фракцию неметилированного полимера, диольную фракцию. Диольная фракция присутствует в большей степени в мПЭГ с высоким молекулярным весом из-за того, что более трудно контролировать процесс полимеризации для очень длинных цепей (Roberts M. J., Bentley M. D., Harris J. M. (2002) Chemistry for peptide and protein PEGylation. Adv. Drug Deliv. Reviews 54:459-76).
Одной из первых молекул-производных ПЭГ была синтезирована в реакции с цианоген хлоридом. Но эксперименты по конъюгированию с этим реагентом вызывали излишнее ПЭГилирование. Это нежелательно для терапевтических белков, поскольку высокая степень ПЭГилирования вызывает внезапное падение биологической активности из-за прямого блокирования активных участков или топологических изменений, которые скрывают эти участки от открытой поверхности белка. Обычно желаемый конъюгат представляет собой тот, где присутствует только одна молекула ПЭГ на каждую молекулу белка; такую молекулу называют моноПЭГилированной.
В начале 1980 гг. начали использовать «более мягкие» активные группы. В основном это N-гидроксисукцинимидные эфиры, хотя также использовали и другие группы. Тремя наиболее популярными группами являются: сукцинимидил-сукцинат, трезилат и сукцинимидил-карбонат. Это поколение активированных ПЭГ известно как первое поколение (Roberts M. J., Bentley M. D., Harris J. M. (2002) Chemistry for peptide and protein PEGylation. Adv. Drug Deliv. Reviews 54:459-76).
Во второй половине 1990 гг. появилось второе поколение активированных ПЭГ. У них было два важных преимущества: группы, которые позволяли более избирательное ПЭГилирование (например: альдегидные группы, которые образуют конъюгаты предпочтительно с N-концом белков) и разветвленные структуры (Roberts M. J., Bentley M. D., Harris J. M. (2002) Chemistry for peptide and protein PEGylation. Adv. Drug Deliv. Reviews 54:459-76). Примерами разветвленных ПЭГ являются монофункциональные с двумя ветвями (US 5932462), тетрафункциональные с четырьмя ветвями и октафункциональные с восемью ветвями. Более используемые активированные ПЭГ для конъюгирования с терапевтическими белками представляют собой монофункциональные, поскольку они позволяют избежать перекрестной сшивки между белком и полимером. Разветвленные ПЭГ также имеют зонтичные структуры, которые позволяют лучшую защиту поверхности белка.
Монофункциональные ПЭГ из двух ветвей позволили получить конъюгат с интерфероном альфа 2а, который, как было показано, имел лучшие результаты в клиническом применении, чем природный белок (Rajender Reddy K., Modi M.W., Pedder S. (2002) Use of peginterferon alfa-2a (40 KD) (Pegasys) for the treatment of hepatitis C. Adv. Drug Deliv. Reviews 54:571-86).
С помощью существующей на сегодняшний день методики синтеза мПЭГ можно получить цепи размером только 30 кД, что является причиной, по которой реагенты с двумя ветвями позволяют получить молекулярные массы максимум 60 кД. Желательно иметь структуры с монофункциональным ПЭГ с более высокой молекулярной массой, что позволит исследовать более широкий диапазон конъюгатов, чтобы получить оптимальную величину у некоторых белков. Однако ни в одной из ранее описанных статей не применялся, не был охарактеризован или упомянут реагент для ПЭГилирования, который бы был монофункциональным и с более чем двумя ПЭГ-цепями. В случае если получен реагент с более чем двумя ПЭГ-цепями, можно получить конъюгаты с более высокой молекулярной массой, и в дополнение к ранее упомянутому преимуществу это может позволить использовать более короткие линейные цепи мПЭГ для создания реагентов для ПЭГилирования с молекулярной массой, похожей на структуры с двумя цепями. Эти ветви меньшего размера будут иметь меньшую диольную фракцию, делая процесс синтеза легче.
Описание изобретения
Настоящее изобретение решает упомянутую выше проблему, предоставляя монофункциональную дендример-подобную структуру, которая имеет 4 ветви мПЭГ. Эта структура позволяет получать конъюгаты с полимерными остатками до 120 кД. Этот факт позволяет исследовать конъюгаты с большими вариациями молекулярных масс, включая высокомолекулярные. Более того, с использованием этого подхода могут быть получены молекулы ПЭГ с молекулярной массой, похожей на молекулярную массу других разветвленных монофункциональных реагентов, но с более низкомолекулярными линейными цепями.
В предпочтительном варианте настоящего изобретения получена полимерная структура, где молекулярная масса ПЭГ-цепи находится между 5000 и 30000 Д и общая молекулярная масса находится между 20000 и 120000 Д.
Использование низкомолекулярный линейных цепей позволило практически полностью устранить диольное загрязнение, типичное для более крупных линейных молекул ПЭГ. Неожиданно, но конъюгаты со структурой, предложенной авторами, имели намного более высокую физико-химическую стабильность (устойчивость к высоким температурам и деградации протеазами), чем конъюгаты с похожей молекулярной массой, но полученными со структурами из только двух цепей. Также неожиданно они имели более высокое время жизни в крови. Другим неожиданным результатом являлся тот, что конъюгаты с предложенной авторами дендример-подобной структурой были более гомогенными с меньшим количеством позиционных изомеров, чем те, что были получены с конъюгатами с похожей молекулярной массой, но только с двумя цепями.
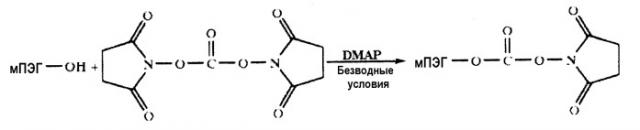
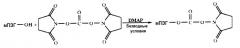
Дендример-подобный с четырьмя ветвями монофункциональный ПЭГ получают в двух основных стадиях. Первая стадия представляет собой синтез производных с двумя ветвями путем соединения двух молекул ПЭГ с ядром, которым может быть, например, лизин. Похожий процесс использовался другими авторами с хорошими результатами (US 5932462). Вторая стадия представляет собой объединение двух молекул производных с двумя ветвями с ядром, аналогичным предыдущему, чтобы получить производные с четырьмя ветвями. Для того чтобы объединить две линейные ПЭГ-ветви с ядром в первой стадии, они должны иметь активную группу. Эту группу можно выбрать из ряда известных в данной области. Например, сукцинимидилсукцинат, сукцинимидилкарбонат, п-нитрофенилкарбонат, сукцинимидилпропионат, сукцинимидилбутаноат среди других. Предпочтительный линейный активированный ПЭГ в настоящем изобретении представляет собой сукцинимидилкарбонат. Это так из-за главных различных причин: хорошего выхода реакции между этим реагентом и ядрами с свободными аминогруппами и легкости способа получения этого реакционно-способного ПЭГ. Способ этого синтеза (Mirоn T., Wilchek M. (1993) A Simplified Method for the Preparation of Succinimidyl Carbonate Polyethylene Glycol for Coupling to Proteins. Bioconjugate Chem. 4:568-69) известен работающим в данной области:
Как только получен линейный активированный ПЭГ, первая стадия легко выполняется путем введения его в реакцию с молекулой, выбранной в качестве ядра. В предпочтительном варианте осуществления этого изобретения ядро представляет собой L-лизин из-за его биологически совместимой природы, с двумя свободными аминогруппами и карбоксильной группой, которую можно использовать позже для активации.
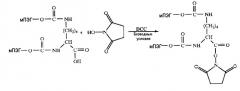
Производные с двумя ветвями легко очистить из реакционной смеси хроматографическими методами. Это производное с двумя ветвями активируют для последующей реакции с молекулой ядра и синтеза производного с четырьмя ветвями. Этот продукт может быть активирован различными путями, но предпочтительным благодаря его эффективности и легкости является образование N-гидроксисукцинимидного эфира.
Эту методику успешно применяли для активации карбоксильных групп со структурами, содержащими ПЭГ-цепи, как N-гидроксисукцинимидный эфир (US 4732863 и US 5932462).
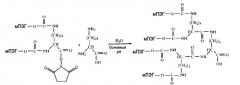
Вторая стадия получения производного с четырьмя ветвями состоит из реакции производного с двумя ветвями с ядерной молекулой, где так же, как и в первой стадии этого изобретения, предпочтительный вариант осуществления этого изобретения представляет собой L-лизин в качестве ядра.
Представляющее интерес производное легко очищается из реакционной смеси при помощи хроматографических методов.
Эту дендример-подобную молекулу ПЭГ можно активировать с использованием различных реакционно-способных групп для соединения ее с белками. Любые из функциональных групп, используемых для активации других ПЭГ-структур, можно использовать для дендример-подобных ПЭГ, описанных в этом патенте. Некоторые примеры этих групп представляют собой: N-гидроксисукцинимидные эфиры, сукцинимидил-карбонат, различные типы альдегидов, малеимиды и т.д. Другие типы групп, позволяющих соединение этой структуры с белками, представляют собой хелатирующие группы нитрилоацетата (NTA), который может образовывать соединение с остатками гистидина, присутствующими в пептидном скелете, через переходный металл. Выбор реакционной группы будет зависеть от белка, к которому желательно присоединить молекулу ПЭГ.
Например, если предпочтительно соединение со свободными аминогруппами, то дендример-подобный полимер можно активировать как N-гидроксисукцинимидный эфир. N-гидроксисукцинимидный эфир, таким образом, получают как осуществление на практике этого изобретения, следуя той же методике, которая описана для активации структуры с двумя ветвями на стадии 1.
Конъюгирование белка с активированным ПЭГ происходит в соответствующем буферном растворе. Характеристики буферного раствора зависят среди других факторов от функциональной группы полимера и предмета конъюгирования. Если желательно конъюгирование свободных аминогрупп с функционально-активным ПЭГ в качестве N-гидроксисукцинимидного эфира, участки конъюгирования можно предсказать до определенной степени, используя предопределенный рН. Значение рН около 9 будет способствовать конъюгированию через ε-аминогруппы лизинов.
Другим примером является то, что в конъюгировании с альдегидами сильно кислотный рН позволяет, чтобы ПЭГилирование происходило предпочтительно на N-конце белка. Последующую очистку представляющего интерес конъюгата можно провести при помощи различных хроматографических методик.
В практическом осуществлении изобретения описаны конъюгаты, где нуклеофильная группа содержится в биомолекуле, выбранной из группы, состоящей из белков, пептидов и полипептидов.
Некоторые химические, физические и биологические свойства конъюгатов должны быть проанализированы для достижения наиболее полной характеристики очищенного конъюгата. Например, концентрация конъюгата может быть обычно определена посредством УФ-спектроскопии (поглощение при 280 нм), поскольку ПЭГ-остаток практически не влияет на коэффициент поглощения белка. Чистота очищенного продукта должна быть определена предпочтительно посредством электрофореза в додецилсульфат натриевом полиакриламидном геле (ДСН-ПААГ), поскольку методы хроматографии могут плохо разделять сигналы, соответствующие представляющему интерес конъюгату и примесям. Другие физико-химические свойства можно изучить при помощи обычных методов.
Как результат данной работы, предпочтительное выполнение на практике этого изобретения описывает получение конъюгатов, где белок выбран из группы, состоящей из интерферон альфа 2b, стрептокиназы, гранулоцитарного колониестимулирующего фактора, эритропоэтина и эпидермального фактора роста.
Краткое описание фигур
Фиг.1. Защита против деградации протеазами. На оси Х представлено время в часах, а на оси Y - количество недеградированного белка, представленного в процентах от количества в нулевой временной точке.
Фиг.2. Температурная устойчивость. На оси Х представлено время в днях, а на оси Y - количество недеградированного белка, представленного в процентах от количества в нулевой временной точке.
Подробное описание видов получения/Примеры
Пример 1
Синтез ПЭГ, активированного как N-гидроксисукцинимидный эфир
Получение структуры и активация
Получение сукцинимидилкарбоната монометоксиполиэтиленгликоля (СК-ПЭГ)
Пятнадцать грамм монометоксиполиэтиленгликоля с молекулярной массой 12000 Д (мПЭГ12К) растворили в 500 мл толуола и азеотропно высушили в течение 3 часов. После этого времени объем уменьшился до 250 мл, и смесь остудили до комнатной температуры. К раствору добавили следующие реагенты: 60 мл сухого дихлорметана, 2 г дисукцинимидилкарбоната (DSC), растворенного в 15 мл сухого ацетона, и 1 г диметиламинопиридина, растворенного в 10 мл 3:1 смеси толуол:DCM. Реакцию проводили в течение ночи (16 ч) при перемешивании. Реакционную смесь осаждали 1 л холодного диэтилового эфира, и осадок собирали фильтрованием. Этот продукт перекристаллизовали три раза, растворяя в ацетоне и осаждая диэтиловым эфиром. Конечный продукт высушивали под высоким вакуумом и хранили под азотом при -20°С. Конечный выход реакции был выше 90%. Фракцию активированного ПЭГ определяли посредством реакции с глицил-глицином и количественным определением свободных аминогрупп посредством реакции с TNBS.
Получение биПЭГилированного лизина (Lys-2ПЭГ)
Двенадцать грамм СК-ПЭГ12К вводили в реакцию с 46 мг L-(+)-лизина, растворенного при концентрации 0,2 мг/мл в 100 мМ боратном буфере, рН 8,5. Реакция происходила при комнатной температуре, при перемешивании в течение 16 часов. После этого времени реакционную смесь разводили в 5 раз в бидистиллированной воде и подводили рН соляной кислотой. Экстрагировали ПЭГ три раза одним объемом DCM. Объединенные три экстракционные фракции высушивали над безводным сульфатом натрия и фильтровали. Раствор ПЭГ в DCM концентрировали до 20 мл на роторном испарителе. Концентрат осаждали 120 мл холодного диэтилового эфира, собирали фильтрованием и высушивали под высоким вакуумом. Lys-2ПЭГ отделяли от оставшихся компонентов реакционной смеси посредством ионообменной хроматографии на DEAE-сефарозе.
Колонку, содержащую 1 литр хроматографического носителя, уравновешивали 3 объемами 100 мМ раствора боратного буфера при рН 7,5 и затем промывали 5 объемами бидистиллированной воды. Наносили десять граммов реакционной смеси, растворенной в бидистиллированной воде при концентрации 5 мг/мл. Непрореагировавший ПЭГ удаляли, промывая колонку двумя объемами бидистиллированной воды, и элюировали Lys-2ПЭГ 1 мМ раствором хлорида натрия. рН этой фракции подводили до 3 соляной кислотой и экстрагировали три раза одним объемом DCM. Объединенные три экстракционные фракции высушивали над безводным сульфатом натрия и затем фильтровали. Раствор ПЭГ в DCM концентрировали до 10 мл в роторном испарителе. Концентрат осаждали 60 мл холодного диэтилового эфира, отделяли фильтрованием и высушивали под высоким вакуумом. Степень чистоты определяли при помощи ДСН-ПААГ, окрашивания геля 5% раствором хлорида бария и 100 мМ йодом. Молекулярная масса, определенная посредством MALDI-TOF, была 23,0-24,5 кД. Общий выход метода был выше чем 40%.
Активация биПЭГилированного лизина как N-гидроксисукцинимидного эфира (ПЭГ 2,12К -NHS)
Шесть граммов Lys-2ПЭГ растворили в 20 мл сухого DCM и добавили 60 мг N-гидроксисукцинимида и 250 мг N,N'-дициклогексилкарбодиимида (DCC). Реакцию перемешивали в течение 24 часов при комнатной температуре. Смесь фильтровали и концентрировали на роторном испарителе до 5 мл. Продукт осаждали 20 мл холодного диэтилового эфира и кристаллизовали три раза, растворяя в ацетоне и осаждая диэтиловым эфиром. Конечный продукт высушивали под высоким вакуумом и хранили под азотом при -20°С. Общий выход метода был выше чем 95%. Фракцию активированного ПЭГ определяли посредством реакции с глицил-глицином, а число аминогрупп количественно определяли посредством реакции с TNBS.
Получение дендример-подобного ПЭГ с четырьмя ветвями
Пять граммов ПЭГ2,12К-NHS вводили в реакцию с 7 мг L-(+)-лизина, растворенного в концентрации 0,1 мг/мл в 100 мМ растворе боратного буфера, рН 8,5. Реакция проходила при комнатной температуре с перемешиванием в течение 16 часов. После этого времени реакционную смесь разводили в 5 раз бидистиллированной водой и подводили рН до 3 соляной кислотой. ПЭГ экстрагировали три раза одним объемом DCM. Объединенные три экстракционные фракции высушивали над безводным сульфатом натрия и фильтровали. Раствор ПЭГ в DCM концентрировали до 5 мл в роторном испарителе. Концентрат осаждали 30 мл холодного диэтилового эфира, отделяли фильтрованием и высушивали под высоким вакуумом. Дендример-подобный ПЭГ с четырьмя ветвями очищали при помощи гель-фильтрации в колонке G3000PW. рН фракции, содержащей желаемую структуру, подводили до 3 соляной кислотой и экстрагировали три раза одним объемом DCM. Объединенные три экстракционные фракции высушивали над безводным сульфатом натрия и затем фильтровали. Раствор ПЭГ в DCM концентрировали до 5 мл в роторном испарителе. Концентрат осаждали 30 мл холодного диэтилового эфира, отделяли фильтрованием и высушивали под высоким вакуумом. Степень чистоты определяли при помощи ДСН-ПААГ, окрашивая гель 5% раствором хлорида бария и 100 мМ йодом, и она была выше чем 98%. Молекулярная масса, определенная посредством MALDI-TOF, была 45,5-50 кД. Общий выход метода был выше чем 30%.
Функциональная активация дендример-подобного ПЭГ с четырьмя ветвями как N-гидроксисукцинимидного эфира (ПЭГ 4,12К -NHS)
Один с половиной граммов дендример-подобного ПЭГ с четырьмя ветвями растворили в 5 мл сухого DCM и добавили 9 мг N-гидроксисукцинимида и 37 мг N,N'-дициклогексилкарбодиимида. Реакцию перемешивали в течение 24 часов при комнатной температуре. Продукт отфильтровывали и осаждали 20 мл холодного диэтилового эфира. Осадок перекристаллизовали три раза, растворяя в ацетоне и осаждая диэтиловым эфиром. Конечный продукт высушивали под высоким вакуумом и хранили под азотом при -20°С. Общий выход метода был выше чем 95%. Фракцию активированного ПЭГ определяли посредством реакции с глицил-глицином, а число аминогрупп определяли посредством реакции с TNBS.
Пример 2
Получение IFN-α2b, конъюгированного с ПЭГ 4,12К -NHS
Реакция конъюгирования
Четыре грамма дендример-подобного ПЭГ с четырьмя ветвями, активированного как N-гидроксисукцинимидный эфир (ПЭГ4-12К-NHS), добавили к раствору, содержащему 1 грамм IFN-α2b в концентрации 6 мг/мл в 120 мМ растворе боратного буфера, рН 8,5. Реакцию проводили 1 час при 4°С при мягком перемешивании и затем останавливали, разводя в 50 раз 10 мМ буферным раствором ацетата натрия, рН 4. Выход реакции определяли при помощи денситометрического анализа окрашивания ДСН-ПААГ с помощью красителя Coomassie Brilliant Blue R-250. Фракция моноПЭГилированного IFN-α2b с дендример-подобным ПЭГ с четырьмя ветками была выше 40%.
Очистка моноПЭГилированного IFN-α2b с дендример-подобным ПЭГ с четырьмя ветками
Колонку ХК 50/60 (от компании Pharmacia), содержащую 500 мл Fractogel EMD 650 (M) COO-, уравновешивали 3 объемами 10 мМ ацетатного буферного раствора, рН 4, при скорости потока 40 мл/мин. Раствор, содержащий реакционную смесь, наносили на колонку при той же скорости. Непрореагировавший ПЭГ и конъюгаты с более чем одним остатком ПЭГ удаляли в течение 2-часовой промывки 40 мМ ацетатным буферным раствором, рН 4, с 25 мМ хлорида натрия. МоноПЭГилированный конъюгат элюировали 50 мМ буферным раствором ацетата натрия, рН 4, с 150 мМ хлоридом натрия. Чистота была выше 96%, и основные загрязнения представляли собой немодифицированный интерферон и биПЭГилированный конъюгат. Фракцию, представляющую интерес, концентрировали до 200 мл и наносили на колонку ХК 50/60 (от компании Pharmacia), содержащую 1 л Sephadex G-25, уравновешенную 50 мМ фосфатным буферным раствором, рН 7, с 100 мМ хлоридом натрия. МоноПЭГилированный интерферон с дендример-подобным ПЭГ с четырьмя ветвями отфильтровывали через целлюлозоацетатную мембрану с размером пор 0,2 мкм и хранили при 4°С.
Пример 3
Физико-химическая характеристика ПЭГ 4,12К -IFN-α2b
Определение концентрации конъюгата
Концентрацию конъюгата как функцию белкового остатка определяли УФ-поглощением при 280 нм. Считали, что одна единица поглощения равна концентрации 1 мг/мл.
Определение молекулярной массы конъюгата
Молекулярную массу конъюгата определяли при помощи MALDI-TOF. Средняя молекулярная масса, ожидаемая для дендример-подобного ПЭГ с четырьмя ветвями, составляла 48000 Д, а для IFN-α2b - 19200 Д, таким образом, теоретическая масса конъюгата была 67200 Д. Вычисленная масса для ПЭГ4,12К-IFN-α2b была 64000-70000 Д.
Пример 4
Биологическая характеристика конъюгата ПЭГ 4-12К -IFN-α2b
Иммунологическая идентификация конъютата в твердофазном иммуноферментном анализе (ELISA-тип)
Примеры конъюгата в различных концентрациях, а также отрицательный контроль наносили на микротитровочный планшет для ELISA, покрытый моноклональными антителами против IFN-α2b. Потом добавляли другое моноклональное антитело, которое распознает другой эпитоп из IFN-α2b, конъюгированное с пероксидазой хрена. Считали, что образцы распознаются иммунологически, когда поглощение в лунках с образцами конъюгатов было выше чем среднее поглощение в лунках с отрицательными образами плюс трехкратное стандартное отклонение этих значений. Антитела распознавали образцы во всех случаях.
Противовирусная активность in vitro
Противовирусную активность in vitro определяли посредством ингибирования цитопатического эффекта, производимого менговирусом на клетки Нер-2 (АТСС № ССL23). Серийные разведения (1:2) конъюгата в минимальной необходимой среде с 2% фетальной бычьей сывороткой и 40 мкг/мл гентамицина смешивали с монослоями клеток в 96-луночных микротитровочных планшетах. Планшеты инкубировали при 37°С в течение 24 часов при 3% атмосфере диоксида углерода и относительной влажности 95%. Добавляли вирус (107 TCID), и планшеты инкубировали до очевидного цитопатического эффекта (90% лизиса клеток). Уровень разрушения клеток измеряли окрашиванием клеток кристаллическим фиолетовым. Активность каждого образца выражали в международных единицах (МЕ), оценивающих IFN-α2b по международному стандарту 69/19 от Всемирной Организации Здравоохранения, а полученные результаты представлены в таблице 1.
| Таблица 1 Противовирусная активность in vitro исходного IFN-α2b и конъюгированного с дендример-подобным ПЭГ с четырьмя ветвями | ||
| Образец | Препарат | Противовирусная активность (МЕ/мг) |
| Исходный интерферон | - | 2,0×108 |
| Интерферон, модифицированный дендример-подобным ПЭГ с четырьмя ветвями | 1 | 1,1×107 |
| 2 | 0,9×107 | |
| 3 | 1,2×107 |
Антипролиферативная активность in vitro
Антипролиферативную активность in vitro измеряли посредством способности конъюгированного IFN-α2b ингибировать рост клеток Дауди (лимфомы Буркита). Результаты показали, что активность in vitro ПЭГ4,12К-IFN-α2b была равна до 5% от активности немодифицированного IFN-α2b.
Пример 5
Физико-химическая стабильность ПЭГ 4,12К -IFN-α2b
Устойчивость к деградации протеазами
Сорок микролитров 4% раствора бикарбоната натрия, рН 8, содержащего 400 мкг/мл нативного IFN-α2b, конъюгированного с ПЭГ с двумя или четырьмя ветвями с похожими молекулярными массами, смешивали с 10 мкл из 160 мкг/мл раствора трипсина. Образец инкубировали при 37°С определенное время. Реакцию останавливали 10 мкл трифторуксусной кислоты. Остаточное количество белка (конъюгированного или нет) оценивали по исчезновению полосы на ДСН-ПААГ, окрашенном Coomassie Brilliant Blue. Результаты (фиг.1) показывают, что защита, которую приносит структура ПЭГ с четырьмя цепями (▲), от деградации конъюгата IFN-α2b является превосходной по отношению к той, что дает структура с двумя ветвями с похожей молекулярной массой (●).
Термическая стабильность
Для того чтобы определить стабильность конъюгата IFN-α2b с дендример-подобными ПЭГ с четырьмя ветвями, образцы нативного и конъюгированного белка инкубировали при 60°С в фосфатно-солевом буферном растворе. Образец IFN-α2b, конъюгированный с ПЭГ с двумя ветвями, использовали в качестве контроля. Образцы извлекали через определенное время и оценивали остаточное количество белка (конъюгированного или нет) по исчезновению полосы на ДСН-ПААГ, окрашенному Coomassie Brilliant Blue. Результаты (фиг.2) показывают, что термическая стабильность конъюгата со структурой с четырьмя ветвями (▲) является выше, чем стабильность конъюгата в двух других случаях [нативный IFN (■), IFN, конъюгированный со структурой с двумя ветвями (●)].
Пример 6
Фармакокинетика ПЭГ 4,12К -IFN-α2b
Сравнительное фармакокинетическое исследование между немодифицированным интерфероном и белком, конъюгированным с дендример-подобным ПЭГ с четырьмя ветвями, проводили на новозеландских кроликах со средним весом 2 кг. В качестве контроля использовали образец IFN-α2b, конъюгированный с ПЭГ с двумя ветвями. Биологически активные молекулы вводили при помощи подкожной инъекции в количестве 150 мкг на кг веса. Отбирали образцы крови в интервале 144 часа в определенных временных точках. Образцы центрифугировали, и сыворотку отделяли и хранили при -20°С до проведения анализа. Концентрацию IFN-α2b, конъюгированного или нет, определяли посредством твердофазного иммуноферментного анализа (ELISA-тип) с моноклональными антителами, специфическими к этому цитокину. Интерпретация результатов была основана на классической компартментальной модели. Результаты представлены в таблице 2.
| Таблица 2 Сравнение фармакокинетики исходного IFN-α2b и конъюгированного с ПЭГ с двумя ветвями и с ПЭГ4,12К-IFN-α2b | |||
| Параметр | Исходный IFN-α2b | IFN-ПЭГ с двумя ветвями | ПЭГ 4-12К -IFN-α2b |
| AUC, мкг.ч/мл | 339,12 | 74907,38 | 88952,15 |
| t1/2, ч | 2,38 | 50,48 | 63,58 |
| MRT, ч | 4,33 | 90,68 | 105,23 |
Пример 7
Конъюгирование других терапевтических белков с дендример-подобными ПЭГ с четырьмя ветвями
Конъюгировали другие терапевтические белки, такие как рекомбинантная стрептокиназа (r-SK), эритропоэтин (EPO), гранулоцитарный колониестимулирующий фактор (G-CSF) и эпидермальный фактор роста (EGF), с дендример-подобным ПЭГ с четырьмя ветвями. Оценивали эффект конъюгирования на скорость деградации протеазами.
Конъюгирование дендример-подобного ПЭГ с четырьмя ветвями, активированного как N-гидроксисукцинимидный эфир
100 миллиграммов дендример-подобного ПЭГ с четырьмя ветвями, активированного как N-гидроксисукцинимидный эфир (ПЭГ4,12К-NHS), добавили к раствору, содержащему 25 мг терапевтического белка в концентрации 6 мг/мл в 120 мМ растворе боратного буфера, рН 8,5. Реакцию проводили 1 час при 4°С при мягком перемешивании. Реакцию останавливали 50-кратным разведением в 10 мМ буферном растворе ацетата натрия, рН 4. Выход реакции определяли денситометрическим анализом ДСН-ПААГ образцов, окрашенного с помощью красителя Coomassie Brilliant Blue R-250. Фракция моноПЭГилированного белка с дендример-подобным ПЭГ с четырьмя ветвями была выше 30% во всех случаях.
Конъюгирование дендример-подобного ПЭГ, активированного как альдегид
100 миллиграммов дендример-подобного ПЭГ с четырьмя ветвями, активированного как альдегид (ПЭГ4,12К-ALD), добавили к раствору, содержащему 15 мг терапевтического белка в концентрации 4 мг/мл в 100 мМ растворе ацетатного буфера, рН 5, с 20 мМ цианоборгидрида натрия. Реакция длилась 24 часа при 4°С с мягким перемешиванием, и ее останавливали 20-кратным разведением 1мМ HCl. Выход реакции определяли посредством денситометрического анализа ДСН-ПААГ образцов, окрашенных Coomassie Brilliant Blue R-250. Фракция моноПЭГилированного белка с дендример-подобным ПЭГ с четырьмя ветвями была выше 30% во всех случаях.
Эффект конъюгирования дендример-подобного ПЭГ с четырьмя ветвями на деградацию белков протеазами
Сорок микролитров 4% раствора бикарбоната, рН 8, содержащего 400 мкг/мл нативного белка или конъюгированного с ПЭГ с четырьмя ветвями, смешивали с 10 мкл раствора трипсина с концентрацией 160 мкг/мл. Образец инкубировали при 37°С в течение 4 часов с мягким перемешиванием. После этого времени реакцию останавливали 10 мкл трихлоруксусной кислоты. Полученное в результате количество белка (конъюгированного или нет) оценивали по исчезновению полосы на ДСН-ПААГ, окрашенном Coomassie Brilliant Blue R-250. Результаты (таблица 3) указывают на то, что конъюгация с дендример-подобным ПЭГ с четырьмя ветвями защищает конъюгированные белки от деградации трипсином. Во всех случаях более чем 35% белка не расщеплялось после 4 часов реакции с трипсином независимо от примененного химического способа конъюгирования. Однако никаких следов нативных белков не было обнаружено после этого времени.
| Таблица 3 Фракция (%) нерасщепленного белка по отношению к количеству белка перед реакцией | |||
| Белок | Нативный | Конъюгированный с ПЭГ 4,12К -NHS | Конъюгированный с ПЭГ 4,12К -ALD |
| r-SK | 0% | 38,2±1,5% | 41,5±0,9% |
| EPO | 0% | 39,8±2,3% | 37,5±1,7% |
| G-CSF | 0% | 45,6±3,4% | 42,1±2,9% |
| EGF | 0% | 35,1±4,4% | 37,6±4,8% |
1. Полимерная дендример-подобная структура, включающая четыре ветви монометоксиполиэтиленгликоля, которая может быть представлена как: для получения конъюгатов, представляющих фармацевтический интерес, где молекулярная масса каждой ПЭГ-цепи находится между 11000 и 13500 Д, а общая молекулярная масса находится между 44000 и 54000 Д.
2. Полимерная структура по п.1, активированная для конъюгирования с нуклеофильными группами, полученная функциональной активацией карбоксильной группы.
3. Конъюгат, включающий полимерную структуру по п.1 и нуклеофильную группу.
4. Конъюгат по п.3, где нуклеофильная группа содержится в биомолекуле, выбранной из группы, состоящей из белков, пептидов и полипептидов.
5. Конъюгат по п.4, где белок выбран из группы, состоящей из интерферона альфа 2-b, стрептокиназы, гранулоцитарного колониестимулирующего фактора, эритропоэтина и эпидермального ростового фактора.