Способ получения алкил(мет)акрилатов
Иллюстрации
Показать всеИзобретение относится к усовершенствованному способу получения алкил(мет)акрилатов, применяющихся в получении полимеров и сополимеров с другими способными полимеризоваться соединениями, включающему стадию переэтерификации сложного алкилового эфира α-гидроксикарбоновой кислоты (мет)акриловой кислотой, сопровождаемую образованием алкил(мет)акрилатов и α-гидроксикарбоновой кислоты, и стадию дегидратации α-гидроксикарбоновой кислоты, сопровождаемую образованием (мет)акриловой кислоты. Способ позволяет получать алкил(мет)акрилаты с высокой селективностью. 21 з.п. ф-лы, 2 табл., 2 ил.
Реферат
Настоящее изобретение относится к способу получения алкил(мет)-акрилатов.
Сложные эфиры акриловой кислоты и метакриловой кислоты, ниженазываемые алкил(мет)-акрилатами, нашли основную область применения в получении полимеров и сополимеров с другими способными полимеризоваться соединениями.
Кроме того, сложный эфир метакриловой кислоты, например, такой как метилметакрилат, является важным мономером для разных особых сложных эфиров на основе метакриловой кислоты, которые получают переэтерификацией соответствующим спиртом.
Метилметакрилат и метакриловую кислоту в настоящее время преимущественно получают из синильной кислоты и ацетона через образующийся в качестве основного промежуточного соединения ацетонциангидрин (АЦГ).
В соответствующей патентной литературе описаны и реализованы в промышленном масштабе другие способы получения метилметакрилата и метакриловой кислоты, предусматривающие использование иных исходных соединений вместо АЦГ. В связи с этим, сырье на основе углеводородов с четырьмя атомами углерода, например, таких как изобутилен или трет-бутанол, в настоящее время используют в качестве реагентов, которые превращают в целевые производные метакриловой кислоты посредством многостадийного способа.
Дополнительным объектом интенсивного исследования явилось использование пропилена в качестве основного сырья, причем ступенчатое гидрокарбонилирование (с образованием изомасляной кислоты) и окислительное дегидрирование приводит к получению метакриловой кислоты с умеренными выходами.
Известно, что в качестве основного сырья можно использовать пропаналь или пропионовую кислоту, которые могут быть получены в технически реализуемых процессах из этилена и структур с одним атомом углерода, таких как монооксид углерода. В подобных процессах образующееся по реакции альдольной конденсации с формальдегидом β-гидроксикарбонильное соединение дегидратацией in situ превращают в соответствующее α,β-ненасыщенное соединение. Обзор общепринятых способов получения метакриловой кислоты и ее сложных эфиров приведен, например, в Weissermel, Агре „Industrielle organische Chemie", VCH, Вейнгейм 1994, 4-е издание, страница 305 и следующие, а также в Kirk Othmer „Encyclopedia of Chemical Technology", 3-е издание, том 15, страница 357.
Общеизвестно, что первую реакционную стадию технических способов, основанных на использовании АЦГ (так называемое амидирование АЦГ), осуществляют высококонцентрированной серной кислотой (около 100% мас. H2SO4) при температуре от 80 до почти 110°С.
Предвтавительным для такого процесса является, например, патент US 4529816, в соответствии с которым амидирование АЦГ осуществляют при температуре около 100°С и молярном отношении АЦГ к H2SO4 в примерном интервале от 1:1,5 до 1:1,8. Основными стадиями процесса по этому способу являются а) амидирование, b) конверсия и с) этерификация.
На стадии амидирования в качестве основных продуктов взаимодействия получают амид сульфокси-α-гидроксиизомасляной кислоты-водород сульфат (СИМА) и амид метакриловой кислоты-водородсульфат (МАКА×H2SO4) в виде раствора в избыточной серной кислоте. Кроме того, типичный раствор стадии амидирования содержит амид α-гидроксиизомасляной кислоты-водород-сульфат (ГИМА×H2SO4), выход которого в пересчете на АЦГ составляет менее 5%. При более или менее полном превращении АЦГ подобный весьма селективный процесс амидирования протекает с суммарным выходом указанных промежуточных соединений примерно от 96 до 97%.
Однако на стадии амидирования в качестве побочных продуктов образуются незначительные количества монооксида углерода, ацетона, продуктов сульфирования ацетона и продуктов циклоконденсации ацетона с различными промежуточными соединениями.
В зависимости от содержания воды в используемой серной кислоте образующаяся на стадии амидирования смесь, наряду с СИМА, содержит также ГИМА. Так, например, при использовании серной кислоты с концентрацией 97% мас. (1,5 эквивалента H2SO4 относительно АЦГ) образуется уже около 25% мас. ГИМА, которую не удается селективно и полностью конвертировать в МАКА. Таким образом, относительно высокое содержание воды на стадии осуществляемого при температуре от 90 до 110°С амидирования обусловливает относительно высокое содержание ГИМА, который может быть превращен обычной конверсией в целевой промежуточный продукт МАКА×H2SO4 лишь с относительно невысокой селективностью.
Целью конверсии является максимально полное превращение СИМА и ГИМА в МАКА, протекающее благодаря β-отщеплению серной кислоты (в используемой в качестве растворителя избыточной серной кислоте).
Таким образом, на стадии конверсии при повышенных температурах (от 140 до 160°С) и незначительном времени контакта реагентов (около 10 минут или менее) осуществляют превращение содержащихся в сернокислотном (безводном) растворе ГИМА, СИМА и МАКА (в виде соответствующих гидросульфатов).
Реакционная смесь стадии конверсии характеризуется значительным избытком серной кислоты и примерным содержанием основного продукта МАКА×H2SO4 в растворе, составляющем от 30 до 35% мас. (в зависимости от используемого избытка серной кислоты).
При более или менее полном превращении СИМА×H2SO4 на стадии конверсии примерный выход МАКА×H2SO4 составляет от 94 до 95%. Таким образом, с учетом потерь при амидировании, обусловленных указанными выше побочными реакциями, для последующей этерификации в целевой продукт - метилметакрилат (ММА) в распоряжении имеется лишь от 90 до 92% МАКА (в пересчете на АЦГ).
Побочными продуктами, образующимися в жестких реакционных условиях стадии конверсии, являются значительные количества продуктов взаимной конденсации и присоединения промежуточных соединений.
Цель этерификации состоит в максимально полном превращении полученного на стадии конверсии МАКА × H2SO4 в ММА. Этерификацию осуществляют добавлением к сернокислотному раствору МАКА смеси воды с метанолом, и она, по меньшей мере, частично протекает с образованием метакриловой кислоты (МАК) в качестве промежуточного продукта. Этерификацию можно осуществлять под давлением или без давления.
В результате омыления/этерификации подвергнутого конверсии раствора при температуре от 90 до 140°С и времени реакции от одного до нескольких часов обычно получают сернокислотный раствор ММА, МАК и образующегося гидросульфата аммония.
Селективность превращения метанола на стадии этерификации вследствие специфических условий реакции и присутствия свободной серной кислоты составляет лишь около 90% или менее, причем побочным продуктом является образующийся вследствие конденсации метанола диметиловый эфир.
При более или менее полном превращении МАКА × H2SO4 примерный выход ММА на стадии этерификации составляет от 98 до 99% в пересчете на используемый МАКА (суммарная селективность образования МАК+ММА). Таким образом, с учетом потерь на стадиях амидирования и конверсии, обусловленных указанными выше побочными реакциями, максимальный выход ММА в результате осуществления включающего все стадии общего технологического процесса при оптимальном осуществлении реакций составляет 90% в пересчете на АЦГ.
Наряду с неудовлетворительным общим выходом целевых продуктов, недостатком рассмотренного выше процесса, реализация которого, особенно в производственном масштабе, связана с образованием значительных количеств побочных продуктов и газообразных отходов, состоит в необходимости использования сверхстехиометрических количеств серной кислоты.
Кроме того, при переработке содержащей гидросульфат аммония и серную кислоту технологической кислоты на установке для регенерации контактной серной кислоты выделяются дегтеподобные твердые продукты конденсации, которые препятствуют надежному транспортированию технологической кислоты и устранение которых связано со значительными затратами.
В связи со значительными потерями выхода целевых продуктов, характерными для предложенного в патенте US 4529816 способа, предлагалось осуществлять амидирование и гидролиз АЦГ в присутствии воды при сохранении, по меньшей мере, на первых стадиях превращения присоединенных к молекулам гидроксильных функциональных групп.
Подобные альтернативные варианты реализуемого в присутствии воды амидирования в зависимости от того, осуществляют их в присутствии метанола или без него, сопровождаются образованием либо сложного метилового эфира 2-гидроксиизомасляной кислоты (ГИМКМ), либо 2-гидроксиизомасляной кислоты (ГИМК).
2-Гидроксиизомасляная кислота является основным промежуточным продуктом получения метакриловой кислоты и соответствующих сложных эфиров метакриловой кислоты, особенно метилметакрилата.
Другой альтернативный вариант получения из АЦГ сложных эфиров 2-гидроксиизо-масляной кислоты, особенно сложного метилового эфира 2-гидроксиизомасляной кислоты, предложен в японском патенте JP Hei 4-193845. В соответствии с подобным вариантом АЦГ сначала амидируют серной кислотой, используемой в количестве от 0,8 до 1,25 эквивалента, в присутствии менее 0,8 эквивалента воды при температуре ниже 60°С, а затем с целью превращения продуктов амидирования в ГИМКМ или соответствующие сложные эфиры подвергают взаимодействию при температуре выше 55°С со спиртом, особенно метанолом, используемым в количестве более 1,2 эквивалента. Сведения о присутствии снижающих вязкость сред, стабильных по отношению к реакционной матрице, в указанной публикации отсутствуют.
Недостатки и проблемы технической реализации указанного выше способа обусловлены чрезвычайно сильным повышением вязкости на конечной стадии реакции.
В патентной литературе приведены некоторые составы, предназначенные для утилизации и преобразования ГИМКМ дегидратацией в метилметакрилат.
Так, например, согласно европейскому патенту ЕР 0429800 ГИМКМ или смесь ГИМКМ с соответствующим альфа- или бета-алкоксилированным сложным эфиром подвергают превращению в газовой фазе в присутствии метанола в качестве совместно используемого исходного компонента на гетерогенном катализаторе, состоящем из кристаллического алюмосиликата и смешанной примеси, состоящей из щелочного металла, с одной стороны, и благородного металла, с другой стороны. Хотя, по меньшей мере, в начале реакции катализатор обеспечивает вполне удовлетворительные степени превращения и селективность, однако по мере продолжения реакции катализатор весьма резко утрачивает свою активность, что сопровождается снижением выходов.
Аналогичный состав предложен в европейском патенте ЕР 0941984, в котором описана газофазная дегидратация ГИМКМ в виде отдельной стадии синтеза ММА, реализуемой в присутствии гетерогенного катализатора, состоящего из соли щелочного металла и фосфорной кислоты на диоксиде кремния. Однако соответствующая многостадийная технология в целом весьма сложна, отдельные стадии подлежат реализации при повышенном давлении, а следовательно, с использованием дорогостоящего оборудования, и она не обеспечивает удовлетворительных выходов.
Наряду с указанными выше публикациями, касающимися дегидратации ГИМКМ и родственных сложных эфиров в газовой фазе с их превращением в соответствующие альфа-бета-ненасыщенные производные метакриловой кислоты, дегидратацию предлагается осуществлять также в жидкой фазе.
Получение МАК из 2-гидроксиизомасляной кислоты описано, например, в патенте US 3487101, в котором предложен жидкофазный синтез различных производных метакриловой кислоты, прежде всего, метакриловой кислота и ее сложных эфиров, из 2-гидроксиизомасляной кислоты, отличающийся тем, что превращение ГИМК в метакриловую кислоту осуществляют в присутствии растворенного щелочного катализатора при повышенной температуре, составляющей от 180 до 320°С, в присутствии высококипящих сложных эфиров (например, диметилфталата) и внутренних ангидридов (например, фталевого ангидрида). Согласно указанному патенту селективность образования МАК при степенях превращения ГИМК, превышающих 90%, достигает 98%. Сведения, касающиеся долговременной стабильности жидкого раствора катализатора, прежде всего истощения используемого ангидрида, отсутствуют.
Наряду с этим в японском патенте JP 184047/1985 рассматривается дегидратация ГИМКМ в присутствии высококонцентрированной серной кислоты (концентрация от 90 до 100% мас.). Недостатком подобного метода является повышенный расход серной кислоты и выход больших количеств водной серной кислоты, образующейся вследствие выделения воды из ГИМКМ в результате дегидратации. В связи с образованием больших количеств отработанной серной кислоты указанный метод не имеет экономического значения.
Немецкая заявка на патент DE-OS 1191367 относится к получению метакриловой кислоты из 2-гидроксиизомасляной кислоты в жидкой фазе, отличающемуся тем, что превращение ГИМК в метакриловую кислоту осуществляют в присутствии ингибиторов полимеризации (например, таких как порошок меди) и смеси катализаторов, состоящей из галогенидов металлов и галогенидов щелочных металлов, при повышенной температуре, составляющей от 180 до 220°С. Согласно указанной заявке селективность образования МАК при степенях превращения ГИМК, превышающих 90%, составляет более 99%. Наилучших результатов достигают благодаря использованию смесей катализаторов на основе бромида цинка и бромида лития. Однако общеизвестно, что использование содержащих галогениды катализаторов при высоких температурах предъявляет жесткие требования к применяемым конструкционным материалам, причем проблемы, обусловленные присутствием в дистилляте уносимых галогенированных побочных продуктов, относятся также к последующим узлам технологического оборудования.
Из европейского патента ЕР 0487853 известно получение метакриловой кислоты из ацетонциангидрина, отличающееся тем, что на первой стадии АЦГ подвергают взаимодействию с водой при умеренных температурах в присутствии гетерогенного катализатора гидролиза, на второй стадии осуществляют взаимодействие амида 2-гидроксиизомасляной кислоты с метилформиатом или метанолом/монооксидом углерода, приводящее к образованию формамида и сложного метилового эфира гидроксиизомасляной кислоты, на третьей стадии ГИМКМ в присутствии гетерогенного ионита омыляют водой до гидроксиизомасляной кислоты, а на четвертой стадии осуществляют дегидратацию ГИМК в жидкой фазе при высоких температурах в присутствии растворенной соли щелочного металла. Метакриловую кислоту получают из ГИМК с высокими степенями превращения (99%) и более или менее количественной селективностью. Однако в связи с необходимостью осуществления большого числа реакционных стадий и промежуточного выделения индивидуальных промежуточных соединений, а также в особенности в связи с необходимостью реализации отдельных технологических операций при повышенном давлении подобная технология является слишком сложной, а следовательно, в конечном итоге нерентабельной. Кроме того, приходится синтезировать формамид, который часто рассматривают в качестве нежелательного побочного продукта, подлежащего дорогостоящей утилизации.
В немецкой заявке на патент DE-OS 1768253 описан способ получения метакриловой кислоты дегидратацией α-гидроксиизомасляной кислоты, отличающийся тем, что ГИМК подвергают жидкофазному превращению при температуре, составляющей по меньшей мере 160°С, в присутствии катализатора дегидратации, представляющего собой металлическую соль α-гидроксиизомасляной кислоты. Особенно пригодными в данном случае являются соли ГИМК со щелочными и щелочноземельными металлами, которые могут быть получены в расплаве ГИМК in situ в результате превращения пригодной соли металла. Согласно указанной публикации выход МАК из ГИМК достигает 95%, причем исходная реакционная смесь при непрерывном осуществлении способа содержит ГИМК и около 1,5% мас. соли ГИМК со щелочным металлом.
Из патента RU 89631 известен способ получения метакриловой кислоты из 2-гидроксиизомасляной кислоты отщеплением воды в жидкой фазе, отличающийся тем, что реакцию осуществляют в отсутствие катализатора в водном растворе ГИМК (до 62% мас. ГИМК в воде) под давлением и при повышенных температурах, составляющих от 200 до 240°С.
Кроме того, известно о получении 2-гидроксиизомасляной кислоты из ацетонциангидрина, которое может быть реализовано омылением нитрильных функциональных групп в присутствии минеральных кислот (смотри J. Brit. Chem. Soc. (1930) и Спет.Вег.72 (1939), 800).
В соответствии с процессом подобного типа, известным, например, из японского патента JP Sho 63-61932, 2-гидроксиизомасляную кислоту (ГИМК) получают двухстадийным омылением АЦГ. При этом сначала АЦГ в присутствии от 0,2 до 1,0 моля воды и от 0,5 до 2 эквивалентов серной кислоты превращают в соответствующие соли амида. Уже на этой стадии, предусматривающей использование небольших количеств воды и серной кислоты, необходимых для обеспечения высоких выходов, сокращения времени реакции и образования незначительных количеств отходов технологической кислоты, сталкиваются с серьезной проблемой пригодности амидируемой смеси для перемешивания, что обусловлено ее высокой вязкостью, в особенности на конечной стадии реакции.
Повышение количества воды с целью снижения вязкости приводит к резкому замедлению амидирования и побочным реакциям, прежде всего фрагментированию АЦГ на эдукты (ацетон и синильную кислоту), которые в реакционных условиях образуют продукты последовательно протекающих реакций. Хотя повышение температуры в соответствии с японским патентом JP SHO 63-61932 и позволяет регулировать вязкость реакционной смеси, снижение которой обеспечивает возможность перемешивания реакционных композиций, однако в этом случае уже при умеренных температурах также резко усиливается протекание побочных реакций, что в конечном итоге проявляется в снижение выхода целевого продукта (смотри сравнительные примеры).
При осуществлении амидирования при пониженных температурах (ниже 50°С), то есть в условиях, которые могли бы обеспечить более высокую селективность, к моменту завершения реакции вследствие повышения концентрации трудно растворимых в реакционных условиях солей амида сначала происходит образование трудно перемешиваемой суспензии, а затем полное затвердевание реакционной системы.
На второй стадии предложенного в японском патенте JP SHO 63-61932 способа к полученному в результате амидирования раствору добавляют воду и осуществляют гидролиз при аналогичной амидированию повышенной температуре, причем из полученных при амидировании солей образуется 2-гидроксиизомасляная кислота (ГИМК) с одновременным выделением свободного гидросульфата аммония.
Для обеспечения рентабельности технического процесса, наряду с селективным образованием ГИМК в качестве целевого продукта реакции, большое значение имеет также ее выделение из реакционной матрицы, соответственно отделение ГИМК от остаточной технологической кислоты.
В соответствии с используемым в японском патенте JP Sho 57-131736 методом выделения α-оксиизомасляной кислоты (ГИМК) указанная проблема решается благодаря обработке содержащего α-гидроксиизомасляную кислоту и кислый гидросульфат аммония реакционного раствора, полученного в результате гидролитического расщепления ацетонциангидрина при его взаимодействии с серной кислотой и водой, экстрагирующим агентом, причем 2-гидроксиизомасляная кислота переходит в экстрагирующий агент, а кислый сульфат аммония остается в водной фазе.
В соответствии с указанной технологией с целью повышения степени экстракции ГИМК органическим экстрагентом содержащуюся в реакционной системе свободную серную кислоту перед экстракцией нейтрализуют благодаря обработке щелочной средой. Нейтрализация серной кислоты связана со значительными дополнительными расходами на аминное или минеральное основание и образованием значительного количества отходов в виде соответствующих солей, которые невозможно утилизировать без отрицательного воздействия на экологию и экономичность процесса.
Таким образом, недостатки предложенного в японском патенте JP Sho 57-131736 способа получения ММА через амид метакриловой кислоты - гидросульфат (реакционная последовательность: амидирование - конверсия - гидролитическая этерификация) состоят в следующем.
a) Использование значительного молярного избытка серной кислоты по отношению к АЦГ (в технически реализуемом процессе примерно от 1,5 до 2 эквивалентов серной кислоты на 1 эквивалент АЦГ).
b) Значительные потери выхода на стадии амидирования (примерно от 3 до 4%) и стадии конверсии (примерно от 5 до 6%), что в конечном итоге негативно отражается на максимальном выходе амидосульфата метакриловой кислота, составляющем около 91%.
c) Значительные потоки отходов в виде водной серной кислоты с растворенными в ней гидросульфатом аммония и органическими побочными продуктами. Выделение дегтеподобных остатков неопределенного состава из подобной отработанной технологической кислоты требует осуществления дополнительной обработки, соответственно затратоемкой утилизации.
Недостатки предложенного в японском патенте JP Sho 57-131736 способа получения ММА через гидроксиизомасляную кислоту в качестве основного промежуточного соединения (реакционная последовательность: амидирование - гидролитический синтез ГИМК- синтез МАК - гидролитическая этерификация) можно резюмировать следующим образом.
а) Использование серной кислоты даже при ее незначительном молярном избытке по отношению к АЦГ (не более 1,0 эквивалента серной кислоты на один эквивалент АЦГ) приводит к серьезным проблемам, обусловленным повышением вязкости и недостаточной пригодностью амидируемой среды для перемешивания, вплоть до полного затвердевания реакционных составов; предлагаемое разбавление спиртами (метанолом) или различными сложными эфирами в используемых для амидирования реакционных условиях приводит к неполному превращению АЦГ, резкому усилению протекания побочных реакций или химической деструкции разбавителей.
b) Значительные потери выхода на стадии амидирования (примерно от 5 до 6%) и дорогостоящая экстракция органическим растворителем, сопровождаемая образованием содержащей воду и ГИМК фазы экстрагирующего агента, выделение ГИМК из которой методом дистилляции связано с повышенным расходом энергии. На каждый килограмм ГИМК приходится около двух килограммов образующейся отработанной технологической кислоты, содержащей около 34% мас. воды и 66% мас. гидросульфата аммония (смотри пример 4 в японском патенте JP Sho 57-131736). Регенерация отработанного солевого раствора с высоким содержанием воды на установке для получения контактной серной кислоты требует значительных затрат энергии, что существенно ограничивает производственную мощность подобной установки.
Общей особенностью всех рассмотренных выше способов является чрезвычайно дорогостоящее выделение ГИМК из содержащей гидросульфат аммония водной реакционной матрицы. Присутствие слишком большого количества воды в содержащей ГИМК экстракционной фазе обусловливает также унос гидросульфата аммония на последующую стадию синтеза МАК, непрерывная реализация которой в техническом масштабе в течение допустимого периода времени не представляется возможной. Кроме того, предлагаемые способы вследствие высоких энергетических затрат на регенерацию как содержащей воду высококонцентрированной технологической кислоты, так и экстракционных потоков, являются нерентабельными и не могут служить подлинной альтернативой хотя и неселективной, но надежной технологии, приводящей к конечной цели благодаря реализации небольшого количества несложных технологических операций.
С учетом рассмотренного выше уровня техники в основу настоящего изобретения была положена задача предложить способ получения алкил(мет)акрилатов, отличающийся простотой и экономичностью осуществления.
Другая задача настоящего изобретения состояла в разработке способа, позволяющего получать алкил(мет)акрилаты с чрезвычайно высокой селективностью.
Кроме того, в основу настоящего изобретения была положена задача предложить способ получения алкил(мет)акрилатов, реализация которого сопровождалась бы образованием лишь незначительного количества побочных продуктов. При этом целевой продукт необходимо получать с максимально высокими выходами при незначительном суммарном потреблении энергии.
Другая задача настоящего изобретения состояла в том, чтобы предложить способ получения алкил(мет)акрилатов, которой можно было бы осуществлять особенно просто и экономично.
Указанные выше задачи, а также другие задачи изобретения, не сформулированные в явном виде, однако безусловно вытекающие из контекста соответствующего описания, решаются благодаря способу, отличительные признаки которого сформулированы в пункте 1 формулы изобретения. Целесообразные варианты предлагаемого в изобретении способа представлены в соответствующих зависимых пунктах формулы изобретения.
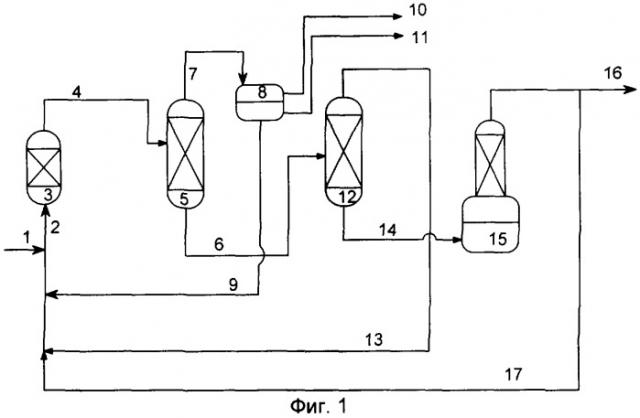
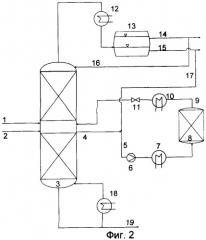
Таким образом, объектом настоящего изобретения является способ получения алкил(мет)акрилатов, включающий стадию переэтерификации сложного алкилового эфира α-гидроксикарбоновой кислоты (мет)акриловой кислотой, сопровождаемую образованием алкил(мет)акрилатов и α-гидроксикарбоновой кислоты, и стадию дегидратации α-гидроксикарбоновой кислоты, сопровождаемую образованием (мет)акриловой кислоты.
Благодаря реализации предлагаемых в изобретении операций могут быть достигнуты, в частности, следующие преимущества.
Способ позволяет отказаться от использования больших количеств серной кислоты в качестве реагента. Следовательно, в соответствии с предлагаемым в изобретении способом отсутствует образование больших количеств отходов гидросульфата аммония.
Алкил(мет)акрилаты, получаемые предлагаемым в изобретении способом, образуются с высокими выходами. Прежде всего, это становится очевидным из сравнения предлагаемого в изобретении способа со способом, описанным в европейской заявке на патент ЕР-А-0941984, в соответствии с которым сложные алкиловые эфиры α-гидроксикарбоновой кислоты подвергают непосредственной дегидратации в алкил(мет)акрилаты. Неожиданно было установлено, что, благодаря дополнительной реакционной стадии переэтерификации сложного алкилового эфира α-гидроксикарбоновой кислоты (мет)акриловой кислотой, в конечном итоге достигают более высоких значений селективности.
При этом образуются весьма незначительные количества побочных продуктов. Кроме того, прежде всего, с учетом высокой селективности, достигают высоких степеней превращения.
Предлагаемый в изобретении способ приводит к образованию незначительных количеств побочных продуктов.
Предлагаемый в изобретении способ может быть реализован рентабельно и, прежде всего, при незначительном потреблении энергии. При этом используемые для дегидратации и переэтерификации катализаторы можно эксплуатировать в течение продолжительного времени без снижения селективности или активности.
Предлагаемый в изобретении способ может быть реализован в промышленном масштабе.
Согласно изобретению сложный алкиловый эфир α-гидроксикарбоновой кислоты подвергают взаимодействию с (мет)акриловой кислотой. Используемые при этом (мет)акриловые кислоты известны, и являются коммерчески доступными продуктами. Наряду с акриловой кислотой (пропеновой кислотой) и метакриловой кислотой (2-метилпропеновой кислотой) к подобным кислотам, прежде всего, относятся соответствующие замещенные производные. Пригодными заместителями, прежде всего, являются галогены, такие как хлор, фтор и бром, а также алкильные группы, которые предпочтительно могут содержать от 1 до 10, особенно предпочтительно от 1 до 4 атомов углерода. К пригодным кислотам относятся, в частности, β-метилакриловая кислота (бутеновая кислота), α,β-диметилакриловая кислота, β-этилакриловая кислота, а также β,β-диметилакриловая кислота. Предпочтительными кислотами являются акриловая кислота (пропеновая кислота) и метакриловая кислота (2-метилпропеновая кислота), причем особенно предпочтительной является метакриловая кислота.
Подвергаемые переэтерификации сложные алкиловые эфиры α-гидроксикарбоновой кислоты являются известными эфирами, спиртовый остаток которых предпочтительно содержит от 1 до 20, прежде всего, от 1 до 10, особенно предпочтительно от 1 до 5 атомов углерода. Предпочтительные спиртовые остатки, прежде всего, происходят от метанола, этанола, пропанола, бутанола, в особенности н-бутанола и 2-метил-1-пропанола, пентанола, гексанола и 2-этилгексанола, причем особенно предпочтительные спиртовые остатки происходят от метанола и этанола.
Кислотный остаток подвергаемых переэтерификации сложных алкиловых эфиров α-гидроксикарбоновой кислоты предпочтительно происходит от (мет)акриловой кислоты, которая может быть получена дегидратацией α-гидроксикарбоновой кислоты. Так, например, если используют метакриловую кислоту, то переэтерификации подвергают сложный эфир α-гидроксиизомасляной кислоты. В случае использования акриловой кислоты переэтерификации предпочтительно подвергают сложный эфир α-гидроксиизопропионовой кислоты.
Предпочтительно используемыми сложными алкиловыми эфирами α-гидроксикарбоновой кислоты являются сложный метиловый эфир α-гидроксипропионовой кислоты, сложный этиловый эфир α-гидроксипропионовой кислоты, сложный метиловый эфир α-гидроксиизомасляной кислоты и сложный этиловый эфир α-гидроксиизомасляной кислоты.
Подобные сложные алкиловые эфиры α-гидроксикарбоновой кислоты часто с оптимальными затратами получают из соответствующих циангидринов. При этом степень чистоты циангидрина не является критическим параметром. Следовательно, для осуществления гидролиза можно использовать очищенный или неочищенный циангидрин. В соответствии с этим подлежащие использованию согласно изобретению сложные алкиловые эфиры α-гидроксикарбоновой кислоты могут быть синтезированы из кетонов и альдегидов, а также синильной кислоты и соответствующего спирта.
На первой стадии подобного синтеза карбонильное соединение, например, кетон, прежде всего, ацетон, или альдегид, например, ацетальдегид, пропаналь или бутаналь, превращают в соответствующий циангидрин взаимодействием с синильной кислотой. При этом превращению, в типичном случае осуществляемому с использованием в качестве катализатора незначительного количества щелочи или амина, особенно предпочтительно подвергают ацетон и/или ацетальдегид.
Полученный циангидрин на следующей стадии подвергают взаимодействию с водой, сопровождаемому образованием амида гидроксикарбоновой кислоты.
Подобное взаимодействие в типичном случае осуществляют в присутствии катализатора. Для этой цели, прежде всего, пригодны катализаторы на основе оксида марганца, описанные, например, в европейских заявках на патент ЕР-А-0945429, ЕР-А-0561614 и ЕР-А-0545697. При этом оксид марганца можно использовать в форме диоксида марганца, получаемого осуществляемой в кислой среде обработкой сульфата марганца перманганатом калия (смотри Biochem.J., 50, страница 43 (1951) и J.Chem.Soc., 1953, страница 2189, 1953) или электролитическим окислением сульфата марганца в водном растворе. В общем случае катализатор часто используют в виде порошка или гранулята с частицами подходящего размера. Кроме того, катализатор может быть нанесен на носитель. При этом, прежде всего, можно использовать также реакторы со взвешенным или неподвижным слоем катализатора, в частности, описанные в европейской заявке на патент ЕР-А-956 898.
Кроме того, реакцию гидролиза циангидрина можно катализировать ферментами. Пригодными ферментами являются, в частности, нитрилгидратазы. Подобная реакция приведена, например, в "Screening, Characterization and Application of Cyanide-resistant Nitrile Hydratases" Eng. Life. Sci. 2004, 4, №6.
Наряду с этим реакцию гидролиза циангидрина можно катализировать кислотами, в особенности серной кислотой. Кислотный катализ предлагается использовать, в частности, в японском патенте JP Hei 4-193845.
Воду, необходимую для осуществления гидролиза циангидрина, часто можно использовать в качестве растворителя. Молярное соотношение воды к циангидрину предпочтительно составляет, по меньшей мере, 1:1 и особенно предпочтительно находится в интервале от 0,5:1 до 25:1, еще более предпочтительно в интервале от 1:1 до 10:1.
Используемая для гидролиза вода может обладать высокой степенью чистоты. Однако это условие не является обязательным. Так, например, наряду со свежей водой, можно использовать также производственную или технологическую воду, содержащую более или менее значительные количества примесей. Следовательно, для гидролиза можно использовать также оборотную воду.
Кроме того, в используемой для гидролиза циангидрина реакционной смеси могут присутствовать и другие компоненты. К подобным компонентам относятся, в частности, альдегиды и кетоны, прежде всего, те из них, которые были использованы для синтеза циангидрина. Так, например, реакционная смесь может содержать ацетон и/или ацетальдегид. Подобная реакционная смесь приведена, например, в патенте US 4018829-A. Степень чистоты добавляемых альдегидов и/или кетонов в общем случае не является особенно критическим параметром. Следовательно, указанные вещества могут содержать примеси, прежде всего, спирты, например, метанол, воду и/или сложный метиловый эфир α-гидроксиизомасляной кислоты (ГИМКМ). Количество используемых в реакционной смеси карбонильных соединений, прежде всего, ацетона и/или ацетальдегида, можно варьировать в широких пределах. Предпочтительное количество используемого карбонильного соединения составляет от 0,1 до 6 молей, предпочтительно от 0,1 до 2 молей в расчете на моль циангидрина.
Температура, при которой осуществляют реакцию гидролиза, в общем случае может находиться в интервале от 10 до 150°С, предпочтительно от 20 до 100°С и особенно предпочтительно от 30 до 80°С.
Гидролиз циангидрина можно осуществлять, например, в реакторе со стационарным или взвешенным слоем катализатора.
Полученная указанным образом реакционная смесь, наряду с целевым амидом гидроксикислоты, в общем случае содержит другие компоненты, прежде всего, непревращенный циангидрин, а также, при необходимости, используемый ацетон и/или ацетальдегид. В соответствии с этим реакционная смесь может быть подвергнута очистке, при которой непревращенный циангидрин может быть расщеплен до ацетона и синильной кислоты, которые повторно используют для получения циангидрина. То же самое относится и к выделенному ацетону и/или ацетальдегиду.
Кроме того, очищенная реакционная смесь, содержащая амид гидроксикислоты, может быть освобождена от других компонентов, благодаря пропусканию через колонны с ионообменными смолами.
В качестве ионообменных смол, прежде всего, можно использовать катиониты и аниониты. Пригодные для этого иониты являются известными продуктами. Так, например, пригодные катиониты могут быть получены сульфированием сополимеров стирола с дивинилбензолом. Щелочные аниониты содержат четвертичные аммониевые группы, ковалентно соединенные с сополимерами стирола с дивинилбензолом.
Стадии получения амидов α-гидроксикарбоновой кислоты подробно рассмотрены, в частности, в европейской заявке на патент ЕР-А-0686623.
Полученный рассмотренным выше образом амид α-гидроксикарбоновой кислоты на следующей стадии может быть превращен в сложный алкиловый эфир α-гидроксикарбоновой кислоты. Соответствующая реакция может быть реализована, например, при использовании алкилформиатов. Пригодным, прежде всего, является метилформиат или смесь метанола с монооксидом углерода (пример подобной реакции приведен в европейской заявке на патент ЕР-А-0407811).
Амид α-гидроксикарбоновой кислоты предпочтительно подвергают алкоголизу спиртом предпочтительно с 1-10, особенно предпочтительно с 1-5 атомами углерода. Предпочтительными спиртами являются, в частности, метанол, этанол, пропанол, бутанол, прежде всего, н-бутанол и 2-метил-1-пропанол, пентанол, гексанол, гептанол, 2-этилгексанол, октанол, нонанол и деканол.