Новый пептид, участвующий в энергетическом гомеостазе
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описана фармацевтическая композиция, содержащая пептид Enho 1 или его функциональный фрагмент, функциональный гомолог или функциональный структурный аналог с консервативными аминокислотными заменами, и фармацевтически приемлемый носитель для лечения и профилактики патофизиологического состояния, связанного с повышенной массой тела. Предложены способы лечения и профилактики патофизиологического состояния, относящегося к гомеостазу массы тела, включающие введение индивидууму терапевтически эффективного количества описанной фармацевтической композиции. Представлены способы улучшения или снижения резистентности к инсулину у индивидуума, облегчения или лечения симптомов диабета у индивидуума, предотвращения или задержки начала ожирения у индивидуума, включающие введение индивидууму терапевтически эффективного количества пептида Enho l или его функционального фрагмента, функционального гомолога или функционального структурного аналога с консервативными аминокислотными заменами. Изобретение можно использовать в качестве терапевтических или диагностических средств при гиперхолестеринемии, гипертриглицеридемии, резистентности к инсулину, ожирении, диабете и/или нарушениях энергетического баланса. 7 н. и 4 з.п. ф-лы, 23 ил., 5 табл.
Реферат
В соответствии с договорами и соглашениями во всех странах по настоящей заявке испрашивается приоритет предварительной патентной заявки США № 60/705940, дата подачи 5 августа 2005 года. В США испрашивается приоритет предварительной патентной заявки США № 60/705940, дата подачи 5 августа 2005 года в соответствии со статьей 35 U.S.C. §119(e).
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому гену и образующемуся в результате белку, называемому "ассоциированный с энергетическим гомеостазом 1" (Enho1), который, как было обнаружено, связан с резистентностью к инсулину и липидемией при ожирении и с изменениями в энергетическом гомеостазе.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Ожирение представляет собой все больше распространяющееся глобальное заболевание, достигшее размахов эпидемии. В настоящий момент оценки указывают, что по меньшей мере 50% западной популяции либо имеют избыточный вес, либо страдают ожирением. Ожирение, особенно ожирение по абдоминальному типу, в сочетании с другими состояниями, такими как резистентность к инсулину, дислипидемия, жировой гепатоз и гипертензия, называется метаболический синдром или синдром резистентности к инсулину. Основными патофизиологическими признаками дислипидемии, связанной с резистентностью к инсулину и диабетом типа 2, являются повышение уровня триглицеридов (TG) плазмы во фракции липопротеинов очень низкой плотности (VLDL) и пониженный холестерин липопротеинов высокой плотности (HDL). Как правило, повышенные количества циркулирующего TG гидролизуются в свободные жирные кислоты (FFA) и захватываются периферическими тканями, включая печень, что может приводить к жировому гепатозу или неалкогольному ожирению печени. Исследования на нескольких моделях ожирения и метаболических расстройств мутантных мышей позволили предположить о сложной связи между резистентностью к инсулину и нарушением регуляции TG и вовлеченности периферических и центральных факторов.
Резистентность к инсулину относится к пониженному поглощению глюкозы в скелетной мускулатуре и жировой ткани, стимулируемому инсулином, и пониженному подавлению выхода глюкозы из печени [2]. Гипергликемия и гиперлипидемия являются побочными эффектами и причинными факторами в патофизиологическом состоянии диабета типа 2. Глюкотоксичность и липотоксичность дополнительно способствуют развитию резистентности к инсулину и диабета типа 2 за счет подавления действия инсулина и его секреции из β-клеток. Сначала гиперинсулинемия успешно подавляет выход глюкозы из печени, кроме того, вредные воздействия повышенного уровня инсулина нейтрализуют благоприятный эффект поддержания нормальных уровней глюкозы в крови [2]. Предполагают, что гиперинсулинемия является фактором в группе метаболических нарушений, включая гипертензию, неалкогольное ожирение печени (NAFLD) и коронарное заболевание сердца [2]. Заболевание NAFLD часто связано с резистентностью к инсулину, и для него необходимы два фактора транскрипции: белок, связывающий регулируемый стеролами элемент, 1c (SREBP1c), и рецептор пролифератора пероксисом γ (PPARγ) (3-6). Отсутствие передачи сигнала SREBP1c или PPARγ в печени ингибирует развитие жирового гепатоза, возникающего у тучных мышей с резистентностью к инсулину [5-7].
Определение общего механизма, объясняющего резистентность к инсулину, было затруднено вследствие сложной системы передачи сигнала рецептора инсулина (IR) и понимания того, что существует не один, а множество факторов, вносящих вклад в развитие заболевания. Фосфорилирование тирозина двух адаптерных белков, IRS1 и IRS2, является важной ранней стадией стимуляции захвата глюкозы под действием инсулина [8-11]. IRS1 и IRS2 не обладают собственной ферментативной активностью и, как полагают, функционируют как часть молекулярного каркаса, облегчающего формирование комплексов белков с киназной, фосфатазной или убиквитинлигазной функцией [12]. Стимуляция фосфоинозитид-3'-киназы (PI3K) посредством ассоциации с IRS является важной стадией захвата глюкозы, стимулированного инсулином. Активация каталитической субъединицы PI3K p110 активирует липидкиназный домен, который фосфорилирует фосфатидилинозит-4,5-бисфосфат. Для полной стимуляции захвата глюкозы под действием инсулина обязательна активация PI3K, хотя также могут быть вовлечены другие пути [12].
Полагают, что метаболическое состояние, ведущее к развитию резистентности к инсулину, является результатом дисбаланса между потреблением калорий и окислительным метаболизмом [13, 14]. Исследования позволяют предположить, что пониженная функция митохондрий в мышцах является фактором развития резистентности к инсулину, связанной с ожирением [14, 15]. Стимуляция потребления энергии и подавление аппетита приводят к улучшению метаболизма глюкозы на моделях ожирения и диабета типа 2 мышей. Хорошо изученным примером является адипоцитокин лептин. Лептин действует в гипоталамусе и заднем мозге, подавляя аппетит, и посредством стимуляции вегетативной нервной системы увеличивает окислительный метаболизм в скелетной мускулатуре [16-20]. Кроме того, независимо от указанного действия на потребление пищи или массу тела лептин также может улучшать чувствительность печени к инсулину [17].
Инфузия жирных кислот (FA) связана с быстрым снижением чувствительности к инсулину в мышцах в пределах 4-6 час [21-23]. Точный механизм, посредством которого FA снижают стимулированный инсулином захват глюкозы, остается предметом дискуссий. Последние данные указывают на то, что FA влияет на сигнальный путь IR, стимулирующий захват глюкозы [21, 22, 24]. Одна из гипотез состоит в том, что повышение внутриклеточной концентрации FA и диацилглицерина ведет к активации серинкиназы, протеинкизазы C θ (PKCθ) [25]. Фосфорилирование IRS1 по Ser307 посредством PKCθ ингибирует фосфорилирование IRS-1 посредством IR, что приводит к пониженной активации PI3K и снижению стимуляции захвата глюкозы под действием инсулина.
Патологическая активность секретируемых полипептидов как связь между ожирением и резистентностью к инсулину. Определение механизмов, связывающих ожирение с резистентностью к инсулину, является важным для разработки новых способов лечения снижения глюкозы. Недавние исследования по изучению резистентности к инсулину были сфокусированы на адипоцитах. Ожирение связано с нарушенной регуляцией и функционированием регуляторной сети полипептидов, секретируемых адипоцитами (адипоцитокинами). Адипоцитокины, такие как лептин, адипонектин и резистин, регулируют продукцию глюкозы в печени, потребление глюкозы в мышцах и пролиферацию адипоцитов и накопление в них липидов [26]. Лептин регулирует энергетический гомеостаз путем воздействия на нейроны, расположенные в гипоталамусе и заднем мозге, которые регулируют пищевое поведение, активность вегетативной нервной системы и нейроэндокринной системы, регулирующих метаболизм (щитовидная железа, надпочечники) [16]. Резистентность к лептину или пониженный сывороточный адипонектин, связанные с ожирением, являются факторами, делающими вклад в развитие резистентности к инсулину, за счет понижения активирующей инсулин активности и за счет увеличения риска развития ожирения (внутриклеточное накопление жирных кислот) [27, 28]. Нежировые ткани также секретируют пептиды, которые влияют на энергетический метаболизм и чувствительность к инсулину, такие как масклин мышц [29] и родственный ангиопоэтину ростовой фактор печени [30]. Эти факторы также могут быть мишенями для лечения метаболического синдрома.
Нокаут рецепторов меланокортина для исследования связи между ожирением и резистентностью к инсулину: В энергетический гомеостаз вовлечены два рецептора меланокортина, экспрессируемых в областях центральной нервной системы. Направленная делеция гена нейронального рецептора меланокортина-4 (MC4R) у мышей (мыши Mc4r-/- или Mc4rKO) вызывает ожирение и гиперинсулинемию, а также связана с увеличенной экспрессией генов липогенеза в печени и жировым гепатозом. У мышей с дефицитом другого нейронального рецептора меланокортина (мыши Mc3r-/- или Mc3rKO) при диете с высоким потреблением жиров развивается степень ожирения, сходная со степенью ожирения мышей Mc4r-/-, но резистентность к инсулину, гиперлипидемия и увеличенный жировой гепатоз имеют отличный уровень. Исследования с использованием линий Mc3rKO и Mc4rKO показали, что в обеих линиях происходит развитие патологического ожирения, вызванное диетой, однако ухудшение чувствительности к инсулину у Mc4rKO происходит быстрее и тяжелее [31, 32]. На фиг.1A-1E проиллюстрированы некоторые из известных различий у мышей дикого типа (C57BL/6J) и двух мышей с нокаутом в единицах массы тела как функция в зависимости от диеты с низким содержанием жира или диеты с высоким содержанием жира [31, 32]. Тяжелая резистентность к инсулину у мышей и людей связана с гепатомегалией и ожирением с увеличенным липогенезом в печени [33]. У Mc4rKO ожирение сопровождается печеночной резистентностью к инсулину и гепатомегалией, а при диете с высоким содержанием жира (HFD) у Mc4rKO отмечается заметное ухудшение гомеостаза глюкозы, связанное с тяжелой непереносимостью глюкозы и инсулина. На фиг.2A-2E показаны различия гепатомегалии и ожирения у двух линий мышей, а также различия экспрессии генов, вовлеченных в метаболизм липидов [4, 17, 57]. С другой стороны, у Mc3rKO, соответствующих Mc4rKO по жировой массе (FM), отмечают крайне незначительное ухудшение гомеостаза глюкозы.
Последовательности кДНК, сходные с Enho1. Последовательность и предполагаемая открытая рамка считывания кДНК, кодирующие соответствующие белковые гомологи ENHO1, опубликованы ранее несколькими группами, принимающими участие в широкомасштабном секвенировании кДНК. См. R.L. Stausberg et al., "Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences," Proc. Natl. Acad. Sci. U.S.A., vol. 99, pp. 16899-16903 (2002) (инвентарный номер Genbank: BC021944, кДНК с полной кодирующей последовательностью); и H.F. Clark et al. "The secreted protein discovery initiative (SPDI), a large-scale effort to identify novel human secreted and transmembrane proteins: a bioinformatics assessment," Genome Res., vol. 13, pp. 2265-2270 (инвентарный номер Genbank: NM_198573, кДНК с полной кодирующей последовательностью). Идентифицирован белок с высокой гомологией с первыми 37 аминокислотными остатками SEQ ID NO: 2. Кроме того, нуклеотидная и аминокислотная последовательность описанного белка может быть неправильной вследствие однонуклеотидных ошибок при секвенировании кДНК. Данные о функции описанного в настоящем документе белка ранее опубликованы не были.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы обнаружили новый секретируемый пептид (ENHO1) при исследовании с использованием двух моделей ожирения на трансгенных мышах. Используя анализ экспрессии генов на микрочипах и проверки посредством количественной ПЦР с детекцией в реальном времени, было обнаружено, что экспрессия мРНК (инвентарный номер Genbank: AK009710), кодирующей предполагаемый секретируемый белок с 76 аминокислотами, в 10 раз снижена у мышей Mc4rKO с тяжелой резистентностью к инсулину и непереносимостью глюкозы и у мышей с дефицитом без лептина (Lepob/Lepob). Напротив, у мышей Mc3rKO с ожирением и умеренной непереносимостью глюкозы, но демонстрирующих нормальный ответ на инсулин, наблюдали невысокое 30-40% снижение экспрессии белка Enho1. У мышей C57BL/6J выявлена отрицательная корреляция экспрессии мРНК Enho1 в печени с уровнями глюкозы при голодании. Экспрессия Enho1 в гипоталамусе при ожирении и резистентности к инсулину также снижалась. Авторы также подтвердили, что мРНК кодировала секретируемый белок. На основе отрицательного воздействия индуцированного диетой ожирения и резистентности к инсулину на экспрессию мРНК Enho1 в печени и головном мозге ген, кодирующий белок, назвали "Enho1" ("ассоциированный с энергетическим гомеостазом 1"). Для увеличения экспрессии Enho1 в моделях ожирения на мышах использовали рекомбинантный аденовирус. Сверхэкспрессия Enho1 путем инъекции аденовируса значительно и воспроизводимо снижала уровни инсулинового голодания, триглицеридов и холестерина. Кроме того, у мышей Lepob/Lepob при обработке аденовирусом с Enho 1 снижались уровни экспрессии ключевого гена, вовлеченного в липогенез (синтазы жирных кислот), и белка FAS.
С использованием ДНК Enho1 (SEQ ID NO: 1) под контролем промотора β-актина человека, который экспрессируется во всех тканях, получена линия трансгенных мышей FVB/NJ, сверхэкспрессирующих белок Enho1. Самки мышей FVB/NJ, сверхэкспрессирующих Enho1, обладали значимо пониженной массой жира и повышенным уровнем метаболизма, определяемого посредством измерения потребления кислорода (VO2) с применением непрямой калориметрии (Oxymax, Columbus Instruments, Columbus, Ohio). Наблюдаемое у трансгенных мышей повышение уровня метаболизма было спрогнозировано на основе результатов экспериментов с использованием мышей с инъекцией рекомбинантного аденовируса, экспрессирующего Enho1. Мыши, инфицированные рекомбинантным аденовирусом, экспрессирующим Enho1, теряли больше массы при ночном голодании, что означает ухудшенную способность снижать уровень метаболизма для компенсации голодания. У трансгенных по Enho1 мышей FVB/NJ наблюдалась сходная увеличенная потеря массы при голодании, связанная с повышенным уровнем метаболизма. Таким образом, составляющая часть антидиабетического действия Enho1 может вовлекать стимуляцию путей, вовлеченных в окислительный метаболизм. Т.е. Enho1 может улучшать метаболический профиль устойчивых к инсулину индивидуумов с ожирением частично посредством нормализации баланса потребления калорий и расхода калорий (кДж) посредством воздействия на психическую активность, базальный уровень метаболизма или их сочетание.
Полноразмерный пептид Enho1 или фрагменты, производные, гомологи, аналоги пептида или их миметики, вводимые путем перорального приема, инъекции, подкожного пластыря или интраназального введения, можно использовать в качестве терапевтических или диагностических средств при гиперхолестеринемии, гипертриглицеридемии, резистентности к инсулину, ожирении, диабете и/или нарушениях энергетического баланса.
К пептидным фрагментам, получаемым на основе открытой рамки считывания, предположенной для BC021944 и показанной на фиг.5, индуцированы антитела (AB1 (SEQ ID NO: 8) и AB2 (SEQ ID NO: 9)). Эти антитела использовали для подтверждения наличия иммунологической реактивности к Enho1 в сыворотке человека и головном мозге крысы, убедительно подтверждая заключение, что открытая рамка считывания, предположенная для BC021944, кодирует небольшой секретируемый пептид. Иммунологическая реактивность к Enho1 выявлена в плазме человека (данные не показаны). В головном мозге крыс нейроны с иммунологической реактивностью к Enho1 выявлены в дугообразном ядре гипоталамуса. Значение этого открытия состоит в том, что нейроны в дугообразном ядре гипоталамуса вовлечены в регуляцию потребления энергии посредством воздействия на условные термогенез и физическую активность и на гомеостаз глюкозы [Cone RD. Anatomy and regulation of the central melanocortin system. Nat. Neurosci. 2005 May; 8(5): 571-8; Coppari R., Ichinose M., Lee C.E., Pullen A.E., Kenny C.D., McGovern R.A., Tang V., Liu S.M., Ludwig T., Chua S.C. Jr., Lowell B.B., Elmquist J.K. The hypothalamic arcuate nucleus: a key site for mediating leptin's effects on glucose homeostasis and locomotor activity. Cell Metab. 2005 Jan.; 1(1): 63-72]. Таким образом, повышенное потребление энергии и физическая активность трансгенных по Enho1 мышей FVB/NJ может включать в себя действие в центральной нервной системе, а более конкретно, посредством действия на основе регуляторной активности нейронов в дугообразном ядре гипоталамуса.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1A показано различие массы тела у 6-месячных самок мышей после 12 недель на диете с низким содержанием жира (LF) или на диете с высоким содержанием жира (HF) в трех различных линиях, дикого типа (WT), мыши с дефицитом Mc3r -/- (Mc3rKO) и мыши с дефицитом Mc4r -/- (Mc4rKO). (Достоверный эффект диеты обозначен посредством "*" (р<0,001) или "#" (р<0,05); достоверные эффекты в пределах диеты обозначены буквами, со значимо отличными группами (р<0,05), определенными различными буквами; достоверность на основе 2-стороннего ANOVA).
На фиг.1B показано различие массы тела, приведенное как процент от исходной массы у 6-месячных самок мышей после 12 недель на диете с низким содержанием жира (LF) или на диете с высоким содержанием жира (HF) в трех различных линиях, дикого типа (WT), мыши с дефицитом Mc3r -/- (Mc3rKO) и мыши с дефицитом Mc4r -/- (Mc4rKO). (Достоверный эффект диеты обозначен посредством "*" (р<0,001) или "#" (р<0,05); достоверные эффекты в пределах диеты обозначены буквами, со значимо отличными группами (р<0,05), определенными различными буквами; достоверность на основе 2-стороннего ANOVA).
На фиг.1C показано различие процента телесного жира у 6-месячных самок мышей после 12 недель на диете с низким содержанием жира (LF) или на диете с высоким содержанием жира (HF) в трех различных линиях, дикого типа (WT), мыши с дефицитом Mc3r -/- (Mc3rKO) и мыши с дефицитом Mc4r -/- (Mc4rKO). (Достоверный эффект диеты обозначен посредством "*" (р<0,001) или "#" (р<0,05); достоверные эффекты в пределах диеты обозначены буквами, со значимо отличными группами (р<0,05), определенными различными буквами; достоверность на основе 2-стороннего ANOVA).
На фиг.1D показано различие массы жира у 6-месячных самок мышей после 12 недель на диете с низким содержанием жира (LF) или на диете с высоким содержанием жира (HF) в трех различных линиях, дикого типа (WT), мыши с дефицитом Mc3r -/- (Mc3rKO) и мыши с дефицитом Mc4r -/- (Mc4rKO). (Достоверный эффект диеты обозначен посредством "*" (р<0,001) или "#" (р<0,05); достоверные эффекты в пределах диеты обозначены буквами, со значимо отличными группами (р<0,05), определенными различными буквами; достоверность на основе 2-стороннего ANOVA).
На фиг.1E показано различие массы без жира у 6-месячных самок мышей после 12 недель на диете с низким содержанием жира (LF) или на диете с высоким содержанием жира (HF) в трех различных линиях, дикого типа (WT), мыши с дефицитом Mc3r -/- (Mc3rKO) и мыши с дефицитом Mc4r -/- (Mc4rKO). (Достоверный эффект диеты обозначен посредством "*" (р<0,001) или "#" (р<0,05); достоверные эффекты в пределах диеты обозначены буквами, со значимо отличными группами (р<0,05), определенными различными буквами; достоверность на основе 2-стороннего ANOVA).
На фиг.2A показано сравнение гистологии печени, поперечные сечения печени, окрашенные гематоксилином и эозином, у самок мышей на диете с высоким содержанием жира в трех линиях мышей, дикого типа (WT), мыши с дефицитом Mc3r -/- (Mc3rKO) и мыши с дефицитом Mc4r -/- (Mc4rKO).
На фиг.2B показано различие массы печени как функции тучности (процента телесного жира) у мышей на диетах с низким и высоким содержанием жира в трех линиях мышей, дикого типа (WT), мыши с дефицитом Mc3r -/- (Mc3rKO) и мыши с дефицитом Mc4r -/- (Mc4rKO).
На фиг.2C показано различие средней массы печени (n=5-6/группа) самцов и самок мышей на диете с умеренно высоким содержанием жира в трех линиях мышей, дикого типа (WT), мыши с дефицитом Mc3r -/- (Mc3rKO) и мыши с дефицитом Mc4r -/- (Mc4rKO). ("*" означает р<0,05 относительно мышей WT и Mc3rKO).
На фиг.2D показано различие экспрессии стеароил-КоА-десатуразы 1 (SCD1) в печени мышей на диете с высоким содержанием жира в трех линиях мышей, дикого типа (WT), мыши с дефицитом Mc3r -/- (Mc3rKO) и мыши с дефицитом Mc4r -/- (Mc4rKO). Данные выражены в виде относительных единиц (о.е.). ("*" означает р<0,05 относительно мышей WT и Mc3rKO).
На фиг.2E показано различие экспрессии аполипопротеина A4 (ApoA4) в печени мышей на диете с высоким содержанием жира в трех линиях мышей, дикого типа (WT), мыши с дефицитом Mc3r -/- (Mc3rKO) и мыши с дефицитом Mc4r -/- (Mc4rKO). ("*" означает р<0,05 относительно мышей WT и Mc3rKO; "#" означает р<0,05 относительно мышей WT, в пределах пола).
На фиг.3A показан уровень экспрессии мРНК AK009710 в печени (приведенный как процент от экспрессии WT) у мышей дикого типа (WT) и у мышей с дефицитом Mc3r -/- с ожирением (Mc3rKO).
На фиг.3B показан уровень экспрессии мРНК AK009710 в печени (приведенный как процент от экспрессии WT) у мышей дикого типа (WT), мышей с дефицитом Mc4r -/- (Mc4rKO) и мышей с дефицитом лептина Lepob/Lepob (две модели ожирения).
На фиг.3C показан уровень экспрессии мРНК AK009710 в печени (приведенный как процент экспрессии с физиологическим раствором) у мышей с дефицитом лептина Lepob/Lepob, 4 раза в течение 2 суток инъецированных или физиологическим раствором, или лептином (0,5 мг/г).
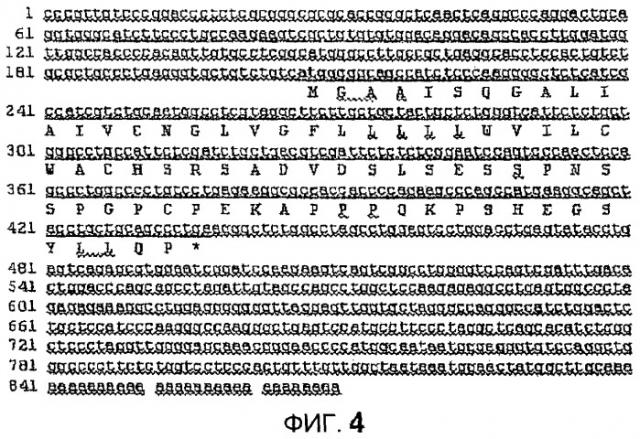
На фиг.4 показана последовательность мРНК гена Enho1 (BC021944; SEQ ID NO: 1) с подчеркнутой открытой рамкой считывания, кодирующей белок Enho1, и демонстрируя предполагаемый продукт трансляции в аминокислоты Enho1 (SEQ ID NO: 2).
На фиг.5 показано выравнивание предполагаемых белковых последовательностей Enho1 для мыши (SEQ ID NO: 2), человека (SEQ ID NO: 14), крысы (SEQ ID NO: 12), собаки (SEQ ID NO: 15), свиньи (SEQ ID NO: 16), коровы (SEQ ID NO: 17), овцы (SEQ ID NO: 18) и шимпанзе (SEQ ID NO: 13), демонстрирующее области предполагаемого секретируемого полипептида, используемые для получения поликлональных антител (pAB1 (SEQ ID NO: 8) и pAB2 (SEQ ID NO: 9)).
На фиг.6A показаны результаты анализа нозерн-блот с использованием радиоактивно меченной части последовательности ДНК AK009710, кодирующей белок Enho1, в образцах ткани человека (дорожки 1-8 представляют РНК из сердца, головного мозга, плаценты, легкого, печени, скелетных мышц, почки и поджелудочной железы соответственно).
На фиг.6B показана относительная интенсивность полос мРНК Enho1 из анализа нозерн-блот с применением зонда полноразмерной ДНК AK009710 мыши на образцах ткани мышей.
На фиг.6C показаны результаты анализа вестерн-блот на иммунологическую реактивность на FLAG в средах (M) и клеточных лизатах (Pel) из полученных из клеток почки человека HEK293, трансфицированных pCMV-Enho1:FLAG, pCMV-GFP, или в средах от клеток HEK293, инфицированных аденовирусным вектором, экспрессирующим слитый белок Enho1:Flag [отсутствие трансфицированной ДНК (дорожки 1, 2); трансфицированные конструкцией pCMV-Enho1:FLAG (дорожки 3, 4); трансфицированные pCMV-Enho1 (дорожки 5, 6) или трансфицированные pCMV-GFP (дорожки 7, 8); инфицированные Ad5Enho1:FLAG (дорожка 9); инфицированные Ad5Enho1 (дорожка 10) или инфицированные Ad5GFP (дорожка 11)]. Для визуализации белка Enho1 получен слитый белок с C-концевой эпитопной меткой FLAG.
На фиг.6D показаны результаты анализа вестерн-блот на белок Enho1 в различных тканях (печень, мышцы и головной мозг) от мышей Mc4r-/-, с инъекцией Ad5-Enho1:FLAG за 4 суток до анализа, вместе с контролями, положительным (клетки HEK293, инфицированные Ad5-Enho1:FLAG) и отрицательным (печень от неинъецированных мышей Mc4r-/-).
На фиг.7A показаны результаты анализа вестерн-блот с использованием лизата из клеток HEK293, инфицированных рекомбинантным Ad5Enho1 (природный белок) или Ad5Enho1:FLAG (меченный C-концевым FLAG слитый белок) после инкубации с поликлональным антителом (pAB1) к N-концу Enho1 (как показано на фиг.5).
На фиг.7B показаны результаты анализа вестерн-блот, используя лизат клеток HEK293, инфицированных рекомбинантным Ad5Enho1 (нативный белок) или Ad5Enho1:FLAG (меченный C-концевым FLAG слитый белок) после инкубации с поликлональным антителом (pAB2, SEQ ID NO: 9) к C-концу Enho1 (как показано на фиг.5).
На фиг.7C показан протокол обработки, используемый для введения Ad5Enho1 или Ad5-GFP в хвостовую вену различных линий мышей для тестирования действия обработки Enho1 на метаболизм мышей (результаты представлены в таблице 1).
На фиг.8A показан уровень экспрессии мРНК синтазы жирных кислот (Fasn) в печени мышей с дефицитом лептина (Lepob/Lepob) с ожирением через восемь суток после инъекции Ad5-Enho1 или Ad5-GFP. Данные выражены в относительных единицах (AU, о.е.) (n=6-8/группа; "*" р<0,05).
На фиг.8B показан уровень экспрессии белка стеароил-КоА-десатуразы (Scd1) в печени мышей с дефицитом лептина (Lepob/Lepob) с ожирением через восемь суток после инъекции Ad5-Enho1 или Ad5-GFP. Данные выражены в относительных единицах (AU) (n=6-8/группа; "*" р<0,05).
На фиг.8C показан уровень экспрессии мРНК ацетил-КоА-карбоксилазы (Acс) в печени мышей с дефицитом лептина (Lepob/Lepob) с ожирением через восемь суток после инъекции Ad5- Enho1 или Ad5-GFP. Данные выражены в относительных единицах (AU) (n=6-8/группа; "*" р<0,05).
На фиг.8D показан уровень экспрессии гена, вовлеченного в резистентность к инсулину (супрессор цитокиновой передачи сигнала), в печени мышей с дефицитом лептина (Lepob/Lepob) с ожирением через восемь суток после инъекции Ad5-Enho1 или Ad5-GFP. Данные выражены в относительных единицах (AU) (n=6-8/группа; "*" р<0,05).
На фиг.9A показана конструкция трансгена (BAP-Enho1), используемая для получения линий трансгенных мышей, сверхэкспрессирующих Enho1.
На фиг.9B показан уровень экспрессии Enho1 в печени трансгенных мышат (полученных с применением трансгена с фиг.9A) от основателей FVB/NJ на 5 неделе.
На фиг.9C показан уровень триглицеридов (TG) при голодании из сыворотки трансгенных мышат (полученных с применением трансгена с фиг.9A) от основателей FVB/NJ на 9 неделе.
На фиг.9D показан состав тканей тела, как измеряют, в виде процента телесного жира (% телесного жира; левая диаграмма) и массы жира (демонстрируя массу свободного жира (FFM) и массу жира (FM); правая диаграмма) у трансгенных мышат (полученных с применением трансгена с фиг.9A) от основателей FVB/NJ на 5 и 9 неделях по сравнению с контролем.
На фиг.9E показано изменение массы жира (демонстрируя массу свободного жира (FFM) и массу жира (FM)) трансгенных мышат (полученных с применением трансгена с фиг.9A) от основателей FVB/NJ через 7 суток на диете с уровнем содержания жира 60%.
На фиг.10 показаны результаты скрининга ПЦР на интеграцию BAP-Enho1 в геном детенышей C57BL/6J (после инъекции BAP-Enho1 в ооциты C57BL/6J), демонстрирующие шесть детенышей из 23 с интеграцией трансгена в геном.
На фиг.11A показано увеличение фосфорилирования Erk в адипоцитах 3T3-L1 через 15 минут после применения секретируемой части белка Enho1 (Enho134-76; SEQ ID NO: 10).
На фиг.11B показано увеличение фосфорилирования Erk в гепатоцитах HepG2 через 15 минут после применения секретируемой части белка Enho1 (Enho134-76; SEQ ID NO: 10).
На фиг.12A показана связь между экспрессией мРНК Enho1 в гипоталамусе и массой тела у шестимесячных мышей трех линий (C57BL/6J (WT), Mc3rKO (Mc3r) или Mc4rKO (Mc4r), в течение трех месяцев содержавшихся на двух диетах (LF=10% кДж/жир; HF=60% кДж/жир).
На фиг.12B показана связь между экспрессией мРНК Enho1 в гипоталамусе и HOMA-IR [(инсулин × глюкоза при голодании)/22,5] у шестимесячных мышей трех линий (C57BL/6J(WT), Mc3rKO (Mc3r) или Mc4rKO (Mc4r), в течение трех месяцев содержавшихся на двух диетах (LF=10% кДж/жир; HF=60% кДж/жир).
На фиг.12C показана связь между HOMA-IR [(инсулин × глюкоза при голодании)/22,5] и экспрессией мРНК Socs3 (супрессор цитокиновой передачи сигнала 3) в гипоталамусе у шестимесячных мышей трех линий (C57BL/6J(WT), Mc3rKO (Mc3r) и Mc4rKO (Mc4r), в течение трех месяцев содержавшихся на двух диетах (LF=10% кДж/жир; HF=60% кДж/жир).
На фиг.13A показана физическая активность (измеренная в перекрытиях луча/10 мин) у мышей дикого типа (WT) и трансгенных мышей BAP-Enho1 (FVB.Tg) в течение 3 суток.
На фиг.13B показана физическая активность (измеренная в перекрытиях луча/10 мин в течение периода) в светлые и темные периоды у мышей дикого типа (WT) и трансгенных мышей BAP-Enho1 (FVB.Tg) в течение периода 24 часа.
На фиг.13C показано полное окисление телесного жира (RER) в темные и светлые периоды у мышей дикого типа (WT) и трансгенных мышей BAP-Enho1 (FVB.Tg) в течение периода 24 часа.
На фиг.13D показан уровень метаболизма (измеренный как VO2 (мл/час × 103)) в темные и светлые периоды у мышей дикого типа (WT) и трансгенных мышей BAP-Enho1 (FVB.Tg) в течение периода 24 часа.
На фиг.13E показан уровень метаболизма как функция от массы свободного жира (измеренный как VO2 (мл/час/гFFM×103)) в темные и светлые периоды у мышей дикого типа (WT) и трансгенных мышей BAP-Enho1 (FVB.Tg) в течение периода 24 часа.
На фиг.13F показан уровень метаболизма как функция от массы тела (измеренный как VO2 (мл/час/гМТ × 103)) в темные и светлые периоды у мышей дикого типа (WT) и трансгенных мышей BAP-Enho1 (FVB.Tg) в течение периода 24 часа.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому секретируемому белку (Enho1) и идентифицирует некоторые из его функций. Обнаружено, что последовательность указанного белка высококонсервативна у различных видов млекопитающих, и последовательности приведены в SEQ ID NO: 2 и 12-18. Кроме того, нуклеиновые кислоты, кодирующие этот белок, использовали для получения мышей, сверхэкспрессирующих белок Enho1, либо посредством инфекции рекомбинантным аденовирусом, экспрессирующим Enho1, либо посредством получения трансгенной линии с использованием ДНК Enho1 под контролем промотора актина.
В одном из вариантов осуществления белок, фрагмент, производное или аналоги Enho1 терапевтически используют для предотвращения патофизиологического состояния, связанного с повышенной массой тела, например, ожирения, гипергликемии, гиперинсулинемии, резистентности к инсулину, гиперлипидемии и инсулиннезависимого сахарного диабета типа 2.
В другом варианте осуществления очищенные белок, фрагмент, производное или аналоги Enho1 выделяют из различных млекопитающих или получают синтетически, или получают с применением клеточных культур, экспрессирующих белок, фрагменты, производные или аналоги, с применением нуклеиновых кислот, кодирующих по меньшей мере двадцать аминокислот из открытой рамки считывания в SEQ ID NO: 1 и как показано на фиг.4.
В другом варианте осуществления получают антитела к белку Enho1, его фрагментам, производным или аналогам. Эти антитела можно использовать в наборе для идентификации белка Enho1 в различных образцах, включая жидкости организма.
В другом варианте осуществления получают трансгенных животных, сверхэкспрессирующих белок Enho1, посредством связывания последовательности Enho1 и активным промотором, например, с промотором актина.
В другом варианте осуществления получают трансформирующий вектор, содержащий по меньшей мере открытую рамку считывания SEQ ID NO: 1 (часть, подчеркнутую на фиг.4).
ПРИМЕР 1
Открытие белка Enho1 и его функции
Проводили анализ экспрессии генов в печени на микрочипах у худых мышей и мышей с ожирением Mc3rKO с применением чипов, напечатанных из библиотек 16463-18400 70-членных олигонуклеотидов (Mouse Array-Ready Oligo Set Version 2,0, Qiagen Operon, Alameda, CA) (34-36). Данные микрочипов указывали на повышенную экспрессию генов, вовлеченных в метаболизм липидов (аполипопротеины) и окислительный стресс, дополнительно к ожирению. Представляет интерес, что в печени мышей Mc3rKO независимо от возраста, пола и степени ожирения была снижена экспрессия только трех генов. Два из генов кодировали белки с известной функцией: нейраминидазу 3 (neu3), кодирующую фермент, отщепляющий сиаловую кислоту от гликопротеинов и гликолипидов, и представитель семейства растворенных носителей 21 (slc21al), кодирующий транспортер органических анионов. Третий ген (AK009710) являлся новым и не имел установленной функции в базах данных.
Количественная ПЦР с детекцией в реальном времени подтвердила данные микрочипов, демонстрируя тенденцию к умеренному снижению экспрессии AK009710 в печени Mc3rKO (фиг.3A). Представляет интерес, что более сильное снижение экспрессии AK009710 наблюдали в печени у мышей Mc4rKO с сильной устойчивостью к инсулину и у мышей с дефицитом лептина (Lepob/Lepob) (фиг.3B). Кроме того, кратковременная обработка лептином (4 инъекции 0,5 мг/г лептина в течение 2 суток) значимо увеличивала Enho1 в печени мышей Lepob/Lepob (Фиг.3C). Экспрессия AK009710 у 6-месячных худых Mc4rKO находится в норме (данные не показаны), указывая на то, что снижение экспрессии в печени Mc4rKO является вторичным относительно связанного с возрастом начала ожирения, резистентности к инсулину и жирового гепатоза [32]. Кроме того, экспрессия AK009710 отрицательно коррелировала с уровнем глюкозы при голодании у мышей с индуцированным диетой ожирением C57BL/6J (n=13, R2=0,67, P<0,001) (данные не показаны).
Все вместе, эти результаты означают идентификацию небольшого секретируемого белка, экспрессия которого в печени снижается с чувствительностью к инсулину и жировым гепатозом. На основе наблюдения того, что снижение экспрессии AK009710 в печени коррелирует с тяжестью жирового гепатоза и резистентности к инсулину и того, что это снижение обращается посредством активатора инсулина, было выбрано название "ассоциированный с энергетическим гомеостазом 1" (Enho1).
Олигонуклеотидные праймеры к мРНК AK009710 использовали для измерения экспрессии гена AK009710 в кДНК печени различных моделей ожирения и резистентности к инсулину на мышах. Последовательности праймеров представляли собой: смысловой 5'-cctgagggtgctgtctgtcatg-3' (SEQ ID NO: 3), антисмысловой 5'-cagtagcagcaagaagcctacg-3' (SEQ ID NO: 4), зонд 5'-6FAM- ctctcatcgccatcgtctgca-BHQ-3' (SEQ ID NO: 5). В соответствии с исходным результатом на микрочипах экспрессия мРНК AK009710 была снижена в печени мышей Mc3r-/- по сравнению с мышами WT (на 55%, р<0,05; фиг.3A). Затем исследовали экспрессию мРНК AK009710 в печени в двух моделях ожирения: мыши Mc4r-/- и мыши с дефицитом лептина Lepob/Lepob. По сравнению с мышами дикого типа (WT) мРНК AK009710 в обеих моделях экспрессировалась на уровнях приблизительно в 10 раз меньших (фиг.3B). Когда всех животных группировали вместе, наблюдали отрицательные связи между экспрессией мРНК AK009710 и уровнями глюкозы и инсулина (данные не показаны). Экспрессия гена AK009710 была не изменена в печени получавших в достатке пищу молодых и взрослых мышей WT, голодавших 16 часов или голодавших 24 часа, и снова получавших пищу в течение 4 часов (данные не показаны). Полагают, что AK009710 не изменяется в зависимости от состояния питания.
Для определения того, может ли уровень мРНК AK009710 регулироваться вторично, относительно развития резистентности к инсулину, мРНК AK009710 измеряли в печени молодых, нормоинсулинемических, и более взрослых, гиперинсулинемических, мышей Mc4r-/-. Наблюдали, что уровень мРНК AK009710 у молодых мышей Mc4r-/- (средний возраст ~7 недель) был сходен с уровнем у мышей дикого типа, тогда как он значимо снижался у более взрослых (~16 недель) мышей Mc4r-/- (данные не показаны). Кроме того, уровень мРНК AK009710 также измеряли в небольшом количестве (n=4) полученных от человека гепатоцитов от индивидуумов с диабетом и без. Хотя в образцах с диабетом экспрессия имела тенденцию к снижению, различия были статистически недостоверными (данные не показаны).
Таким образом, хотя ожирение у мышей Mc3r-/- и Mc4r-/- сходно, известно, что у мышей Mc4r-/- резистентность к инсулину и повышенные уровни липидов в сыворотке (триглицериды, холестерин) являются более сильными. У мышей Mc4r-/- снижение экспрессии гена AK009710 в печени коррелирует с известной тяжестью резистентности к инсулину и гиперлипидемии.
ПРИМЕР 2
Анализ последовательности и биоинформационный анализ
AK009710 представляет собой клон кДНК языка мыши 1247 п.н. в длину и принадлежит кластеру Unigene Mm.34074, 2310040A07Rik: RIKEN кДНК гена 2310040A07. Гипотетически он может кодировать белок из 534 аминокислот непосредственно от 5'-конца последовательности. Учитывая, что этот предполагаемый белок не начинается с остатка метионина, он был зарегистрирован как укороченный продукт. Анализ BLAST AK009710 на гомологичные последовательности EST или кДНК по базе данных NCBI выявил значительное соответствие с NM198573, транскриптом человека, открытым с помощью широкомасштабного проекта по открытию секретируемых белков, кодирующим гипотетический белок из 87 а.к. (UNQ470/GAAI470) (37). Совпадение с последовательностью человека, NM_198573, составляло 85% идентичности на протяжении 392 нуклеотидов, p=5e-83. Последовательность человека кодировала белок из 87 аминокислот в одном экзоне. Трансляция AK009710 в шесть рамок выявила открытую рамку считывания, кодирующую белок из 76 аминокислот (SEQ ID NO: 2). Выравнивание этого предполагаемого белка мыши и белка человека, кодируемого NM_198573 (GAAI470 или UNQ470), выявило сильную гомологию на протяжении первых 37 остатков. UNQ470/GAAI470 картируется на хромосоме 9p13.2 и расположен рядом с геном рецептора цилиарного нейротрофического фактора (CNTFR).
Последовательность AK009710 подтверждали с использованием кДНК, выделенной из печени мышей. Кроме того, с данными секвенирования авторов согласуется кДНК длиной 868 п.н., клонированная из печени мышей в National Institutes of Health Mammalian Gene Collection (MGC) Program, с инвентарным номером BC021944, недавно помещенная в базу данных NCBI (фиг.4, SEQ ID NO: 1). Анализ BLAST выявил, что предсказанная последовательность из 76 а.к. для мыши (SEQ ID NO: 2) является высококонсервативной у различных видов млекопитающих (фиг.5; SEQ ID NO: 12 (крыса), SEQ ID NO: 13 (шимпанзе); SEQ ID NO: 14 (человек); SEQ ID NO: 15 (собака); SEQ ID NO: 16 (свинья); SEQ ID NO: 17 (корова); SEQ ID NO: 18 (овца)). На фиг.5, pAB1 (SEQ ID NO: 8) и pAB2 (SEQ ID NO: 9) относятся к областям предполагаемого секретируемого полипептида, используемым для получения поликлональных антител. Предсказанная сигнальная последовательность подчеркнута. Кроме того, были синтезированы пептиды, соответствующие аминокислотам с 34 до 76