Способ ускорения регенерации костной ткани при проведении остеосинтеза
Иллюстрации
Показать всеИзобретение относится к медицине, а в частности к реконструктивной хирургии. В качестве имплантата для остеосинтеза используют титановые пластины с многофункциональным биоактивным наноструктурным покрытием, включающим композиционные СВС - мишени ТiС0.5+10%Са10(РO4)6(ОН)2, нанесенные по технологии ионноплазменного осаждения на металлические подложки при одновременной ионной имплантации. Сначала осуществляют моделирование имплантата в соответствии с необходимым контуром костных фрагментов и его фиксацию к кости титановыми шурупами. Далее укрывают область остеосинтеза окружающими мягкими тканями, после чего в область остеосинтеза инъекционно вводят 2-20 мл аутологичного красного костного мозга. На 7-е и 10-е сутки послеоперационного периода под ультразвуковой навигацией осуществляют транскутанное пошаговое пункционное введение аутологичного красного костного мозга по ходу фиксированного титанового имплантата в зоне остеосинтеза. В том случае, если к моменту повторных введений в зоне оперативного вмешательства сохраняется выраженная местная воспалительная реакция тканей, объем вводимого красного костного мозга удваивают по сравнению с объемом, введенным интраоперационно, а в том случае, если местная воспалительная реакция выражена слабо, красный костный мозг вводят в том же объеме, что и интраоперационно. Способ обеспечивает снижение послеоперационных осложнений, ускорение регенерации костной ткани в области остеосинтеза при обширных хирургических вмешательствах у больных, имеющих снижение регенераторных свойств костной ткани. 2 ил.
Реферат
Изобретение относится к медицине, в частности реконструктивной хирургии, и может быть использовано при операциях на костных структурах челюстно-лицевой зоны и опорно-двигательной системы.
Название «остеосинтез» происходит от греческих слов osteon (кость) и synthesis (соединение). Исходя из названия, этот метод лечения заключается в соединении отломков поврежденных костей для достижения репозиции отломков и восстановления целостности кости. Применяются два вида остеосинтеза: погружной и наружный. Кроме того, разработаны комбинированные методики репозиции костной ткани: внутрикостно-чрескостный, внутрикостно-накостный и чрескостно-накостный.
Различают абсолютные и относительные показания для проведения остеосинтеза. Среди абсолютных показаний переломы, срастание которых без оперативного вмешательства не представляется возможным. Это переломы в области многофункциональных суставов, таких как шейка бедренной кости, надколенник, локтевой отросток, открытые переломы, переломы с повреждением крупных сосудов и нервных волокон. Относительными показаниями являются: вторичное смещение отломков кости, несрастающиеся переломы, формирование ложного сустава.
Из уровня техники известны различные способы и устройства для проведения остеосинтеза при операциях на костных структурах челюстно-лицевой зоны и опорно-двигательной системы. В частности, известен способ остеосинтеза при травматическом повреждении позвоночника, включающий фиксацию к телам позвонком матрицы-фиксатора из пористого никелида титана с мобилизованными культивированными стромальными стволовыми клетками костного мозга (RU 2269961 С2, 20.02.2006).
К недостаткам этого метода следует отнести:
- выраженные трудности по культивированию стромальных клеток из костного мозга, требующие наличие специализированной лаборатории;
- наличие ячеистой, пористой структуры материала является оптимальным для адсорбции и культивирования стволовых клеток, однако подобная структура материала резко снижает прочностные характеристики никелида титана, что особенно важно при использовании данного материала при имплантации в ткани, подвергающиеся высокой физической нагрузке.
Наиболее близким способом, выбранным нами в качестве ближайшего аналога, является способ проведения остеосинтеза, описанный в работе Бахтинова А.А. «Способ аутотрансплантации костного мозга в сочетании с препаратами гидроксиапатита для замещения дефектов и костных полостей челюстных костей» (Бахтинов А.А. «Клинико-рентгенологическая и биохимическая характеристика результатов аутотрансплантации костного мозга в сочетании с препаратами гидроксиапатита для замещения дефектов и костных полостей челюстных костей», автореферат дисс. к.м.н., 2004). Способ заключается в том, что для замещения костных дефектов используют пломбировку патологических полостей посредством аутотрансплантации костного мозга в сочетании с имплантацией различных видов и форм гидроксиапатита.
К недостаткам этого метода следует отнести:
- возможность возмещения только небольших полостных костных дефектов;
- технические трудности возмещения костных дефектов основания черепа и лицевой зоны посредством моделирования имплантата согласно конфигурации дефекта и его фиксация к окружающим тканям;
- невозможность обеспечения прочностных свойств костных структур, работающих под нагрузкой.
Техническим результатом предложенного нами способа является снижение количества послеоперационных осложнений и ускорение регенерации костной ткани в области остеосинтеза при обширных хирургических вмешательствах у больных, имеющих снижение регенераторных свойств костной ткани (у онкологических больных, ранее проходивших курсы полихимиотерапии и лучевой терапии), а также при выраженных воспалительных и травматических поражениях опорно-двигательной системы. Кроме того, предложенный способ обеспечивает предотвращение иммунных реакций отторжения трансплантата, надежную фиксацию имплантата и стабильность костных структур в зоне остеосинтеза, и позволяет избежать трудностей, связанных с культивированием стромальных клеток. Также предложенный способ позволяет сохранить и постепенно, дозировано увеличить количество стромальных клеток в области остеосинтеза, за счет двукратного дополнительного введения свежего красного костного мозга в послеоперационном периоде, уменьшить риск полной гибели стромальных клеток в случае присоединения инфекционного агента.
Указанный технический результат достигается при осуществлении совокупности приемов предложенного нами способа.
Способ осуществляют следующим образом.
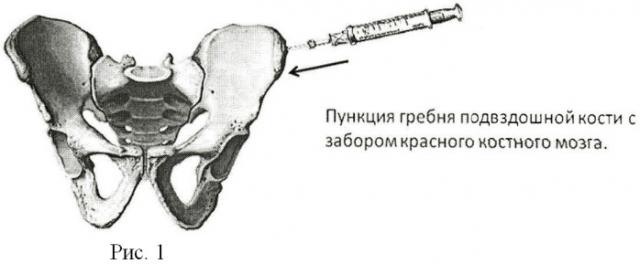
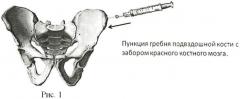
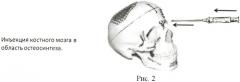
Остеосинтез в области резекции костных фрагментов осуществляют посредством титановых пластин для остеосинтеза с многофункциональным биоактивным наноструктурным покрытием (ТУ 9438-003-11458417-2004) с использованием композиционных СВС-мишеней (СВС - самораспространяющийся высокотемпературный синтез - процесс перемещения волны химической реакции по смеси реагентов с образованием твердых конечных продуктов, проводимый с целью синтеза веществ, материалов) ТiС0.5+10%Са10(РO4)6(ОН)2 (ТУ 1984-019-11301236-2005) производства ЗАО НПО «Металл», нанесенных по технологии ионноплазменного осаждения на металлические подложки при одновременной ионной имплантации. Данное биосовместимое покрытие защищено патентом RU №2281122 С1, 10.08.2006. Осуществляют моделирование в соответствии с необходимым контуром костных фрагментов и фиксацию к кости титановыми шурупами. Область остеосинтеза укрывают окружающими мягкими тканями. Далее посредством пункции гребня подвздошной кости иглой Кассирского осуществляют забор красного костного мозга (рис.1) в объеме от 2 до 20 мл в зависимости от размера операционного дефекта. Полученный аутологичный костный мозг инъекционно вводят непосредственно в область осуществленного остеосинтеза (рис.2). Операционную рану ушивают послойно наглухо. В послеоперационном периоде больному проводят стандартную противовоспалительную и антибактериальную терапию. На 7-е и 10-е сутки послеоперационного периода под ультразвуковой навигацией осуществляют транскутанное (чрескожное) пошаговое пункционное введение аутологичного красного костного мозга по ходу фиксированного титанового имплантата в зоне остеосинтеза. В том случае, если к моменту повторных введений в зоне оперативного вмешательства сохраняется выраженная местная воспалительная реакция тканей, объем вводимого красного костного мозга удваивают (по сравнению с объемом, введенным интраоперационно). В том случае, если местная воспалительная реакция выражена слабо, красный костный мозг вводят в том же объеме, что и интраоперационно.
Особенность заявляемого способа заключается в том, что данный способ позволяет, во-первых, объединить вместе прочностные характеристики титановой пластины, возможность свободного моделирования контура и формы имплантата в зависимости от размеров и формы костных структур непосредственно во время операции, и «репаративные» свойства аутологичного красного костного мозга. Во-вторых, наноструктурное кальцийсодержащее покрытие обладает определенной биологической активностью, то есть способностью активно взаимодействовать с окружающими тканями с образованием непосредственной связи с ними. В сочетании с введенными аутологичными клетками красного мозга наноструктурное покрытие проявляет свойство остеоиндуктивности, то есть способность к адгезии на материале остеогенных клеток, которая в сочетании с пористостью материала обеспечивает неоваскуляризацию, поддержку пролиферации и дифференцировки клеток из окружающей живой ткани (в частности, вводимого костного мозга), что приводит к ускорению образования костной ткани. Пористая структура и шероховатая поверхность используемого имплантата с наноструктурным кальцийсодержащим покрытием позволяет обеспечить оптимальные условия для адгезии стволовых клеток из аутологичного костного мозга, осуществлять надежную интеграцию имплантата в области остеосинтеза. Использование аутологичного красного костного мозга, содержащего стволовые клетки, обеспечивает надежную и ускоренную регенерацию костной ткани в области остеосинтеза даже у пациентов, ранее подвергнутых лучевой и химиотерапии, и, как следствие, имеющих выраженное ослабление регенераторных свойств тканей.
Предложенный способ поясняется следующими клиническими примерами.
Пример 1. Больной О., 47 лет. Диагноз: рак слизистой дна полости рта IV стадии T4N1M0. Состояние после 3-х курсов ПХТ в IX-X 2007 году. Продолженный рост опухоли. Выполнена операция: удаление опухоли дна полости рта с остеосинтезом тела нижней челюсти титановыми пластинами с наноструктурным покрытием.
При хирургическом вмешательстве по поводу остаточной опухоли слизистой оболочки полости рта с вовлечением в процесс тела нижней челюсти после ранее проведенного химиолучевого лечения производилось удаление опухоли в пределах здоровых тканей с блоковой резекцией фрагмента тела нижней челюсти, с последующим остеосинтезом резецированных фрагментов нижней челюсти титановой пластиной с наноструктурным покрытием, фиксированной посредством титановых шурупов. Дефект слизистой полости рта и обнаженные костные структуры укрывали перемещенными слизистыми и мышечными лоскутами полости. Далее в область имплантации титанового имплантата пункционным методом вводили 5 мл аутологичного костного мозга. Ранний послеоперационный период сопровождался выраженной местной воспалительной реакцией тканей в зоне хирургического вмешательства - к 7 суткам в зоне хирургического вмешательства значительный отек, гиперемия тканей, обильное отделяемое по дренажам. Больному согласно срокам на 7 и 10-е сутки под ультразвуковой навигацией осуществляется транскутанное пошаговое пункционное введение аутологичного красного костного мозга по ходу фиксированного титанового имплантата в зоне остеосинтеза в объеме 10 мл. Дальнейший послеоперационной период протекал гладко, операционная рана зажила первичным натяжением. Состояние костных структур в области остеосинтеза контролировалось рентгенологически, патологических изменений со стороны костных структур не выявлено, зрелая костная мозоль сформирована. В настоящее время больной направлен в Центральный Научно-исследовательский институт стоматологии для дентального протезирования.
Пример 2. Больная Ч., 51 год. Диагноз: рак слизистой правой щеки. Состояние после химиолучевой терапии СОД-58Гр в 2004 году. Продолженный рост опухоли. Состояние после хирургического лечения в 2005 году. Без рецидива и метастазов. Тризм III степени. Состояние после отсроченной микрохирургической реконструкции в 12.2006 г.
Выполнена операция: контурная пластика лица справа с остеосинтезом нижней челюсти титановой пластиной с наноструктурным покрытием.
Хирургическое вмешательство при отсутствии опухолевого рецидива, требующее коррекции тканей после ранее перенесенного противоопухолевого лечения, включало в себя иссечение рубцово-измененных тканей, мобилизацию костных фрагментов ранее пересаженного трансплантата и сохраненных собственных костных фрагментов челюстно-лицевого скелета. Производился демонтаж ранее установленных стабилизирующих материалов и повторная остеотомия. Далее производилась контурная пластика костных фрагментов аутотрансплантата согласно конфигурации конкретной области лицевого скелета с остеосинтезом костных фрагментов титановой пластиной с наноструктурным покрытием. Дополнительно производилась коррекция избытка мягких тканей лица. Операционная рана ушивалась послойно с тщательной изоляцией мягкими тканями области остеосинтеза. В область остеосинтеза пункционно введено 7 мл аутологичного костного мозга. Ранний послеоперационный период протекал без осложнений - к 7-ым суткам в зоне вмешательства отек и гиперемия тканей отсутствовали, по дренажам - скудное серозное отделяемое. Больной согласно срокам на 7 и 10-е сутки под ультразвуковой навигацией осуществляется транскутанное пошаговое пункционное введение аутологичного красного костного мозга по ходу фиксированного титанового имплантата в зоне остеосинтеза в объеме 7 мл. Состояние костных структур в области остеосинтеза контролировалось рентгенологически, патологических изменений со стороны костных структур не выявлено, зрелая костная мозоль сформирована. В настоящее время больная направлен в Центральный Научно-исследовательский институт стоматологии для дентального протезирования.
Пример 3. Больная Ш., 44 года.
Диагноз: Хондросаркома верхней челюсти слева 1а стадия. T1aN0M0G1. Состояние после хирургического лечения в октябре 2005 года. Рецидив опухоли. Состояние после трех сеансов внутритканевой СВЧ гипертермии в 2006 г. и хирургического лечения в 2006 г. Оростома. Трахеостома. Без рецидива опухоли. Состояние после отсроченной микрохирургической реконструкции нижней челюсти в 02.2008 г.
Выполнена операция: коррекция костного трансплантата верхней челюсти с остеосинтезом титановыми пластинами с наноструктурным покрытием.
При хирургическом вмешательстве по коррекции лоскута в зоне стенок орбиты производился инфраорбитальный доступ к тканям орбиты и верхней челюсти, с иссечением рубцово-измененных тканей. Обнажались ткани ранее пересаженного лоскута, при необходимости производилась редукция избытка костного фрагмента ранее пересаженного лоскута. Согласно имеющегося дефекта костных структур черепа, по имеющейся стериолитографической модели, выполнялось моделирование титановой пластины согласно анатомическим контурам орбиты, дополнительно к имплантату фиксировался фрагмент резецированного костного фрагмента аутотрансплантата. Смоделированный имплантат располагался в операционном дефекте и фиксировался к окружающим костным структурам посредством титановых шурупов. Операционная рана зашивалась наглухо с тщательной изоляцией титанового имплантата окружающими мягкими тканями. В область остеосинтеза пункционно введено 10 мл аутологичного костного мозга. Ранний послеоперационный период протекал без осложнений. Больной согласно срокам на 7 и 10-е сутки под ультразвуковой навигацией осуществляется транскутанное пошаговое пункционное введение аутологичного красного костного мозга по ходу фиксированного титанового имплантата в зоне остеосинтеза в объеме 10 мл. Состояние костных структур в области остеосинтеза контролировалось рентгенологически, патологических изменений со стороны костных структур не выявлено, титановый имплантат стабилен, фрагмент трансплантированной аутологичной костной ткани жизнеспособен.
Пример 4. Больной Ж., 32 года. Диагноз: злокачественная фиброзная гистиоцитома левого предплечья IАст. T1aNoMo G1. Выполнена операция: сегментарная резекция левого предплечья с реконструкцией дистального сегмента предплечья малоберцовым трансплантатом.
При хирургическом вмешательстве по поводу опухоли левого предплечья произведена сегментарная резекция левого предплечья с резекцией левой локтевой кости на протяжении 20 см. Для замещения дефекта тканей левого предплечья использована микрохирургическая пересадка аутологичного кожно-мышечно-костного трансплантата с левой голени, включающего фрагмент левой малоберцовой кости длиной 20 см, мягкие ткани левой голени и кожная площадка размером 10×10 см. Костный фрагмент малоберцового трансплантата фиксирован к фрагментам резецированной локтевой кости шурупами посредством титановой пластины с наноструктурированным биокерамическим покрытием и внешним аппаратом внеочагового остеосинтеза Елизарова. После осуществления остеосинтеза и послойного ушивания операционной раны в область остеосинтеза малоберцового трансплантата и резецированной локтевой кости левого предплечья пункционно введено 20 мл аутологичного костного мозга. Ранний послеоперационный период протекал без осложнений и выраженной местно воспалительной реакцией тканей в зоне хирургического вмешательства. Больному согласно срокам на 7 и 10-е сутки под ультразвуковой навигацией осуществляется транскутанное пошаговое пункционное введение аутологичного красного костного мозга по ходу фиксированного титанового имплантата в зоне остеосинтеза в объеме 20 мл. Дальнейший послеоперационной период протекал гладко, операционная рана зажила первичным натяжением. Состояние костных структур в области остеосинтеза контролировалось. Рентгенологически патологических изменений со стороны костных структур не выявлено, зрелая костная мозоль сформирована. В настоящее время больной полностью реабилитирован. Функция левой верхней конечности удовлетворительная.
Пример 5. Больная В., 17 лет. Диагноз: рабдомиосаркома верхней трети левой голени IB ст T2bNoMoG2.
Выполнена операция: сегментарная резекция левой большеберцовой кости с реконструкцией дистального сегмента голени малоберцой костью с правой нижней конечности.
При хирургическом вмешательстве по поводу опухоли левой большеберцовой кости произведена сегментарная резекция левой голени с резекцией левой большеберцовой кости на протяжении 10 см. Для замещения дефекта тканей левой голени использована микрохирургическая пересадка аутологичного кожно-мышечно-костного транспланта с правой голени, включающего фрагмент левой малоберцовой кости длиной 10 см, мягкие ткани правой голени. Костный фрагмент малоберцового трансплантата фиксирован к фрагментам резецированной левой большеберцовой кости титановой пластиной с наноструктурированным биокерамическим покрытием посредством шурупов и внешним аппаратом внеочагового остеосинтеза Елизарова. После осуществления остеосинтеза и послойного ушивания операционной раны в область остеосинтеза малоберцового трансплантата и резецированной локтевой кости левого предплечья пункционно введено 20 мл аутологичного костного мозга. Ранний послеоперационный период протекал без осложнений и выраженной местно воспалительной реакцией тканей в зоне хирургического вмешательства. Больному согласно срокам на 7 и 10-е сутки под ультразвуковой навигацией осуществляется транскутанное пошаговое пункционное введение аутологичного красного костного мозга по ходу фиксированного титанового имплантата в зоне остеосинтеза в объеме 20 мл. Дальнейший послеоперационной период протекал гладко, операционная рана зажила первичным натяжение. Состояние костных структур в области остеосинтеза контролировалось. Рентгенологически патологических изменений со стороны костных структур не выявлено, зрелая костная мозоль сформирована через 3 мес. В настоящее время больная полностью реабилитирована. Опорная функция левой нижней конечности сохранена.
Способ ускорения регенерации костной ткани при проведении остеосинтеза, включающий использование аутологичного красного костного мозга, полученного путем пункции гребня подвздошной кости, и имплантата, отличающийся тем, что в качестве имплантата используют титановые пластины для остеосинтеза с многофункциональным биоактивным наноструктурным покрытием, включающим композиционные СВС-мишени ТiС0,5+10%Са10(РO4)6(ОН)2, нанесенные по технологии ионноплазменного осаждения на металлические подложки при одновременной ионной имплантации; осуществляют моделирование имплантата в соответствии с необходимым контуром костных фрагментов и его фиксацию к кости титановыми шурупами, далее укрывают область остеосинтеза окружающими мягкими тканями, после чего в область остеосинтеза инъекционно вводят 2-20 мл аутологичного красного костного мозга; на 7-е и 10-е сутки послеоперационного периода под ультразвуковой навигацией осуществляют транскутанное пошаговое пункционное введение аутологичного красного костного мозга по ходу фиксированного титанового имплантата в зоне остеосинтеза, при этом, если к моменту повторных введений в зоне оперативного вмешательства сохраняется выраженная местная воспалительная реакция тканей, объем вводимого красного костного мозга удваивают по сравнению с объемом, введенным интраоперационно, а в том случае, если местная воспалительная реакция выражена слабо, красный костный мозг вводят в том же объеме, что и интраоперационно.