Применение ингибиторов урокиназы для лечения и/или предупреждения невропатологических заболеваний
Иллюстрации
Показать всеНастоящее изобретение относится к области медицины и фармакологии и касается применения ингибитора урокиназы, представляющего собой 4-хлорбензилсульфонил-(D)-Ser-Gly-(4-гуанидинобензил)амид или его фармацевтически приемлемую соль, для профилактики и/или лечения бокового амиотрофического склероза, фармацевтичекой композиции для профилактики и/или лечения бокового амиотрофического склероза, ее применения для лечения и/или предупреждения нейропатологических и/или нейродегенеративных заболеваний, а также способа ингибирования активности урокиназы. Изобретение повышает эффективность лечения. 4 н. и 3 з.п. ф-лы, 4 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам и композициям для лечения и/или предупреждения невропатологических и/или нейродегенеративных заболеваний. В частности, изобретение относится к новым применениям ингибиторов активатора плазминогена типа урокиназы при лечении бокового амиотрофического склероза.
Уровень техники
Система активации плазминогена
Удаление сгустков крови из кровотока и метаболизм белков внеклеточного матрикса облегчаются специальными ферментами. Одним очень важным ферментом в таком наборе является плазмин. Плазмин выполняет несколько функций, но вообще признано, что его основной ролью является разрушение фибрина - структурного скелета сгустка крови. Активатор тканевого плазминогена серинпротеазы (t-PA) и урокиназа (u-РА) опосредуют образование плазмина из его неактивного предшественника плазминогена. Специфические физиологические ингибиторы серинпротеаз, такие как ингибитор активатора плазминогена (PAI)-1 и PAI-2, в свою очередь регулируют протеолитическую активность t-PA и u-РА. Также существует специфический рецептор клеточной поверхности для u-РА, который не только обеспечивает средство генерации локализованной протеолитической активности в перицеллюлярной окружающей среде, но, с помощью соседних трансмембранных белков, может передавать сигналы в клеточное ядро и влиять на картину экспрессии других генов.
Система активации плазминогена также принимает активное участие в перемещении клеток, заживлении ран и метастатическом распространении рака. Наконец, кроме того, существует свидетельство того, что система активации плазминогена также вносит вклад в метаболизм внеклеточного матрикса в центральной нервной системе.
Также имеется в виду, что функции системы урокиназы в головном мозгу обнаруживаются при различных нормальных и патологических событиях, включая пластичность и неврологические расстройства и опухоли, имеющие нейронное или глиальное происхождение. Поэтому представляется, что урокиназа и ее рецептор, экспрессированные в центральной нервной системе, играют роль в нейронной и/или (астро)глиальной миграции, синаптогенезе, ремоделировании и реактивных процессах (Del Biglio et al., Int. J. Dev. Neurosci., 1999, 17, 387-99). Например, показано, что t-PA играет роль в способности к запоминанию, может опосредовать обратную пластичность окклюзии зрительной зоны коры головного мозга и промотирует нейродегенерацию.
Макрофаги и микроглиальные клетки секретируют активаторы плазминогена при различных состояниях. Представляет интерес, что микроглиальные клетки и макрофаги пролиферируют и накапливаются в поврежденных участках головного мозга, вероятно, запуская, помимо других действий, внеклеточный протеолиз. Разрушение белков внеклеточного матрикса участвует не только во вторичных повреждениях головного мозга, но также в ангиогенезе. Более того, в литературе сообщается, что uPA в головном мозге может играть роль в регуляции потребления пищи (Miskin and Masos, J.Gerontol., A Bio. Sci. Med. Sci., 1997, 52, B118-24). Результаты, полученные позднее, подтверждают участие системы урокиназы в пластичности, связанной с обучением (Meiri et al., Proc. Natl. Acad. Sci., 1994, 91, 3196-3200).
Кроме опухолей головного мозга, таких как злокачественные глиомы, местами заметно вырастает процент западного населения, страдающего от невропатологических заболеваний, в которых серинпротеаза может играть существенную роль.
Оказывается, что серинпротеазы играют активную роль в пластичности нейромышечной связи и, следовательно, являются основной для функционирования и дисфункции нейронов. Плазминогенная система также вовлекается в протеолитические процессы при повреждении головного мозга и при воспалении, и все может вносить вклад в патогенез нейродегенеративных заболеваний, таких как, например, болезнь Альцгеймера, болезнь Крейтцфельда-Якоба, боковой амиотрофный склероз (ALS), рассеянный склероз (MS), болезнь Паркинсона и т.д.
Компоненты повреждений системы активатора плазминогена при рассеянном склерозе (MS) охарактеризованы и, оказывается, концентрируются в клетках зоны воспаления. Предполагается, что возрастание активатора плазминогена урокиназы в повреждениях при MS облегчает клеточную инфильтрацию в паренхиму головного мозга и, таким образом, поддерживает воспалительный процесс в центральной нервной системе больных MS (Washington et al., J.Neurosci. Re., 1998, 45, 392-399).
ALS характеризуется возрастанием потери двигательных нейронов, патологические изменения которых ведут к резко выраженной мышечной слабости, приводящей к смерти большинства пораженных пациентов в течение 2-5 лет после постановки диагноза. Патология описана уже в начале 20-го века как потеря клеток переднего рога спинного мозга, клеток Беца в коре головного мозга и дегенерация корково-спинномозгового пирамидного пути (Holmes, 1909).
Документально подтверждена повышенная экспрессия желатиназ ММР-2 и ММР-9 в центральной нервной системе и спинном мозге больных ALS, причем наивысшая концентрация ММР-9 обнаружена в грудном и поясничном отделах. Статистически значимые различия при сравнении с контролем обнаружены в лобной и затылочной коре, а также во всем спинном мозге больных ALS (Lim et al., J. Neurochem., 1996, 67, 251-9). Плазма больных ALS показывает значительное возрастание концентраций ММР-9 (Beuche et al., Neuroreport., 2000, 11, 3419-22). С другой стороны, концентрация TIMP-1 - важного контррегулятора ММР-2 не изменяется по сравнению с контролем. Такие данные позволяют предполагать потенциальную патогенную роль ММР при ALS.
При врожденной форме ALS идентифицирована мутация в генах Cu2+/Zn2+ - супероксиддисмутазы (SOD1) (Deng et al., Science, 1993, 261, 1047-51; Rosen et al., Am. J. Med. Genet., 1994, 51, 61-9). Кроме того, в литературе описано, что специфические изменения в окружающем клетки матриксе являются результатом генерализованного протеолиза в нервно-мышечных концевых пластинах (Maselli et al., Muscle Nerve, 1993, 16, 1193-303; Tsujihata et al., Muscle Nerve, 1984, 7, 243-9).
Супероксиддисмутазы (SOD) составляют семейство ферментов, играющих заметную роль в защите клеток от повреждения свободными радикалами (Fridovich, J. Biol. Chem., 1989, 264, 7761-4). SOD1 представляет собой растворимый гомодимер длиной в 153 аминокислоты, обнаруженный в цитоплазме, а также в ядрах многих клеток эукариот. Главная функция ферментов заключается в детоксификации пероксидных анионных радикалов и синтезированного попутно пероксида водорода. Образовавшийся пероксид водорода переносится в воду через действие или глутатионпероксидазы или каталазы (Halliwell, J.Neurochem., 1992, 59, 1609-23; Ann. Neurol., 1992, 32, Suppl. S10-5).
Важным моментом в исследовании патогенеза ALS стало открытие мутаций в гене SOD1 у 15-20% больных с диагнозом врожденного ALS (Rosen et al., Nature, 1993, 362, 59-62). Такие мутации являются причиной появления SOD1 с пониженной ферментативной активностью in vivo и пониженного времени полужизни фермента (Bowling et al., J. Neurochem., 61, 2322-2325; Borchelt et al., 1994, Proc. Natl. Acad. Sci. USA, 91, 8292-8296). Однако результаты более позднего исследования дают указание на потерю функции у мутированного фермента. Однако сильные аргументы против полной потери функции включают доминантное наследование заболевания и корреляцию потери функции и клинического хода заболевания (Brown, 1995, Cell, 80, 687-692). Трансгенные мыши, лишенные гена SOD1, не имеют укороченного времени полужизни, и у них не развиваются заболевания, связанные с двигательными нейронами (Reaume et al., 1996, Nature Genet., 13, 43-47). Более того, у мышей, экспрессирующих нативную немутированную SOD1 на эквивалентных уровнях, сравнимых с уровнями эндогенной мышиной SOD, также не развиваются заболевания, связанные с двигательными нейронами. В отличие от этого, у трансгенных мышей, экспрессирующих мутацию G93A или G37R гена человеческой SOD1, приводящей к более высокой активности SOD1, или у мышей, экспрессирующих мутацию SOD1 G85R, приводящую к концентрациям белка и активности, сравнимым с эндогенными уровнями, имеет место прогрессирующий парапарез и резко выраженная мышечная атрофия (Bruijn et al., 1997, Neuron, 18, 327-338; Gurney et al., 1994, Science, 264, 1772-1775; Wong et al., 1995, Neuron, 14, 1105-1116).
В основном, две гипотезы пытаются объяснить развитие ALS из-за мутаций SOD1. Согласно одной из гипотез неправильное сложение мутированного белка приводит к преципитации и образованию токсичных внутриклеточных агрегатов. Вторая гипотеза утверждает, что мутированная SOD1 имеет измененную субстратспецифичность, которая приводит к образованию токсичных побочных продуктов.
Мутированная SOD1 демонстрирует измененное связывание субстрата каталитическим ионом меди в активном сайге фермента, а также изменения в связывании других субстратов (Deng et al., 1993, Science, 261, 1047-1051). В частности, оказывается облегченным связывание субстрата пероксида водорода и пероксинитрита (Beckman and Crow, 1993, Biochem. Soc. Trans., 21, 330-334). Пероксинитрит может трансформироваться в высокореакционноспособное промежуточное соединение нитрония с помощью каталитической меди мутированного фермента. Такое промежуточное соединение нитрония снова способно нитрировать тирозиновые остатки белка. Напротив, связывание цинка не настолько выражено (Crow et al., 1997, J.Neurochem., 69, 1936-1944; Lyons et al., 1996. Proc. Natl. Acad. Sci. USA, 93, 12240-12244). Такое недостаточное связывание цинка дестабилизирует фермент, что проявляется в повышенном образовании иона нитрония. Это может привести к нитрованию легких цепей нейрофиламента, которое, в свою очередь, предотвращает образование триплета нейрофиламента (Crow et al., 1997, J. Neurochem., 69, 1936-1944). Такая реакция частично ответственна за цитоскелетные изменения, которые являются патогномоничными для ALS (Sasaki et al., 1990, J. Neurol. Sci., 97, 233-240; Rouleau et al., 1996, Ann. Neurol., 39, 128-131). Концентрация 3-нитротирозина повышена у трансгенных мышей, имеющих мутацию G37R или G93A (Bruijn et al., 1997, Neuron, 18, 327-338; Ferrante et al., 1997, Ann. Neurol., 42, 326-334). После этого также было описано обнаружение повышенных концентраций 3-нитротирозина в спинном мозгу больных спорадическим и врожденным ALS (Beal et al., 1997. Ann. Neurol., 42, 646-654).
Описано другое потенциальное токсическое взаимодействие между мутированным ферментом SOD1 и пероксидом водорода. Показано in vitro, что мутированный фермент SOD1 легче взаимодействует с пероксидом водорода с образованием гидроксильных радикалов, чем нативный фермент (Wiadau-Pazo et al., 1996, Science, 271, 515-518; Yim et al., 1997, J. Biol. Chem., 272, 8861-8863). Экспрессия мутированной SOD1 в клетках PC-12 сопровождается повышенным образованием кислородных радикалов. Введение медьсодержащих хелаторов, глутатиона, витамина Е и ингибиторов каспазы может в результате уменьшить гибель клеток (Ghadge et al., 1997, J. Neurosci., 17, 8756-8766). Кроме того, показано, что культивированные клетки, имеющие мутированную SOD1, но не клетки с SOD1 дикого типа, демонстрируют повышенную скорость апоптоза (Wiadau-Pazo et al., 1996, Science, 271, 515-518; Ghadge et al., 1997, J. Neurosci., 17, 8756-8766). Повышенное образование кислородных радикалов и повышенное повреждение белка кислородными радикалами показано у трансгенных мышей с мутацией SOD1 G93A (Liu et al., 1998, Ann. Neurol., 44, 763-770; Andrus et al., 1998, J. Neurochem., 71, 2041-2048).
Трансгенных мышей G93A используют в качестве модельной системы для ALS. Течение нейродегенеративного заболевания во времени у мышей G93A известно. Появление клинических симптомов характеризуется дрожанием конечностей в возрасте приблизительно 90 дней с последующим параличом и впоследствии смертью в возрасте 120 дней (Dal Canto and Gurney, 1994, and 1995, Brain Res., 676, 25-40; Chiu et al., 1995, Molec. Cell. Neurosci., 6, 349-363). Самые ранние патологические изменения проявляются в митохондриальной вакуолизации в спинномозговых двигательных нейронах, которую можно наблюдать с 37 дня сначала в проксимальных аксонах и позднее в возрасте 45 дней в клеточных телах (Chiu et al., 1995, Molec. Cell. Neurosci., 6, 349-363). В возрасте 70 дней такие изменения можно обнаружить почти во всех двигательных нейронах с последующей значительной потерей двигательных нейронов в возрасте от 90 дней. Митохондриальная вакуолизация непосредственно предшествует фазе быстрого развития миастении и, следовательно, является патофизиологически важной (Kong and Xu, 1997, Soc. Neurosci. Abst, 23, 1913). Экспрессия мутанта SOD1 G93A вызывает in vitro потерю митохондриальных мембранных потенциалов, а также повышает цитозольную концентрацию кальция (Carri et al., 1997, FEBS Lett., 414, 265-368). Более того, у мышей G93A развивается накопление нейрофиламента в аксонных сфероидах (Tu et al., 1996, Proc. Natl. Acad. Sci. USA, 93, 3155-3160).
Связь между дисфункцией SOD и экспрессией ММР обсуждалась недавно. Ингибирование CuZn-SOD существенно снижает уровни мРНК ММР-1 в кожных фибробластах (Brenneisen et al., 1997, Free. Rad. Biol. Med., 22, 515-524). Данное исследование также показало, что такой эффект сочетается с ослабленной защитой от внутриклеточного пероксида водорода. Путем ингибирования марганец-SOD обнаружено появление образовавшегося пероксида водорода в мРНК ММР-1, которое частично опосредовалось фактором АР-1 (Wenk et al., 1999, J. Biol. Chem., 274, 25869-25876). Полагают, что продуцирование пероксида водорода коррелирует с активацией различных ММР, таких как ММР-1, ММР-3 и ММР-7 (Ranganathan et al., 2001). Более того, пероксид водорода стимулирует экспрессию ММР в человеческих эндотелиальных клетках in vitro (Belkhiri et al., 1997, Lab. Invest., 77, 533-539). Оказывается, что продуцирование свободных радикалов является следствием мутации SOD1 и может привести к повышенной экспрессии ММР, которая в свою очередь может привести к гибели нейронов. Следовательно, можно сделать вывод, с одной стороны, о тесной связи между образованием свободных кислородных радикалов и экспрессией ММР, в то время как, с другой стороны, экспрессия ММР может быть инициирована мутацией CuZnSOD.
Несмотря на передовые способы лечения при боковом амиотрофическом склерозе и улучшенном уходе за пациентами через паллиативное лечение, прогноз при таком заболевании пока плохой. Как правило, пораженные пациенты умирают в течение 2 лет после постановки диагноза. Одной из основных причин является развивающаяся миастения, в конечном итоге приводящая к параличу вспомогательных дыхательных мышц. Сложные процессы, лежащие в основе патофизиологических механизмов, известны только частично. В настоящее время не имеется способа анализа роли мутаций SOD1 у человека или осуществления широкой гистологической проверки органов человека в определенные моменты времени при развитии болезни. Представляет интерес, что трансгенные мыши показывают изменения и клинические результаты, такие как прогрессирующий парапарез и миастения, сравнимые с изменениями и результатами, обнаруживаемыми при заболевании человека.
Распространенность ALS составляет приблизит. 6-8 на 100000 человек при коэффициенте заболеваемости 1,5-2 на 100000 человек в год, с тенденцией к возрастанию. Большинство случаев диагностируется в возрасте 40-70 с тенденцией к повышению в более позднем возрасте. Заболевание, как правило, быстро прогрессирует, и больные умирают в течение 2-5 лет после постановки диагноза. Конечная стадия заболевания характеризуется поражением мышц туловища и дыхательной мускулатуры, когда больные умирают от дыхательной недостаточности, часто сопровождающейся аспирационной пневмонией.
Точная этиология ALS неизвестна, и несколько гипотез пытаются объяснить причину через иммунологические расстройства в системе нейротрансмиттеров, хроническую интоксикацию, метаболическое расстройство, вирусные инфекции, недостаточность нейротрофного фактора и разрушение механизмов восстановления ДНК.
Большей частью без ответа остаются вопросы, касающиеся восприимчивости двигательных нейронов к предполагаемым патогенным механизмам. Возможно, что экспрессия ММР через активированные микроглии или нейроны может играть роль, в частности, в гибели апоптозных клеток.
Единственный известный способ лечения включает лечение рилузолом - веществом, которое, кроме прочего, снижает секрецию глутамата. Показано, что такое лечение ослабляет симптомы и замедляет развитие физической недееспособности. Это приводит к продлению жизни примерно на 3 месяца.
Роль плазминогенной системы в патогенезе ALS исследовалась подробнее для выяснения концепций дегенерации синапса. ALS представляет собой расстройство, описанное выше, которое вызывается раздражителями или средствами, которые активируют каскад внеклеточно действующих протеаз, которые разрушают синаптические связи с катастрофическими реперкуссиями на двигательных нейронах в спинном мозгу. Исследования на животных и эксперименты с клеточными культурами указывают на вовлечение серинпротеаз, являющихся важными регуляторами ремоделирования в нервно-мышечном соединении, слабо управляемых физиологическими ингибиторами для предотвращения разрушения, которое происходит при ALS или других формах денервации. Это также может действовать при других синаптических дегенерациях в центральной нервной системе.
Обнаружена неожиданная роль урокиназы при таком истощающем заболевании. Такие результаты могут иметь важные последствия для превентивных или лечебных стратегий для больных с урокиназазависимыми невропатологиями и/или нейродегенеративными заболеваниями.
Цель изобретения
Настоящее изобретение относится к лечебными средствам для улучшения здоровья пациентов, страдающих от последствий урокиназазависимого невропатологического и/или нейродегенеративного заболевания. В частности, настоящее изобретение относится к применению ингибиторов урокиназы для получения лекарственного средства для лечения больных, страдающих от такого невропатологического и/или нейродегенеративного заболевания. Другой целью настоящего изобретения являются фармацевтические композиции для применения в указанных способах лечения, и еще одной целью настоящего изобретения являются способы лечения больных, страдающих от таких урокиназазависимых невропатологических и/или нейродегенеративных заболеваний.
Подробное описание изобретения
Как будет показано в приведенных далее примерах, настоящее изобретение открывает неожиданную терапевтическую активность ингибиторов урокиназы при нейродегенеративном заболевании ALS. Настоящее изобретение представляет наблюдение, что оказывается, что активатор плазминогена урокиназа обладает свойственной ей биологической активностью при нейродегенеративном заболевании. Путем блокирования такой активности специфическими и/или селективными ингибиторами урокиназы можно получить положительный лечебный эффект.
В некоторых документах описываются ингибиторы урокиназ, которые подходят для применения в настоящем изобретении. Предпочтительные соединения и фармацевтические композиции описываются в пат. США №5340833, пат. США №5550213, пат. США №6207701, пат. США №6093731, пат. США №592307, СН 689611, WO 00/06154, WO 00/05245, WO 00/05214, WO 01/14324, WO 99/40088, WO 99/20608, WO 99/05096, WO 98/11089, WO 01/44172, EP 1044967, EP 568289, WO 00/04954, WO 03/103644, WO 00/17158, WO 02/74756, WO 01/70204, WO 03/053999, WO 98/46632, US 6586405, EP 1182207 A, WO 02/14349, WO 03/048127, WO 03/076391, WO 01/96286, WO 2004/103984, включенных в данное описание в качестве ссылок.
Предпочтительные ингибиторы урокиназы описываются в US 2004/0266766, включенной в данное описание в качестве ссылки, т.е. это соединения общей формулы I
в которой
Ar обозначает ароматическую или гетероароматическую циклическую систему,
Е обозначает
или
или Ar и Е вместе образуют радикал
или
где Z может представлять собой О, NH или С=O, и X4 может представлять собой С=O, NH или СН2, и W может представлять собой N, CR3 или CR6, и X5 может представлять собой СН, CR3, CR6 или N,
В обозначает -SO2-, -CR3 2-, -NR3- или -NH-,
X1 обозначает NR13R4, OR3, SR3, COOR3, CONR3R4 или COR5,
R1 обозначает Н, необязательно замещенный алкильный, алкенильный, алкинильный, арильный, гетероарильный радикал или COOR3, CONR3R4 или COR5,
R2 обозначает галоген, C(R6)3, C2(R6)5, ОС(R6)3 или OC2(R6)5,
R3 обозначает Н или любой органический радикал,
R13 обозначает группу общей формулы (IIa) или (IIb)
X2 обозначает NH, NR4, О или S,
X3 обозначает NH, NR4, О, S, CO, COO, CONH или CONR4,
Y обозначает C(R8)2, NH или NR3,
R4 обозначает Н или разветвленный или неразветвленный необязательно замещенный алкильный, алкенильный или алкинильный радикал,
R5 обозначает Н, алкил, алкенил, алкинил, карбоксиалкил, карбоксиалкенил, карбоксилалкинил, карбоксиарил, карбоксигетероарил, -(CO)NR3R4 или -COO-R3, где алкильный, арильный и гетероарильный радикалы могут быть, необязательно, замещенными,
R6 в каждом случае представляет собой, независимо, Н или галоген и, в частности, F,
R7 обозначает Н или необязательно замещенный алкильный, алкенильный, алкинильный, арильный или гетероарильный радикал или -COR9,
R8 в каждом случае представляет собой, независимо, Н или разветвленный или неразветвленный необязательно замещенный алкильный, алкенильный, алкинильный, арильный, гетероарильный, аралкильный, алкиларильный, гетероаралкильный радикал и/или замещенный или незамещенный бициклический или полициклический радикал,
R9 обозначает Н или разветвленный или неразветвленный необязательно замещенный алкильный, алкенильный, алкинильный, арильный и/или гетероарильный радикал,
R10 обозначает радикал (C(R1)2)o-X3R5,
R11 обозначает Н, карбонильный радикал -CO-R12, радикал карбонамидо-CONR12 2, оксикарбонильный радикал -COO-R12 или, особенно предпочтительно, сульфонильный радикал -SO2R12,
R12 обозначает Н, разветвленный или неразветвленный, замещенный или незамещенный алкильный, алкенильный, алкинильный, арильный и/или гетероарильный радикал, или замещенный или незамещенный циклический алкильный радикал, или замещенный или незамещенный аралкильный, алкиларильный или гетероаралкильный радикал, или замещенный или незамещенный бициклический или полициклический радикал,
R15 представляет С=Х2, NR3 или CR3 2,
n равен целому числу от 0 до 2,
m равен целому числу от 0 до 5,
о равен целому числу от 1 до 5,
р равен целому числу от 1 до 5,
или соли таких соединений.
Более предпочтительные ингибиторы урокиназы представляют собой соединения общей формулы III
в которой
Ar обозначает ароматическую или гетероароматическую циклическую систему,
X1 обозначает NR13R4, OR3, SR3, COOR3, CONR3R4 или COR5,
R1 обозначает Н, необязательно замещенный алкильный, алкенильный, алкинильный, арильный, гетероарильный радикал или COOR3, CONR3R4 или COR5,
R2 обозначает галоген, С(R6)3, C2(R6)5, OC(R6)3 или OC2(R6)5,
R3 обозначает Н или любой органический радикал,
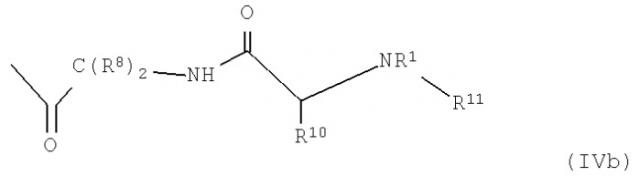
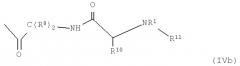
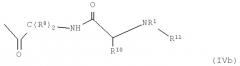
R13 обозначает группу общей формулы (IVa) или (IVb)
X2 обозначает NH, NR4, О или S,
X3 обозначает NH, NR4, О, S, CO, COO, CONH или CONR4,
Y обозначает C(R8)2, NH или NR3,
R4 обозначает Н или разветвленный или неразветвленный необязательно замещенный алкильный, алкенильный или алкинильный радикал,
R5 обозначает Н, алкил, алкенил, алкинил, карбоксиалкил, карбоксиалкенил, карбоксилалкинил, карбоксиарил, карбоксигетероарил, -(CO)NR3R4 или -COO-R3, где алкильный, арильный и гетероарильный радикалы могут быть, необязательно, замещенными,
R6 в каждом случае представляет собой, независимо, Н или галоген и, в частности, F,
R7 обозначает Н или необязательно замещенный алкильный, алкенильный, алкинильный, арильный или гетероарильный радикал или -COR9,
R8 в каждом случае представляет собой, независимо, Н, галоген или разветвленный или неразветвленный необязательно замещенный алкильный, алкинильный, арильный, гетероарильный радикал и/или (СН2)m-ОН,
R9 обозначает Н или разветвленный или неразветвленный необязательно замещенный алкильный, алкенильный, алкинильный, арильный и/или гетероарильный радикал,
R10 обозначает радикал (С(R1)2)o-X3R5,
R11 обозначает Н, карбонильный радикал -CO-R12, оксикарбонильный радикал -COO-R12 или, особенно предпочтительно, сульфонильный радикал -SO2R12,
R12 обозначает разветвленный или неразветвленный, замещенный или незамещенный алкильный, алкенильный, алкинильный, арильный или гетероарильный радикал, или замещенный или незамещенный циклический алкильный радикал, или замещенный или незамещенный аралкильный, алкиларильный или гетероаралкильный радикал, или замещенный или незамещенный бициклический или полициклический радикал,
n равен целому числу от 0 до 2,
m равен целому числу от 0 до 5,
о равен целому числу от 1 до 5,
или соли таких соединений.
Соединения могут находиться в виде солей, предпочтительно, физиологически приемлемых солей присоединения кислот, например в виде солей присоединения неорганических кислот, особенно предпочтительно, в виде гидрохлоридов, или солей присоединения подходящих органических кислот. Гуанидиниевая группа может, предпочтительно, иметь защитные функциональные группы, которые могут отщепляться, предпочтительно, в физиологических условиях. Соединения могут находиться в виде оптически чистых соединений или в виде смесей энантиомеров и/или диастереоизомеров.
Циклическая система Ar, предпочтительно, содержит 4-30 и, в частности, 5-10 С-атомов. В соединениях общей формулы (I) или (III) Ar представляет собой, предпочтительно, ароматическую или гетероароматическую циклическую систему с одним циклом. Также предпочтительны соединения, в которых Ar и Е вместе образуют бициклическую систему. Гетероароматические системы, предпочтительно, содержат один или несколько атомов О, S и/или N. Предпочтительной ароматической циклической системой является бензольный цикл; предпочтительными гетероароматическими циклическими системами являются пиридинил, пиримидинил или пиразинил, особенно, с атомом азота в положении 2. Предпочтительными бициклическими системами являются системы с атомом азота или кислорода в положениях Z или W. Ar, наиболее предпочтительно, представляет собой бензольный цикл.
Особенно предпочтительны соединения со следующими структурными элементами
или
в частности,
или
или
В соединениях общей формулы (I) или (III) заместители В, например CHX1R1, и Е, например NHC(NH)NH3 (гуанидино) или NH2CNH (амидино), в циклической системе Ar находятся, предпочтительно, в мета- или пара-положении и, в особенности, в пара-положении относительно друг друга. Более того, Ar может содержать один или несколько других заместителей R2, которые отличаются от атома водорода. Число заместителей R2 равно, предпочтительно, 0, 1, 2 или 3, особенно предпочтительно, 0 или 1 и, наиболее предпочтительно, 0. R2 может обозначать галоген, С(R6)3, C2(R6)5, ОС(R6)3 или OC2(R6)5, в таком случае R6 представляет собой в каждом случае, независимо, Н или галоген и, в частности, F. Предпочтительными примерами R2 являются атомы галогена (F, Cl или Br), СН3, CF3, ОН, ОСН3 или OCF3.
Соединения по изобретению содержат гуанидиногруппу и характеризуются высокой селективностью. По этой причине Е часто представляет собой, предпочтительно, -NH-C(NH)-NH2.
Заместитель В в формуле (I) или CHX1R1 в формуле (III) важен для ингибирующей активности. В, предпочтительно, выбирают из числа -SO2-, -NR3-, -NH- и/или -CR3 2-, в особенности, -CR1 2-.
R1 может представлять собой Н или необязательно замещенный алкильный, алкенильный, алкинильный, арильный и/или гетероарильный радикал или COOR3, CONR3R4 или COR5. R1, наиболее предпочтительно, представляет собой Н.
Если не указано иное, алкильный радикал, используемый в данном описании, представляет собой, предпочтительно, линейную или разветвленную C1-С30-алкильную группу, предпочтительно, C1-С10-алкильную группу, в частности С1-С4-алкильную группу, или С3-С30-циклоалкильную группу, предпочтительно, С3-С8-циклоалкильную группу, которая может быть, например, замещена C1-С3-алкокси, гидроксилом, карбоксилом, амино, сульфонилом, нитро, циано, оксо и/или галогеном, а также арильными или гетероарильными радикалами. Если не указано иное, алкенильный и алкинильный радикалы в данном описании представляют собой, предпочтительно, С2-С10-группы, в частности С2-С4-группы, которые могут быть, необязательно, замещены, как указано ранее. Арильные и гетероарильные радикалы могут быть, например, замещены C1-С6-алкилом, C1-С3-алкокси, гидроксилом, карбоксилом, сульфонилом, нитро, циано и/или оксо. Арильные и гетероарильные радикалы, предпочтительно, содержат 3-30, в частности 4-20, предпочтительно, 5-15 и, наиболее предпочтительно, 6-10 атомов С.
X1, предпочтительно, представляет NR13R4.
R3 может обозначать Н или любой органический радикал. Органический радикал представляет собой, в частности, радикал с 1-30 атомами углерода. Такой радикал может быть насыщенным или ненасыщенным, линейным, разветвленным или циклическим и, необязательно, содержит заместители. В предпочтительном воплощении R3=Н, в особенности, в группе В=-CR3 2-.
В особенно предпочтительном воплощении В представляет группу -SO2-, так что соединения являются сульфосоединениями. Такая группа SO2 является изостерической к группе СН2. Замена группы СН2 изостерической группой SO2 дает возможность образования дополнительных Н-мостиков с группами NH Gly 193, Asp 194 и Ser 195 урокиназы, что также улучшает ингибирующую активность (см. фигуру 1).
R13 представляет группу формулы (IIa) или (IIb)
В формуле (IIa) R15 обозначает С=Х2 или CR3, где X2 представляет собой NH, NR4, О или S, и X3 представляет собой NH, NR4, О, S, CO, COO, CONH или CONR4. Y представляет собой C(R8)2, NH или NR3. R4, в свою очередь, обозначает Н или разветвленный или неразветвленный необязательно замещенный алкильный, алкенильный или алкинильный радикал. R7 обозначает Н или необязательно замещенный алкильный, алкенильный, алкинильный, арильный или гетероарильный радикал или -COR9, где R9, в свою очередь, обозначает Н или разветвленный или неразветвленный необязательно замещенный алкильный, алкенильный, алкинильный, арильный и/или гетероарильный радикал.
R13 представляет собой, предпочтительно, группу формулы (IIb).
Кроме того, R13 представляет собой, предпочтительно, группу формулы (IVа) или (IVb), в особенности, в соединениях формулы (III)
В формуле (IVa) X2 обозначает, предпочтительно, NH, NR4, О или S, в частности О, и X3 представляет NH, NR4, О, S, СО, СОО, CONH или CONR4. Y представляет С(R8)2, NH или NR3. R4, в свою очередь, обозначает Н или разветвленный или неразветвленный необязательно замещенный алкильный, алкенильный или алкинильный радикал. R7 обозначает Н или необязательно замещенный алкильный, алкенильный, алкинильный, арильный или гетероарильный радикал или -COR9, где R9, в свою очередь, представляет Н или разветвленный или неразветвленный необязательно замещенный алкильный, алкенильный, алкинильный, арильный и/или гетероарильный радикал. В соединениях формулы (III) R13 представляет, предпочтительно, группу формулы (IVb).
R8 представляет собой, предпочтительно, Н или (СН2)m-ОН и, особенно предпочтительно, H. R10 представляет радикал (C(RR1)2)o-X3R5. В данном случае R1 представляет собой, особенно предпочтительно, водород, X3 представляет собой, особенно предпочтительно, кислород, R5 представляет собой, особенно предпочтительно, водород, и о, особенно предпочтительно, равен 1.
R11 представляет собой, особенно предпочтительно, сульфонильный радикал -SO2-R12, где R12 представляет собой, предпочтительно, аралкильный радикал и, в частности, бензильный радикал. В особенно предпочтительном воплощении бензильный радикал замещен в мета- и/или пара-положении галогеном и, наиболее предпочтительно, Cl. В другом предпочтительном воплощении R12 представляет собой адамантильный или камфорный радикал.
R15 представляет собой, особенно предпочтительно, карбонильный радикал -СО, аминный радикал -NR3- и/или алкильный радикал -CR3 2, предпочтительно, -CR1 2- и, наиболее предпочтительно, -СН2-. Соединения, в которых R15 представляет CH2, характеризуются особенно простым синтезом. Так как такое положение не вовлекается в образование водородных мостиков с урокиназой, группа СН2 может быть представлена вместо карбонила без ассоциации с потерей ингибирующей активности.
Также предпочтительны соединения, которые содержат в качестве строительного блока аминокислоту, не являющуюся природной, особенно для радикала R10. Более того, предпочтительны азасоединения, содержащие группу NH-NH, в которых, например, Y=NH и n=1 (соединения формулы IIb).
Другие особенно предпочтительные соединения представляют собой бисульфонамиды, т.е. соединения, которые дважды содержат элемент -SO2NH. Также предпочтительны соединения, в которых R15 представляет группу формулы IIb и Y представляет -C(R8)2-, где R8 в одном случае представляет Н и в другом случае представляет радикал, который содержит ароматическую группу и, в частности, -СН2-СН2-С6Н5.
Также предпочтительны соединения, в которых X1 обозначает
Наиболее предпочтительными являются следующие соединения: гидрохлорид N-[2-(4-гуанидинобензолсульфониламино)этил]-3-гидрокси-2-фенилметансульфониламинопропионамида, гидрохлорид Bz-SO2-(D)-Ser-(Aza-Gly)-4-гуанидинобензиламида или гидрохлорид N-(4-гуанидинобензил)-2-(3-гидрокси-2-фенилметансульфониламинопропиониламино)-4-фенилбутирамида и N-[(4-гуанидинобензилкарбамоил)метил]-3-гидрокси-2-фенилметансульфониламинопропионамид (см. также фигуру 2: WX-508). Другими предпочтительными соединениями являются гидрохлорид 3-нитробензилсульфонил-(D)-Ser-Gly-(4-гуанидинобензил)амида (WXC-316), гидрохлорид 3-хлорбензилсульфонил-(D)-Ser-Gly-(4-гуанидинобензил)амида (WXC-318), гидрохлорид 4-хлорбензилсульфонил-(D)-Ser-Gly-(4-гуанидинобензил)амида (WXC-340), гидрохлорид бензилсульфонил-(D)-Ser-Ala-(4-гуанидинобензил)амида (WX-532), 4-хлорбензилсульфонил-(D)-Ser-N-Ме-Ala-(4-гуанидинобензил)амид (WX-582) или бензилсульфонил-(D)-Ser-N-Ме-Gly-(4-гуанидинобензил)амид (WX-538).
Особенно предпочтительным соединением является 4-хлорбензилсульфонил-(D)-Ser-Gly-(4-гуанидинобензил)амид или его фармацевтически приемлемая соль, например гидрохлорид (WX-C340).
Таким образом, первый аспект изобретения относится к применению ингибиторов урокиназы при получении фармацевтической композиции для лечения невропатологических и/или нейродегенеративных заболеваний, в частности ALS, рассеянного склероза, болезни Паркинсона, болезни Альцгеймера и бактериального менингита.
В частности, настоящее изобретение относится к применению ингибиторов урокиназы для получения лекарственного средства для лечения и/или профилак