Иммунолипосомальная форма фотосенсибилизатора
Иллюстрации
Показать всеИзобретение относится к иммунолипосомальной форме фотосенсибилизатора на основе тетра-3-фенилтиофталоцианина гидроксиалюминия, которая используется в фотодинамической терапии злокачественных опухолей. Иммунолипосомальная форма содержит указанный фотосенсибилизатор (0,011 г), яичный фосфатидилхолин (2,2 г), холестерин (0,264 г), mPEG2000-DSPE [метокси(полиэтиленгликоль-2000)]1,2-дистеароил-sn-глицеро-3-фосфатидилэтаноламин-N (0,0528 г), (pNP-PEG3400-DOPE) 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин-N-[n-нитрофенилкарбонил (полиэтиленгликоль-3400)] (0,0176 г), цитрат натрия трехзамещенный (0,53 г) и МКА анти-CD5 (ICO-80) (моноклональные антитела анти-CD5) (0,00237 г). Указанная иммунолипосомальная форма фотосенсибилизатора обладает высоким фототоксическим эффектом. 3 ил.
Реферат
Настоящее изобретение относится к медицине, а именно к фотосенсибилизаторам, и может быть использовано в фотодинамической терапии (ФДТ) злокачественных опухолей.
Известны фотосенсибилизаторы (ФС), используемые для лечения злокачественных опухолей [1, 2, 3].
Однако созданные к настоящему времени ФС обладают недостаточно высокой селективностью накопления в опухоли по сравнению с нормальной тканью. Их возбуждение осуществляется светом в диапазоне 600-700 нм, сильно поглощаемым самой биологической тканью, что ограничивает глубину воздействия и снижает эффективность ФДТ. Многие ФС в течение длительного времени (от недель до месяцев) сохраняют высокую концентрацию в коже, что приводит к длительной кожной фототоксичности и необходимости соблюдения пациентом "темнового" режима, что снижает качество его жизни [4, 5, 6].
Одним из путей устранения этого недостатка является создание иммунолипосомальной формы фотосенсибилизатора направленного действия.
Известна липосомальная форма фотосенсибилизатора тетра-3-фенилтиофталоцианина гидроксиалюминия [7], которая принята за прототип.
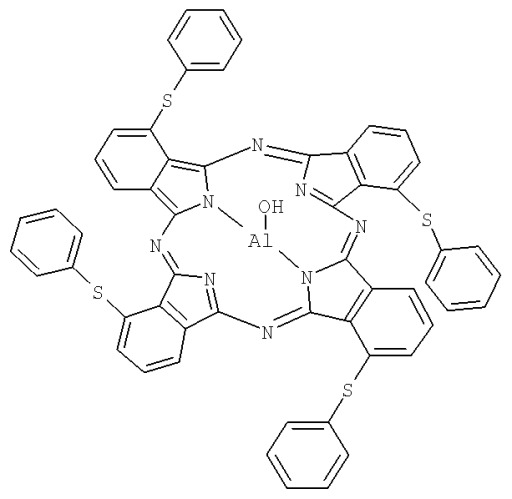
Она представляет собой композицию смеси липидов (лецитина, холестерина, кардиолипина) и фотосенсибилизатора, представляющего собой тетра-3-фенилтиофталоцианина гидроксиалюминия (Формула А).
Формула А
Однако фармакокинетические исследования показали, что эта липосомальная форма фотосенсибилизатора обладает длительной кожной фототоксичностью.
Задачей настоящего изобретения является устранение этого недостатка путем создания новой иммунолипосомальной формы фотосенсибилизатора, осуществляющей направленную доставку препарата к опухоли.
Поставленная задача достигается тем, что на основе липосомалыной формы фотосенсибилизатора тетра-3-фенилтиофталоцианина гидроксиалюминия создана его иммунолипосомальная форма, содержащая:
Яичный фосфатидилхолин (Е PC S) (Lipoid, Германия);
Холестерин (Sigma-Aldrich, Co., США);
mPEG2000-DSPE [метокси(полиэтиленгликоль-2000)] 1,2-дистеароил-sn-глицеро-3-фосфатидилэтаноламин-N (Lipoid, Германия);
(pNP-PEG3400-DOPE) 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин-N-[п-нитрофенилкарбонил(полиэтиленгликоль-3400)];
Цитрат натрия трехзамещенный (Химмед, РФ);
МКА анти-CD5 (ICO-80) (моноклональные антитела анти-CD5) (ООО НПЦ «МедБиоСпектр», РФ).
при следующем соотношении компонентов (г):
| Фотосенсибилизатор, инкапсулированный в липосомы | 0,011 |
| Яичный фосфатидилхолин (Е PC S) | 2,2 |
| Холестерин | 0,264 |
| mPEG2000-DSPE [метокси(полиэтиленгликоль-2000)] 1,2-дистеароил-sn-глицеро-3-фосфатидилэтаноламин-N | 0,0528 |
| (pNP-PEG3400-DSPE) 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин-N-[п-нитрофенилкарбонил(полиэтиленгликоль-3400)] | 0,0176 |
| Цитрат натрия трехзамещенный | 0,53 |
| МКА анти-CD5 (ICO-80) | 0,00237 |
Иммунолипосомальную форму тетра-3-фенилтиофталоцианина гидроксиалюминия получают методом Бенгема (Bangham) редиспергированием цитратным буферным раствором с pH 5,0 тонкой однородной пленки лецитиновых многослойных липосом, образованной упариванием в вакууме на роторном испарителе раствора смеси липидов и фенилтиозамещенного фталоцианина в хлороформе [8, 9]. Смесь липидов включает яичный фосфатидилхолин, холестерин, mPEG2000-DSPE и pNP-PEG3400-DOPE в молярном соотношении 7:3:0,2:0,6), молярное соотношение "смесь липидов: фенилтиозамещенный фталоцианин" составляло 2,7:1. Уменьшение размеров липосом осуществлялось методами ультразвуковой соникации и экструзии.
Изобретение иллюстрируется следующими примерами:
Пример 1
| Фотосенсибилизатор, инкапсулированный в липосомы | 0,011 |
| Яичный фосфатидилхолин (ЕРС) | 2,2 |
| Холестерин | 0,264 |
| mPEG2000-DSPE [метокси(полиэтиленгликоль-2000)] 1,2-дистеароил-sn-глицеро-3-фосфатидилэтаноламин-N | 0,0528 |
| (pNP-PEG3400-DOPE) 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин -N-[п-нитрофенилкарбонил (полиэтиленгликоль-3400)] | 0,0176 |
| Цитрат натрия трехзамещенный | 0,53 |
| МКА анти-CD5 (ICO-80) | 0,00237 |
Иммунолипосомальная форма тетра-3-фенилтиофталоцианина гидроксиалюминия представляет собой дисперсию, которая готовится следующим образом: навески лецитина, холестерина, mPEG-DSPE и pNP-PEG-DOPE объединяют и растворяют в 50 мл хлороформа. Затем раствор переносят в круглодонную колбу и к нему прибавляют раствор тетра-3-фенилтиофталоцианина гидроксиалюминия в 5 мл хлороформа. Содержимое колбы перемешивают и упаривают на роторном испарителе при Т=+37°C до образования однородной липидной пленки. Затем в колбу добавляют 17 мл цитратного буфера с pH 5,0 и взбалтывают в ультразвуковой ванне до полного смывания пленки со стенок колбы и образования липосомальной эмульсии. Полученную липосомальную дисперсию в количестве 20 мл измельчают с помощью ручного мини-экструдера через поликарбонатные мембранные фильтры с размером пор 0,2 нм.
Полученную липосомальную дисперсию в количестве 20 мл делят на 3 части:
- 3 мл липосомальной дисперсии используют для получения иммунолипосомальной формы тетра-3-фенилтиофталоцианина гидроксиалюминия;
- 12 мл оставляют в качестве сравнения в исследованиях in vitro;
- 5 мл используют для количественного определения тетра-3-фенилтиофталоцианина гидроксиалюминия.
Получение иммунолипосомальной формы тетра-3-фенилтиофталоцианина гидроксиалюминия.
3 мл липосомальной формы перемешивают с раствором моноклональных антител (МКА) анти-CD5 (ICO80) и инкубируют в течение 14 часов при Т=+4°С при постоянном перемешиваний. Затем pH смеси липосомальной формы и моноклональных антител доводят до значения 8,5 и инкубируют в течение 2 часов при Т=+4°С.
Очистку иммунолипосомальной формы от несвязавшихся МКА проводят с помощью метола гель-фильтрации. В качестве наполнителя для хроматографической колонки используют Sepharose CL-4B. Разделение фракции контролируют с помощью проточного УФ-спектрометра UVIS-920 (Amersham Biosciences ВС) с длиной волны 215 нм.
Концентрирование очищенной фракции иммунолипосомальной формы тетра-3-фенилтиофталоцианина гидроксиалюминия проводят с помощью центрифугирования препаратов в центрифужных пробирках с фильтром (Millipore, 10 NMWL) со скоростью 2000 g в течение 2 часов.
Проведено сравнительное изучение биологической активности иммунолипосомальной формы тетра-3-фенилтиофталоцианина гидроксиалюминия и липосомальной формы тетра-3-фенилтиофталоцианина гидроксиалюминия в культуре клеток Jurkat- Т-клеточной лимфомы.
Примеры, иллюстрирующие изобретение на клеточных линиях in vitro.
Пример 1. Клетки линии Jurkat раскапывали в количестве 50×103 клеток в 180 мкл полной среды RPMI-1640 в 96-луночные плоскодонные планшеты (Costar, USA) и инкубировали 24 ч. Для оценки фототоксичности липосомальной и иммунолипосомальной формы в каждую лунку добавляли по 20 мкл исследуемых препаратов при Т=+4°C и инкубировали с клетками в течение 1 часа при Т=+4°С. После инкубации клетки дважды отмывали полной средой RPMI-1640. Затем планшеты помещали в CO2-инкубатор на 24 часа при температуре Т=+37°С. После инкубации клетки однократно отмывали полной средой RPMI-1640. Облучение клеточных линий проводили сразу после отмывки клеток от липосомальных форм лазером ЛФТ-630/670-01-БИОСПЕК мощностью облучения 45 мВт/см2 в течение 10 минут.
После лазерного облучения клетки инкубировали в СО2-инкубаторе в течение 24 часов при Т=+37°C, после чего в каждую лунку вносили по 20 мкл раствора МТТ (маточный раствор 5 мг/мл, конечная концентрация 1 мг/мл), инкубировали в атмосфере 5% CO2 в течение 5 часов при Т=+37°С.
После образования формазана надосадочную жидкость удаляли. Осадок растворяли, добавляя в лунки по 150 мкл диметилсульфоксида (DMSO). Планшеты помещали на 5-7 минут в термостат при температуре Т=+37°С, далее встряхивали на шейкере, затем интенсивность окрашивания среды измеряли на спектрофотометре «Titertek Multiscan МСС/340» при λ=540 нм.
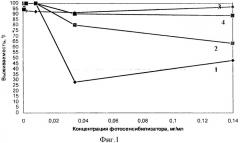
На фигуре 1 представлен фототоксический эффект заявляемого изобретения (1) и прототипа (2), пустых иммунолипосом (3) и пустых липосом (4). Фототоксический эффект заявляемого препарата при концентрации 0,034 мг/мл равен 28%, а прототипа при той же концентрации составил 80%, т.е. в 2,9 раза достоверно ниже, чем для прототипа.
Результаты изучения фототоксического эффекта заявляемого препарата и прототипа на клетках линии Jurkat после 1 часовой инкубации при Т=+4°С, представленные на фигуре 1, показали, что наиболее низкий процент выживаемости наблюдали в лунках с клетками. инкубированными с заявляемым препаратом. При концентрации фотосенсибилизатора, равной 0,034 и 0,14 мг/мл, процент выживших клеток для заявляемого препарата составил 28 и 48%, а для прототипа при тех же концентрациях составил 80 и 64% соответственно.
Пример 2. Клетки линии Jurkat раскапывали в количестве 50×103 клеток в 180 мкл полной среды RPMI-1640 в 96-луночные плоскодонные планшеты (Costar, USA) и инкубировали в течение 24 ч. Для оценки фототоксичности липосомальной и иммунолипосомальной формы в каждую лунку добавляли по 20 мкл исследуемых препаратов и инкубировали с клетками в течение 24 часов при Т=+37°C. После инкубации клетки дважды отмывали полной средой RPMI-1640. Облучение клеточных линий проводили сразу после отмывки клеток от липосомальных форм лазером ЛФТ-630/670-01-БИОСПЕК мощностью облучения 45 мВт/см2 в течение 10 минут.
После лазерного облучения клетки инкубировали в СО2-инкубаторе в течение 24 часов при Т=+37°С, затем клетки переносили в пробирки, добавляли 1 мкл флюоресцеина диацетат (FDA) (конц. 1 мкг/мл), а также 10 мкл пропидий йодида (PI) (конц. 5 мкг/мл). Пробирки помещали в термостат при Т=+37°С на 15 минут. Пробирки с исследуемыми образцами помещали в ледяную воду и проводили цитофлуориметрический анализ на проточном цитофлуориметре FACSCalibur (Becton Dickinson, США) с использованием программного обеспечения CELLQuest.
PI окрашивает клеточные ядра мертвых клеток, а FDA окрашивает эндоплазматический ретикулум живых клеток.
На фигуре 2 представлен фототоксический эффект заявляемого изобретения (1) и прототипа (2), пустых иммунолипосом (3) и пустых липосом (4), полученный при двойном окрашивании клеток с FDA и PI. После 24 часовой инкубации при Т=+37°С наиболее высокий процент мертвых клеток наблюдали в группе клеток, инкубированных с заявляемым препаратом. Так, при концентрации фотосенсибилизатора 0,034, 0,14 и 0,01 мг/мл процент живых клеток для заявляемого препарата в среднем составил 98%, а для прототипа при тех же концентрациях составил 88, 91 и 75% соответственно.
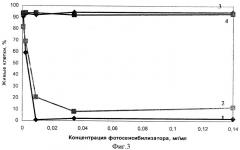
На фигуре 3 представлен фототоксический эффект заявляемого изобретения (1) и прототипа (2), пустых иммунолипосом (3) и пустых липосом (4), полученный при двойном окрашивании клеток с FDA и PI. После 24 часовой инкубации при Т=+37°C наиболее низкий процент живых клеток наблюдали в группе клеток, инкубированных с заявляемым препаратом. Так, при концентрации фотосенсибилизатора 0,034, 0,14 и 0,01 мг/мл процент живых, клеток для заявляемого препарата в среднем составил 2%, а для прототипа при тех же концентрациях составил 8, 12 и 20% соответственно.
ТЕХНИЧЕСКИЙ РЕЗУЛЬТАТ
Предлагаемая иммунолипосомальная форма фотосенсибилизатора обеспечивает высокий фототоксический эффект.
Литература
1. Васильев Д.В., Стуков А.H., Гельфонд М.Л. Повышение эффективности фотодинамической терапии опухолей с применением Фотодитазина. // Российский биотерапевтический журнал. - 2003. - Т.2. - №4. - С.61-66.
2. Гельфонд М.Л., Барчук А.С., Васильев Д.В., Стуков А.Н. Возможности фотодинамической терапии в онкологической практике. // Российский биотерапевтический журнал. - 2003. - Т.2. - №4. - С.67-71.
3. Миронов А.Ф. Фотосенсибилизаторы на основе порфиринов и родственных соединений. // Итоги науки и техники. Совр. пробл. лаз. физ. М.: ВИНИТИ. - 1990. - Т.3. - С.224.
4. Вакуловская Е.Г., Летягин В.П., Погодина Е.М. Фотодинамическая терапия и флюоресцентная диагностика у больных раком молочной железы. // Российский биотерапевтический журнал. - 2003. - №4. - Т.2. - С.57-60.
5. Вакуловская Е.Г., Шенталь В.В. Фотодинамическая терапия и флюоресцентная диагностика у больных раком кожи головы и шеи. // Материалы 6-й ежегодной Российской Онкологической конференции. - г.Москва. - 2002. - С.44-45.
6. Вакуловская Е.Г., Шенталь В.В., Кувшинов Ю.П., Поддубный Б.К. Фотодинамическая терапия у больных с опухолями головы и шеи. // Вестник Российского онкологического центра. - 2003. - №2. - С.46-49.
7. Фотосенсибилизатор, липосомальная форма фотосенсибилизатора и способ проведения фотодинамической терапии. Патент РФ №2257898 (от 10 августа 2005 г.). Авторы: Барышников А.Ю., Борисова Л.М., Ворожцов Г.Н., Герасимова Г.К., Давыдов М.И., Деркачева В.М., Кокарева В.И., Кубасова И.Ю., Лощенов В.Б., Лужков Ю.М., Лукьянец Е.A., Меерович Г.А., Меерович И.Г., Оборотова Н.А., Полозкова А.П., Смирнова З.С., Стратонников А.А.
8. Liposomes: a practical approach, in D.Rickwood and B.D.Hames (eds.) Practical Approach Series. Oil Press at Oxford University Press, Oxford, 1990.
9. Preparation of liposomes, in G.Gregoriadis (ed.), Liposome technology, Vol.1, CRC Press., Boca Raton, FL, 1984.
Иммунолипосомальная форма фотосенсибилизатора на основе тетра-3-фенилтиофталоцианина гидроксиалюминия, отличающаяся тем, что она содержитяичный фосфатидилхолин;холестерин;mPEG2000-DSPE [метокси(полиэтиленгликоль-2000)] 1,2-дистеароил-sn-глицеро-3-фосфатидилэтаноламин-N;(pNP-PEG3400-DOPE) 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин-N-[п-нитрофенилкарбонил (полиэтиленгликоль-3400)цитрат натрия трехзамещенный;МКА анти - CD5 (ICO-80) (моноклональные антитела анти - CD5),при следующем соотношении компонентов (г):
| Фотосенсибилизатор, инкапсулированный в липосомы | 0,011 |
| Яичный фосфатидилхолин | 2,2 |
| Холестерин | 0,264 |
| mPEG2000-DSPE [метокси(полиэтиленгликоль-2000)] | |
| 1,2-дистеароил-sn-глицеро-3-фосфатидилэтаноламин-N | 0,0528 |
| (pNP-PEG3400-DOPE) 1,2-диолеоил-sn-глицеро-3- | |
| фосфатидилэтаноламин-N-[п-нитрофенилкарбонил (полиэтиленгликоль-3400)] | 0,0176 |
| Цитрат натрия трехзамещенный | 0,53 |
| МКА анти-CD5 (ICO-80) | 0,00237 |