Способ получения экстракта, обладающего противолепрозной активностью
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к фитотерапии, и может быть, в частности, использовано для получения экстракта, обладающего противолепрозной активностью. После 6-дневной экстракции корня солодки голой 40% этиловым спиртом в неотфильтрованную смесь (20 г растительного сырья в 100 мл спиртового раствора) добавляют в соотношении 1:1 (100 мл смеси, 100 мл буфера) буфер, содержащий, мас.%: хлористый кальций не более 0,014, хлористый калий не более 0,04, калий фосфорнокислый однозамещенный не более 0,006, магний сернокислый не более 0,02, хлористый магний не более 0,02, хлористый натрий не более 0,08, натрий кислый углекислый не более 0,035, натрий фосфорнокислый двухзамещенный не более 0,024; глюкоза не более 0,1, растворенных в 100 мл дистиллированной воды, при этом полученный раствор последующие 4 дня хранят при температуре 3°С, в темном месте при ежедневном его встряхивании. После чего экстракт отфильтровывают и 3-кратно автоклавируют при 0,5 атм в течение 10 мин. Изобретение позволяет реализовать указанное назначение. 9 табл.
Реферат
Изобретение относится к области медицины, а именно к фитотерапии, и может быть, в частности, использовано для получения экстракта, обладающего противолепрозной активностью.
Из практики медицины известен способ получения экстракта, обладающего противовоспалительными и антисептическими свойствами, состоящий из сушки, измельчения листьев эвкалипта прутовидного и настаивания его в 70% спирте в соотношении 1:5 (Машковский М.Д. Лекарственные средства: в 2 т. / М.Д.Машковский. - М.: ООО «Издательство Новая Волна»: Издатель С.Б.Дивов, 2002. - T.1. - С.316). Однако известный способ получения обладает недостаточной бактерицидной активностью, что не позволяет получить технический результат - противолепрозную активность и отсутствие побочного действия.
Известен также способ получения настойки, обладающей антисептическими и противовоспалительными свойствами, состоящий из сушки, измельчения цветков и цветочных корзинок календулы и настаивания его в 70% спирте в соотношении 1:10 (Машковский М.Д. Лекарственные средства: в 2 т. / М.Д.Машковский. - М.: ООО «Издательство Новая Волна»: Издатель С.Б.Дивов, 2002. - Т.2. - С.401). Однако известный способ получения имеет недостатки: приготовленная известным способом настойка обладает ограниченным действием из-за побочного эффекта спиртового раствора на печень, селезенку и другие органы. Кроме того, известный способ не дает возможность получить препарат, обладающий противолепрозной активностью.
Таким образом, изложенные недостатки не дают возможность получить технический результат - противолепрозную активность препарата и отсутствие побочного действия.
Наиболее близким способом к предлагаемому является способ получения экстракта из подземных и наземных частей солодки голой Glycyrrhiza glabra по патенту №2362577 от 27.07.2009 года, состоящий из высушивания, измельчения и десятидневной водно-спиртовой экстракции подземных (корня и корневища) и наземных (стебля, листьев, соцветий) частей солодки голой, после чего экстракт фильтруют и автоклавируют под давлением 0,5-0,3 атм в течение 15-30 минут.
Сходство предлагаемого способа с известным состоит в том, что они оба относятся к медицине, а именно к фитотерапии, и включает сушку, измельчение корня солодки голой и десятидневную водно-спиртовую его экстракцию с последующим фильтрованием экстракта и автоклавированием под давлением 0,5 атм в течение 30 минут (трехкратное автоклавирование по 10 минут).
К недостаткам известного способа можно отнести: полученный известным способом экстракт выделяет недостаточное количество биологически активных веществ. Этот недостаток не дает возможность получить конкретный технический результат - высокую противолепрозную активность препарата.
Предлагаемое изобретение решает основную задачу - получить экстракт с высокой концентрацией биологически активных веществ, обладающий противолепрозной активностью. Сущность изобретения выражена совокупностью существенных признаков, достаточных для обеспечиваемого изобретением технического результата.
Решение поставленной задачи заключается в том, что после 6-дневной экстракции корня солодки голой 40%этиловым спиртом в неотфильтрованную смесь (20 г растительного сырья в 100 мл спиртового раствора) добавляют в соотношении 1:1 (100 мл смеси, 100 мл буфера) буфер, содержащий, мас.%:
хлористый кальций не более 0,014,
хлористый калий не более 0,04,
калий фосфорнокислый однозамещенный не более 0,006,
магний сернокислый не более 0,02,
хлористый магний не более 0,02,
хлористый натрий не более 0,08,
натрий кислый углекислый не более 0,035,
натрий фосфорнокислый двухзамещенный не более 0,024;
глюкоза не более 0,1, растворенных в 100 мл дистиллированной воды, при этом полученный раствор последующие 4 дня хранят при температуре 3°С, в темном месте при ежедневном его встряхивании.
Отличительной особенностью предлагаемого способа является то, что авторы впервые для выделения биологически активных веществ в сочетании с водно-спиртовой экстракцией применили буфер с определенным содержанием солей, которые способствуют выделению большей концентрации биологически активных веществ, по сравнению с прототипом, в том числе белковых соединений, таких как лектины, являющихся аналогами антител животного и человека и обладающих иммунологическими свойствами.
В связи с развитием множественной лекарственной устойчивости возбудителей многих тяжелых инфекционных заболеваний к химиотерапевтическим препаратам поиск новых нативных растительных препаратов, губительно влияющих на структуру бактериальных клеток, не вызывая появление резистентных форм микроорганизмов, является необходимым и весьма актуальным.
Изучение взаимодействий между поверхностными углеводами оболочки бактерий и биологически активными веществами растений дает информацию о белках-лектинах, содержащихся среди них, а также обосновывает применение растительных препаратов при лечении инфекционных заболеваний. Высокая активность этих компонентов растений, которые могут обладать иммунологическими свойствами и связываться с углеводными рецепторами клеток бактерий, позволяет использовать их в качестве новых лекарственных средств, способных воздействовать непосредственно на возбудителя заболевания и при этом не вызывать осложнений в организме хозяина при лечении.
Поэтому необходимость выявлять новые противомикробные препараты, которые будут наилучшим образом проникать внутрь бактериальных клеток, инактивировать их и разрушать, не вызывает сомнений.
Следует отметить, что в растениях синтезируются одновременно сотни, если не тысячи биологически активных веществ, среди которых наибольший интерес в последнее время представляют компоненты, проявляющие антиоксидантные свойства, среди которых наибольшей активностью обладают биофлавоноиды. Растительные биофлавоноиды (апигенин, лютеолин, рутин, ликвиритин, изоликвиритин, гелихризин, изосалипурпозид, флавонол и мн.др.) относятся к группе низкомолекулярных природных антиоксидантов. Удельное содержание их в растительных препаратах колеблется от 16 до 40%. Антиоксидантное действие их заключается в замедлении или предотвращении окисления органических соединений.
Использование именно биологически активных веществ растений связано с высокой их активностью по отношению к клеткам-возбудителям и меньшей степенью резистентности микроорганизмов к растительным веществам (Сухенко, Л.Т. Разработка фитопрепаратов «ГЛИЦИР-ФИТ» с противотуберкулезной активностью. / Л.Т.Сухенко, М.А.Егоров, В.Я.Ноздрачев, Г.Н.Назарова, А.В.Ковалева // Биоресурсы, биотехнологии, экологическое развитие регионов юга России: Материалы докл. Междунар. конф. - Сочи, 2007. - С.71-75).
Поэтому необходимо изучать возможность использования биологически активных веществ, экстрагируемых из растений для оптимизации лечения ряда инфекционных заболеваний в эксперименте.
Предлагаемый способ дает возможность выделить биологически активные вещества, обладающие противолепрозной активностью, за счет использования дополнительного экстрагирования буфером, а соблюдение определенных температурных режимов обеспечивает экстракту долгую сохранность и безвредность.
Предлагаемый способ осуществляется следующим образом.
Корни и корневища солодки голой после промывания водой подвяливают, режут ножом, дробят в механических дробилках и высушивают в тени. Затем при комнатной температуре настаивают его в 40% водно-спиртовом растворе в соотношении 1:5 (20 г растительного сырья в 100 мл 40% раствора этилового спирта). После истечения 6-ти дней неотфильтрованную смесь настоя корня солодки голой дополнительно экстрагируют в соотношении 1:1 (100 мл смеси, 100 мл буфера) в темном месте при температуре 3°С буфером, содержащим, мас.% в 100 мл дистиллированной воды следующие вещества:
хлористого кальция не более 0,014,
хлористого калия не более 0,04,
калия фосфорнокислого однозамещенного не более 0,006,
магния сернокислого не более 0,02,
хлористого магния не более 0,02,
хлористого натрия не более 0,08,
натрия кислого углекислого не более 0,035,
натрия фосфорнокислого двухзамещенного не более 0,024 и
глюкозы не более 0,1.
Через 4 дня экстракт отфильтровывают от растительного сырья и 3-кратно автоклавируют в течение 10 минут при 0,5 атм.
Предлагаемый способ прошел успешную апробацию на базе лаборатории ФГУ «НИИЛ Росздрава» в течение 2007-2009 года.
Ниже приводятся результаты апробации.
Пример 1
Корни и корневища солодки голой после промывания водой подвяливают, режут ножом, дробят в механических дробилках и высушивают в тени. Затем методом водно-спиртовой экстракции в соотношении 1:5 (20 г растительного сырья в 100 мл 40% раствора этилового спирта) настаивают его при комнатной температуре. После истечения 6-ти дней в неотфильтрованную смесь настоя корня солодки голой добавляют буфер, содержащий, мас.% в 100 мл дистиллированной воды, следующие вещества:
хлористый кальций не более 0,014,
хлористый калий не более 0,04,
калий фосфорнокислый однозамещенный не более 0,006,
магний сернокислый не более 0,02,
хлористый магний не более 0,02,
хлористый натрий не более 0,08,
натрий кислый углекислый не более 0,035,
натрий фосфорнокислый двухзамещенный не более 0,024,
глюкозу не более 0,1;
дополнительно экстрагируют в соотношении 1:1 (100 мл смеси, 100 мл буфера) при температуре 3°С в темном месте при ежедневном его встряхивании. Через 4 дня экстракт отфильтровывают и 3-кратно автоклавируют под давлением 0,5 атм в течение 10 минут.
180 подопытных мышей, линии СВА с начальным весом 25-30 г, из которых 150 заражали интраплантарно (в подушечку правой задней лапы) взвесью M.leprae, выделенных от больных и трехкратно пассированных на экспериментальных животных (модель лепры по Шепарду). Доза инфекта составляла 1×104 микробных тел в 0,03 мл взвеси.
Все мыши были разделены на 6 групп. Опытные животные (I группа) спустя 2 месяца после заражения получали через зонд в пищевод ежедневно испытуемый растительный экстракт в дозе 0,2 мл/кг. Для контроля использовали мышей той же линии и с тем же начальным весом. Контролем служили мыши, получающие буферный экстракт солодки голой в дозе 0,2 мл/кг массы (II группа), мыши, получающие водно-спиртовой экстракт солодки голой в дозе 0,2 мл/кг массы (III группа), мыши, получающие кормолекарственную смесь, состоящую из комбикорма, в 1 кг которого содержалось 100 мг основного противолепрозного средства - диаминодифенилсульфона (ДДС) (IV группа). V группа мышей после заражения не получала лечения (в качестве плацебо использовали дистиллированную воду). VI группа экспериментальных животных (30 мышей) не заражалась, и в качестве плацебо получали дистиллированную воду. Все эксперименты по моделированию патологических процессов у животных и выведению их из опыта были проведены в соответствии с принципами биоэтики, правилами лабораторной практики (GLP). Методы соответствуют этическим нормам, изложенным в Женевской конвенции (1971), «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985) и в соответствии с приказом МЗ РФ №267 от 19.06.2003, «Об утверждении правил лабораторной практики» (Минздрав СССР №755 от 12.08.1977). Все опыты проводились после введения животным этаминала натрия в концентрации 40 мг/кг.
Через 5, 7 и 9 мес от начала эксперимента (заражения мышей) и через 3, 5 и 7 мес после начала лечения у 10 мышей из каждой группы брали воспалительный инфильтрат и кровь.
Количество M.leprae в лапках мышей подсчитывали методом Shepard и McRae (1968).
Приготовление суспензии для подсчета микобактерий лепры:
→ Срезали ткани с подушечек лапок мышей и измельчали ножницами.
→ Растирали ткани в 2,0 мл 0,1% раствора бычьего сывороточного альбумина (БСА).
→ Полученную суспензию центрифугировали при 200 g в течение 3 минут для осаждения грубых частиц тканей.
→ 0,01 мл суспензии и 0,01 мл 0,1% раствора БСА наносили на середину трех кругов (d=1 см), очерченных на специальных предметных стеклах; жидкости смешивали.
→ Мазок высушивали на воздухе, фиксировали над пламенем спиртовки, окрашивали по методу Циля-Нильсепа.
После высыхания мазка на воздухе проводили микроскопические исследования. Подсчет числа микобактерий осуществляли с использованием иммерсионного объектива 100х и окуляра 7х в любых 20 полях зрения микроскопа по диаметру каждого круга. Общее число полей зрения, подсчитываемых для каждой суспензии, составляло 60.
Расчет общего числа микобактерий в суспензии проводили по следующей формуле:
NКУМ=ΣКУМ/60×1/0,01×πR1 2/πR2 2=670000 ΣКУМ/60,
где NКУМ - количество кислотоустойчивых микобактерий в 1 мл суспензии;
ΣКУМ - общее количество кислотоустойчивых микобактерий, подсчитанное в 60 полях зрения;
R1 - радиус круга, нанесенного на предметное стекло;
R2 - радиус поля зрения, измеренного по мерной шкале;
670000 - фактор увеличения, вычисленный для используемого микроскопа.
Результаты подсчета количества микобактерий лепры в лапах мышей представлены в табл.1.
Терапия буферным и испытуемым экстрактом корня солодки голой уже через 3 мес лечения приводила к значительному подавлению роста M.leprae в подушечках лап мышей по отношению к контролю (в 15 раз и в 17 раз соответственно) и по отношению к монотерапии ДДС в 1,5 раза и в 1,7 раза соответственно. Через 5 и 7 месяцев лечения животных буферным и испытуемым экстрактом отмечалась та же тенденция к нормальной физиологической деятельности тканей и клеток в подушечках лапок экспериментальных животных, то есть действие экстракта способствовало подавлению размножения M.leprae в 9 раз и в 11 раз соответственно больше по отношению к контролю и по отношению к лечению ДДС - в 1,2 раза и в 1,3 раза соответственно. При этом водно-спиртовой экстракт солодки голой не проявил выраженной противолерозной активности на всех этапах эксперимента. (Табл.1).
Таким образом, данный способ получения экстракта способствует выделению биологически активных веществ, которые при лечении экспериментальной лепры в дозе 0,2 мл/кг массы мыши приводят к достоверному снижению количества возбудителя в подушечках лап мышей, экспериментально зараженных микобактериями лепры, по сравнению с контролем. В этом случае отмечено преобладание фармакологического эффекта используемого экстракта по сравнению с прототипом и ДДС.
Уровень токсичности исследуемого препарата на организм экспериментальных животных определяли по данным вскрытия испытуемых и интактных животных (незараженными мышами). Вскрытие показало, что мыши, принимающие используемый экстракт, были правильного телосложения, удовлетворительного питания. Шерсть была опрятного вида, очагов облысения не определялось. Выделения из естественных отверстий отсутствовали.
Видимые слизистые оболочки были блестящими, гладкими, бледного цвета.
Грудная и брюшная полости выпота не содержали. Положение внутренних органов нарушений не представляло.
Подчелюстные лимфатические узлы и слюнные железы имели округлую и овальную форму, беловатый цвет, умеренно плотную консистенцию, розоватый цвет.
Щитовидная железа была обычной величины и формы, красноватого цвета. Тимус имел треугольную форму, беловатый цвет и чуть плотноватую консистенцию.
Интима аорты была гладкой, блестящей. Величина и форма сердца изменений не представляли. Мышца сердца была умеренно плотной, коричневатой окраски.
Просвет трахеи и крупных бронхов был равномерно широким. Легкие легко спадались при вскрытии грудной клетки. Их поверхность была однородной бледно-розовой окраски. Ткань легких на ощупь представлялась воздушной.
Слизистая пищевода была блестящей, гладкой. Желудок имел обычные размеры, просвет его был заполнен пищевым содержимым. Слизистая оболочка была складчатая, однородного розоватого цвета. Раздражения, гиперемии не отмечалось. Слизистая оболочка тонкой кишки была бледно-розовой, блестящей, гладкой. Слизистая оболочка толстой была также гладкой, слегка сероватого цвета.
Форма и величина печени изменений не представляла. Ткань печени была умеренно полнокровной. Поджелудочная железа была бледно-розового цвета, дольчатая.
Размеры и форма селезенки изменений не представляли. Ткань селезенки была умеренно плотной консистенции, темно-вишневого цвета. Капсула почек легко снималась, поверхность была гладкой, однородно коричневато-сероватого цвета. На разрезе органа хорошо различимы корковое и мозговое вещества. Надпочечники были округлой формы, беловатого цвета и умеренно плотной консистенции.
Слизистая оболочка мочевого пузыря была гладкой, блестящей, бледной окраски. Тело и рога матки имели обычный вид и размеры. Яичники имели неровную поверхность, красноватый цвет и умеренную плотность. Яички самцов лежали в брюшной полости, поверхность их была гладкой, цвет - беловатым, форма - округлой.
Оболочки головного мозга были блестящими, тонкими, гладкими. На фронтальных разрезах расширения желудочков не наблюдалось.
Результаты измерения массовых коэффициентов приведены в таблице 2.
| Таблица 2 | ||||
| Массовый коэффициент (МК) органов экспериментальных мышей при введении экстракта (мг/10 г веса тела) | ||||
| МК | Исследуемые группы и пол | |||
| Контроль | Препарат | |||
| самцы | самки | самцы | самки | |
| Сердце | 3,6±0,4 | 3,8±0,6 | 4,0±0,2 | 4,1±0,6 |
| Легкие с трахеей | 6,3±0,5 | 6,9±0,4 | 6,5±0,3 | 6,9±0,4 |
| Тимус | 0,92±0,06 | 0,90±0,03 | 0,8б±0,04 | 0,88±0,05 |
| Печень | 38,6±0,9 | 37,5±1,5 | 40,1±2,8 | 38,3±2,6 |
| Селезенка | 3,2±0,2 | 3,3±0,3 | 3,4±0,8 | 3,6±0,6 |
| Почка (лев.) | 4,5±0,5 | 4,4±0,б | 4,3±0,7 | 4,6±0,2 |
| Надпочечники | 0,20±0,05 | 0,18±0,07 | 0,20±0,06 | 0,17±0,03 |
| Головной мозг | 15,2±0,6 | 16,1±0,7 | 15,4+0,6 | 16,2±0,8 |
Таким образом, по данным морфологического исследования (внутренние органы не изменены) исследуемый экстракт при в/ж введении экспериментальным животным можно отнести к нетоксичным и малоопасным веществам.
Для изучения сенсибилизирующего действия в кожу наружной поверхности уха мыши туберкулиновым шприцем вводили однократно 0,2 мл экстракта, а через 10 дней на предварительно выстриженные участки кожи боковой поверхности спины размером 2×2 см наносили экстракт из расчета 0,2 мл/см2. Кровь у животных брали через 3 часа после постановки кожных проб. При этом на коже спины не отмечалось признаков раздражения, а в периферической крови - признаков сенсибилизации (табл.3).
Результаты сенсибилизирующего действия экстракта представлены в таблице 3.
| Таблица 3 | ||
| Влияние введения экстракта на показатели гуморальных факторов иммунной системы | ||
| Показатели | Контроль | Опыт |
| Лейкоциты, 109/л | 2,1±0,2 | 2,5±0,1 |
| Эозинофилы, % | 2,8±0,4 | 3,7±0,8 |
| Лимфоциты, % | 62±3,4 | 55,4±6,3 |
| Моноциты, % | 0,2±0,02 | 0,4±0,03 |
| Палочкоядерные нейтрофилы, % | 8,2±0,9 | 10±0,8 |
| Сегментоядерные нейтрофилы, % | 27±3,8 | 26±6,2 |
Следовательно, исследуемый экстракт, полученный предлагаемым способом, не обладает раздражающим кожу мышей и сенсибилизирующим действием. Таким образом, исследуемый экстракт не токсичен.
На всем протяжении опыта (9 месяцев) испытуемый экстракт хранился при комнатной температуре и не потерял своих антибактериальных свойств.
Пример 2
Условия эксперимента аналогичны примеру 1. 180 мышей линии СВА (6 групп по 30 животных), 150 из которых заражали взвесью микобактерий лепры, выделенных от больного и пассированных трехкратно на мышах. I-й группе мышей после заражения давали испытуемый растительный экстракт в дозе 0,2 мл/кг, но при приготовлении дополнительно экстрагируемый в соотношении 1:1 буфером, содержащим, мас.% в 100 мл дистиллированной воды следующие вещества:
хлористый кальций 0,007,
хлористый калий 0,02,
калий фосфорнокислый однозамещенный 0,003,
магний сернокислый 0,01,
хлористый магний 0,01,
хлористый натрий 0,04,
натрий кислый углекислый 0,018,
натрий фосфорнокислый двухзамещенный 0,012 и
глюкозу 0,05.
Контроли осуществлялись аналогично примеру 1. Животных исследовали через 3, 5 и 7 мес с момента лечения. Подсчитывали количество микобактерий в лапах мышей и определяли токсичность используемого препарата на организм мышей способами, указанными в примере 1.
Результаты представлены в таблице 4.
Терапия испытуемым экстрактом корня солодки голой через 3 мес лечения приводила к подавлению роста M.leprae в подушечках лап мышей, хотя была недостоверно меньше по сравнению с противолепрозной активностью буферного экстракта. Через 5 и 7 месяцев лечения животных испытуемым экстрактом отмечалась та же тенденция к подавлению размножения M.leprae в подушечках лап мышей в 6 раз больше по отношению к контролю и по отношению к лечению ДДС - в 1,3 раза. При этом водно-спиртовой экстракт солодки голой не проявил выраженной противолерозной активности на всех этапах эксперимента. (Табл. 4).
Таким образом, лечение экспериментально зараженных микобактериями лепры мышей полученным предлагаемым способом экстрактом в дозе 0,2 мл/кг массы мыши, но при приготовлении дополнительно экстрагируемым буфером в соотношении 1:1, содержащим, мас.% в 100 мл дистиллированной воды, следующие вещества:
хлористый кальций 0,007,
хлористый калий 0,02,
калий фосфорнокислый однозамещенный 0,003,
магний сернокислый 0,01,
хлористый магний 0,01,
хлористый натрий 0,04,
натрий кислый углекислый 0,018,
натрий фосфорнокислый двухзамещенный 0,012 и
глюкозу 0,05
приводит к достоверному снижению количества возбудителя лепры в подушечках лап мышей по сравнению с контролем. Отмечено преобладание фармакологического эффекта по сравнению с прототипом и ДДС.
Уровень токсичности исследуемого препарата на организм экспериментальных животных определяли по данным вскрытия испытуемых и интактных животных (незараженными мышами). Вскрытие показало, что мыши, принимающие исследуемый экстракт, были правильного телосложения, удовлетворительного питания. Шерсть была опрятного вида, очагов облысения не определялось. Выделения из естественных отверстий отсутствовали.
Видимые слизистые оболочки были блестящими, гладкими, бледного цвета.
Грудная и брюшная полости выпота не содержали. Положение внутренних органов нарушений не представляло.
Подчелюстные лимфатические узлы и слюнные железы имели округлую и овальную форму, беловатый цвет, умеренно плотную консистенцию, розоватый цвет.
Щитовидная железа была обычной величины и формы, красноватого цвета. Тимус имел треугольную форму, беловатый цвет и чуть плотноватую консистенцию.
Интима аорты была гладкой, блестящей. Величина и форма сердца изменений не представляли. Мышца сердца была умеренно плотной, коричневатой окраски.
Просвет трахеи и крупных бронхов был равномерно широким. Легкие легко спадались при вскрытии грудной клетки. Их поверхность была однородной бледно-розовой окраски. Ткань легких на ощупь представлялась воздушной.
Слизистая пищевода была блестящей, гладкой. Желудок имел обычные размеры, просвет его был заполнен пищевым содержимым. Слизистая оболочка была складчатая, однородного розоватого цвета. Раздражения, гиперемии не отмечалось. Слизистая оболочка тонкой кишки была бледно-розовой, блестящей, гладкой. Слизистая оболочка толстой была также гладкой, слегка сероватого цвета.
Форма и величина печени изменений не представляла. Ткань печени была умеренно полнокровной. Поджелудочная железа была бледно-розового цвета, дольчатая.
Размеры и форма селезенки изменений не представляли. Ткань селезенки была умеренно плотной консистенции, темно-вишневого цвета. Капсула почек легко снималась, поверхность была гладкой, однородно коричневато-сероватого цвета. На разрезе органа хорошо различимы корковое и мозговое вещества. Надпочечники были округлой формы, беловатого цвета и умеренно плотной консистенции.
Результаты измерения массовых коэффициентов приведены в таблице 5.
| Таблица 5 | ||||
| Массовый коэффициент (МК) органов экспериментальных мышей при введении экстракта (мг/10 г веса тела) | ||||
| МК | Исследуемые группы и пол | |||
| Контроль | Препарат | |||
| самцы | самки | самцы | самки | |
| Сердце | 3,4±0,4 | 3,5±0,6 | 3,9±0,1 | 4,0±0,3 |
| Легкие с трахеей | 6,0±0,5 | 6.3±0.4 | 6,2±0,2 | 6,5±0,3 |
| Тимус | 1,02±0,06 | 0,98±0,03 | 1,06±0,03 | 1,01±0,01 |
| Печень | 35,2±0,9 | 33,7±1,5 | 39,1±1,3 | 37,1±2,3 |
| Селезенка | 3,6±0,9 | 3,4±0,7 | 3,5±0,7 | 3,7±0,5 |
| Почка (лев.) | 4,8±0,4 | 4,6±0,2 | 4,5±0,5 | 4,3±0,8 |
| Надпочечники | 0,19±0,01 | 0,2±0,01 | 0,18±0,03 | 0,21±0,06 |
| Головной мозг | 18,2±0,9 | 19,1±0,9 | 17,4+0,3 | 15,9±0,2 |
Слизистая оболочка мочевого пузыря была гладкой, блестящей, бледной окраски. Тело и рога матки имели обычный вид и размеры. Яичники имели неровную поверхность, красноватый цвет и умеренную плотность. Яички самцов лежали в брюшной полости, поверхность их была гладкой, цвет - беловатым, форма - округлой.
Оболочки головного мозга были блестящими, тонкими, гладкими. На фронтальных разрезах расширения желудочков не наблюдалось.
Таким образом, по данным морфологического исследования (внутренние органы не изменены) исследуемый экстракт, полученный предлагаемым способом, при в/ж введении экспериментальным животным можно отнести к нетоксичным и малоопасным веществам.
Для изучения сенсибилизирующего действия в кожу наружной поверхности уха мыши туберкулиновым шприцем вводили однократно 0,2 мл экстракта, а через 10 дней на предварительно выстриженные участки кожи боковой поверхности спины размером 2×2 см наносили экстракт из расчета 0,2 мл/см2. Кровь у животных брали через 3 часа после постановки кожных проб. При этом на коже спины не отмечалось признаков раздражения, а в периферической крови - признаков сенсибилизации (табл.6).
Результаты сенсибилизирующего действия экстракта представлены в таблице 6.
| Таблица 6 | ||
| Влияние введения экстракта на показатели гуморальных факторов иммунной системы | ||
| Показатели | Контроль | Опыт |
| Лейкоциты, 10% | 3,2±0,4 | 3,4±0,9 |
| Эозинофилы, % | 6,6±0,7 | 4,7±1,14 |
| Лимфоциты, % | 58,5±4,4 | 64,2±5,3 |
| Моноциты, % | 1,0±0,3 | 1,0±0,9 |
| Палочкоядерные нейтрофилы, % | 2,4±0,03 | 3,8±0,6 |
| Сегментоядерные нейтрофилы, % | 31,8±3,9 | 36,2±4,2 |
Следовательно, исследуемый экстракт, полученный предлагаемым способом, не обладает раздражающим на кожу мыши и сенсибилизирующим действием. Таким образом, исследуемый экстракт не токсичен.
Пример 3
Условия эксперимента аналогичны примеру 1. 180 мышей линии СВА (6 групп по 30 животных), 150 из которых заражали взвесью микобактерий лепры, выделенных от больного и пассированных трехкратно на мышах. I-ой группе мышей после заражения давали испытуемый растительный экстракт в дозе 0,2 мл/кг, но при приготовлении дополнительно экстрагируемый буфером в соотношении 1:1, содержащим, мас.% в 100 мл дистиллированной воды следующие вещества:
хлористый кальций 0,028,
хлористый калий 0,08,
калий фосфорнокислый однозамещенный 0, 012,
магний сернокислый 0,04,
хлористый магний 0,04,
хлористый натрий 0,016,
натрий кислый углекислый 0,07,
натрий фосфорнокислый двухзамещенный 0,048,
глюкозу 0,2.
Контроли осуществлялись аналогично примеру 1. Животных исследовали через 3, 5 и 7 мес с момента лечения. Подсчитывали количество микобактерий в лапах мышей и определяли токсичность используемого препарата на организм мышей способами, указанным в примере 1.
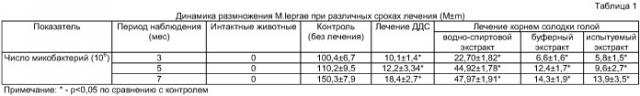
Терапия буферным экстрактом корня солодки голой через 3, 5 и 7 месяцев лечения приводила к подавлению роста M.leprae в подушечках лап мышей, в среднем в 9 раз больше по сравнению с контролем. При этом водно-спиртовой и испытуемый экстракты солодки голой проявили противолерозную активность на всех этапах эксперимента, которая была аналогична противолепрозной активности ДДС, но в 1,5 раза меньше, чем активность буферного экстракта корня солодки голой (Табл. 7).
Результаты представлены в таблице 7.
| Таблица 7 | |||||||
| Динамика размножения M.leprae при различных сроках лечения (М±m) | |||||||
| Показатель | Период наблюдения (мес) | Интактные животные | Контроль (без лечения) | ДДС | Лечение корнем солодки голой | ||
| водно-спиртовой экстракт | буферный экстракт | испытуемый экстракт | |||||
| Число микобактерий (106) | 3 | 0 | 111,5±7,2 | 23,4±3,7* | 24,2±2,1* | 11,9±1,6* | 22,4±4,1* |
| 5 | 0 | 158,4±9,7 | 37,9±2,8* | 38,4±3,2* | 15,3±0,9* | 29,1±5,3* | |
| 7 | 0 | 239,4±8,3 | 45,4±1,2* | 45,8±6,4* | 26,113,7* | 38,2±2,7* | |
| Примечание * - р<0,05 по сравнению с контролем |
Таким образом, лечение экспериментально зараженных микобактериями лепры мышей полученным предлагаемым способом экстрактом в дозе 0,2 мл/кг массы мыши, но при приготовлении дополнительно экстрагируемым буфером в соотношении 1:1, содержащим, мас.% в 100 мл дистиллированной воды следующие вещества:
хлористый кальций 0,028,
хлористый калий 0,08,
калий фосфорнокислый однозамещенный 0,012,
магний сернокислый 0,04,
хлористый магний 0,04,
хлористый натрий 0,016,
натрий кислый углекислый 0,07,
натрий фосфорнокислый двухзамещенный 0,048,
глюкозу 0,2,
приводит к достоверному снижению количества возбудителя лепры в подушечках лап мышей по сравнению с контролем. Однако его противолепрозное действие было меньше активности буферного экстракта с коротким сроком хранения. В этом случае не отмечено достоверного преобладания фармакологического эффекта по сравнению с прототипом и ДДС.
Уровень токсичности исследуемого препарата на организм экспериментальных животных определяли по данным вскрытия испытуемых и интактных животных (незараженными мышами). Вскрытие показало, что мыши, принимающие используемый экстракт, были правильного телосложения, удовлетворительного питания. Шерсть была опрятного вида, очагов облысения не определялось. Выделения из естественных отверстий отсутствовали.
Видимые слизистые оболочки были блестящими, гладкими, бледного цвета.
Грудная и брюшная полости выпота не содержали. Положение внутренних органов нарушений не представляло.
Подчелюстные лимфатические узлы и слюнные железы имели округлую и овальную форму, беловатый цвет, умеренно плотную консистенцию, розоватый цвет.
Щитовидная железа была обычной величины и формы, красноватого цвета. Тимус имел треугольную форму, беловатый цвет и чуть плотноватую консистенцию.
Интима аорты была гладкой, блестящей. Величина и форма сердца изменений не представляли. Мышца сердца была умеренно плотной, коричневатой окраски.
Просвет трахеи и крупных бронхов был равномерно широким. Легкие легко спадались при вскрытии грудной клетки. Их поверхность была однородной бледно-розовой окраски. Ткань легких на ощупь представлялась воздушной.
Слизистая пищевода была блестящей, гладкой. Желудок имел обычные размеры, просвет его был заполнен пищевым содержимым. Слизистая оболочка была складчатая, однородного розоватого цвета. Раздражения, гиперемии не отмечалось. Слизистая оболочка тонкой кишки была бледно-розовой, блестящей, гладкой. Слизистая оболочка толстой была также гладкой, слегка сероватого цвета.
Форма и величина печени изменений не представляла. Ткань печени была умеренно полнокровной. Поджелудочная железа была бледно-розового цвета, дольчатая.
Размеры и форма селезенки изменений не представляли. Ткань селезенки была умеренно плотной консистенции, темно-вишневого цвета. Капсула почек легко снималась, поверхность была гладкой, однородно коричневато-сероватого цвета. На разрезе органа хорошо различимы корковое и мозговое вещества. Надпочечники были округлой формы, беловатого цвета и умеренно плотной консистенции.
Слизистая оболочка мочевого пузыря была гладкой, блестящей, бледной окраски. Тело и рога матки имели обычный вид и размеры. Яичники имели неровную поверхность, красноватый цвет и умеренную плотность. Яички самцов лежали в брюшной полости, поверхность их была гладкой, цвет - беловатым, форма - округлой.
Оболочки головного мозга были блестящими, тонкими, гладкими. На фронтальных разрезах расширения желудочков не наблюдалось.
Результаты измерения массовых коэффициентов приведены в таблице 8.
| Таблица 8 | ||||
| Массовый коэффициент (МК) органов экспериментальных мышей при введении экстракта (мг/10 г веса тела) | ||||
| МК | Исследуемые группы и пол | |||
| Контроль | Препарат | |||
| самцы | самки | самцы | самки | |
| Сердце | 3,6±0,4 | 3,8±0,6 | 4,0±0,2 | 4,1±0,6 |
| Легкие с трахеей | 6,3±0,5 | 6.9±0.4 | 6,5±0,3 | 6,9±0,4 |
| Тимус | 0,92±0,06 | 0,90±0,03 | 0,86±0,04 | 0,88±0,05 |
| Печень | 45,6±0,9 | 40,5±1,5 | 48,1±2,8 | 47,3±2,6 |
| Селезенка | 4,2±0,2 | 4,3±0,3 | 5,4±0,8 | 5,6±0,6 |
| Почка (лев.) | 4,7±0,3 | 4,6±0,4 | 4,7±0,5 | 4,8±0,01 |
| Надпочечники | 0,21±0,1 | 0,18±0,02 | 0.19±0,6 | 0,20±0,3 |
| Головной мозг | 16,3±0,3 | 17,6±0,02 | 16,4+0,1 | 18,1±0,5 |
Таким образом, по данным морфологического исследования (внутренние органы не изменены) исследуемый экстракт, полученный предлагаемым способом, при в/ж введении экспериментальным животным можно отнести к нетоксичным и малоопасным веществам.
Результаты сенсибилизирующего действия экстракта представлены в таблице 9.
| Таблица 9 | ||
| Влияние введения экстракта на показатели гуморальных факторов иммунной системы | ||
| Показатели | Контроль | Опыт |
| Лейкоциты, 109/л | 2,0±0,05 | 2,3±0,31 |
| Эозинофилы, % | 1,6±0,03 | 2,7±0,4 |
| Лимфоциты, % | 73,2±4,7 | 72,4±2,9 |
| Моноциты, % | 1,2±0,15 | 0,6±0,17 |
| Палочкоядерные нейтрофилы, % | 4,4±0,5 | 3,8±0,7 |
| Сегментоядерные нейтрофилы, % | 21,4±1,7 | 23±0,2 |
Для изучения сенсибилизирующего действия в кожу наружной поверхности уха мыши туберкулиновым шприцем вводили однократно 0,2 мл экстракта, а через 10 дней на предварительно выстриженные участки кожи боковой поверхности спины размером 2×2 см наносили экстракт из расчета 0,2 мл/см2. Кровь у животных брали через 3 часа после постановки кожных проб. При этом на коже спины не отмечалось признаков раздражения, а в периферической крови - признаков сенсибилизации (табл.9).
Следовательно, исследуемый экстракт, полученный предлагаемым способом, не обладает раздражающим на кожу мыши и сенсибилизирующим действием. Таким образом, исследуемый экстракт не токсичен.
Таким образом, анализ приведенных примеров показывает, что предлагаемый способ получения экстракта корня солодки голой, содержащего 1 часть спиртового экстракта и 1 часть буфера, способствует выделению набора биологически активных веществ, которые дают лучшие результаты в отношении подавления роста микобактерий лепры, в подушечках лап экспериментально зараженных мышей, при лечении полученным экстрактом в дозе 0,2 мл/кг массы животного. Снижение количества возбудителя лепры в подушечках лап мышей достоверно по сравнению с контролем (мыши без лечения) и по сравнению с лечением ДДС. При снижении дозы солей в буфере в 2 раза не отмечено достоверного снижения фармакологического эффекта по сравнению с первоначальным вариантом.
При повышении дозы солей в буфере отмечался несколько лучший, но статистически недостоверный (р>0,05) антибактериальный эффект по сравнению с прототипом и ДДС.
Проведенный анализ патентной и научной литературы показал, что ранее приготовление экстрактов из растительного сырья не основывалось на сочета