Вирусвакцина против болезни марека
Иллюстрации
Показать всеИзобретение относится к области ветеринарной вирусологии и биотехнологии. Вирусвакцина содержит клеточно-ассоциированный вирус герпеса индеек (ВГИ) штамма «Владимир», сыворотку крови крупного рогатого скота (КРС) и диметилсульфоксид (ДМСО) в соотношении, мас.%: 60,0-80,0; 15,0-25,0 и 5,0-15,0 соответственно. Штамм депонирован в коллекцию микроорганизмов ФГУ «ВГНКИ» под регистрационным номером (ссылкой) «Владимир №124-ДЕП» ВГИ (далее «Штамм»). Штамм репродуцируется в культуре клеток фибропластов эмбрионов SPF-кур (ФЭК) и достигает титра 3,5·106 ФОЕ/см3, при этом для изготовления вирусвакцины используют суспензию инфицированных клеток ФЭК с титром не ниже 5,5·105 ФОЕ/см3. Вирусвакцина обладает высокой иммуногенной активностью, защищает иммунизированное поголовье домашней птицы от заражения эпизоотическим ВБМ, циркулирующим на территории России. 5 з.п. ф-лы, 3 табл.
Реферат
Изобретение относится к области ветеринарной вирусологии и биотехнологии и может быть использовано при разработке и изготовлении средств специфической профилактики болезни Марека.
Болезнь Марека (БМ) - высококонтагиозное, лимфопролиферативное, злокачественное, вирусное заболевание птиц. БМ регистрируется во всех странах мира, где развито промышленное птицеводство, в том числе и в нашей стране, вызывая большие экономические потери. БМ характеризуется образованием единичных (в начальной стадии) и множественных опухолей во внутренних органах, коже, мышцах, а также изменениями центральной и периферической нервной системы. Вирус болезни Марека (ВБМ) повреждает иммунокомпетентные органы (селезенку, тимус, клоакальную сумку) и обладает, таким образом, иммунодепрессивной активностью, что приводит к снижению общей резистентности птиц и повышению их чувствительности к другим болезням. В связи с этим БМ довольно часто протекает в ассоциации с другими заболеваниями. Важным средством предупреждения БМ и снижения потерь от заболевания является вакцинопрофилактика. Для специфической профилактики используют вакцины трех типов: 1) из аттенуированных штаммов ВБМ (серотип 1); 2) из природноослабленного непатогенного ВБМ (серотип 2) и 3) из штаммов вируса герпеса индеек (серотип 3). Основой профилактики БМ является активная иммунизация цыплят в суточном возрасте живыми моно-, би - и поливалентными вакцинами. Большинство известных в мире профилактических препаратов созданы на основе штамма FC-126 вируса герпеса индеек (ВГИ) или его комбинаций с известными в природе представителями 1 и 2 серотипов ВБМ и надежно защищают привитое поголовье от полевых штаммов ВБМ средней степени патогенности [1, 2, 3, 4].
Популярность вирусвакцины на основе ВГИ (штамм FC-126) обусловлена тем, что данный вирус не требует аттенуации, не опасен в плане риверсии и подвергается стабилизации во внеклеточном состоянии. На основе ВГИ готовят 2 типа вакцин: свободную от клеток (сухую) и клеточно-ассоциированную (нативную).
Известна вирусвакцина против БМ, содержащая суспензию клеток фибробластов эмбрионов SPF-кур (ФЭК), инфицированных клеточно-ассоциированным ВГИ штамма FC-126, с инфекционной активностью не ниже 1,0·105 ФОЕ/см3, сыворотку крови крупного рогатого скота (КРС) и диметилсульфоксид (ДМСО) в качестве криопротектора в соотношении, мас.%:
| Суспензия инфицированных клеток | 80,0÷90,0 |
| Сыворотка крови КРС | 5,0÷10,0 |
| ДМСО | 5,0÷10,0 [5]. |
Недостаток данной вирусвакцины состоит в том, что она не обеспечивает удовлетворительной защиты против ВБМ, циркулирующего на территории Российской Федерации.
В связи с появлением в последнее время в птицехозяйствах высокопатогенных возбудителей БМ участились случаи не всегда достаточной эффективности известных вирусвакцин, используемых для профилактики БМ. Это обстоятельство вынуждает вести постоянный поиск новых штаммов ВГИ, пригодных для изготовления эффективных вакцинных препаратов против БМ.
Наиболее близким предлагаемому изобретению по совокупности существенных признаков является вирусвакцина против БМ, содержащая суспензию клеток ФЭК, инфицированных клеточно-ассоциированным ВГИ штамма «ВНИИЗЖ/№110», с инфекционной активностью не ниже 1,0·105 ФОЕ/см3, сыворотку крови КРС и ДМСО в качестве криопротектора в соотношении, мас.%:
| Суспензия инфицированных клеток | 60,0÷80,0 |
| Сыворотка крови КРС | 15,0÷25,0 |
| ДМСО | 5,0÷15,0 [6]. |
Существенный недостаток вирусвакцины-прототипа состоит в том, что ее применение не исключает выделение вакцинированной птицей возбудителя БМ в окружающую среду.
Задача, на решение которой направлено настоящее изобретение, заключается в получении вирусвакцины против БМ на основе нового штамма ВГИ, создающей эффективную защиту домашней птицы против БМ и предотвращающей выделение вакцинированной птицей возбудителя БМ в окружающую среду.
Технический результат от использования предлагаемого изобретения заключается в расширении арсенала высокоиммуногенных, безвредных и ареактогенных вирусвакцин против БМ, способных защитить домашнюю птицу от высокопатогенных штаммов возбудителя БМ, циркулирующих на территории Российской Федерации.
Указанный технический результат достигнут созданием вирусвакцины против БМ, охарактеризованной следующей совокупностью признаков.
Согласно изобретению предлагаемая вирусвакцина содержит суспензию клеток ФЭК, инфицированных клеточно-ассоциированным ВГИ штамма «Владимир» (авторское наименование), с инфекционной активностью не ниже 5,5·105 ФОЕ/см3, сыворотку крови КРС и ДМСО в качестве криопротектора в соотношении, мас.%:
| Суспензия инфицированных клеток | 60,0÷80,0 |
| Сыворотка крови КРС | 15,0÷25,0, |
| ДМСО | 5,0÷15,0 |
Вирусный изолят, послуживший источником для получения штамма «Владимир», был выделен в 1999 году от здоровых индеек частного сектора в Ростовской области. Производственный штамм «Владимир» ВГИ получен путем последовательного пассирования в культуре клеток ФЭК. Штамм «Владимир» представляет собой апатогенный генетически однородный вирусный материал, активно размножающийся в культуре клеток ФЭК с инфекционной активностью 2,0·106 ФОЕ/см3.
Штамм «Владимир» ВГИ депонирован 19 июля 2005 г. во Всероссийскую государственную коллекцию штаммов микроорганизмов, используемых в ветеринарии и животноводстве, Федерального государственного учреждения «Всероссийский государственный центр качества и стандартизации лекарственных средств для животных и кормов» (ФГУ «ВГНКИ») под регистрационным номером (ссылкой): штамм «Владимир №124 - ДЕП» ВГИ.
Экспериментально подтверждена возможность его использования для изготовления вирусвакцины против БМ. Штамм «Владимир» обеспечивает получение вирусвакцины против БМ, создающей защиту домашней птицы против высокопатогенных штаммов возбудителя болезни.
Предлагаемое изобретение включает следующую совокупность существенных признаков, обеспечивающих получение технического результата во всех случаях, на которые испрашивается правовая охрана:
1. Вирусвакцина БМ.
2. Суспензия клеток ФЭК, инфицированных клеточно-ассоциированным ВГИ штамма «Владимир», в эффективном количестве.
3. Сыворотка крови КРС.
4. ДМСО в качестве криопротектора.
Признаками изобретения, характеризующими предлагаемую вирусвакцину и совпадающими с признаками прототипа, в том числе родовое понятие, отражающее назначение, являются:
1. Вирусвакцина против БМ.
2. Суспензия клеток ФЭК, инфицированных клеточно-ассоциированным ВГИ в эффективном количестве.
3. Сыворотка крови КРС.
4. ДМСО в качестве криопротектора.
По сравнению с вирусвакциной-прототипом существенным отличительным признаком предлагаемой вирусвакцины является то, что она содержит суспензию клеток ФЭК, инфицированных клеточно-ассоциированным ВГИ штамма «Владимир», обладающего высокой антигенной и иммуногенной активностью, в эффективном количестве.
Предлагаемое изобретение характеризуется также другими отличительными признаками, выражающими конкретные формы выполнения или особые условия его использования:
1. Суспензия клеток ФЭК, инфицированных клеточно-ассоциированным ВГИ штамма «Владимир», с инфекционной активностью не ниже 5,5·106 ФОЕ/см3 в эффективном количестве.
2. Суспензия клеток ФЭК, инфицированных клеточно-ассоциированным ВГИ штамма «Владимир», с инфекционной активностью не ниже 5,5·106 ФОЕ/см3 в количестве 60,0÷80,0 мас.%.
3. Сыворотка крови КРС в количестве 15,0÷25,0 мас.%.
4. ДМСО в качестве криопротектора в количестве 5,0÷15,0 мас.%.
5. Суспензия клеток ФЭК, инфицированных клеточно-ассоциированным ВГИ, с инфекционной активностью не ниже 5,5·106 ФОЕ/см3, сыворотка крови КРС и ДМСО в качестве криопротектора в соотношении, мас.%:
| Суспензия инфицированных клеток | 60,0÷80,0 |
| Сыворотка крови КРС | 15,0÷25,0 |
| ДМСО | 5,0÷15,0 |
Предлагаемое изобретение расширяет арсенал высокоиммуногенных, безвредных и ареактивных вирусвакцин против БМ, способных защитить домашнюю птицу от высокопатогенных штаммов возбудителя БМ, циркулирующих на территории Российской Федерации.
Достижение технического результата от использования предлагаемого изобретения объясняется тем, что оно содержит антигенный материал из штамма «Владимир» ВГИ, обладающего высокой антигенной и иммуногенной активностью.
Штамм «Владимир» ВГИ характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм «Владимир» относится к семейству Herpesviridae, подсемейству Gammaherpesvirinae, роду Herpesvirus, серотипу 3 и является клеточно-ассоциированным вирусом. На основании сравнительного электронно-микроскопического изучения производственного штамма «ВНИИЗЖ» ВГИ и штамма «Владимир» ВГИ при репродукции их в культурах клеток установлена идентичность морфологических характеристик обоих штаммов. Эти вирусы проходили онтогенетический цикл развития в нуклеоплазме, а в цитоплазме - завершающие стадии морфогенеза. Внутриядерный цикл развития включает стадии виропласта, нуклеоида, сборку нуклеокапсида, формирование наружной суперкапсидной мембраны. Наиболее частой формой, присутствующей на всех стадиях культивирования, является нуклеокапсид с нуклеоидом, представленным плотным образованием, заключенным в капсидную белковую оболочку. При электронно-микроскопическом исследовании штамм «Владимир» ВГИ представлен типичными для ВБМ вирионами, имеющими кубический тип симметрии и форму икосаэдра. Вирус обладает полиморфизмом, может быть с оболочкой и без нее. В ядре пораженной клетки вирион имеет величину 90÷100 нм, в цитоплазме его размер увеличивается за счет белковой оболочки до 180÷200 нм. Оболочка состоит из 162 капсидов, расположенных в кубической симметрии.
Антигенные свойства
По своим антигенным свойствам штамм «Владимир» ВГИ относится к 3-му серотипу. При введении в организм домашней птицы вызывает латентно протекающую вирусемию. Антитела к данному вирусу обнаруживают в крови цыплят к 14÷21-дневному сроку жизни с дальнейшим наращиванием к 40÷60 дню. При вакцинации вирус индуцирует образование специфических антител, выявляемых в реакции диффузионной преципитации (РДП) и иммуноферментном анализе (ИФА). Активность в реакции связывания комплемента (РСК) не установлена. Концентрированный антиген из штамма «Владимир» ВГИ реагирует в РДП со специфическими сыворотками к ВГИ и ВБМ. Выявляются общие антигены с ВБМ в прямой и непрямой реакции иммунофлюоресценции (РИФ). При разрушении клетки вступает в реакцию с антителами к ВГИ и ВБМ в реакции нейтрализации (РН). В ИФА вступает в реакцию с антителами к ВГИ и ВБМ. В реакции задержки гемагглютинации (РЗГА) и реакции гемагглютинации (РГА) эритроциты не агглютинирует.
Биотехнологические характеристики
Штамм «Владимир» ВГИ активно размножается в культуре клеток ФЭК. Культивирование фибробластов проводят по общепринятым методикам с использованием смеси сред на основе гидролизата лактальбумина (ГЛА), Игла и 199, взятых в равных частях, с добавлением 10% эмбриональной сыворотки крови КРС. Клетки фибробластов выращивают во флаконах емкостью 50 см3 и 100 см3 (Повицкого), в матрасах емкостью 1,5 дм3 и в роллерных 3-литровых сосудах. Посевная концентрация клеток составляет 0,6÷0,7 млн/см3 для 50 см3 флаконов и 1,2÷1,5 млн/см3 для 3-литровых роллерных сосудов. При размножении в монослое куриных фибробластов вирус проявляет ярко выраженные цитопатические изменения в виде однородных фокусов размером 0,1÷0,2 мм. При проведении последовательных пассажей в культуре клеток ФЭК инфекционный титр вируса увеличивался и достигал 3,5·106 ФОЕ/см3. Штамм не патогенен для эмбрионов кур. У эмбрионов, инфицированных штаммом «Владимир» ВГИ, при вскрытии отмечали слабовыраженный гепатит, на ХАО - бляшки серовато-белого цвета звездчатой формы размером 0,5÷0,1 мм в количестве 30÷50 штук. Штамм «Владимир» ВГИ предназначен для изготовления вирусвакцины против БМ.
Генотаксономическая характеристика
Штамм «Владимир» ВГИ является ДНК-содержащим вирусом с молекулярной массой 108÷120·106 Д. Нуклеиновая кислота представлена двуцепочечной линейной молекулой. Содержание G+С - 46%. Вирион состоит из нуклеоида, икосаэдрического капсида, асимметрично расположенного вокруг капсида электронно-плотного материала, обозначенного как тегумент, и липопротеидной оболочки. Вирионная ДНК участвует в образовании белков-предшественников вируса. Основными антигенными белками являются гликопротеины A(gA) и В (gB). Гликопротеин В играет важную роль в индукции защитного иммунитета и является высококонсервативным среди герпесвирусов. Он представляет собой комплекс трех гликопротеинов: gp 49, gp 60 и gp 100.
С помощью полимеразной цепной реакции (ПЦР) с использованием праймеров, комплементарных консервативному гену gB, кодирующему гликопротеин В, был проведен анализ нуклеотидной последовательности штамма «Владимир» ВГИ.
Контролями служили: эпителий перьевых фолликулов, собранный от цыплят, зараженных вирусом БМ штамма «HPRS-16», относящегося к серотипу 1; вирус БМ штамма SB 1, относящийся к серотипу 2, и образцы вирусвакцины против БМ на основе штамма «ВНИИЗЖ» ВГИ, относящегося к серотипу 3. Для детекции были рассчитаны универсальные для всех типов вируса праймеры М, которые фланкируют фрагмент гена gB размером 450 нуклеотидов. Для типирования использовали внутренние типоспецифические праймеры М, MS и MF, которые комплементарны геномам ВБМ 1-го, 2-го и 3-го серотипа соответственно. Результаты ПЦР показали наличие специфических ампликонов с праймерами М (421 н.), что подтверждало принадлежность генома штамма «Владимир» ВГИ к 3-му серотипу ВБМ. При этом праймер MS (386 н.) взаимодействовал с геномом ВБМ 2-го серотипа, а с праймером MF (380 н.) геном ВГИ 3-го серотипа, что свидетельствовало о методически правильно проведенном опыте и показало высокую специфичность и чувствительность ПЦР применительно к моделям вирусов БМ и ГИ.
Устойчивость к внешним факторам
Устойчивость штамма «Владимир» ВГИ к физическим и химическим факторам характеризуется следующими данными.
Центрифугирование при 50000 g осаждает вирус в течение 1 часа. В пределах рН 4÷10 вирус чувствителен к эфиру. Вирус выдерживает неоднократное замораживание - оттаивание и воздействие ультразвуком в течение 10 минут. Полная термоинактивация вируса происходит при 4°С через 2 недели хранения, при (+20)-(+25)°С через 4 дня, при 37°С через 18 часов и при 60°С за 10 мин.
Хранение и консервирование
Вирус сохраняется в Клеточно-ассоциированном виде в защитной среде с 20% сыворотки крови КРС и 10% ДМСО в герметически запаянных ампулах в жидком азоте при - 196°С в течение 24 месяцев.
Патогенные свойства
Не вызывает заболевания у эмбрионов и цыплят, контагиозность не установлена. Лабораторные и домашние животные к вирусу не чувствительны.
Иммуногенность штамма
Штамм «Владимир» ВГИ предохраняет от развития опухолей в дозе 1000 ФОЕ у более 93% цыплят в производственных условиях. Иммуногенность не меняется в течение 5 последовательных пассажей.
Дополнительные признаки и свойства
Штамм «Владимир» ВГИ свободен от контаминации бактериальной и грибковой флорой, чужеродными вирусами и микоплазмами, безвреден в 10-кратной дозе для суточных цыплят.
Сущность предлагаемого изобретения пояснена примерами его исполнения и использования, которые не ограничивают объем изобретения.
Пример 1
Производственный штамм «Владимир» ВГИ получен путем последовательного пассирования в культуре клеток ФЭК. Для этого в асептических условиях из тушек индеек извлекали почки в чашки Петри, освобождали из капсульной ткани и переносили в плоскодонную колбу. Почечную ткань подвергали измельчению ножницами, промывали раствором Хенкса с антибиотиками (пенициллин со стрептомицином по 100 ЕД/см3). Затем в колбу вносили 0,25% раствор трипсина, опускали в нее стерильный магнит и суспензию подвергали диспергированию на магнитной мешалке в течение 3-7 мин. После окончания диспергирования в суспензию вносили 2% эмбриональной сыворотки от объема суспензии. Затем полученную из почечной ткани суспензию вносили на сформированный монослой культуры клеток ФЭК. Инфицированную культуру клеток ФЭК переносили в термостат (37,5±1)°C на 2 часа с целью контакта с инокулятом. В дальнейшем по истечении срока контакта инокулят удаляли, монослой промывали раствором Хенкса и вносили питательную поддерживающую среду, состоящую из равных частей 0,5% гидролизата лактальбумина (ГЛА), сред Игла и 199 с 10% эмбриональной сыворотки. Культуру ежедневно просматривали под микроскопом. Через 3 суток провели «слепой» пассаж, т.е. клетками, снятыми с одного флакона без признаков дегенерации монослоя, инокулировали 2 флакона с культурой. Аналогичным способом провели еще один «слепой пассаж». Через 48 часов в этих флаконах отмечали первые очаги цитопатического действия (ЦПД) вируса, которые характеризовались появлением единичных поликариоцитов по всему монослою. Спустя 24 часа после этого провели третий пассаж. В этом случае заражение проводили из расчета 1:5. На третьем пассажном уровне по всему монослою обнаружили ЦПД вируса в виде бляшек, характерных для ВГИ. При достижении ЦПД вируса 60÷70% площадки монослоя клетки снимали со стекла с помощью диспергирующего раствора по общепринятой методике. Часть клеточной суспензии использовали для проведения следующего пассажа. Другую часть подвергали хранению в жидком азоте по модифицированной в ФГУ «ВНИИЗЖ» методике.
В результате проведенных работ из почек здоровых индеек был выделен штамм ВГИ, которому было присвоено авторское наименование штамм «Владимир» ВГИ.
Полученный штамм был подвергнут всестороннему контролю в соответствии с Руководством МЭБ по стандартным диагностическим методам и вакцинам (1996) и на уровне 3-го пассажа заложен на хранение в жидкий азот в качестве посевного вируса.
Производственный штамм «Владимир» ВГИ был испытан по следующим параметрам: определение видовой и штаммовой принадлежности; контроль на отсутствие контаминации бактериальной и грибной флорой; контроль на отсутствие контаминации микоплазмами; контроль на отсутствие контаминации чужеродными вирусами; контроль инфекционной активности штамма; контроль безвредности штамма.
Определение видовой и штаммовой принадлежности проводили двумя методами:
- оценка поражений хориоаллантоисной оболочки (ХАО), зараженных в желточный мешок эмбрионов SPF-кур.
При оценке поражений через 13 суток на ХАО обнаружили бляшки серовато-белого цвета звездчатой формы в количестве 15÷25 на оболочке, что является характерным для ВГИ.
При изучении нуклеотидной последовательности генома штамма «Владимир» методом секвенирования по Сенгеру показало, что по аминокислотной последовательности вирус соответствует данным ВГИ, представленным в международном генетическом банке.
Контроль на отсутствие контаминации бактериальной и грибной флорой проводили по ГОСТу 28085-89.
Рост бактерий и грибной флоры на всех питательных средах отсутствовал.
Контроль на отсутствие контаминации микоплазмами проводили последовательным пассажем на среду Эдварда и тест-системой «МК-КОМ» в ПЦР. Наличие микоплазм в посевном вирусе не обнаружено.
Контроль на отсутствие контаминации чужеродными вирусами проводили методом биопробы на эмбрионах SPF-кур разного возраста и тремя методами заражения.
Зараженные эмбрионы инкубировали при 36,5°С: в желточный мешок в течение 13 суток, в аллантоисную полость 6 суток и на ХАО 9 суток. По окончании сроков инкубирования проводили вскрытие эмбрионов с последующим учетом возможных патизменений. Дополнительно проводили электронно-микроскопический контроль методом фазового контрастирования.
Наличие чужеродных вирусов-контаминантов в посевном вирусе не обнаружено.
Контроль инфекционной активности штамма определяли путем титрования вируса в культуре клеток ФЭК.
Титр посевного вируса составил 2,0×106 ФОЕ/см3.
Контроль безвредности штамма «Владимир» ВГИ определяли путем введения суточным SPF-цыплятам десятикратной дозы вируса. Наблюдение за цыплятами вели в течение 15 суток, учитывая их сохранность и физиологическое состояние.
В течение всего периода наблюдения цыплята оставались клинически здоровыми и при вскрытии на месте введения воспалительных изменений не обнаружено.
В результате проведенных работ посевной вирус герпеса штамма «Владимир» оказался стерильным, контаминация микоплазмами и чужеродными вирусами отсутствовала.
Вируссодержащий материал из штамма «Владимир» безвреден для суточных SPF-цыплят, специфичен, инфекционная активность штамма составила 2,0·106 ФОЕ/см3.
Пример 2
Жидкую культуральную вирусвакцину против БМ готовят на основе клеточно-ассоциированного ВГИ апатогенного штамма «Владимир». Посевной ВГИ и производственные серии вирусвакцины готовят в культуре клеток ФЭК и хранят в жидком азоте. Для получения первичной культуры клеток используют эмбрионы SPF-кур 11÷12-суточного возраста. Трипсинизацию эмбрионов проводят по общепринятым методикам. Полученную концентрированную суспензию клеток разводят до посевной концентрации 0,2÷0,5 млн/ см3 питательной средой, содержащей 20% ГЛА, 30% среды 199, 30% среды Игла и 10% сыворотки крови КРС (ростовая среда). рН готовой ростовой среды 7,0÷7,2. Готовую суспензию разливают в бутыли емкостью 3 дм3 по 400÷450 см3. Культуру клеток инкубируют при (38,0±0,5)°С в течение 24÷36 часов до получения сплошного монослоя на роллерных аппаратах со скоростью вращения 9÷10 об/ч. Культуру клеток для титрования вируса выращивают в 50 см3 флаконах (посевная концентрация 0,5÷0,6 млн/см3). Через 24÷36 часов в сосудах с культурой клеток проводят смену ростовой среды на поддерживающую. Поддерживающая среда содержит равное количество ГЛА, сред Игла и 199 с добавлением 2% сыворотки крови КРС. Для приготовления производственного объема посевной ВГИ из штамма «Владимир» вносят в сосуды с полученной культурой клеток, залитые поддерживающей средой. Количество ампул с посевным вирусом, используемых для заражения культуры клеток, определяют, исходя из титра маточного штамма «Владимир» ВГИ. Содержимое ампул объединяют (если позволяет титр вируса, то лучше заражать 1÷2 бутыли с культурой клеток из одной ампулы) и разводят (или используют без разведения) питательный средой из расчета, чтобы в каждом см3 содержалось 10000 ФОЕ. Для первого пассажа необходимо заражать не менее 4 бутылей. К моменту сбора вируса типичные фокусные поражения в культуре клеток должны быть отчетливо видны под микроскопом на 30-50% площади монослоя. Монослой с вирусом снимают трипсином и проводят второй пассаж. Для этого инфицированными клетками, собранными с одной бутыли, заражают свежий монослой из расчета 1:5-1:10, т.е. 5÷10 бутылей, и культивируют монослой до съема вируса в течение 48 часов. Вирус второго пассажа поражает гораздо большую часть клеток: в культуре клеток на 50÷70% монослоя образуются симпласты и поликариоциты (крупные многоядерные клетки), которые легко можно увидеть под микроскопом. Монослой с вирусом второго пассажа снимают трипсином. После удаления трипсина в бутыли вносят поддерживающую среду с 10% сыворотки крови КРС и 10% ДМСО. Собранные суспензии инфицированных клеток объединяют в общем объеме, фасуют по 1÷2 см3 в ампулы, которые подвергают замораживанию и хранят в жидком азоте. Объем производственной расплодки должен быть не менее 800÷1000 см3 с концентрацией клеток до замораживания 5÷10 млн/см3.
Контроль полученного антигенного материала на безвредность проводят на 20 цыплятах однодневного возраста.
Цыплятам вводят 10-кратную иммунизирующую дозу. За контрольными цыплятами наблюдают 15 дней.
Инфекционную активность производственной расплодки определяют титрованием на 1÷2-суточной культуре клеток ФЭК, выращенной во флаконах емкостью 50 см3. Инфекционная активность производственной расплодки вируса должна быть не ниже 1,0·105 ФОЕ/см3.
Для контроля стерильности используют 3÷4 ампулы. Высевы делают на мясопептонный бульон (МПБ), мясопептонный агар (МПА), тиогликолевую среду и среду Сабуро по 5 пробирок каждой среды.
Маточную (посевную) производственную серию вируса контролируют для исключения контаминации возбудителями БМ, инфекционного энцефаломиелита, болезни Ньюкасла, гриппа птиц, инфекционного ларинготрахеита, инфекционного бронхита, оспы птиц.
Контроль проводят методом биопробы на развивающихся эмбрионах кур (РЭК) 4÷6-, 8÷9- и 11÷12-дневного возраста.
В случае выделения вируса-контаминанта его идентифицируют с использованием специфических сывороток методом постановки РГА, РЗГА, РДП или РН по общепринятым методикам.
Для изготовления производственной серии вирусвакцины против БМ из штамма «Владимир» ВГИ используют вирус со 2 по 5 последовательные пассажи (от матриксных производственных расплодок) в культуре клеток ФЭК. Клеточно-ассоциированным вирусом заражают культуру клеток и через 72÷120 часов инкубации при наличии типичных для вирусов изменений на монослое (60÷80% ЦПД) в термальной комнате при (30÷40)°С производят сбор инфекцированных клеток. Для этого инфицированные монослойные культуры клеток обрабатывают 0,125÷0,25% раствором трипсина. После удаления трипсина в бутыли вносят поддерживающую среду с 20% сыворотки крови КРС и 10% ДМСО. Объем среды для сбора и суспендирования клеток составляет 0,02÷0,04 см3/см2 площади бутыли. Собранные суспензии инфицированных клеток (антигенный материал) объединяют в общем объеме. Концентрация клеток в суспензии должна быть 8-10 млн/см3. Полученный антигенный материал разливают по 1 см3 в ампулы емкостью 3÷5 см3, которые запаивают, замораживают и хранят в жидком азоте. Объем производственной серии вирусвакцины должен быть не менее 500÷600 см3.
Предлагаемая вирусвакцина против БМ имеет оптимальный компонентный состав, мас.%:
| Суспензия клеток ФЭК, инфицированных | |
| клеточно-ассоциированным ВГИ штамма «Владимир», | |
| с инфекционной активностью не ниже 5,5·105 ФОЕ/см3 | 60,0÷80,0 |
| Сыворотка крови КРС | 15,0÷25,0 |
| ДМСО | 5,0÷15,0 |
Технологический контроль производства вирусвакцины против БМ включает контроль на отсутствие контаминации бактериальной и грибной флоры культуральных питательных сред и растворов, используемых на каждой стадии технологического процесса, полуфабриката вирусвакцины, а также контроль полуфабриката на инфекционную активность.
Контроль готовой вирусвакцины против БМ включает:
- определение внешнего вида препарата;
- определение контаминации бактериальной и грибной флорой;
- определение контаминации микоплазмами;
- определение контаминации чужеродными вирусами;
- определение безвредности и инфекционной активности.
Титр вируса в вирусвакцине должен быть не ниже 5,5·105 ФОЕ/см3, за одну прививную дозу принимают 1000 ФОЕ. При разведении вакцины разбавителем прививная доза должна содержаться в 0,2 см3. Ампула с готовой вирусвакциной содержит 400 или 800 доз препарата. Срок годности вирусвакцины при условии ее хранения в жидком азоте составляет 24 месяца со дня изготовления. Вирусвакцина жидкая культуральная из штамма «Владимир» ВГИ применяется с профилактической целью. Вакцинации подлежит клинически здоровая птица однодневного возраста (в первые часы жизни) однократно. Иммунитет формируется через 14÷21 сутки после вакцинации. Вирусвакцину в дозе 1000 ФОЕ/0,2 см3 вводят цыплятам внутримышечно в верхнюю часть внутренней стороны бедра или подкожно в область верхней трети шеи в объеме 0,2 см3.
Пример 3
Проведены испытания иммуногенной активности вирусвакцины против БМ, изготовленной так, как описано в примере 2, и содержащей, мас.%:
| Суспензия клеток ФЭК, инфицированных | |
| клеточно-ассоциированным ВГИ штамма «Владимир», | |
| с инфекционной активностью 6,0·105 ФОЕ/см3 | 70,0 |
| Сыворотка крови КРС | 20,0 |
| ДМСО | 10,0 |
Иммуногенную активность вирусвакцины из штамма «Владимир» ВГИ определяли методом введения одной иммунизирующей дозы препарата в количестве 1000 ФОЕ коммерческим цыплятам внутримышечно в объеме 0,2 см3. Цыплята были доставлены из птицефабрики «Верхневолжская» Тверской области.
Контролем опыта при проверке препарата служили:
- положительный контроль - группа цыплят, иммунизированных вакциной «МАРЕК-БИО», изготовленной ООО «АвиНова»;
- отрицательный контроль - группа цыплят, зараженных вирулетным ВБМ, штамм «047»;
- контроль чистоты опыта - группа изолированных интактных цыплят.
Подопытных цыплят содержали в изолированных боксах в течение 90-120 дней с ежедневным учетом их состояния. Был обеспечен их обогрев в соответствии с технологическими требованиями, предусмотрен запас полноценных кормов с учетом породы и возраста.
Перед началом опыта образцы биопрепаратов были комиссионно обезличены и зашифрованы. Краской различных цветов была проведена групповая метка цыплят.
Исследуемые препараты вводили внутримышечно в область верхней трети внутренней поверхности бедра в дозах, указанных в паспортах.
Через 21 день после прививки цыплята всех групп, за исключением группы контроля условий содержания, были внутримышечно заражены вирулентным штаммом «047» ВБМ в дозе 1000 ФОЕ/0,2 см3.
Сохранность подопытной птицы регистрировали ежедневно. Трупы павших цыплят подвергали заморозке при минус 20°С и хранили до момента комиссионного вскрытия.
Убой всей птицы с последующим вскрытием и патолого-анатомическим исследованием был проведен в 108-суточном возрасте. Одновременно было проведено патолого-анатомическое вскрытие цыплят, павших за весь период опыта.
При вскрытии регистрировали наличие характерных для БМ изменений во внутренних органах. В случае гибели цыплят без признаков БМ у них отбирали пробы патматериала для подтверждения специфичности падежа по результатам гистологического исследования.
Эффективность иммунизации рассчитывали по формуле:
,
где Э - эффективность иммунизации;
В - % птицы с признаками болезни Марека в вакцинированной группе;
К - % больной птицы с признаками болезни Марека в контрольной группе.
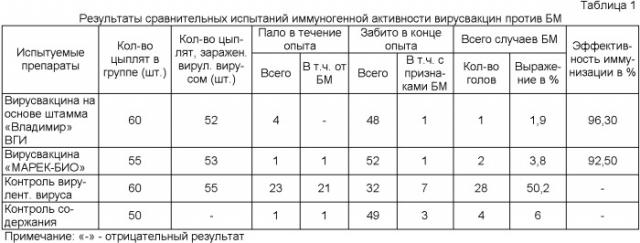
Полученные результаты представлены в таблице 1.
Данные таблицы 1 свидетельствуют о том, что эффективность иммунизации цыплят вирусвакциной против БМ из штамма «Владимир» ВГИ составила 96,3%, что на 3,8% превышает показатели положительного контроля. При этом заболело и пало с признаками БМ 50,2% цыплят в контрольной невакцинированной группе.
Пример 4
Проведены испытания иммуногенной активности вирусвакцины против БМ, изготовленной так, как описано в примере 2, и содержащей, мас.%:
| Суспензия клеток ФЭК, инфицированных | |
| клеточно-ассоциированным ВГИ штамма «Владимир», | |
| с инфекционной активностью 5,5·105 ФОЕ/см3 | 75,0 |
| Сыворотка крови КРС | 15,0 |
| ДМСО | 10,0 |
Иммуногенную активность вирусвакцины против БМ из штамма «Владимир» ВГИ определяли в сравнительных опытах, проведенных на базе ФГУ «ВНИИЗЖ» с использованием коммерческих цыплят-бройлеров, полученных из птицефабрики «Владимирский бройлер». Было сформировано 5 подопытных групп по 50 голов в каждой, которым в суточном возрасте вводили:
- вирусвакцину против БМ из штамма «ВНИИЗЖ/№110» ВГИ в дозе 1000 ФОЕ/0,2 см3 (группа №1);
- опытный образец вирусвакцины против БМ из штамма «Владимир» ВГИ в дозе 1000 ФОЕ/0,2 см3 (группа №2);
- опытный образец сухой вирусвакцины против БМ из штамма «Владимир» ВГИ в дозе 2000 ФОЕ/0,2 см3 (группа №3).
Цыплята группы №4 не были вакцинированы и служили контролем вирулентного вируса. В группе №5 цыплят не вакцинировали и не заражали. Эта группа служила контролем содержания цыплят и находилась в изолированном помещении. Через 14 дней цыплят первых четырех групп заразили вирулентным вирусом БМ из штамма Gm. В течение 210 суток за птицей вели ежедневное наблюдение. Иммуногенную активность учитывали по результатам клинического, патолого-анатомического и гистологического проявления БМ. В случае гибели цыплят без типичных признаков БМ от них отбирали кусочки паренхиматозных органов, сердца и седалищного нерва, фиксировали в 9%-ном растворе формалина и проводили гистологическое исследование полученных патпрепаратов для подтверждения диагноза.
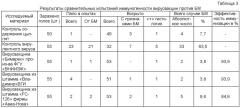
Эффективность иммунизации испытуемыми препаратами определяли так, как описано в примере 3. Результаты проведенных исследований представлены в таблице 2.
Согласно данным таблицы 2 в группе №4 погибло от БМ 34 головы, что составляет 65,4% цыплят, при этом 60% из них имели четко выраженную патологию БМ (истощение, опухоли в печени, селезенке, железистом желудке). Специфическая гибель цыплят из этой группы была подтверждена гистологическими исследованиями патологического материала, что позволило оценить иммуногенную активность испытуемых препаратов с высокой степенью достоверности.
В группе №2 цыплят, привитых вирусвакциной против БМ из штамма «Владимир» ВГИ, эффективность иммунизации оказалась самой высокой и составила 94,11%. В отличие от нее иммуногенная активность вирусвакцины против БМ из штамма «ВНИИЗЖ/№110» ВГИ была самой низкой и составила 79,41%. Это свидетельствует о том, что вирусвакцина против БМ из штамма «Владимир» ВГИ обладает более высокой иммуногенной активностью по сравнению с вирусвакциной-прототипом из штамма «ВНИИЗЖ/№110». В группе №5, которая служила в качестве контроля условий содержания цыплят, проявления признаков БМ не наблюдалось.
Пример 5
Проведены испытания иммуногенной активности предлагаемой вирусвакцины против БМ, изготовленной так, как описано в примере 2, и содержащей, мас.%:
| Суспензия клеток ФЭК, инфицированных | |
| клеточно-ассоциированным ВГИ штамма «Владимир», | |
| с инфекционной активностью 6,0·105 ФОЕ/см3 | 70,0 |
| Сыворотка крови КРС | 20,0 |
| ДМСО | 10,0 |
Иммуногенную активность вирусвакцины против БМ из штамма «Владимир» ВГИ определяли в сравнительных опытах на Верхневолоцкой базе ВИЭВ с использованием коммерческих цыплят-бройлеров, полученных из птицефабрики «Верхневолжская» Тверской области. Было сформировано 5 подопытных групп по 50-55 голов в каждой, три из которых были контрольными, а две - опытные.
Первую опытную группу цыплят-бройлеров иммунизировали вирусвакциной «Бимарек» в дозе 2000 ФОЕ/см3. Вторую опытную группу цыплят-бройлеров иммунизировали вирусвакциной против БМ из штамма «Владимир» ВГИ в дозе 1000 ФОЕ/0,2 см3.
Контролем опыта при проверке моновалентной вакцины против БМ из штамма «Владимир» ВГИ служили:
- группа цыплят-бройлеров, иммунизированных вирусвакциной «МАРЕК-БИО», изготовленной ООО «АвиНова» (положительный контроль);
- группа цыплят, зараженных вирулентным ВБМ, штамма «047» (отрицательный контроль);
- группа изолированных интактных цыплят (контроль чистоты опыта).
Подопытных цыплят содержали в изолированных боксах в течение 90-120 дней с ежедневным учетом их состояния. Был обеспечен обогрев в соответствии с технологическими требованиями, предусмотрен запас полноценных кормов с учетом породы и возраста.
Перед началом опыта образцы биопрепаратов были комиссионно обезличены и зашифрованы. Краской различных цветов была проведена групповая метка цыплят.
Испытуемые препараты вводили внутримышечно в область верхней трети внутренней поверхности бедра в дозах, указанных выше.
Через 21 день после прививки цыплята всех групп, за исключением группы контроля у