Способ удаления патологического прионного белка из продуктов крови
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предложен способ удаления патологического прионного белка из продукта крови. Осуществляют фильтрацию продукта крови через фильтр, заполненный носителем, покрытым полимером. Данный полимер образован тремя элементами: элементом, происходящим из гидрофобного полимеризуемого мономера, элементом, происходящим из полимеризуемого мономера, содержащего основную азотсодержащую часть, и элементом, происходящим из полимеризуемого мономера, содержащего протонную нейтральную гидрофильную часть в качестве баланса. После фильтрации проводят сбор продукта крови. Способ обеспечивает эффективное удаление патологического прионного белка из продукта крови с одновременным удалением лейкоцитов. Эффективность удаления патологического прионного белка составляет от 1,2 до 4,1 и более. 11 з.п. ф-лы, 1 ил., 1 табл.
Реферат
Область техники
Настоящее изобретение относится к способу удаления патологического прионного белка из продукта крови. В частности, настоящее изобретение относится к способу селективного удаления патологического прионного белка, который может присутствовать в продукте крови, таком как цельная кровь, концентрированный раствор эритроцитов или тромбоцитов.
Уровень техники
Трансмиссивная губчатая энцефалопатия (TSE) или прионная болезнь вызывает смертельные нейродегенеративные заболевания у людей и других млекопитающих. Наиболее известны скрейпи овец и губчатая энцефалопатия крупного рогатого скота (BSE). Болезни человека включают спорадическую болезнь Крейцфельда-Якоба (sCJD), ятрогенную болезнь Крейцфельда-Якоба, синдром Герстманна-Штройслера-Шейнкера (GSS), фатальную семейную бессонницу (FFI) и куру. Прионная болезнь может возникать в результате изменения конформации природного нормального прионного белка в вариантный патологический прионный белок (вариантный прионный белок может вызывать прионную болезнь), инфицирующий людей и других млекопитающих. Вариантный прионный белок обладает структурой, обогащенной β-слоями по сравнению с нормальным прионным белком, поэтому вариантный прионный белок обладает высокой гидрофобностью, легко образует мультимеры и устойчив к протеазе К.
В последнее время в нескольких работах было показано, что <вариантная> CJD, встречающаяся, как правило, в Великобритании, связана с потреблением говядины коров, зараженных BSE (непатентные документы 1 и 2). В этих работах было сделано предположение, что <вариантная> CJD может переноситься при употреблении в пищу говядины и передаваться от человека к человеку при переливания <продукта крови> или переноса вариантного прионного белка, присутствующего в тканевом трансплантате. В связи с этим в 2004 г. были описаны два случая инфицирования <вариантной> CJD реципиентов, получавшим донорную кровь, у которых развилась <вариантная> CJD после сдачи крови, и в 2006 г. был описан третий случай, так что существует высокая вероятность переноса <вариантной> CJD путем трансфузии. У многих людей, инфицированных CJD, болезнь не развивается, и продукты крови, полученные от таких людей, могут способствовать распространению инфекции. Таким образом, необходим способ удаления патологического прионного белка из продукта крови.
В области переливания крови распространено так называемое переливание крови, не содержащей лейкоцитов, когда переливают продукт крови после удаления лейкоцитов, содержащихся в крови. Эта процедура проводится, поскольку было выяснено, что побочные эффекты, такие как головная боль, тошнота, лихорадка и негемолитическая фебрильная реакция, сопровождающие переливание крови, тяжелые побочные эффекты, такие как аллоантигенная сенсибилизация, посттрансфузионное заболевание «трансплантат против хозяина» (GVHD) и вирусная инфекция, серьезно поражающие реципиента, как правило, обусловлены присутствием лейкоцитов в продукте крови, используемом при переливании. Способ фильтрации имеет ряд преимуществ, таких как высокая эффективность удаления лейкоцитов, простота в применении и низкая стоимость, поэтому он широко используется в качестве способа удаления лейкоцитов из <продукта крови>. При получении продукта крови кровь обычно фильтруют в центре крови и в последнее время эта процедура проводится перед хранением для достижения полного контроля качества продукта крови, не содержащего лейкоциты, способом фильтрации, то есть с использованием фильтра, удаляющего лейкоциты. Как правило, в случае, когда кровь фильтруют с помощью фильтра, удаляющего лейкоциты, в центре крови, пакет с кровью, содержащий продукт крови, подлежащий фильтрации, помещают на 70-150 см выше, чем пакет для сбора профильтрованного продукта крови, и продукт крови фильтруется под действием силы притяжения.
В качестве систем для получения продукта крови, не содержащего лейкоцитов, широко применяются два типа систем (типа SCD и встроенного типа). В случае применения системы типа SCD пакет, содержащий продукт крови, подлежащий удалению лейкоцитов, асептически соединяют с системой для удаления лейкоцитов. Таким образом, соединяются только фильтр для удаления лейкоцитов и пакет для сбора продукта крови после фильтрации. В случае встроенной системы процесс от забора крови у донора до получения продукта крови проводится в интегрированной системе, так что пакет с кровью обычно содержит раствор консерванта или антикоагулянт. Для стерилизации SCD-системы обычно применяется стерилизация облучением в связи с низкой стоимостью. Однако стерилизация облучением может привести к разложению раствора консерванта и антикоагулянта, поэтому для встроенной системы обычно применяется стерилизация автоклавированием.
Уровень гемолиза является одним из показателей качества продукта крови, содержащего эритроциты. Поставляемый высококачественный продукт крови, свободный от лейкоцитов, содержащий эритроциты, уровень гемолиза должен быть менее чем 0,8% (непатентный документ 3).
С точки зрения оперативности работы центра крови, стоимости и потерь продукта крови способ удаления патологического прионного белка из продукта крови предпочтительно представляет собой способ одновременного удаления патологического прионного белка и лейкоцитов.
В патентном документе 1 раскрыт полимер для покрытия материала фильтров для удаления лейкоцитов, содержащий элемент, происходящий из гидрофобного полимеризуемого мономера, элемент, происходящий из полимеризуемого мономера, содержащего основную азотсодержащую часть, и элемент, происходящий из полимеризуемого мономера, содержащего протонную нейтральную гидрофильную часть в качестве материала, высокоэффективно удаляющего лейкоциты, но не раскрывается и не предлагается удаления патологического прионного белка. Фильтрация крови, не содержащей лейкоцитов, перед хранением в многих случаях включает как фильтрацию при комнатной температуре, при которой кровь фильтруют при комнатной температуре в течение одного дня после забора крови, так и фильтрацию при низкой температуре, при которой кровь фильтруют после хранения крови в холодильнике в течение 1-3 дней. В случае фильтрации при комнатной температуре большее количество лейкоцитов просачивается через фильтр, чем в случае охлажденной крови, несмотря на короткое время фильтрации, в то время как в случае фильтрации при низкой температуре фильтрация проводится в течение более длительного времени, и возможно до некоторой степени предотвратить протечку лейкоцитов через фильтр. Однако в патентном документе 1 не изучалось время фильтрации при низкой температуре.
В патентном документе 2 раскрыт способ образования комплекса прионного белка в биологической жидкости с полимерным матриксом, содержащим гидрофильную, гидрофобную или амфифильную функциональную группу, или с прион-связывающим веществом, содержащим окись алюминия или окись кремния. Однако этот комплекс не способен к удалению лейкоцитов, несмотря на то, что в примерах функциональная группа связана со смолой, и таким образом при фактическом использовании в центре крови необходимо применять фильтр для удаления лейкоцитов. При раздельном удалении лейкоцитов и патологических прионных белков могут увеличиваться потери продукта крови, затраты труда в центре крови и стоимость. Кроме того, известно, что окиси алюминия и кремния индуцируют активацию системы свертывания, а также демонстрируют высокую неселективную адсорбцию белков, и таким образом эти вещества не подходят для продукта крови.
В патентном документе 3 раскрыт способ удаления прионных белков из произвольного образца жидкости с использованием устройства, такого как проточной колонки и сферических полимерных бусин, чья поверхность покрыта агентом, образующим комплекс с прионом, такого как соль металла (такого как натрий) фосфовольфрамовой кислоты. Однако образец должен подвергаться воздействию агента, образующего комплекс, в течение достаточного времени для образования комплекса агента, образующего комплекс, с практически всеми патологическими прионными белками, содержащимися в образце. Например, образец инкубируют при температуре приблизительно 30-45°С (предпочтительно, 37°С) в течение приблизительно 1-16 часов. Однако температура 37°С является неподходящей для хранения продукта крови, и в общепринятом способе, использующем фильтр для удаления лейкоцитов, как правило, используется фильтрация при комнатной температуре или при пониженной температуре. Кроме того, в этом способе применяется фильтрация на основе силы притяжения, так что такой способ не подходит для удаления патологических прионных белков или лейкоцитов из продукта крови.
В патентном документе 4 раскрыт способ образования комплекса прионного белка и полимерного матрикса, содержащего гидрофильную, гидрофобную или амфифильную группу для удаления или обнаружения приона или прион-связывающее вещество, такое как окись алюминия или окись кремния. Однако прион-связывающее вещество, используемое в примерах, не способно к удалению лейкоцитов, и в случае раздельного удаления лейкоцитов и патологических прионных белков существует проблема увеличения потерь продукта крови, затрат труда в центре крови и стоимости. Кроме того, известно, что окиси алюминия и кремния индуцируют активацию системы свертывания, а также демонстрируют высокую неселективную адсорбцию белков, и таким образом эти вещества не подходят для продукта крови.
Таким образом, для удаления патологического прионного белка из продукта крови необходим простой и эффективный способ удаления патологического прионного белка из продукта крови, и кроме того, желательно, чтобы такой способ обеспечивал одновременное удаление патологического прионного белка и лейкоцитов.
[Непатентный документ 1] G. Chazot, et al., (1996) Lancet 347: 1181
[Непатентный документ 2] R.G. Will, et al., (1996) Lancet 347: 921-25
[Непатентный документ 3] Guide to the preparation, use and quality assurance of blood components 9th edition/ Council of Europe Publishing
[Патентный документ 1] WO 03/011924
[Патентный документ 2] US 2005/0014196 A
[Патентный документ 3] JP 2002-539081 A
[Патентный документ 4] JP 2006-522344 A
Описание изобретения
Задачи, решаемые изобретением
Ввиду вышеописанных проблем общепринятых технологий целью настоящего изобретения является разработка простого и эффективного способа удаления патологического прионного белка из продукта крови и способа одновременного удаления патологического прионного белка и лейкоцитов.
Пути решения задач
Авторы настоящего изобретения провели широкие исследования, в результате которых было обнаружено, что патологический прионный белок возможно очень просто и эффективно удалить из продукта крови с помощью фильтра, покрытого терполимером, включающим гидрофобный полимеризуемый мономер, полимеризуемый мономер, содержащий основную азотсодержащую часть и полимеризуемый мономер, содержащий протонную нейтральную гидрофильную часть (неполимер, включающий любой один из этих мономеров), и таким образом выполнили настоящее изобретение. Таким образом, настоящее изобретение относится к:
(1) способу удаления патологического прионного белка из продукта крови, включающему: фильтрацию продукта крови через фильтр, заполненный носителем, покрытым полимером, образованным тремя элементами, включающими 20 молярных процентов или более и 40 молярных процентов или менее элемента, происходящего из гидрофобного полимеризуемого мономера, 5 молярных процентов или более и 13 молярных процентов или менее элемента, происходящего из полимеризуемого мономера, содержащего основную азотсодержащую часть и элемента, происходящего из полимеризуемого мономера, содержащего протонную нейтральную гидрофильную часть в качестве баланса; и сбора профильтрованного продукта крови;
(2) способ удаления патологического прионного белка из продукта крови по вышеприведенному пункту (1), отличающийся тем, что продукт крови представляет собой продукт цельной крови, а фильтр подвергается стерилизации облучением и затем стерилизации автоклавированием;
(3) способ удаления патологического прионного белка из продукта крови по вышеприведенному пункту (2), отличающийся тем, что облучение представляет собой γ-лучи или электронные лучи;
(4) способ удаления патологического прионного белка из продукта крови по любому из вышеперечисленных пунктов (1)-(3), отличающийся тем, что полимер представляет собой полимер винилового типа;
(5) способ удаления патологического прионного белка из продукта крови по любому из вышеперечисленных пунктов (1)-(4), отличающийся тем, что гидрофобный полимеризуемый мономер, полимеризуемый мономер, содержащий основную азотсодержащую часть и полимеризуемый мономер, содержащий протонную нейтральную гидрофильную часть, представляют собой производные акриловой кислоты и/или производные метакриловой кислоты;
(6) способ удаления патологического прионного белка из продукта крови по любому из вышеперечисленных пунктов (1)-(5), отличающийся тем, что основная азотсодержащая группа представляет собой третичную аминогруппу;
(7) способ удаления патологического прионного белка из продукта крови по любому из вышеперечисленных пунктов (1)-(6), отличающийся тем, что протонная нейтральная гидрофильная группа представляет собой гидроксильную группу;
(8) способ удаления патологического прионного белка из продукта крови по любому из вышеперечисленных пунктов (1)-(7), отличающийся тем, что фильтр представляет собой фильтр для удаления лейкоцитов;
(9) способ удаления патологического прионного белка из продукта крови по вышеприведенному пункту (8), отличающийся тем, что носитель, покрытый полимером, представляет собой волокнистый материал или материал с губчатой структурой;
(10) способ удаления патологического прионного белка из продукта крови по вышеприведенному пункту (8) или (9), отличающийся тем, что удельная площадь носителя, покрытого полимером, составляет 1,0 м2/г или более и 5,0 м2/г или менее;
(11) способ удаления патологического прионного белка из продукта крови по любому из вышеперечисленных пунктов (8)-(10), отличающийся тем, что средний диаметр поры носителя составляет 1 мкм или более и 60 мкм или менее;
(12) способ удаления патологического прионного белка из продукта крови по любому из вышеперечисленных пунктов (8)-(11), отличающийся тем, что плотность заполнения носителем, покрытым полимером, составляет 0,1 г/см3 или более и 0,5 г/см3 или менее;
(13) способ удаления патологического прионного белка из продукта крови по любому из вышеперечисленных пунктов (8)-(12), отличающийся тем, что пористость носителя, покрытого полимером, составляет 60% или более и 90% или менее;
(14) способ удаления патологического прионного белка из продукта крови по любому из вышеперечисленных пунктов (8)-(13), отличающийся тем, что носитель, покрытый полимером, представляет собой нетканый материал; и
(15) способ удаления патологического прионного белка из продукта крови по вышеприведенному пункту (14), отличающийся тем, что диаметр волокна нетканого материала составляет 0,3 мкм или более и 3,0 мкм или менее.
Эффект изобретения
Согласно настоящему изобретению, возможно просто и эффективно удалять патологический прионный белок из продукта крови и одновременно удалять патологический прионный белок и лейкоциты. Кроме того, способ по настоящему изобретению может использоваться при получении высококачественного продукта крови, обладающего высокой текучестью и содержащего меньше гемолизированных клеток.
Краткое описание чертежей
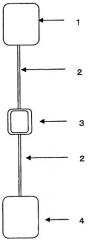
На чертеже представлено схематическое изображение системы, посредством которой осуществляется настоящее изобретение.
Описание позиций на чертеже:
1: пакет с продуктом крови,
2: шланг,
3: фильтр,
4: пакет для сбора продукта крови после фильтрации.
Наилучший вариант осуществления изобретения
Ниже настоящее изобретение описано более детально.
Термин «полимер» в настоящем изобретении означает полимер (полимеры), включающий элемент, происходящий из гидрофобного полимеризуемого мономера, элемент, происходящий из полимеризуемого мономера, содержащего основную азотсодержащую часть, и элемент, происходящий из полимеризуемого мономера, содержащего протонную нейтральную гидрофильную часть.
Термин «элемент» в настоящем изобретении означает минимальный повторяющийся элемент, происходящий из каждого полимеризуемого мономера в составе полимерной молекулы. Например, в случае полиприсоединения полимеризуемого мономера винилового соединения с формулой СH2=CXY (X: H или заместитель, отличный от Н, Y: заместитель, отличный от Х) путем раскрытия двойной связи минимальный повторяющийся элемент представляет собой -(CH2-CXY)-. В случае, когда полимер синтезируют путем поликонденсации из полимерного предшественника с формулой A-(R)-B (R: часть, не высвобождающаяся при полимеризации, А и В: части, высвобождающиеся во время реакции полимеризации), в качестве минимального повторяющегося элемента может приниматься -(R)-, когда А и В высвобождаются при полимеризации.
Примеры гидрофобного полимеризуемого мономера, в особенности с точки зрения доступности и простоты в использовании включают: стирен; метилстирен; акрилаты и метакрилаты, такие как метилакрилат, метилметакрилат, этилакрилат, этилметакрилат, бутилакрилат, бутилметакрилат, фенилакрилат, фенилметакрилат, этилгексилакрилат, этилгексилметакрилат, трихлорэтилакрилат и трихлорэтилметакрилат; алкены, такие как пентен, гексен, гептен и октен; органические соединения кремния, такие как силикон и силоксан; и фторорганические полимеризуемые мономеры, в которых хотя бы один атом водорода в составе этилена заменен на атом фтора. Однако гидрофобный полимеризуемый мономер не ограничивается веществами, приведенными выше. Из этих мономеров с точки зрения доступности и простоты в использовании предпочтительны мономеры, содержащие виниловую группу в качества полимеризуемой части, при полимеризации которых (виниловой полимеризации) образуется полимер винилового типа. Далее предпочтительные гидрофобные полимеризуемые мономеры представляют собой производные акриловой кислоты и производные метакриловой кислоты. Наиболее предпочтительные гидрофобные полимеризуемые мономеры представляют собой акрилаты и метакрилаты.
Материалы, содержащие основную азотсодержащую функциональную группу, имеют положительный заряд на поверхности в биологической жидкости, что дает эффект повышения эффективности удаления патологического прионного белка. Термин «полимеризуемый мономер, содержащий основную азотсодержащую часть», в настоящем изобретении означает полимеризуемый мономер, содержащий основную азотсодержащую часть, описанный ниже. В качестве основной азотсодержащей группы может выступать первичная аминогруппа, вторичная аминогруппа, третичная аминогруппа, четвертичная аминогруппа, пиридиловая группа, имидазоиловая группа и другие. Предпочтительная основная азотсодержащая аминогруппа представляет собой третичную аминогруппу. Полимеризуемые мономеры, содержащие основную азотсодержащую часть с точки зрения доступности и простоты в использовании, включают виниловые производные азотсодержащих ароматических соединений, таких как виниламин, 2-винилпиридин, 4-винилпиридин, 2-метил-5-винилпиридин, 4-винилимидазол, N-винил-2-этилимидазол, и N-винил-2-метилимидазол; акрилаты и метакрилаты, такие как диметиламиноэтилакрилат, диметиламиноэтилметакрилат, диэтиламиноэтилакрилат, диэтиламиноэтилметакрилат, 3- диметиламино-2-гидроксипропилакрилат и 3-диметиламино-2-гидроксипропилметакрилат; амидные производные акриловой кислоты и метакриловой кислоты, такие как амид N,N- диметиламиноэтилакриловой кислоты, амид N,N-диметиламиноэтилметакриловой кислоты, амид N,N- диэтиламиноэтилакриловой кислоты, амид N,N- диэтиламиноэтилметакриловой кислоты и амид N,N-диметиламинопропилакриловой кислоты; производные стирена, такие как п-диметиламинометилстирен и п-диэтиламиноэтилстирен; и производные, такие как четвертичные аммониевые соли, полученные путем реакции полимеризуемого мономера с алкилгалидной группой. Однако полимеризуемый мономер, содержащий основную азотсодержащую часть, не ограничивается этими веществами. Из этих мономеров с точки зрения доступности и простоты в использовании, предпочтительны мономеры, содержащие виниловую группу в качестве полимеризуемой части, образующие полимер винилового типа путем полимеризации (виниловой полимеризации). В качестве полимеризуемого мономера, содержащего основную азотсодержащую часть, предпочтительны производные акриловой кислоты и метакриловой кислоты. Более предпочтительны в качестве полимеризуемого мономера, содержащего основную азотсодержащую часть, акрилаты и метакрилаты. Из этих веществ особенно предпочтительны диметиламиноэтилакрилат, диметиламиноэтилметакрилат, диэтиламиноэтилакрилат и диэтиламиноэтилметакрилат.
Термин «полимеризуемый мономер, содержащий протонную нейтральную гидрофильную часть», в настоящем изобретении означает мономер, чья неполимеризуемая часть диссоциирует с высвобождением протонов (Н+), и мономер, не обладающий сильной кислотностью или основностью, как карбоксильная кислота или основная аминогруппа. Полимеризуемый мономер, содержащий протонную нейтральную гидрофильную часть, проявляет большие гидрофильные свойства по сравнению с мономером, содержащим непротонную нейтральную гидрофильную часть, и обладает прекрасными способностями к активации и предотвращению протока продукта крови. Примеры протонной нейтральной гидрофильной части включают гидроксильную группу, альдегидную группу, имеющую протон в α-положении и амидную группу, имеющую протон в α-положении и 1,3-дикарбониловую группу. В качестве неполимеризуемой протонной нейтральной гидрофильной части особенно предпочтительна гидроксильная группа. Примеры полимеризуемых мономеров, содержащих нейтральную гидрофильную часть, включают 2-гидроксиэтилметакрилат, гидроксипропилметакрилат, гидроксибутилакрилат, акриламид и метакриламид. Однако полимеризуемые мономеры, содержащие протонную нейтральную гидрофильную часть, не ограничиваются вышеперечисленными веществами. Из этих мономеров с точки зрения доступности и простоты в использовании, предпочтительны мономеры, содержащие виниловую группу в качестве полимеризуемой части, образующие полимер винилового типа путем полимеризации (виниловой полимеризации). Из этих мономеров в качестве полимеризуемых мономеров, содержащих протонную нейтральную гидрофильную часть, предпочтительны производные акриловой кислоты и производные метакриловой кислоты. В качестве полимеризуемых мономеров, содержащих протонную нейтральную гидрофильную часть, наиболее предпочтительны акрилаты и метакрилаты. Термин «полимер винилового типа» в настоящем изобретении означает полимер винилового типа в широком смысле, чья основная цепь не содержит циклов. Конкретные примеры включают α-замещенную полиакриловую кислоту и ее производные, поливиниловый эфир, поливиниловый спирт, поливиниловый сложный эфир, полистирен и его производные и также сополимеры, включающие эти полимеры, как описано в J. Brandrup; E.H. Immergut. 1989 “Polymer Hand book Third Edition” A Wiley-interscience publication, стр. VII-5 - VII-18.
Для удаления патологического прионного белка из продукта крови, содержащего компонент плазмы, необходимо использовать вышеупомянутый полимер, включающий три элемента, включающие элемент, происходящий из гидрофобного полимеризуемого мономера, элемент, происходящий из полимеризуемого мономера, содержащего основную азотсодержащую часть, и элемент, происходящий из полимеризуемого мономера, содержащего протонную нейтральную гидрофильную часть. Даже при использовании полимера, содержащего только один из этих элементов, невозможно удалить патологический прионный белок с высокой эффективностью, и в особенности невозможно эффективно удалить патологический прионный белок из продукта крови, содержащего компонент плазмы.
Патологический прионный белок содержит три различные связывающие области, связывающееся с положительно заряженными функциональными группами, отрицательно заряженными функциональными группами и гидрофобными функциональными группами. При этом было показано, что изоэлектрической точке патологического прионного белка соответствует значение pH, равное 4,6, а pH продукта крови находится в пределах приблизительно 5-7,5, так что патологический прионный белок в продукте крови заряжен отрицательно. Таким образом, мономер, содержащий основную азотсодержащую часть и гидрофобный полимеризуемый мономер, могут удалять патологический прионный белок из продукта крови с высокой эффективностью. Кроме того, известно, что контакт между материалом, несущим отрицательные заряды, и продуктом крови может индуцировать продукцию брадикинина, вызывающего анафилактическую реакцию, такую как падение кровяного давления, прилив крови к лицу, конъюнктивальная гиперемия, сокращение гладкой мускулатуры или боль, таким образом, полимер, несущий отрицательные заряды, не подходит для покрытия поверхности носителя при использовании для фильтрации продукта крови.
С другой стороны, фильтрация продукта крови с использованием фильтра необходима для получения продукта крови такого же качества, как продукт крови, полученный с помощью фильтрации через обычный фильтр для удаления лейкоцитов. Протонная нейтральная гидрофильная часть полимера необходима для обеспечения смачиваемости, необходимой для распространения продукта крови по всему фильтру, в особенности для проведения равномерной «активации» колонки, то есть процедуры заполнения фильтра продуктом крови на первой стадии фильтрации. Если композиции мономера, содержащего основную азотсодержащую часть и гидрофобного полимеризуемого мономера в полимере, превышают определенные уровни, это вызывает потерю качества, приводящую к гемолизу или увеличенному времени фильтрации. Таким образом, для производства продукта крови, из которого патологический прионный белок удаляется с высокой эффективностью, необходимо отрегулировать композицию гидрофобного полимеризуемого мономера, полимеризуемого мономера, содержащего основную азотсодержащую часть, и полимеризуемого мономера, содержащего протонную нейтральную гидрофильную часть, в должных пределах.
Термин «гидрофобный полимеризуемый мономер» в настоящем изобретении означает полимеризуемый мономер, обладающий очень низким сродством к воде и растворимостью в воде 12 г на 100 г воды или менее при 20°С и означает мономер, чья молекула не содержит ни основной азотсодержащей части, ни протонной нейтральной гидрофильной части. Если растворимость составляет более чем 12 г на 100 г воды, может не достигаться высокая эффективность удаления патогенного прионного белка, представленная в настоящем изобретении. Более предпочтительна растворимость в пределах 2 г на 100 г воды или менее. Растворимость может определяться известным способом, таким как способ определения точки росы, термальный анализ, электрический способ, включающий измерение электродвижущей силы или электрической проводимости раствора, газовая хроматография или индикаторный способ, в случае, когда полимеризуемый мономер представляет собой твердое вещество. В случае, когда полимеризуемый мономер представляет собой жидкость, растворимость может определяться теми же способами, что применимы к твердому полимеризуемому мономеру, а также способами, известными из уровня техники, такими как емкостный способ, способ рассеяния света или способ давления насыщенного пара. В качестве более простого способа, если точка кипения полимеризуемого мономера значительно выше точки кипения воды, может использоваться способ, где из насыщенного водного раствора полимеризуемого мономера выпаривают воду и измеряют массу сухого остатка.
Для достижения большей эффективности удаления патологического прионного белка и удаления лейкоцитов предпочтительно, чтобы полимер включал вышеперечисленные мономеры в следующих концентрациях (молярные доли): гидрофобный полимеризуемый мономер, 20 молярных процентов или более и 40 молярных процентов или менее; полимеризуемый мономер, содержащий основную азотсодержащую часть, 5 молярных процентов или более и 13 молярных процентов или менее; полимеризуемый мономер, содержащий протонную нейтральную гидрофильную часть, концентрация, получающаяся в результате вычитания суммы молярных долей гидрофобного полимеризуемого мономера в полимере и полимеризуемого мономера, содержащего основную азотсодержащую часть, из 100 молярных процентов. Если молярная доля гидрофобного полимеризуемого мономера в полимере меньше 20 молярных процентов или концентрация полимеризуемого мономера, содержащего основную азотсодержащую часть, меньше 5 молярных процентов, эффективность удаления патологического прионного белка может не повышаться, что нежелательно. Если концентрация гидрофобного полимеризуемого мономера в полимере превышает 40 молярных процентов, может уменьшаться смачиваемость для продукта крови, хранящегося в холодильнике, что нежелательно, поскольку это вызывает уменьшение скорости фильтрации продукта крови при фильтрации продукта крови с использованием фильтра, покрытого полимером по настоящему изобретению. Если концентрация полимеризуемого мономера, содержащего основную азотсодержащую часть, превышает 13 молярных процентов, в продукте крови, хранящемся в холодильнике, может происходить гемолиз, что нежелательно. Чтобы достичь еще большей эффективности удаления патологического прионного белка и удаления лейцкоцитов, предпочтительно, чтобы полимер включал вышеперечисленные мономеры в следующих концентрациях: гидрофобный полимеризуемый мономер, 25 молярных процентов или более и 35 молярных процентов или менее; полимеризуемый мономер, содержащий основную азотсодержащую часть, 7 молярных процентов или более и 12 молярных процентов или менее; полимеризуемый мономер, содержащий протонную нейтральную гидрофильную часть, в концентрации, получающейся в результате вычитания суммы молярных долей гидрофобного полимеризуемого мономера в полимере и полимеризуемого мономера, содержащего основную азотсодержащую часть, из 100 молярных процентов. Наиболее предпочтительно, чтобы полимер включал гидрофобный полимеризуемый мономер в концентрации 27 молярных процентов или более и 33 молярных процентов или менее; полимеризуемый мономер, содержащий основную азотсодержащую часть, в композиции сополимеризации 8 молярных процентов или более и 11 молярных процентов или менее; полимеризуемый мономер, содержащий протонную нейтральную гидрофильную часть, в качестве баланса.
Композиция мономеров в составе полимера может определяться в соответствии с общепринятой физико-химической техникой. Примеры физико-химической техники для определения состава сополимеризации включают известные способы, такие как ядерно-магнитная резонансная спектроскопия (ЯМР, -1Н, -13С) и способ пиролиза GC/MS. Также возможно определить, проходит ли полимеризация в соответствии с планом в отношении композиции заряженного мономера или имеют место вариации от партии к партии. Также возможно растворить и экстрагировать полимер, покрывающий носитель, используя растворитель для полимера, и возможно проанализировать состав мономеров в экстрагированном полимере с помощью вышеперечисленных способов. Также возможно применить способ растворения носителя и полимера, присутствующего на поверхности, дейтерированным растворителем и определения состава с помощью ядерно-магнитной резонансной спектроскопии (ЯМР, -1Н, -13С) в качестве способа определения композиции сополимеризации. Молекулярную массу полимера можно измерить с помощью известного способа гель-проникающей хроматографии. Средняя молекулярная масса предпочтительно находится в пределах 50000 или более и 3000000 или менее, более предпочтительно 100000 или более и 2000000 или менее, наиболее предпочтительно 150000 или более и 1500000 или менее. Если средняя молекулярная масса (Mw) меньше 50000, может иметь место нежелательная элюция полимера в продукт крови в процессе удаления патологического прионного белка и удаления лейкоцитов из продукта крови. Если молекулярная масса (Mw) больше 3000000, имеет место нежелательное уменьшение растворимости полимера в растворителе, используемом для покрытия. Кроме того, может оказаться невозможным стабильное производство полимера при полимеризации. Полимер может представлять собой случайный сополимер или блок-сополимер. Однако более предпочтителен случайный сополимер, поскольку блок-сополимер имеет тенденцию к уменьшению растворимости в растворителе при покрытии и может иметь тенденцию к ухудшению равномерности покрытия из-за образования мицелл в растворе. Полимер может представлять собой линейный полимер или разветвленный полимер. Однако более предпочтительна линейная полимерная цепь, поскольку разветвленная полимерная цепь может иметь тенденцию к уменьшению растворимости в растворителе при покрытии и может иметь тенденцию к ухудшению равномерности покрытия из-за образования мицелл в растворе. Для синтеза полимера может использоваться общепринятый способ полимеризации. Могут применяться аддитивная полимеризация (виниловая полимеризация), представляющая собой цепную реакцию; изомеризационная полимеризация; и реакция элиминации, полимеризация, поликонденсация, аддитивная поликонденсация и подобные способы, представляющие собой последовательные реакции. В качестве переносчиков цепи при получении полимера могут использоваться радикалы или ионы. Что касается типа полимеризации, в качестве примеров можно привести полимеризацию в растворе, полимеризацию в массе, осаждение с одновременной полимеризацией, эмульсионную полимеризацию. Из этих способов предпочтительна полимеризация в растворе.
Ниже приведен пример способа полимеризации.
В качестве растворителя для полимеризации используют этанол, и раствор этанола, в котором растворили мономеры и инициатор (диазо-соединение), добавляют по каплям для проведения реакции, при этом раствор помешивают при постоянной температуре, равной или меньшей, чем точка кипения этанола, в атмосфере азота. При необходимости может быть добавлен стабилизатор или другие вещества. Выход реакции измеряют и подтверждают путем использования общепринятого способа, такого как газовая хроматография. Возможна очистка реакционной смеси с помощью общепринятого способа химической очистки для удаления примесей, таких как низкомолекулярные компоненты и непрореагировавшие вещества, содержащиеся в полимере или в реакционном растворе, содержащем полимер, которые могут элюировать во время обработки продукта. В качестве способа очистки можно привести способ, при котором реакционную смесь заливают в растворитель, растворяющий примеси, но не растворяющий полимер, и затем отделяют осадок путем фильтрования или сцеживания. В качестве альтернативы можно привести способ, где осадок промывают растворителем с растворимостью немного большей, чем растворимость растворителя, содержащего осадок (например, смесь растворителя и растворителя, содержащего осадок), и высушивают осадок при пониженном давлении до тех пор, пока масса осадка не станет постоянной.
Не существует специфических ограничений типа носителя при условии, что в материале имеются поры, через которые может фильтроваться кровь. Среди различных конформаций носителей, пригодных к использованию, особенно предпочтительны волокнистые материалы, такие как натуральное волокно, стеклянное волокно, вязаный, тканый или нетканый материал, пористая мембрана, и материал, обладающий губчатой структурой, содержащий трехмерную сеть протяженных пор. Различные носители, такие как органические полимерные материалы, неорганические полимерные материалы и металлы, могут использоваться без ограничений при условии, что клетки крови не повреждаются. Из перечисленных материалов предпочтительны органические полимерные материалы бл