Способ получения алкиленгликолей
Иллюстрации
Показать всеНастоящее изобретение относится к способу превращения алкиленоксида в соответствующий алкиленгликоль в присутствии диоксида углероды, воды и каталитической композиции, содержащей галогенид, металат и макроциклическое хелатирующее соединение. Как правило, галогенидом является иодидом, выбранным из иодидов щелочных металлов, иодидов четвертичного фосфония и иодидов четвертичного аммония, металат выбран из группы молибдатов, ванадатов и вольфраматов, а макроциклическое хелатирующее соединение является простым краун-эфиром. Предлагаемый способ протекает с повышенной скоростью и позволяет получить алкиленгликоль с повышенной селективностью по отношению с алкиленкарбонату и высшим алкиленгликолям. 9 з.п. ф-лы, 2 табл.
Реферат
Изобретение относится к способу каталитического превращения алкиленоксидов в алкиленгликоли.
УРОВЕНЬ ТЕХНИКИ
Алкиленгликоли, в особенности моноалкиленгликоли, представляют собой коммерческий интерес. Например, моноалкиленгликоли применяют в составах антифризов в качестве растворителей и в качестве основных материалов в производстве полиалкилентерефталатов, например, для производства волокон или бутылок.
Производство алкиленгликолей жидкофазным гидролизом алкиленоксида известно. Гидролиз обычно осуществляют добавлением большого избытка воды, например, 20-25 моль воды на моль алкиленоксида. Реакция, как обоснованно предполагается, является реакцией нуклеофильного замещения, посредством которого происходит раскрытие кольца алкиленоксида, причем вода действует в качестве нуклеофила. Так как образующийся сначала моноалкиленгликоль также действует как нуклеофил, как правило, образуется смесь моноалкиленгликоля, диалкиленгликоля и высших алкиленгликолей. Для того чтобы повысить селективность в отношении моноалкиленгликоля, необходимо подавить вторичную реакцию между первичным продуктом и алкиленоксидом, которая конкурирует с гидролизом алкиленоксида.
Одним из эффективных средств для подавления вторичной реакции является увеличение относительного количества воды, присутствующей в реакционной смеси. Хотя эта мера улучшает селективность в отношении получения моноалкиленгликоля, она создает проблему, заключающуюся в необходимости удалять большие количества воды с целью извлечения продукта.
Немало попыток было сделано, чтобы найти альтернативные средства для повышения селективности реакции без применения большого избытка воды. Гидролиз алкиленоксидов до алкиленгликолей может быть осуществлен с меньшим избытком воды в каталитической системе. Поэтому эти попытки обычно были сфокусированы на выборе более активных катализаторов гидролиза, которые были раскрыты в литературе.
Каталитические процессы, промотирующие более высокую селективность моноалкиленового продукта при пониженных уровнях содержания воды, известны (например, ЕР-А-0156449, US-А-4982021, US-А-5488184, US-А-6153801 и US-А-6124508).
Такие катализаторы часто содержат обменную смолу сильно основного характера (анионную) часто с электроположительными сайтами комплексообразования четвертичного аммония и четвертичного фосфония, координированными с одним или несколькими анионами (например, металатом, галогеном, бикарбонатом, бисульфитом или карбоксилатом).
Дополнительные примеры каталитических процессов, известных для реакции алкиленоксидов до алкиленгликолей, приведены в JP 2001151713 и JP 2001151711, где каталитический состав, содержащий ион галогенида и ион бикарбоната, используют, чтобы превратить алкиленоксид в соответствующий алкиленгликоль в присутствии диоксида углерода и воды.
JP-A-56092228 относится к применению молибдена и/или вольфрама в качестве катализатора для превращения алкиленоксида в алкиленгликоль снова в присутствии диоксида углерода и воды.
US-A-4307256 описывает реакцию алкиленоксидов с водой и диоксидом углерода в присутствии катализатора третичного амина для получения алкиленгликолей. В US-A-4160116 описана подобная система, в которой используемым катализатором является соль четвертичного фосфония.
ЕР-А-1034158 относится к применению каталитического состава, содержащего макроциклическое хелатирующее соединение, образующее комплекс с ионным соединением, выбранным из группы, содержащей галогениды, карбоксилаты, гидрокарбонаты, гидросульфиты, гидрофосфаты и металаты, для гидролиза алкиленоксидов до алкиленгликолей.
В дополнение, способы получения алкиленгликолей из алкиленоксидов, включающие две стадии, описаны в технической литературе. Это способы с вовлечением реакции алкиленоксидов с диоксидом углерода в присутствии катализатора с последующим термическим или каталитическим гидролизом полученного алкиленкарбоната. Примеры таких двухстадийных способов включают те, которые описаны в JP-A-57106631 и JP-A-59013741.
Катализаторы, подходящие для гидролиза алкиленкарбонатов, описаны в публикации UA-A-4283580, которая относится к применению молибдена и вольфрама в виде металла или соединения в качестве катализаторов в производстве замещенных или незамещенных этиленгликолей взаимодействием замещенных или незамещенных этиленкарбонатов с водой.
Хотя прогресс и был достигнут в гидролизе алкиленоксида до алкиленгликоля, потребность в новых способах с повышенными степенями превращения с использованием высокоактивных и селективных каталитических композиций еще сохраняется.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к способу превращения алкиленоксида в соответствующий алкиленгликоль в присутствии каталитического состава, диоксида углерода и воды, где каталитический состав содержит галогенид, металат и необязательно макроциклическое хелатирующее соединение.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Неожиданно было обнаружено, что алкиленгликоли могут быть получены с большей скоростью и/или сетективностью путем реакции соответствующего алкиленоксида в присутствии воды и диоксида углерода с каталитической композицией, содержащей металат, галогенид и необязательно макроциклическое хелатирующее соединение.
Способ по данному изобретению протекает с повышенной скоростью и селективностью по сравнению с непосредственным гидролизом алкиленоксидов до алкиленгликолей, который описан в предшествующей литературе. Кроме того, этот способ происходит также с повышенной селективностью моноалкиленгликоля по отношению к алкиленкарбонату и высшим алкиленгликолям по сравнению с описанными в предшествующей литературе способами превращения алкиленоксидов в алкиленгликоли через соответствующий алкиленкарбонат.
Алкиленоксиды, используемые в качестве исходного вещества в способе по изобретению, имеют их обычное определение, т.е. они являются соединениями, имеющими вицинальную оксидную (эпокси) группу в их молекулах.
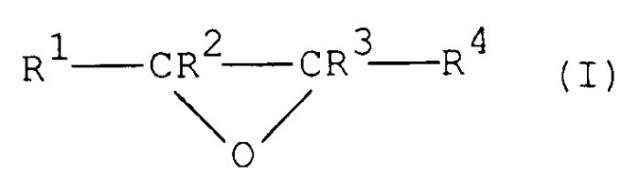
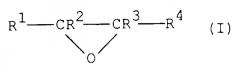
Особенно подходящими являются алкиленоксиды общей формулы (I)
где R1-R4 независимо представляют атом водорода или необязательно замещенную алкилгруппу, имеющую от 1 до 6 атомов углерода. Любая алкилгруппа, представленная R1, R2, R3 и/или R4, предпочтительно имеет от 1 до 3 атомов углерода. В качестве заместителей могут присутствовать неактивные группы, такие как гидроксигруппы. Предпочтительно, R1, R2 и R3 представляют атомы водорода и R4 представляет незамещенную С1-С3-алкилгруппу и, более предпочтительно, R1, R2, R3 и R4 все представляют атомы водорода.
Примеры подходящих алкиленоксидов, следовательно, включают этиленоксид, пропиленоксид, 1,2-эпоксибутан и 2,3-эпоксибутан. В данном изобретении наиболее предпочтительным алкиленоксидом является этиленоксид.
Получение алкиленоксидов хорошо известно специалисту. В случае этиленоксида, он может быть получен хорошо известным непосредственным окислением этилена, например, окислением воздухом или кислородом, с использованием катализаторов на основе серебра и часто также органических модераторов, например, органических галогенидов (см., например, Kirk Othmer's Encyclopedia of Chemical Technology, 4th edition, Vol. 9, pages 923-940).
Используемый здесь термин "металат" определен как анион оксида металла, в котором металл является поливалентным, имеющим положительное функциональное окисленное состояние по меньшей мере +3, и может быть, например, переходным металлом. В данном изобретении металат соответственно выбран из анионов оксидов металлов, содержащих металлы групп 5 и 6 (согласно IUPAC Nomenclature of Inorganic Chemistry, Recommendations 1990. Blackwell Scientific Publications, 1990. Edited by G.J. Leigh). Предпочтительно, металат выбран из группы вольфраматов, ванадатов и молибдатов. Наиболее предпочтительно, металат является молибдатом.
Типичные примеры таких анионов металатов включают анионы, обычно, характеризующиеся формулой [MoO4]2-, [VO3]-, [V2O7H]3-, [V2O7]4- и [WO4]2-. Признано, что химия указанных анионов металатов является сложной и действительная химическая формула в условиях способа по данному изобретению на практике может быть другой, но указанные выше являются общепринятой характеристикой.
Количество металата, используемое в способе по данному изобретению, соответственно находится в пределах от около 0,0001 до 0,5 моль/моль алкиленоксида. Предпочтительно, металат присутствует в количестве в пределах от около 0,001 до 0,1 моль/моль алкиленоксида.
Термин галогенид относится к соединению, содержащему анион одного из элементов группы 17 Периодической системы (согласно IUPAC Nomenclature of Inorganic Chemistry, Recommendations 1990. Blackwell Scientific Publications, 1990. Edited by G.J. Leigh). Предпочтительно, галогенид выбран из группы хлоридов, бромидов и иодидов. Наиболее предпочтительно, галогенид является иодидом.
Подходящие галогениды включают галогениды четвертичного фосфония, галогениды четвертичного аммония и галогениды щелочных металлов.
Количество галогенида, используемое в способе по данному изобретению, соответственно находится в пределах от 0,0001 до 0,5 моль/моль алкиленоксида. Предпочтительно, галогенид присутствует в количестве в пределах от 0,001 до 0,1 моль/моль алкиленоксида.
Макроциклические хелатирующие соединения известны - см., например, J. March in Advanced Organic Chemistry; Reactions, Mechanisms and Structures, 4th Edition 1992, pp 82-87 и 363-364. Они имеют свойство формирования комплексов с положительными ионами (катионами), хотя они могут также связывать в комплекс нейтральные молекулы. Они имеют правильную органическую кольцевую структуру, содержащую множество гетероатомов, таких, как кислород, азот или сера. Они могут быть моноциклическими, бициклическими или циклами высшего порядка. Связывание катионов в указанных комплексах является результатом притяжений типа ион-диполь между гетероатомами и положительными ионами. Таким образом, число гетероатомов в молекуле определяет силу связывания, и размер и форма полости определяют ионы (или нейтральные молекулы), которые могут быть связаны. Макроцикл называют хозяином, и ион является гостем. Благодаря их форме и размеру способность молекул-хозяев связывать гостей часто очень специфическая, позволяющая хозяину оттягивать только один катион или молекулу из смеси.
Предполагается, что какое-либо макроциклическое хелатирующее соединение может быть использовано в процессе по данному изобретению.
Наиболее хорошо известными макроциклическими хелатирующими соединениями являются те, в которых все или большинство гетероатомов являются атомами кислорода, в частности простые краун-эфиры, кольцевая структура которых является двухмерной (моноциклической), и криптанды, где кольцевая структура является трехмерной (бициклической, трициклической и т.д.). Когда полость макроцикла является сферической, молекулу называют сферандом. Другими более экзотическими типами являются каликсарены, криптофаны, гемисферанды и понданды.
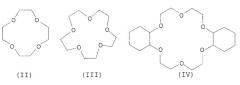
Простые краун-эфиры обычно обозначают по их общему числу атомов и числу гетероатомов в кольце плюс заместители, когда присутствуют. Примерами являются 12-краун-4 (II), 15-краун-5 (III) и дициклогексано-18-краун-6 (IV).
В данном изобретении макроциклическое хелатирующее соединение предпочтительно выбрано из группы простых краун-эфиров и криптандов. Более предпочтительно, макроциклическое хелатирующее соединение является простым краун-эфиром. Еще более предпочтительно, простым краун-эфиром является 18-краун-6.
Макроциклическое хелатирующее соединение может быть использовано в сочетании с каким-либо каталитическим составом по изобретению. Однако макроциклическое хелатирующее соединение является наиболее полезно используемым, когда галогенидом является галогенид щелочного металла.
Если макроциклическое хелатирующее соединение используют в сочетании с галогенидом, два соединения могут быть смешаны, чтобы сформировать комплекс перед добавлением к реакционной смеси, или макроциклическое хелатирующее соединение м иодид могут быть добавлены к реакционной смеси раздельно.
Соответственно, молярное отношение галогенида к макроциклическому хелатирующему соединению в реакционной смеси по меньшей мере 1:0,5, более подходяще молярное отношение галогенида к макроциклическому хелатирующему соединению в реакционной смеси по меньшей мере 1:0,75. Соответственно, молярное отношение галогенида к макроциклическому хелатирующему соединению по большей мере 1:10, более подходяще молярное отношение галогенида к макроциклическому хелатирующему соединению по большей мере 1:5.
Количество присутствующей воды обычно по меньшей мере 0,2 моль/моль алкиленоксида, присутствующего в реакционной смеси, предпочтительно по меньшей мере 0,5 моль/моль алкиленоксида. Количество присутствующей воды по меньшей мере 1 моль/моль алкиленоксида является наиболее предпочтительным. Предпочтительно, количество присутствующей воды менее чем 25 моль/моль алкиленоксида, более предпочтительно менее чем 15 моль/моль алкиленоксида. Количество присутствующей воды по большей мере 5 моль/моль алкиленоксида является наиболее предпочтительным.
Преимущество данного изобретения в том, что возможно проводить способ с высокими скоростью и селективностью в присутствии близкого к стехиометрическому количеству воды по отношению к алкиленоксиду, например, с количеством воды в пределах от 1 моль/моль алкиленоксида до 1,3 моль/моль алкиленоксида, особенно с количеством воды 1 моль/моль алкиленоксида или 1,1 моль/моль алкиленоксида. Это уменьшает количество энергии, необходимое для удаления избыточной воды из продукта реакции.
Вода, представленная в реакционной смеси по данному изобретению, может быть добавлена к реакционной смеси отдельно от алкиленоксида. В качестве варианта алкиленоксид и вода могут быть предварительно смешаны перед подачей в реактор. В предпочтительном варианте воплощения изобретения алкиленоксидную смесь продуктов из алкиленоксидного реактора используют или без непосредственного использования дополнительных стадий обработки, или после некоторого концентрирования в стриппере. Наиболее предпочтительно, когда используют смесь этиленоксид/вода, образованную абсорбцией продуктового потока из реактора непосредственного окисления этиленоксида. Этот способ имеет дополнительное преимущество в том, что энергия, расходуемая при отделении алкиленоксида, уменьшается.
Предпочтительно, общее количество диоксида углерода, подаваемого в реактор, является количеством по меньшей мере 0,5 моль/моль алкиленоксида, предпочтительно по меньшей мере 1 моль/моль алкиленоксида. Предпочтительно, общее количество диоксида углерода, подаваемого в реактор, является количеством по большей мере 100 моль/моль алкиленоксида, более предпочтительно количество по большей мере 10 моль/моль алкиленоксида.
Способ по данному изобретению может быть проведен в периодическом режиме. Однако, в особенности для крупно масштабных вариантов воплощения, предпочтительно проводить процесс непрерывно.
Подходящие температуры реакции для каталитического получения алкиленгликолей по данному изобретению обычно находятся в пределах от 40 до 200°С, причем температуры в пределах от 50 до 120°С предпочтительны.
Давление реакции обычно выбрано в пределах от 100 до 5000 кПа, предпочтительно в пределах от 200 до 3000 кПа, наиболее предпочтительно в пределах от 500 до 2000 кПа.
Следующие примеры будут пояснять изобретение. Примеры 1-13 представляют изобретение, и примеры 14-23 являются сравнительными.
ПРИМЕРЫ
Примеры проводили в автоклаве Medimex на 250 или 125 мл согласно следующим методикам.
Общие условия реакции: Примеры 1-17 и 21-23
Реактор заполняют водой и галогенид (если присутствует) добавляют в достаточном количестве, чтобы обеспечить концентрацию ионов галогенида 0,12 моль/л, металат или карбонат (если присутствует) добавляют в достаточном количестве, чтобы обеспечить концентрацию 0,025 моль/л, и простой краун-эфир (если присутствует) добавляют в достаточном количестве, чтобы обеспечить концентрацию 0,19 моль/л. Реактор затем продувают СО2 и создают избыточное давление с атмосферой СО2 приблизительно 5 бар (500 кПа). Содержимое реактора затем нагревают до соответствующей температуры (см. таблицы 1 и 2) и в реакторе дополнительно создают избыточное давление 5, 10 или 20 бар (500, 1000 или 2000 кПа). Этиленоксид затем нагнетают в реактор со скоростью 6,3 г/мин, пока не будет достигнуто отношение вода/ЕО 4,02 моль/моль. Эти условия имеют результатом концентрацию галогенида (если присутствует) 0,0118 моль/моль этиленоксида и концентрацию металата или карбоната (если присутствует) 0,0035 моль/моль этиленоксида. Содержимое реактора поддерживают при соответствующих температуре и давлении (путем непрерывной подачи СО2) и образцы отбирают через регулярные интервалы времени и анализируют газожидкостной хроматографией (GLC).
Условия реакции: Примеры 18-20
Реактор заполняют водой и катализатор галогенид (если присутствует) добавляют в достаточном количестве, чтобы обеспечить концентрацию ионов галогенида 0,12 моль/л, катализатор металат добавляют в достаточном количестве, чтобы обеспечить концентрацию 0,025 моль/л, и простой краун-эфир (если присутствует) добавляют в достаточном количестве, чтобы обеспечить концентрацию 0,19 моль/л. Реактор затем продувают N2 и создают избыточное давление с атмосферой N2 приблизительно 5-6 бар (500-600 кПа). Содержимое реактора затем нагревают до 90°С. Этиленоксид затем нагнетают в реактор со скоростью 6,3 г/мин (вызывая повышение давления приблизительно до 10-14 бар (1000-1400 кПа), пока не будет достигнуто отношение вода/ЕО 4,02 моль/моль. Эти условия имеют результатом концентрацию галогенида (если присутствует) 0,0118 моль/моль этиленоксида и концентрацию металата (если присутствует) 0,0035 моль/моль этиленоксида. Содержимое реактора поддерживают при 90°С и образцы отбирают через регулярные интервалы времени и анализируют с помощью ГЖХ. Во время протекания реакции давление падает обратно до начального 5-6 бар (500-600 кПа) (благодаря реакции этиленоксида).
Полученные результаты показаны в таблицах 1 и 2.
| Таблица 1 | ||||||||||
| Примеры по изобретению | ||||||||||
| Иодид | Металат | Простой краун-эфир | Превращение | Селективность | TOF# (h-1) | Температура(°C) | Давление CO2(бар) | |||
| EC | MEG | Суммарная | ||||||||
| 1 | KI | K2MoO4 | - | 97,6 | 0,4 | 96,7 | 97,1 | 57 | 90 | 20 |
| 2 | KI | K2MoO4 | 18-краун-6 | 100,0 | 2,5 | 96,6 | 99,1 | 62 | 90 | 20 |
| 3 | KI | K2MoO4 | 18-краун-6 | 99,5 | 2,2 | 96,6 | 98,8 | 74 | 90 | 20 |
| 4 | KI | K2WO4 | 18-краун-6 | 99,3 | 65,0 | 34,4 | 99,4 | 84 | 90 | 20 |
| 5 | KI | Na3VO4 | 18-краун-6 | 99,3 | 65,2 | 33,9 | 99,0 | 77 | 90 | 20 |
| 6 | KI | KVO3 | 18-краун-6 | 98,5 | 70,3 | 28,7 | 99,0 | 71 | 90 | 20 |
| 7 | TBPMI | K2MoO4 | - | 99,7 | 1,5 | 97,4 | 98,9 | 78 | 90 | 20 |
| 8 | TBPMI | K2MoO4 | 18-краун-6 | 99,7 | 4,4 | 94,8 | 99,2 | 84 | 90 | 20 |
| 9 | TBAI | K2MoO4 | - | 99,5 | 2,3 | 96,6 | 98,9 | 79 | 90 | 20 |
| 10 | TBAI | K2MoO4 | 18-краун-6 | 99,8 | 5,1 | 94,3 | 99,4 | 85 | 90 | 20 |
| 11 | KI | K2MoO4 | 18-краун-6 | 100,0 | 0,6 | 98,4 | 99,0 | 69 | 90 | 10 |
| 12 | KI | K2MoO4 | 18-краун-6 | 98,8 | 0,1 | 96,0 | 96,2 | 55 | 90 | 5 |
| 13 | TBPMI | K2MoO4 | - | 84,3 | 17,2 | 81,8 | 99,0 | 47 | 80 | 20 |
| * превращение после 90 минут; #TOF = частота возобновления (моль ЕС + моль полученного MEG/моль катализатора иодида/ч), рассчитанная при 30 мин; TBPMI = иодид трибутилметилфосфония; TBAI = иодид тетрабутиламмония; ЕС = этиленкарбонат; MEG = моноэтиленгликоль. |
Примеры по изобретению демонстрируют высокие скорости (как показано результатами превращения) и превосходную селективность к моноалкиленгликолю.
Высокие степени суммарной селективности демонстрируют низкие степени образования нежелательных высших алкиленгликолей даже в присутствии относительно малого количества воды. Хотя примеры 4-6 (по изобретению) демонстрируют пониженную селективность к моноэтиленгликолю (MEG) по сравнению с другими примерами по изобретению, все эти примеры демонстрируют высокую суммарную селективность. Кроме того, селективности к MEG для примеров 4-6 выше, чем таковые каких-либо из сравнительных примеров, в которых образуется значительное количество промежуточного соединения, этиленкарбоната (примеры 14, 15 и 21-23).
Примеры в таблице 1, в сравнении со сравнительными примерами в таблице 2, указывают на то, что оптимальные результаты получают, когда СО2 присутствует в сочетании с каталитическим составом, содержащим галогенидный катализатор карбоксилирования (необязательно объединенный с макроциклическим хелатирующим соединением) и активный металатный катализатор гидролиза. Сниженные характеристики получают, если какой-либо из указанных трех компонентов (СО2, галогенид, металат) отсутствует.
В отсутствие СО2 (см. сравнительные примеры 18-20) происходит непосредственный гидролиз алкиленоксида до алкиленгликоля, имея результом значительно сниженную суммарную селективность (менее чем 78%), благодаря образованию нежелательных высших гликолей.
В отсутствие галогенидного катализатора карбоксилирования (смотри сравнительные примеры 16-19) наблюдаются очень низкие скорости (менее чем 46% превращение) и суммарной селективности. Опять это указывает на то, что происходит непосредственный гидролиз алкиленоксида до алкиленгликолей, характеризующийся значительным образованием высших алкиленгликолей. Пример 16 является типичным примером процесса, описанного в JP-A-56092228, и пример 19 является типичным примером процесса, описанного в ЕР-А-1034158.
В отсутствие маталатного катализатора гидролиза (см. сравнительные примеры 14, 21 или 22) или в присутствии альтернативного катализатора гидролиза, такого как К2СО3 (см. сравнительные примеры 15 и 23) главным продуктом является алкиленкарбонат. Более строгие условия реакции были бы необходимы, чтобы превратить алкиленкарбонат в желательный алкиленгликоль. Пример 23 является типичным примером способа, описанного в JP 2001151713 и JP 2001151711.
1. Способ превращения алкиленоксида в соответствующий алкиленгликоль в присутствии каталитической композиции, диоксида углерода и воды, где каталитическая композиция содержит галогенид, металат и макроциклическое хелатирующее соединение.
2. Способ по п.1, где галогенид является иодидом, выбранным из иодидов щелочных металлов, иодидов четвертичного фосфония и иодидов четвертичного аммония.
3. Способ по п.1 или 2, где металат выбран из группы молибдатов, ванадатов и вольфраматов.
4. Способ по п.3, где металат является молибдатом.
5. Способ по любому из пп.1, 2 или 4, где макроциклическое хелатирующее соединение является простым краун-эфиром.
6. Способ по любому из пп.1, 2 или 4, где вода присутствует в пределах от 0,2 до 25 моль/моль алкиленоксида, присутствующего в реакционной смеси.
7. Способ по п.6, где вода присутствует в пределах от 1 до 5 моль/моль алкиленоксида, присутствующего в реакционной смеси.
8. Способ по любому из пп.1, 2, 4 или 7, где суммарное количество диоксида углерода, подаваемое в реактор, является количеством в пределах от 0,5 до 100 моль/моль алкиленоксида.
9. Способ по любому из пп.1, 2, 4 или 7, где процесс происходит при температуре от 40 до 200°С и под давлением от 100 до 5000 кПа.
10. Способ по любому из пп.1, 2, 4 или 7, где алкиленоксид является этиленоксидом.