Способы и композиции для ингибирования экспрессии рецептора p2х7
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и генной терапии. Раскрыта группа siNA (siRNA), направленных на определенные участки гена рецептора Р2Х7 (P2RX7) и эффективно подавляющих его экспрессию. Предложено применение siRNA по изобретению, как непосредственно, так и в составе лекарственных средств, для лечения заболеваний, характеризующихся повышенной экспрессией и/или активностью рецептора Р2Х7, таких как нейрональная дегенерация, болезнь Альцгеймера, воспалительные заболевания, некоторые виды злокачественной опухоли и др. 5 н. и 21 з.п. ф-лы, 5 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и композициям для лечения и/или профилактики нейрональной дегенерации или других заболеваний, связанных с высокими уровнями экспрессии или активности рецепторов P2X7 (P2RX7). В предпочтительных вариантах осуществления изобретение относится к применению технологии RNAi (РНК-интерференции) для подавления экспрессии P2RX7.
Способы и композиции предназначены для лечения заболеваний, связанных с высокими уровнями P2RX7, которые включают в себя, но не ограничиваются ими, нейрональную дегенерацию, реперфузию или ишемию при инсульте или инфаркте миокарда, болезнь Альцгеймера, воспалительные заболевания (такие как ревматоидный артрит, остеоартрит, астма, ринит, хроническое обструктивное заболевание легких (COPD), воспалительное заболевание кишечника (IBD), такое как болезнь Крона), аллергии, аутоиммунные заболевания, злокачественную опухоль (такую как лейкоз или немеланомный рак кожи), заболевания кожи (такие как псориаз, экзема, алопеция), заболевания сетчатки и для лечения боли невропатического и воспалительного происхождения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
RNAi в качестве инструмента для подавления экспрессии генов
Направленное воздействие на гены посредством гомологичной рекомбинации широко используется для определения функций генов млекопитающих, но оно представляет собой дорогостоящий и длительный процесс. Альтернативно функции множества генов могут быть определены ингибированием мРНК с применением рибозимов или антисмысловых технологий. Несмотря на результативность в некоторых ситуациях эти технологии сложно использовать универсально. Появление направленного "нокдауна" с помощью siRNA совершило переворот в генетике соматических клеток, предоставив недорогой и быстрый анализ функций генов у млекопитающих.
Создание удобного и надежного способа "нокаута" экспрессии генов на уровне мРНК является периодически возникающим вопросом в молекулярной биологии на протяжении последних 15 лет. В попытках обеспечить потерю функции в клетках или организмах анализировали различные молекулы, которые включают, например, антисмысловые последовательности, рибозимы и химерные олигонуклеотиды, но разработка таких молекул была основана на методе "проб и ошибок", в зависимости от свойств гена-мишени. Более того, требуемые эффекты было трудно предсказать и часто достигали только слабого подавления (Braasch & Corey, 2002).
После открытия этого явления у растений в начале 1990-х в 1998 Andy Fire и Craig Mello впервые продемонстрировали на червях Caenorhabditis elegans, что dsRNA (двухцепочечная РНК) может с максимально высокой эффективностью специфично и селективно ингибировать экспрессию генов (Fire et al., 1998). В их экспериментах последовательность первой цепи (так называемой смысловой РНК) совпадает с последовательностью соответствующего участка целевой матричной РНК (мРНК). Вторая цепь (антисмысловая РНК) комплементарна этой мРНК. Полученная в результате dsRNA оказалась значительно более (на несколько порядков величины) эффективной, чем соответствующие одноцепочечные молекулы РНК (в частности, антисмысловая РНК). Fire et al. в 1998 назвали феноменом RNAi или интерференцией РНК. Было показано, что этот мощный механизм подавления генов работает у различных видов среди большинства филогенетических типов.
RNAi начинается, когда фермент, обозначаемый DICER, встречается с dsRNA и разрезает ее на фрагменты, называемые малыми интерферирующими РНК или siRNA. Этот белок принадлежит семейству нуклеазы РНКазы III. Комплекс белков собирает эти остатки РНК и использует их код в качестве руководства для поиска и уничтожения в клетке любых РНК с совпадающей последовательностью, таких как мРНК-мишени (для ознакомления см. Bosher & Labouesse, 2000).
Феномен RNAi (Akashi et al., 2001) можно свести к следующему:
- Стадия 1: процесс распознавания и считывания dsRNA.
- Стадия 2: расщепление dsRNA вследствие активности РНКазы III и продукция siRNA.
- Стадия 3: ассоциация siRNA и ассоциированных с ними факторов в комплексы RISC.
- Стадия 4: распознавание комплементарной мРНК-мишени.
- Стадия 5: расщепление мРНК-мишени в центре участка, комплементарного siRNA.
- Стадия 6: деградация мРНК-мишени и возврат комплекса в цикл RISC.
При попытках применить феномен RNAi в качестве технологии для "нокдауна" гена скоро стало понятно, что в клетках млекопитающих развиты различные защитные феномены против вирусной инфекции, которые могут препятствовать применению этого подхода. Действительно, наличие очень низкого уровня вирусной dsRNA запускает ответ интерферонов, который приводит к общему неспецифичному подавлению трансляции, которое в свою очередь запускает апоптоз (Williams, 1997, Gil & Esteban, 2000).
В 2000 первая попытка применения dsRNA привела к специфичному ингибированию 3 генов (MmGFP под контролем фактора элонгации Ia, E-кадгерина, и c-mos) в ооците и раннем эмбрионе мышей. Остановка трансляции и, таким образом, ответ PKR не наблюдались при развитии эмбрионов (Wianny & Zernicka-Goetz, 2000). Через один год в исследованиях в Ribopharma AG (Кульмбах, Германия) впервые было показано функционирование RNAi в клетках млекопитающих. С использованием коротких (20-24 пар оснований) dsRNA, которые называются SIRPLEXTM, исследователи специфично выключали гены, даже в клетках человека без инициации ответа острой фазы. Позднее аналогичные эксперименты проводили другие исследовательские группы (Elbashir et al., 2001; Caplen et al., 2001), которые дополнительно подтверждали эти результаты.
Через один год Paddison et al. (Paddison et al., 2002) для ингибирования функции конкретных генов предприняли попытку использовать малые РНК, свернутые в структуры в виде "шпилек". На эту работу повлияли более ранние исследования, в которых было показано, что некоторые гены Caenorhabditis elegans в природе регулируют другие гены с помощью RNAi посредством кодирования структур РНК в виде "шпилек". Протестированные на множестве нормальных и злокачественных клеточных линий человека и мышей короткие РНК в виде "шпилек" (shRNA) способны подавлять гены также эффективно, как и их siRNA аналоги. Более того, для shRNA показана улучшенная кинетика реассоциации in vivo, чем для эквивалентных дуплексов. Более важным является то, что эти авторы получили трансгенные клеточные линии, сконструированные для синтеза shRNA, которые проявляют продолжительный подавляющий эффект на протяжении делений клеток (Eurogentec). Недавно было показано, что другая группа малых РНК (также находящаяся в диапазоне 21-25 нуклеотидов) осуществляет подавление экспрессии генов. Эти РНК, известные как малые временно регулируемые РНК (stRNA), были описаны для Caenorhabditis elegans, где они регулируют продолжительность экспрессии генов в процессе развития. Следует отметить, что stRNA и siRNA, несмотря на очевидные сходства, обладают разными способами воздействия (для ознакомления см. Banerjee & Slack, 2002). В противоположность siRNA, stRNA длиной 22 нуклеотида подавляют экспрессию мРНК-мишени после инициации трансляции без влияния на целостность мРНК. Последние исследования показывают, что две stRNA, впервые описанные у нематод, являются членами огромного семейства совместно с сотнями дополнительных микро-РНК (miРНК), встречающихся у многоклеточных (Grosshans & Slack, 2002).
Ученые изначально использовали RNAi в нескольких системах, включая Caenorhabditis elegans, Drosophila, trypanosomes и различные другие беспозвоночные. Более того, с использованием этого подхода несколько групп недавно показали специфичное подавление биосинтеза белка в различных клеточных линиях млекопитающих, конкретно в клетках HeLa, показав, что RNAi является широко применимым способом подавления генов in vitro. Исходя из этих результатов, RNAi быстро стала широко распространенным инструментом для определения (идентификации и обозначения) функций генов. Интерференция РНК, при которой используются короткие олигонуклеотиды dsRNA, более того, позволит расшифровать функции генов, которые отсеквенированы только частично. Таким образом, RNAi станет обязательной в таких исследованиях, как:
- Ингибирование экспрессии генов на пост-трансляционном уровне в эукариотических клетках. В этом контексте RNAi является непосредственным инструментом для быстрой оценки функции генов и выявления нулевых фенотипов.
- Развитие технологии RNAi для применения для эмбрионов после имплантации.
- Преимущественное экономическое значение интерференции РНК определяется ее использованием в качестве подхода к лечению. Таким образом, RNAi может привести к появлению лекарственных средств на основе РНК для лечения заболеваний у человека.
Снижение высокого уровня P2RX7 для профилактики заболевания
Рецепторы P2X представляют собой мембранные ионные каналы, которые открываются в ответ на связывание внеклеточного АТФ (North, 2002). Они широко распространены, и функциональные ответы наблюдаются в нейронах, глии, эпителии, эндотелии, костной, мышечной и гематопоэтической тканях.
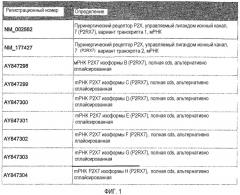
Пуринергические рецепторы P2X7 (P2RX7) представляют собой управляемые лигандами катионные каналы с широким распределением, которое включает клетки иммунной и гематопоэтической системы (Di Virgilio et al., 2001; North 2002). Изначально были идентифицированы две сплайсированные формы P2RX7, соответствующие регистрационным номерам GenBank NM_002562 и NM_177427. Однако недавно сообщили об идентификации семи вариантов P2RX7 человека, которые возникают вследствие альтернативного сплайсинга (Cheewatrakoolpong et al., 2005).
Активация P2RX7 вследствие короткого воздействия внеклеточного АТФ приводит к открытию каналов, которые обеспечивают ток Ca2+ и Na+ внутрь клетки и ток K+ из клетки, и это запускает каскад последующих событий. Они включают стимуляцию фосфолипазы D (El-Moatassim & Dubyak, 1993; Gargett et al., 1996), активацию мембранных металлопротеиназ (Jamieson, et al., 1996; Gu et al., 1998; Sluyter & Wiley, 2002) и стимуляцию внутриклеточных каспаз, которые в итоге приводят к апоптотической гибели клетки-мишени (Ferrari et al., 1999; Humphreys et al., 2000). Активация P2RX7 также приводит к выраженному образованию пузырей в мембране (Virginio et al., 1999), что является типичным морфологическим признаком процесса апоптоза.
P2RX7 опосредует быструю передачу возбуждения в различных участках головного и спинного мозга (North, 2002). Недавно АТФ был идентифицирован как сильный медиатор кальциевой передачи сигнала в астроцитах (Cotrina et al., 1998; Guthrie et al., 1999). Оказалось, что кальциевая передача сигнала в астроцитах является основным механизмом, посредством которого астроциты отвечают на множество стимулов, включающих синаптическую активность, воздействие медиаторов и травматическое повреждение (Fields & Stevens-Graham, 2002). Таким способом локальные астроциты передают кальциевые сигналы нейронам в пределах их собственного географического микродомена. Этот АТФ-зависимый процесс распространения кальциевой волны происходит в головном мозге, а также в паренхиме спинного мозга (Scemes et al., 2000, Fam et al., 2000), где он может участвовать в распространении локального повреждения.
Предварительные исследования показали, что травматическое повреждение запускает как высвобождение АТФ, так и кальциевую передачу сигнала (Cook & McCleskey, 2002; Neary et al., 2003, Du et al., 1999). Тот факт, что P2RX7 экспрессируется в нейронах спинного мозга, включая двигательные нейроны (Deuchars et al., 2001), и что P2RX7 представляет собой управляемые АТФ катионные каналы, активация которых непосредственно опосредует гибель клеток (Di Virgilio et al., 1998), делает P2RX7 хорошим кандидатом для ингибирования в целях профилактики последствий травматического повреждения, а также хронической травмы. Доставка OxАТФ или PPADS, являющихся антагонистами P2RX7, крысам после острого повреждения от удара значительно улучшала функциональное восстановление и снижала гибель клеток в перитравматической области, уменьшая как гистологическую протяженность, так и функциональные последствия острого повреждения спинного мозга (Wang et al., 2004).
Также была показана постишемическая зависимая от времени повышенная регуляция подтипов рецепторов P2X7 на нейрональных и глиальных клетках и полагают, что этот рецептор участвует в патофизиологии ишемии головного мозга in vivo (Franke et al., 2004).
Parvathenani et al. показали значительные различия в окрашивании на P2RX7 в срезах головного мозга трансгенных мышей в модели болезни Альцгеймера (AD) (Parvathenani et al., 2003). Интенсивное окрашивание на P2RX7 вокруг бляшек может быть следствием повышенной регуляции рецепторов P2X7 и/или агрегации глии вокруг бляшек. Поразительная ассоциация in vivo между клетками, положительными в отношении рецептора P2X7, и бляшками в модели AD на трансгенных мышах позволяет предположить, что антагонисты P2RX7 могут обладать терапевтической ценностью для лечения AD посредством регуляции патологически активированной микроглии.
Было показано, что внеклеточная АТФ активирует разнообразные нижеследующие процессы передачи сигнала в T-лимфобластоидной клеточной линии человека (Budagian et al., 2003). Как мРНК, так и белок P2RX7, не специфичные для происхождения, были обнаружены в восьми из одиннадцати гемопоэтических клеточных линий человека (Zhang et al., 2004). Кроме того, образцы мононуклеарных клеток костного мозга из 69 пациентов с лейкозом и 9 пациентов с миелодиспластическим синдромом (МДС) (из 87 и 10 пациентов соответственно) были положительными на P2RX7 на уровне мРНК. Более того, количество положительных результатов и относительный уровень экспрессии были значительно выше в группах острого миелогенного лейкоза (ОМЛ), острого лимфобластного лейкоза (ОЛЛ), хронического миелогенного лейкоза (ХМЛ) и МДС, чем в группах здоровых доноров. После одного курса стандартных лекарственных средств для индукции уровень ремиссии в группе с высокой экспрессией P2RX7 был ниже, чем уровень либо в P2RX7-отрицательной группе, либо в группе с низкой экспрессией P2RX7 (Zhang et al., 2004). Экспрессия и функция P2RX7 также были ассоциированы с клиническим течением у пациентов, страдающих хроническим лимфоцитарным лейкозом (ХЛЛ) (Cabrini et al., 2005).
Дендритные клетки (DC), которые являются основными в инициации адаптивного иммунного ответа (Hart, 1997; Stockwln et al., 2000) экспрессируют P2RX7 (Mutini et al., 1999; Berchtold et al., 1999; Ferrari et al., 2000). Кроме того, было показано, что активация P2RX7 в DC приводит к открытию катион-селективных каналов и приводит к быстрой и полной потере CD23, низкоаффинного рецептора для IgE (Sluyter & Wiley, 2002), который обладает значительной ролью в хронических воспалительных заболеваниях, включая ревматоидный артрит (Bonnefy, 1996).
Электрофизиологические данные и анализ мРНК легочного эпителия и других эпителиальных клеток человека и мышей показывают, что разнообразные P2XR широко экспрессируются в этих тканях и что они активны как на апикальных, так и на базолатеральных поверхностях (Taylor et al., 1999).
P2RX7 также экспрессируются на кератиноцитах кожи человека, где они принимают участие в системе передачи сигнала для регуляции пролиферации, дифференцировки и апоптоза эпидермиса (Greig et al., 2003a; Greig et al., 2003b). В дополнение к вышеупомянутым эффектам, в ответ на связывание АТФ P2RX7 приводит к высвобождению биологически активного воспалительного цитокина интерлейкина IL-1 бета, которое сопровождается активацией клеток иммунного происхождения, в которых он экспрессируется, таких как примированные LPS макрофаги (Verhoef et al., 2003). Вовлечение P2RX7 в осуществление воспалительного ответа моноцитов/макрофагов делает их хорошей мишенью против клеточноопосредованных аутоиммунных нарушений, таких как псориаз.
Экспрессия P2RX7 также была выявлена на глиальных клетках Мюллера сетчатки человека (Pannicke et al., 2000), а также на перицитах микрососудов, выделенных из сетчатки крысы, где они регулируют многоклеточную функциональную организацию сети микрососудов (Kawamura et al., 2003). Недавно было показано, что стимуляция P2RX7 с помощью агонистов, таких как бензоилбензоиладенозинтрифосфат (BzАТФ повышает Ca2+ и вызывает гибель ганглионарных клеток сетчатки (Zhang et al., 2005).
Повышенная активность P2RX7 была выявлена в фибробластах человека у пациентов с диабетом, что позволило сделать предположение о возможном патогенетическом механизме повреждения сосудов при диабете (Solini et al., 2004).
Эксперименты, проведенные на мышах, лишенных P2RX7, показывают, что повышенная воспалительная и невропатическая чувствительность как на механические, так и на температурные стимулы у мутантных мышей полностью отсутствует, в то время как нормальные ноцицептивные проявления сохраняются (Chessell et al., 2005). У животных с "нокаутом" не затрагивается их способность продуцировать мРНК для про-IL-1 бета, и цитометрический анализ лапы и анализ системных цитокинов у животных с "нокаутом" и у животных дикого типа после повреждения адъювантом позволяют сделать предположение о селективном эффекте делеции гена на высвобождение IL-1 бета и IL-10. Эта часть доказательства совместно с тем фактом, что в ганглиях дорзальных корешков и поврежденных нервах, полученных из пациентов с хронической невропатической болью, происходила активация P2RX7, позволили выдвинуть гипотезу, что P2RX7 участвует в развитии боли невропатического и воспалительного происхождения посредством регуляции продукции зрелого IL-1 бета (Chessell et al., 2005). Лекарственные средства, которые блокируют эту мишень, могут обладать потенциалом для обеспечения аналгезии широкого спектра.
Вышеупомянутые экспериментальные данные, таким образом, указывают на ингибирование P2RX7 как на эффективный способ лечения заболеваний, таких как нейрональная дегенерация, реперфузия или ишемия при инсульте или инфаркте миокарда, болезнь Альцгеймера, воспалительные заболевания (такие как ревматоидный артрит, остеоартрит, астма, ринит, хроническое обструктивное заболевание легких (COPD), воспалительное заболевание кишечника (IBD), такое как болезнь Крона), аллергии, аутоиммунные заболевания, злокачественная опухоль (такая как лейкоз, немеланомный рак кожи), кожные заболевания (такие как псориаз, экзема, алопеция), заболевания сетчатки и лечения боли невропатического и воспалительного происхождения.
Новым подходом для обеспечения такого ингибирования является подавление экспрессии гена P2RX7, опосредуемое интерференцией РНК (RNAi).
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы описывают в настоящем изобретении способ лечения и/или профилактики нейрональной дегенерации или других заболеваний, связанных с высокими уровнями P2RX7. Способ основан на подалении экспрессии одной или нескольких сплайсированных форм гена P2RX7. Подавление экспрессии может быть достигнуто использованием двухцепочечных фрагментов нуклеиновой кислоты, называемых siNA или малыми интерферирующими НК, которые направлены на создание препятствия для экспрессии либо одной, либо нескольких сплайсированных форм мРНК гена P2RX7. siNA предпочтительно представляют собой siRNA, хотя модифицированные нуклеиновые кислоты или подобные химически синтезированные молекулы также находятся в объеме этого изобретения.
Варианты осуществления изобретения относятся к фармацевтическим композициям для применения при лечении состояний, связанных с дегенерацией нейронов, и других заболеваний животных (включая человека), связанных с высокими уровнями P2RX7.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Конструирование siNA
Несмотря на то, что механизмы RNAi остаются неизвестными, стадии, необходимые для получения конкретных олигонуклеотидов dsRNA, понятны. Было показано, что дуплексные нити dsRNA длиной 21-26 нуклеотидов осуществляют интерференцию РНК наиболее эффективно. Правильный выбор гомологичного участка в гене также является важным. При намерении получить dsRNA для RNAi важными являются факторы, такие как расстояние от инициирующего кодона, содержание G/C и локализация димеров аденозина. Одним из следствий этого является то, что для наиболее эффективной RNAi может быть необходимым тестирование нескольких различных последовательностей, и это может дорого стоить.
В 1999 Tuschl et al. разгадали эффект подавления посредством siRNA, показав, что их эффективность является функцией длины дуплекса, длины 3'-выступающих концов и последовательности этих выступающих концов. Основываясь на этой исследовательской работе, Eurogentec дает рекомендации в отношении того, что участок мРНК-мишени и, таким образом, последовательность дуплекса siRNA следует выбирать с использованием следующих основных принципов.
Поскольку RNAi основана на базе комплексных взаимодействий белков, очевидно, что на мРНК-мишени должны отсутствовать не относящиеся к этим белкам связывающие факторы. В связи с этим, следует избегать использования как 5'-, так и 3'- нетранслируемых участков (UTR) и областей, расположенных близко к инициирующему кодону, поскольку на них может находиться много участков связывания регуляторных белков. Последовательность siRNA, таким образом, выбирают следующим образом:
- Выбирают участок в последовательности мРНК, расположенный на расстоянии от 50 до 100 нуклеотидов в 5' - 3' направлении от инициирующего кодона AUG или от стоп-кодона в обратном направлении.
- В этом участке осуществляют поиск следующих последовательностей: AA(N19), CA(N19).
- Вычисляют процентное содержание G/C для каждой идентифицированной последовательности. В идеальном варианте содержание G/C составляет 50%, хотя оно должно составлять менее 70% и более 30%.
- Предпочтительно отказываются от последовательностей, содержащих следующие повторы: AAA, CCC, GGG, TTT, AAAA, CCCC, GGGG, TTTT.
- Также в соответствии с вторичной структурой мРНК проводят предварительную оценку доступности.
- Также проводят сравнение в BLAST (т.е. в базе данных NCBI EST) с нуклеотидной последовательностью, наиболее подходящей по предшествующим критериям, для того, чтобы убедиться, что будет инактивирован только один ген.
В целях обеспечить максимальную интерпретацию результатов, при использовании siRNA должны быть выполнены следующие меры предосторожности:
- Необходимо всегда анализировать отдельные смысловую и антисмысловую нити в отдельных экспериментах.
- Необходимо предпринять попытку сделать перестановку в дуплексе siRNA. Состав нуклеотидов должен быть таким же, что и в анализируемой siRNA, но он должен быть лишен значительной гомологии последовательностей с любым другим геном (включая анализируемый).
- Если возможно, для контроля специфичности процесса подавления необходимо осуществить "нокдаун" того же гена двумя независимыми дуплексами siRNA.
Для разработки оптимальных олигонуклеотидов практически каждый из выбранных генов вводят в виде нуклеотидной последовательности для предварительной оценки в программу, которая учитывает все возможные варианты, описанные выше. Эта программа считывает любую нуклеотидную последовательность мРНК на наличие участков, доступных для направленного воздействия siRNA. Результатом этого анализа является шкала возможных олигонуклеотидов siRNA. Наивысший показатель в шкале используется для разработки двухцепочечных олигонуклеотидов РНК (как правило, длиной 21 п.о., хотя также возможна другая длина), которые, как правило, получают химическим синтезом.
В дополнение к siRNA также могут использоваться модифицированные нуклеотиды. Авторы настоящего изобретения планируют провести анализ нескольких химических модификаций, которые хорошо известны в данной области. Эти модификации предназначены для повышения стабильности или доступности siNA. Примеры пригодных модификаций описаны в публикациях, приведенных в качестве ссылок ниже, каждая из которых включена в данное описание в качестве ссылки.
Исследования показывают, что замещение 3'-концевых нуклеотидных выступающих сегментов 21-мерного дуплекса siRNA, обладающего двухнуклеотидными 3'-выступающими концами, на дезоксирибонуклеотиды не приводит к отрицательному влиянию на активность RNAi. Сообщалось, что допустимо замещение дезоксирибонуклеотидами вплоть до четырех нуклеотидов с каждого конца siRNA, в то время как полное замещение на дезоксирибонуклеотиды приводит к отсутствию активности RNAi (Elbashir 2001). Кроме того, Elbashir et al. также сообщили, что замещение siRNA на 2'-O-метилнуклеотиды полностью останавливает активность RNAi.
Могут использоваться нуклеозиды с модифицированной аффинностью, как описано в WO2005/044976. В этой публикации описаны олигонуклеотиды, содержащие нуклеозиды, модифицированные таким образом, что они обладают повышенной или сниженной аффинностью по отношению к комплементарным им нуклеотидам в мРНК-мишени и/или в комплементарной цепи siNA.
В GB2406568 описаны альтернативные модифицированные олигонуклеотиды, химически модифицированные для обеспечения повышенной устойчивости к деградации или повышенной проницаемости. Примеры таких модификаций включают фосфоротиоатные межнуклеотидые связи, 2'-O-метилрибонуклеотиды, 2'-дезоксифторрибонуклеотиды, 2'-дезоксирибонуклеотиды, нуклеотиды, являющиеся "универсальными основаниями", 5-C-метилнуклеотиды и встраивание инвертированных остатков дезоксиоснований.
В WO2004/029212 описаны олигонуклеотиды, модифицированные для усиления стабильности siRNA или для повышения эффективности направленного воздействия. Модификации включают образование химических поперечных связей между двумя комплементарными цепями siRNA и химическую модификацию 3'-конца цепи siRNA. Предпочтительные модификации представляют собой внутренние модификации, например модификации сахара, модификации нуклеиновых оснований и/или модификации остова. Описаны модифицированные 2'-фторрибонуклеотиды и 2'-дезоксирибонуклеотиды.
В WO2005/040537 дополнительно описаны модифицированные олигонуклеотиды, которые могут использоваться по этому изобретению. Помимо применения dsNA и модифицированных dsNA в соответствии с настоящим изобретением могут использоваться короткие NA в виде "шпилек" (shNA); две цепи молекулы siNA могут быть соединены линкером, который может представлять собой нуклеотидный линкер или ненуклеотидный линкер.
В дополнение к siNA, которые предпочтительно комплементарны участку-мишени, для направленного воздействия на гомологичные участки могут использоваться вырожденные последовательности siNA. В WO2005/045037 описано конструирование молекул siNA для направления воздействия на такие гомологичные последовательности, например посредством встраивания неканонических пар оснований, например некомплементарно спаренных оснований и/или пар оснований, обеспечивающих "качание", что может привести к получению дополнительных последовательностей-мишеней. В примерах, где идентифицированы некомплементарно спаренные основания, могут использоваться неканонические пары оснований (например, некомплементарно спаренные основания и/или основания, обеспечивающие "качание") для получения молекул siNA, которые воздействуют на последовательность более одного гена. В качестве неограничивающего примера, для получения молекул siNA, которые способны направлять воздействие на последовательности различных мишеней, которые обладают гомологией последовательностей, используют неканонические пары оснований, такие как пары оснований UU и CC. По существу, одним преимуществом использования siNA по этому изобретению является то, что может быть сконструирована единственная siNA, которая включает последовательность нуклеиновой кислоты, комплементарную нуклеотидной последовательности, которая является консервативной в гомологичных генах. В этом подходе для ингибирования экспрессии более чем одного гена может использоваться единственная siNA вместо использования более чем одной молекулы siNA для направленного воздействия на различные гены.
Предпочтительные молекулы siNA по этому изобретению являются двухцепочечными. Молекула siNA по этому изобретению может содержать тупые концы, то есть концы, которые не имеют каких-либо выступающих нуклеотидов. В одном варианте осуществления молекула siNA по этому изобретению может содержать один или несколько тупых концов. В предпочтительных вариантах осуществления молекулы siNA имеют 3'-выступающие концы. Молекулы siNA по этому изобретению могут содержать дуплексные молекулы нуклеиновых кислот с 3'-выступающими концами из n нуклеотидов (5≥n≥1). Elbashir (2001) показал, что 21-нуклеотидные дуплексы siRNA являются наиболее активными, если содержат 3'-концевые двухнуклеотидные выступающие концы.
Возможные олигонуклеотиды дополнительно отбирают по наличию межвидовой консервативности последовательностей в целях упрощения перехода от клинических испытаний на животных к клиническим испытаниям у человека. В предпочтительных вариантах осуществления этого изобретения используются консервативные олигонуклеотиды; это делает возможным применение единственной олигонуклеотидной последовательности в клинических испытаниях как на животных, так и на человеке.
Регистрационные номера GenBank, соответствующие транскриптам P2RX7, полученным альтернативным сплайсингом, представлены на фигуре 1.
Выбранные олигонуклеотидные последовательности, против которых направлена RNAi, представлены на фигуре 2. Представленные последовательности представляют собой последовательности ДНК, которые являются мишенями для siNA. Таким образом, по этому изобретению могут применяться дуплексы NA с последовательностями, комплиментарными указанным последовательностям ДНК.
Последовательности, представленные на фигуре 2, не являются ограничивающими. В действительности, ДНК-мишени необязательно должны предшествовать AA или CA. Кроме того, ДНК-мишень может содержать последовательности, представленные на фигуре 2, фланкированные любой смежной последовательностью.
Исследования in vitro
Получение дуплексов siRNA
РНК являются предпочтительно химически синтезированными с использованием соответствующим образом защищенных рибонуклеозидфосфорамидитов и общепринятого устройства для синтеза ДНК/РНК.
Замещение одной или обеих цепей дуплекса siRNA 2'-дезокси- или 2'-O-метил-олигорибонуклиотидами приводит к прекращению подавления в экстракте мух (Elbashir et al. 2001). Однако в клетках млекопитающих, по-видимому, является возможным замещение смысловой siRNA 2'-O-метилолигонуклеотидом (Ge et al. 2003).
Удобнее всего, чтобы siRNA были получены из коммерческих источников, осуществляющих синтез олигонуклеотидов РНК, которые продают продукты синтеза РНК различного качества и стоимости. Как правило, 21-нуклеотидные РНК не очень сложно синтезировать и легко обеспечить качество, пригодное для RNAi.
Поставщики реагентов для синтеза РНК включают Proligo (Гамбург, Германия), Dharmacon Research (Лафайет, CO, США), Glen Research (Стерлинг, VA, США), ChemGenes (Ашленд, MA, США) и Cruachem (Глазго, UK), Qiagen (Германия), Ambion (США) и Invitrogen (Шотландия). Указанные выше специализированные на синтезе РНК компании предоставляют siRNA с лицензией на тестирование мишеней. В частности, поставщиками siRNA авторов настоящего изобретения являются Ambion, Dharmacon и Invitrogen, компании, которые предлагают услуги по традиционному специализированному химическому синтезу siRNA, и предоставляют siRNA с очисткой ВЭЖХ и доставляют в сухой форме совместно с не содержащей РНКазу водой. Основные доступные через сеть источники методологии для RNAi и siRNA, совместно со ссылками на дополнительные связанные с siRNA продукты и услуги, могут быть найдены на сайте упомянутых выше поставщиков.
При работе с одноцепочечными молекулами РНК необходима стадия отжига. Необходимо, чтобы все стадии обработки проводились в стерильных условиях в отсутствие РНКазы. Для отжига РНК сначала необходимо количественно определить олигонуклеотиды по УФ-поглощению при 260 нанометрах (нм). Затем для отжига используют следующий протокол, основанный на Elbashir et al. (2001):
- Отдельно разделить на аликвоты и разбавить каждый олигонуклеотид РНК до концентрации 50 мкМ.
- Объединить 30 мкл каждого раствора олигонуклеотида РНК и 15 мкл 5X буфера для отжига. Конечная концентрация буфера составляет: 100 мМ ацетата калия, 30 мМ HEPES-KOH pH 7,4, 2 мМ ацетата магния. Конечный объем составляет 75 мкл.
- Инкубировать раствор в течение 1 минуты при 90°C, центрифугировать пробирку в течение 15 секунд, позволить отстояться в течение 1 часа при 37°C, затем использовать температуру окружающей среды. Раствор может храниться замороженным при -20°C и может быть заморожен и разморожен вплоть до 5 раз. Конечная концентрация дуплекса siRNA, как правило, составляет 20 мкМ.
Альтернативно уже отожженные dsRNA могут быть приобретены у поставщиков.
Также могут использоваться химически модифицированные нуклеиновые кислоты. Например, обзор типов модификации, которые могут использоваться, представлен в WO03/070744, содержание которого включено в данный документ в качестве ссылки. Особое внимание уделено страницам с 11 по 21 этой публикации. Другие возможные модификации представляют собой модификации, как описано выше. Квалифицированный специалист может знать другие типы химической модификации, которая может быть проведена для молекул РНК.
Система "in vitro"
Для проверки специфичности интерференции siRNA использовали как клеточные культуры, так и органотипические культуры, экспрессирующие ген-мишень.
Клетки, используемые для этих экспериментов, представляли собой мышечные клетки мышей, C2C12 и органотипические культуры срезов спинного мозга мышей. Уровень экспрессии P2RX7 анализировали после инкубации с соответствующими дуплексами siRNA. Для определения наличия связи "нокдауна" siRNA с конкретными фенотипами в культивируемых клетках необходимо показать уменьшение количества белка-мишени или по меньшей мере показать снижение количества мРНК-мишени.
Уровень мРНК гена-мишени может быть количественно определен с помощью количественной ПЦР с детекцией в реальном времени (qRT-PCR). Кроме того, уровень белка может быть определен множеством способов, хорошо известных в данной области, таких как вестерн-блоттинг анализ со специфичными антителами против различных мишеней, который делает возможным непосредственный мониторинг уменьшения количества белка-мишени.
Трансфекция дуплексов siRNA в клеточных культурах
Некоторыми примерами способов, хорошо известных в данной области, являются следующие: можно провести однократную трансфекцию дуплекса siRNA с использованием катионного липида, такого как реагент липофектамин 2000 (Invitrogen), и анализ на наличие подавления через 24, 48 и 72 часа после трансфекции.
Может быть выполнен типичный протокол трансфекции, как указано далее: для одной лунки 6-луночного планшета проводят трансфекцию с использованием 100 или 200 нМ siRNA в качестве конечной концентрации. В соответствии с протоколом для реагента липофектамина 2000, за сутки перед трансфекцией производят посев клеток в количестве 2-4·105 клеток на лунку в 3 мл пригодной среды для выращивания, содержащей DMEM, 10% сыворотки, антибиотики и глутамин, и инкубируют клетки при нормальных условиях для выращивания (37°C и 5% CO2). В день трансфекции степень смыкания монослоя клеток должна составлять 30-50%. 12,5 мкл 20 мкМ дуплекса siRNA (что соответствует конечной концентрации 100 нМ) или 25 мкл 20 мкМ дуплекса siRNA (что соответствует конечной концентрации 200 нМ) разбавляют в 250 мкл DMEM и перемешивают. Также 6 мкл липофектамина 2000 разбавляют в 250 мкл DMEM и перемешивают. Через 5 минут инкубации при комнатной температуре разбавленный олигомер (дуплекс siRNA) и разбавленный липофектамин объединяют, чтобы обеспечить формирование комплекса в течение 20 минут инкубации при комнатной температуре. Затем комплексы капельно добавляют в клетки с 2 мл свежей среды для выращивания с низким содержанием антибиотиков и осторожно перемешивают, качая планшет назад и вперед, для обеспечения однородного распределения комплексов для трансфекции. Клетки инкубируют при нормальных условиях для их выращивания и через сутки комплексы удаляют и добавляют свежую и полную среду для выращивания. Для мониторинга подавления генов клетки собирают через 24, 48 и 72 ч после трансфекции.
Эффективность трансфекции может зависеть от типа клеток, а также от количества пассажей и степени смыкания монослоя клеток. Также важными являются время и способ формирования комплексов siRNA-липосома (например, переворачивание по сравнению с интенсивным перемешиванием). Низкая эффективность трансфекции является наиболее частой причиной неуспешного подавления. Высокая трансфекция является непростой задачей и ее необходимо тщательно изучать для каждой новой клеточной линии, предназначенной для применения. Эффективность трансфекции может быть проанализирована с помощью трансфекции репортерных генов, например, управляемой CMV экспрессирующей EGFP плазмиды (