Модифицированные днк аптамеры, ингибирующие активность тромбина
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и медицины, а именно к прямым ингибиторам тромбина. Предложен модифицированный аптамерный олигодезоксирибонуклеотид общей формулы
d R-GTGACGTANGGTTGGTGTGGTTGGGGCGTCAC-R,
где d - дезоксирибоза (олигонуклеотид содержит дезоксирибозу во всех позициях), R - химические заместители, В качестве заместителей используют аминогексанол (NH2 группа), который этерифицирует фосфатную группу на 5′ или 3′ конце и PEG, который присоединяют по 5′ и/или 3′ концу. При этом как минимум один из присоединенных по 5′ или 3′ концу заместителей представляет собой полиэтиленгликоль (PEG). Предложенный модифицированный ДНК аптамер ингибируют активность тромбина в плазме крови человека, удлиняя тромбиновое время, протромбиновое время и АЧТВ, и ингибируют стимулируемую тромбином агрегацию тромбоцитов. При внутривенном введении экспериментальным животным он циркулирует в кровотоке дольше, чем базовый аптамер RE31. Данный ДНК-аптамер способен служить основой для лекарственных антитромботических препаратов. 6 ил.
Реферат
Изобретение относится к области биотехнологии и медицины, а именно к модифицированным ДНК аптамерам, представляющим собой олигодезоксирибонуклеотиды (базовые аптамеры), конъюгированные с химическими заместителями, и обладающие антикоагулянтными свойствами, и более конкретно к прямым ингибиторам тромбина, которые могут служить основой для лекарственных антитромботических препаратов.
Для лечения и профилактики тромбозов, применяются препараты, которые либо растворяют уже образовавшийся тромб, либо препятствуют процессу тромбообразования (Машковский М.Д. Лекарственные средства, М., Медицина, 2000, т.2, стр.73-76; Энциклопедия лекарств, изд. 8, М., РЛС, 2001, стр.1503, Справочник ВИДАЛЬ, М., АстраФармСервис, 2001, стр.725).
По механизму действия все известные препараты разбиты на три группы.
- Тромболитики, действие которых направлено на активацию фибринолитической системы крови и растворение тромба (стрептокиназа, урокиназа, тканевой активатор плазминогена).
- Антиагреганты, действие которых направлено на ингибирование агрегации тромбоцитов (аспирин, антагонисты P2Y12 рецепторов АДФ клопидогрель и др.), антагонисты гликопротеинов IIb-IIIa).
- Антикоагулянты - препараты, действующие на свертывающую систему крови и ингибирующие образование фибрина (гепарин и его производные, непрямые антикоагулянты, прямые ингибиторы тромбина).
То, что препараты действуют на разные системы тромбообразования, дает возможность их комбинированного применения, что повышает эффективность и специфичность терапии.
Тромбин играет ключевую роль в процессах внутрисосудистого тромбообразования. Эта протеиназа участвует как в реакциях коагуляции крови, так и в активации тромбоцитов. Наиболее известная реакция тромбина - это отщепление фибринопептидов А и В с образованием мономеров дезААВВ-фибрина, которые затем агрегируют, сшиваются и переходят в нерастворимое состояние. В процессе свертывания крови тромбин не только вызывает образование фибрина из фибриногена, но и активирует многие факторы коагуляционного каскада. Другая важная функция тромбина - индукция активации и агрегации тромбоцитов, реакции запускающей образование тромбов в сосудах артериального русла. Эта функция осуществляется путем взаимодействия тромбина со специфическими PAR рецепторами (protease activated receptors, рецепторы, активируемые протеазами). Тромбин отщепляет N-концевой пептид рецептора, а появляющийся новый N-концевой фрагмент взаимодействует со специальным внеклеточным участком рецептора, что и приводит к инициации активирующего сигнала. В реакциях гидролиза высокомолекулярных субстратов принимают участие, как минимум, два участка молекулы тромбина - активный центр фермента и область специфичного «узнавания» субстрата, связывание с которой ориентирует субстрат относительно активного центра. Высокоаффинное и специфичное связывание двух упомянутых выше субстратов тромбина - фибриногена и PAR рецептора осуществляется через участок, получивший название экзосайт I. Учитывая ключевую роль тромбина в основных тромботических реакциях - образовании фибрина и активации тромбоцитов, очевидно, что ингибирование активности тромбина представляет собой один из наиболее перспективных и эффективных путей профилактики и терапии тромбозов. [Lane D.A., Philippou H., Huntington J.A. Blood 2005, v.106, pp.2605-2612].
Традиционным антикоагулянтным препаратом, ингибирующим реакции тромбина является гепарин и его производные. Гепарин подавляет активность тромбина не напрямую - механизм его действия основан на активации антитромбина III, главного эндогенного ингибитора тромбина. Кроме того, гепарин способен связывать не только антитромбин, но и многие другие белки плазмы крови и клеток сосудистого русла. Последние обстоятельства определяют негативные побочные эффекты применения гепарина, например тромбоцитопению. Недостатков гепарина лишены прямые ингибиторы тромбина, такие как полипептид гирудин и его производные (бивалирудин) и некоторые низкомолекулярные синтетические ингибиторы (аргатробан, дабигатран), которые подавляют активность тромбина, действуя непосредственно на сам фермент. Гирудин и его производные взаимодействуют как с активным центром, так и с участком связывания субстратов (экзосайт 1), а низкомолекулярные ингибиторы - только с активным центром. Также, в отличие от гепарина, эти соединения не взаимодействуют с другими (кроме тромбина) плазменными и клеточными белками, и не вызывают развития такого нежелательного побочного эффекта, как тромбоцитопения. (Di Nisio M., Middeldorp S., Buller H.R. New Eng. J. Med. 2005, v.353, pp.1028-1040].
Известны пептиды Gly-Pro, Trp-Pro, Pro-Gly, Gly-Pro-Gly-Gly и Pro-Gly-Pro, обладающие антикоагулянтной и фибринолитической активностью (В.Е.Пасторова, Л.Я.Ляпина, Т.Ю.Смолина, И.П.Ашмарин. Антикоагулянтные и фибринолитические эффекты некоторых пролинсодержащих пептидов. Известия АН. Серия биологическая. 1998. №3, с.390-394).
Однако все эти пептиды не обладают антитромбоцитарной и антитромботической активностью.
Известны пептиды Pro-Gly и Pro-Gly-Pro, обладающие антитромбоцитарной активностью (В.Е.Пасторова, Л.Я.Ляпина, И.П.Ашмарин, Р.У.Островская, Т.А.Гудашева, Э.В.Луговской. Фибриндеполимеризационная активность и антитромбоцитарный эффект циклического и линейных коротких пролинсодержащих пептидов. Известия АН. Серия биологическая, 2001, №5, с.593-596).
Однако данные известные пептиды обладают слабым антикоагулянтным действием.
В качестве прямых ингибиторов тромбина могут быть использованы и аптамеры - ДНК или РНК олигонуклеотиды, способные к высокоспецифичному связыванию и ингибированию активности молекул-мишеней.
Подобно антителам молекулы ДНК способны допускать различные трехмерные структуры в зависимости от их последовательности. Некоторые из них могут иметь значение для связывания с мишенью. Такими мишенями могут служить как небольшие лиганды, так и крупные белковые комплексы. Аптамеры отбираются с помощью метода SELEX по связыванию с выбранной мишенью. (Systematic evolution of ligands by exponential enrichment) (Систематическое развитие лигандов посредством экспоненциального обогащения) для отбора и идентификации молекул одноцепочечных молекул ДНК или РНК, называемых аптамерами.
При необходимости проводится направленный дизайн и/или модификация отобранного аптамера. По своему сродству по отношению к молекуле мишени аптамеры сравнимы с антителами. Однако в отличие от антител, и других соединений, имеющих пептидную структуру (например, гирудин и его производные), олигонуклеотидные аптамеры являются неиммуногенными соединениями.
Технология аптамеров объединяет генерирование огромного структурного разнообразия в случайных пулах олигонуклеотидов с мощностью полимеразной цепной реакции (ПЦР) для амплификации отобранных последовательностей. Эта технология включает в себя скрининг большого пула со случайными последовательностями олигонуклеотидов и основана на том факте, что они допускают большое количество третичных структур, некоторые из которых могут обладать желаемой связывающей или каталитической активностью против молекул - мишеней. Хотя ингибирование не является необходимым для этого отбора, во многих случаях эти лиганды непосредственно ингибируют биологические функции белков-мишеней. В этих случаях ингибиторные функции этих лигандов предположительно обусловлены перекрыванием их сайтов с функциональным районом белков.
В последние годы аптамеры рассматривают как потенциальные фармакологические субстанции, которые могут быть использованы для разработки лекарственных препаратов. [Кульбачинский А.В. Успехи биол. химии. 2006. Т.246. С.193-224; Lee J.F., Stovall G.M., Ellington A.D. Curr. Opin. Chem. Biol. 2006, v.10, pp.282-289]. Одно из направлений, связанное с возможностью фармакологического использования аптамеров - это создание на их основе антитромботического препарата - прямого ингибитора тромбина [Спиридонова В.А., Рог Е.В., Дугина Т.Н. Струкова СМ., Копылов A.M. Биоорг. Химия. 2003. Т.29, №5. С.495-498]
Для тромбина получены аптамерные ДНК, свойства которых описаны, например, в ряде публикаций, приведенных ниже:
Bock L.C., Griffin L.C., Latham J.A., Vermaas E.H., Toole J.J. Nature 1992. v.355. p.564-566]
Macaya R.F., Gao H., Joesten M.E., Yang M., Patel R., Bertelsen A.H., Cook A.F. Biochemistry, 1995, v.34, p.4478-92.
Tasset D.M., Kubik M.F., Steiner W.J. Mol.Biol, 1997, v.272, p.688-698.
Kubik M.F., Stephens A.W., Schneider D., Marlar R.A., Tasset D. Nucleic Acid Res. 1994, v.22, p.2619-2626.
Ikebukuro К., Okumura Y., Sumikura K., Karube I., Nucleic Acid Res. 2003, RS 3, p.205-206.
Ikebukuro K, Okumura Y, Sumikura K, Karube I, Nucleic Acid Res. 2005, v.33, N12, e108.
Ikebukuro K., Yoshida W., NomaT., Sode K. Biotechnol Lett. 2006, v. 28, p.1933-1937.
Pagano В., Martino L., Randazzo A., Giancola С.Biophys. J. 2008 v.94, p.562-569.
Griffin L.C., Tidmarsh G.F., Bock L.C., Toole J.J., Leung L.L.K. Blood 1993, v.12, p.3271-3276.
Li W-X., Kaplan A.V., Grant G.W., Toole J.J., Leung L.L. Blood 1994, v.3, p.677-682.
Reyderman L., Stavchansky S. Pharmaceutical research 1998, v.15, p.904-910.
Shaw J.P., Fishback J.A., Cundy K.C., Lee W.A. Pharmaceutical research 1995, v.12, p.1937-1942.
Lee W.A., Fishback J.A., Shaw J.P., Bock L.C., Griffin L.C., Cundy K.C. Pharmaceutical research 1995, v.12, p.1943-1947.
Добровольский А.Б., Титаева Е.В., Хаспекова С.Г., Спиридонова В.А., Копылов A.M., Мазуров А.В. Бюлл. Эксп. Биол. Мед. 2009. Т.147, №7. С.41-45.
В частности, в RU 2360000, 27.06.2009 описаны новые катепсин G-ингибирующие аптамеры, которые являются одно- или двухцепочечными линейными ДНК-последовательностями или полинуклеотидными последовательностями, характеризующимися тем, что они имеют длину цепи по меньшей мере 60 нуклеотидов, предпочтительно 70 нуклеотидов и по существу не подвергаются межмолекулярному и/или внутримолекулярному спариванию.
Эти ДНК-последовательности могут иметь длину цепи 70-120 нуклеотидов, предпочтительно 70-110 нуклеотидов, даже более предпочтительно 80-100 нуклеотидов. Хотя последовательности могут быть одно- или двухцепочечными, предпочтительными являются одноцепочечные последовательности. Последовательности характеризуются также предпочтительно тем, что они имеют молярное содержание гуанина приблизительно 25-50%, предпочтительно 35-45% и/или имеют молярное отношение AG/TC приблизительно 1,0-2,0, предпочтительно 1,2-1,8 (для целей данного изобретения AG обозначает общее число нуклеотидов А и G этой последовательности, тогда как ТС обозначает общее число нуклеотидов Т и С этой последовательности).
Предпочтительными вариантами являются:
олигомеры (GT)n или (АС)n, в которых n находится в диапазоне 35-60, предпочтительно 40-50;
гомополимеры (Т)n, или (G)n, или (А)n, или (С)n, или (инозин)n, в которых n находится в диапазоне 70-120, предпочтительно 80-100.
Эти аптамеры селективно и эффективно ингибируют катепсин G, и, следовательно, они могут быть использованы в приготовлении лекарственного средства для лечения и профилактики воспалительных заболеваний, прокоагулянтных состояний, генетических заболеваний, дегенеративных заболеваний, повреждений ДНК, неоплазии и/или кожных заболеваний.
Ранее авторами заявленного изобретения был разработан оригинальный 31-звенный ДНК аптамер, получивший кодовое название RE31 и имеющий последовательность GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC. Этот аптамер не уступает по своей способности ингибировать активность тромбина, также 31-звенному аптамеру 31ТВА (ТВА - thrombin binding aptamer) с последовательностью CACTGGTAGGTTGGTGTGGTTGGGGCCAGTG, одному из наиболее высокоэффективных из ранее описанных антитромбиновых аптамеров. [Спиридонова В.А., Головин А.В., Копылов A.M., Добровольский А.Б., Мазуров А.В. Заявка на патент РФ №2008149583 от 17 декабря 2008 г.].
Однако известно, что немодифицированные аптамеры, и, в том числе ДНК аптамеры против тромбина, характеризуются очень коротким (не более нескольких минут) временем жизни в кровотоке [Griffin L.C., Tidmarsh G.F., Bock L.C., Toole J.J., Leung L.L.K. Blood 1993, v.12, p.3271-3276]. Это свойство может препятствовать созданию на их основе эффективных лекарственных препаратов. В связи с этим для удлинения времени жизни in vivo базовые олигонуклеотидные последовательности могут подвергаться химическим модификациям. Эти модификации, во-первых, защищают аптамеры от действия нуклеаз, а, во-вторых, замедляют их выведение через почки. Известны модифицированные аптамеры с потенциальными антитромботическими свойствами, направленные против фактора Виллебранда [Gilbert J.C., De Feo-Fraulini Т., Hutabarat R.M., Horvath C.J., Merlino P.C., Marsh H.N. et al. Circulation 2007, v. 116, pp.2678-2686] и фактора IX [Dyke C.K., Steinhubl S.R., Kleiman N.S., Cannon R.O., Aberle L.G., Lin M., et al. Circulation 2006, v.114, pp.2490-2497].
Технической задачей настоящего изобретения является модификация антитромбинового ДНК аптамера RE31 с целью удлинения времени его жизни в кровотоке без существенного снижения способности ингибировать реакции тромбина.
Поставленная техническая задача достигнута модифицированным аптамерным олигонуклеотидом, представляющим собой олигодезоксирибонуклеотид ДНК-аптамер, характеризующийся нуклеотидной последовательностью
GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC и конъюгированный по 5′ или 3′ концу с NH2 группой этерификацией аминогексанолом фосфатной группы на 5′ или 3′ конце и/или с полиэтиленгликолем PEG, присоединенным по 5′ и/или 3′ концу, при этом как минимум один из присоединенных по 5′ и 3′ концу заместителей представляет собой полиэтиленгликоль (PEG), и отвечающий общей формуле
d R-GTGACGTANGGTTGGTGTGGTTGGGGCGTCAC-R,
где d - дезоксирибоза, при этом олигонуклеотид содержит дезоксирибозу во всех позициях, R - химические заместители - NH2 группа и/или полиэтиленгликоль (PEG).
Итак, задача достигается присоединением по 5′ и 3′ концам базового олигонуклеотидного аптамера RE31 с последовательностью GTGACGTANGGTTGGTGTGGTTGGGGCGTCAC аминогексанола (NH2 группы) или полиэтиленгликоля (PEG).
Таким образом, общая формула модифицированных ДНК аптамеров по изобретению может быть представлена как:
где d - дезоксирибоза (олигонуклеотид содержит дезоксирибозу во всех позициях), R - химичекие заместители. В качестве заместителей (модифицирующих агентов) R используют аминогексанол, который этерифицирует фосфатную группу на 5′ или 3′ конце и PEG, при этом как минимум один из присоединенных по 5′ и 3′ концу заместителей представляет собой полиэтиленгликоль (PEG).
На основании формулы (1) было создано 3 модифицированных аптамера с кодовыми названиями NH2-RE-PEG, PEG-RE-NH2 и PEG-RE-PEG. В аптамере NH2-RE-PEG произведено введение NH2 группы по 5′ и PEG по 3′ концам олигонуклеотида, в аптамере PEG-RE-NH2 - введение PEG по 5′ и NH2 по 3′ концам олигонуклеотида, и в аптамере PEG-RE-PEG - введение PEG по обоим концам олигонуклеотида.
Все 3 аптамера по изобретению:
- ингибируют активность тромбина в плазме крови человека, удлиняя АЧТВ, протромбиновое и тромбиновое время, в концентрациях, сравнимых с базовым аптамером RE31;
- ингибируют стимулируемую тромбином агрегацию тромбоцитов, опосредуемую связыванием тромбина с PAR рецепторами тромбоцитов в концентрациях сравнимых с базовым аптамером RE31;
- при внутривенном введении экспериментальным животным циркулируют в кровотоке дольше, чем базовый аптамер RE31.
Получают модифицированные ДНК-аптамеры по изобретению следующим образом.
Базовую олигонуклеотидную последовательность аптамера RE31 синтезируют на автоматическом синтезаторе Applied BioSystems 380b с использованием стандартных производных (синтонов) нуклеотидов, как подробно описано в приложении А к научно-техническому отчету по этапу 1.
После окончания синтеза основной олигонуклеотидной последовательности на 5′-конец вводится нужная модификация. Сначала вводят гликольную группировку, которая фосфорилирована по концевой гидроксильной группе. На 5′-концевой остаток фосфора присоединяют аминогексанол, так что концевой становится алифатическая аминогруппа.
Введение аминогруппы на 3′-конец проводят по аналогичной схеме - после снятия олигонуклеотида с полимерного носителя фосфитного эфира окисляют до фосфатного производного и присоединяют к нему гексанол, который образует эфир с пятивалентным концевым фосфорным остатком, а аминогруппа остается экспонированной в раствор. Масштаб синтеза составлял 0,1-0,2 мкмоля/г.
При введении полиэтиленгликоля нуклеотид, закрепленный на стекле, этерифицируют полиэтиленгликолем (PEG), затем фосфорилируют для дальнейших работ. При введении полиэтиленгликоля на 3′- конец используют спейсеры - небольшие по длине олигонуклеотидные последовательности, которые позволяют придать гибкость полимерной цепочке и дают возможность далее присоединять протяженные гликольные звенья нужной длины.
Отщепление олигодезоксирибонуклеотида с полимерного носителя и снятие защитных групп проводят слудующим образом. Полимер из колонки помещают в пробирку на 1,5 мл, заливают 0,5 мл конц. NH3 и инкубируют при комнатной температуре 1,5-2,0 часа. Осадок собирали центрифугированием, промывали 0,3 мл конц. NH3, супернатанты объединяли и выдерживали при 55° 10-12 часов. После охлаждения раствора аммиак упаривают и остаток растворяют в 1 мл дистиллированной воды.
Анализ реакционной смеси проводят на хроматографе Tracor, колонка 4×250 мм с обращенно-фазовым сорбентом Диасорб С16Т с размером пор 7 мкм. Колонку предварительно уравновешивают буфером: 48 мМ фосфат калия (рН=7,0), 2 мМ дигидрофосфат тетрабутиламмония, 5% ацетонитрил, при 45° и скорости потока 1 мл/мин. Измерения проводят при 260 нм, вещество вводят шприцем в объеме 2,5 мкл. На хроматограмме реакционной смеси, кроме целевого олигонуклеотида, как правило, видны более короткие продукты. Их образование связано с невозможностью полного проведения конденсации, со 100% выходом. Препаративное разделение реакционной смеси проводят обращенно-фазовой хроматографией. Носитель тот же, который используется в первом случае. Как правило, объем реакционной смеси составляет 0,5-1,0 мл. Вещество элюируется в следующем диапазоне (50-80%) буфера 48 мМ фосфат калия (рН=7,0), 2 мМ дигидрофосфат тетрабутиламмония, 40% ацетонитрил. Собранное вещество многократно упаривают при добавлении 1 мл 50% раствора метанола в воде для удаления следов аммония. Удаление 5′-О-диметокситритильной защиты проводят в 1,5 мл 80% уксусной кислоты, 30 мин при комнатной температуре. Для удаления уксусной кислоты раствор многократно упаривают на роторном испарителе, добавляя каждый раз 1,5 мл 50% раствора метанола в воде. Полученный продукт растворяют в 1 мл воды. Для определения количества полученного олигонуклеотида по окончании разделения проводили обработку хроматограмм, интегрируя площадь пиков и рассчитывали концентрацию целевого продукта по формуле S×4×10-6.
Нижеследующие примеры иллюстрируют свойства модифицированных ДНК-аптамеров, как прямых ингибиторов тромбина с удлиненным временем жизни в кровотоке, и их применение (использование), но не ограничивают их.
Пример 1. Ингибирование модифицированными аптамерами коагуляционных реакций тромбина. Сравнение с базовым, немодифицированным аптамером RE31.
Анализ влияния модифицированных аптамеров (NH2-RE-PEG, PEG-RE-NH2 и PEG-RE-PEG) на свертывание крови включал исследование 3-х показателей: тромбинового времени, протромбинового времени и активированного частичного тромбопластинового времени (АЧТВ). Исследования проводили в сравнении с базовым аптамером RE31.
В тесте «тромбиновое время» определяли действие аптамеров на образование фибрина, катализируемое экзогенным тромбином. В кювету коагулометра вносили 0,1 мл раствора аптамеров в 25 мМ HEPES буфере (рН 7,4), содержащем 150 мМ NaCl и 5 мМ KCl и 0.1 мл цитратной плазмы человека. После инкубирования в течение 2 мин при 37°С реакцию стартовали добавлением 0,1 мл раствора тромбина человека с концентрацией 6 ед/мл (удельная активность 4400 ед/мл). Регистрировали время образования сгустка.
Из фиг.1 видно, что все три модифицированных аптамера в концентрациях до 0,38 мкМ существенно (более чем в 8-10 раз) удлиняют время образования фибрина после добавления экзогенного тромбина к человеческой плазме. По способности ингибировать действие экзогенного тромбина они уступают базовому аптамеру RE31, в среднем приблизительно в 1,5 раза в соответствии с концентрациями, при которых достигаются одинаковые эффекты на время свертывания плазмы.
На фиг.1 показано влияние модифицированных аптамеров и базового аптамера RE31 на тромбиновое время. Представлены результаты одного из 3 воспроизводимых экспериментов
В двух следующих сериях экспериментов изучали влияние аптамеров на образование фибринового сгустка, катализируемое эндогенным тромбином при активации свертывания по «внешнему» (протромбиновое время) и «внутреннему» пути (АЧТВ). Влияние аптамеров на протромбиновое время исследовали следующим образом. В кювету коагулометра вносили 20 мкл раствора аптамера в 25 мМ HEPES буфере (рН 7,4), содержащем 150 мМ NaCl и 5 мМ KCl, затем 100 мкл нормальной цитратной плазмы человека. После инкубации в течение 2 мин при 37° реакцию стартовали добавлением 100 мкл Са-тромбопластина ("STA Neoplastin Plus" производства "Diagnostica Stago"). Влияние аптамеров на АЧТВ исследовали следующим образом. В кювету коагулометра вносили 20 мкл раствора аптамера в 25 мМ HEPES буфере (рН 7,4), содержащем 150 мМ NaCl и 5 мМ КС1, затем 100 мкл нормальной цитратной плазмы человека. Инкубировали в течение 2 мин при 37°, добавляли 100 мкл реактива "STA АРТТ" и через 3 мин реакцию стартовали добавлением 100 мкл 25 мМ CaCl2. В обоих тестах регистрировали время образования сгустка.
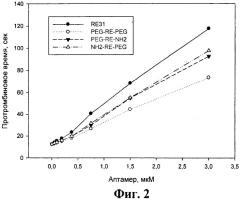
На фиг.2 показано влияние модифицированных аптамеров и базового аптамера RE31 на протромбиновое время.
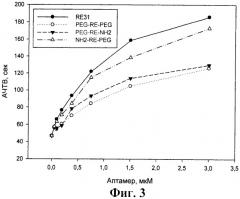
На фиг.3 показано влияние модифицированных аптамеров и базового аптамера RE31 на АЧТВ. Представлены результаты одного из 3 воспроизводимых экспериментов.
Из фиг.2 и 3 видно, что в обоих случаях все три модифицированных аптамера в концентрациях до 3 мкМ существенно удлиняли времена свертывания крови - протромбиновое время не менее чем в 5 раз, а АЧТВ приблизительно в 3-4 раза. Концентрации модифицированных аптамеров, при которых достигались эффекты, сходные с базовым аптамером RE31, были выше в обоих тестах - в тесте протромбиновое время не более чем в 2 раза, а тесте АЧТВ в 1,5-4 раза для разных аптамеров.
Можно отметить, что во всех 3 коагуляционных тестах наибольшую ингибирующую активность среди модифицированных аптамеров проявлял аптамер NH2-RE-PEG. Для этого аптамера различия в одинаково эффективных концентрациях по сравнению с базовым аптамером RE31 не превышали 50%.
Пример 2. Ингибирование модифицированными аптамерами тромбин-индуцированной агрегации тромбоцитов. Сравнение с базовым, немодифицированным аптамером RE31.
Влияние модифицированных аптамеров (NH2-RE-PEG, PEG-RE-NH2 и PEG-RE-PEG) на тромбин-индуцированную агрегацию тромбоцитов, исследовали в сравнении с базовым аптамером RE31.
Отмытые тромбоциты получали из крови здоровых доноров в соответствии с ранее описанным методом [Mazurov A.V., D.V.Vinogradov, N.V.Kabaeva, G.N. Antonova, Yu.A.Romanov, T.N.Vlasik, et al. Thromb. Haemost, 1991, v.66, pp.494-499]. Отмытые тромбоциты суспендировали в растворе Тироде/Hepes (137 мМ NaCl, 2,7 мМ KCl, 0,36 мМ NaH2PO4, 0,1% декстрозы, 1 мМ MgCl2, 0,35% БСА, 5 мМ Hepes, рН 7,35) в концентрации 3×108 на 1 мл. После ресуспендирования к отмытым тромбоцитам добавляли CaCl2 в конечной концентрации 1 мМ. Агрегацию тромбоцитов изучали в агрегометре БИОЛА. В кювету агрегометра добавляли по 300 мкл суспензии отмытых тромбоцитов и регистрировали агрегацию по изменению светопропускания суспензии (Т, %) при 37° и перемешивании со скоростью 800 об/мин. Для стимуляции агрегации использовали тромбин человека в конечной концентрации 0,25 ед/мл (удельная активность 4400 ед/мг). Аптамеры добавляли в агрегационную кювету не менее чем за 2 мин до добавления тромбина, а тромбин (0,1 ед/мл) через 30 с после начала регистрации светопропускания.
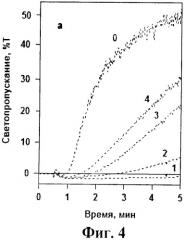
На фиг.4 и 5 представлены кривые тромбин-индуцированной агрегации тромбоцитов в отсутствие и присутствии исследованных аптамеров. Видно, что в концентрации 0,01 мкМ все три модифицированных аптамера в той или иной степени подавляли тромбин-индуцированную агрегацию. При этом максимальный эффект достигался в присутствии NH2-RE-PEG, который ингибировал агреагцию практически также, как и исходный немодифициованный аптамер RE31. (фиг.4). При увеличении концентрации модифицированных аптамеров до 0,02-0,025 мкМ все они полностью подавляли тромбин-индуцированную агрегацию. На фиг.5 в качестве примера представлены кривые агрегации при добавлении различных концентраций наименее эффективного аптамера PEG-RE-PEG.
На фиг.4 и 5 показано влияние модифицированных аптамеров и базового аптамера RE31 на тромбин-индуцированную агрегацию тромбоцитов. Фиг.4. К тромбоцитам не добавляли аптамеров (кривая 0) или добавляли аптамеры RE31 (кривая 1), NH2-RE-PEG (кривая 2), PEG-RE-NH2 (кривая 3), PEG-RE-PEG (кривая 4) в концентрации 0,01 мкМ. Фиг.5. К тромбоцитам не добавляли аптамеров (кривая 0) или добавляли аптамер PEG-RE-PEG в концентрациях 0,025, 0,02, 0,015 и 0,01 мкМ (кривые 1-4 соответственно). На обоих чертежах представлены результаты одного из 3 воспроизводимых экспериментов.
Несмотря на существенный (иногда в несколько раз) разброс абсолютных значений концентраций аптамеров, при которых наблюдалось полное ингибирование агрегации в различных экспериментах, соотношение между эффектами изучаемых аптамеров сохранялось неизменным. По своей ингибирующей активности NH2-RE-PEG незначительно уступал базовому аптамеру RE31, но несколько превосходил 2 других модифицированных аптамера - PEG-RE-NH2 и PEG-RE-PEG (см. фиг.4).
Пример 3. Выведение модифицированных аптамеров из кровотока крысы. Сравнение с базовым, немодифицированным аптамером RE31.
Определяли скорость выведения модифицированных аптамеров (NH2-RE-PEG, PEG-RE-NH2 и PEG-RE-PEG) из кровотока крысы после их внутривенного введения в сравнении с базовым аптамером RE31. Присутствие аптамеров в кровотоке регистрировали по их способности ингибировать действие тромбина на свертывание крови в тесте тромбиновое время.
Крысам линии Wistar (вес от 350 до 500 г) через установленный в предсердие катетер внутривенно вводили аптамеры в дозе 60 мкг на 100 г веса. Кровь отбирали до и затем через 5, 15, 30 и 60 мин после введения аптамеров. В качестве антикоагулянта использовали 0,11 М цитрат натрия в соотношении кровь:антикоагулянт 1:9. Объем крови в каждой пробе - 1 мл. Кровь центрифугировали при 10000 g в течение 5 мин и затем отбирали плазму. Плазму крысы смешивали со стандартной плазмой человека в соотношении 1:3 и измеряли тромбиновое время, стимулируя свертывание раствором тромбина человека с активностью 3 ед/мл. (Разведение крысиной плазмы проводили с целью стандартизации условий измерения). За 100% принимали время образования сгустка в пробах, отобранных до введения аптамеров.
На фиг.6 показано выведение аптамеров из кровотока крысы. Крысам вводили указанные аптамеры и отбирали кровь до и через указанные промежутки времени после введения аптамеров. Плазму крысы смешивали со стандартной плазмой человека в соотношении 1:3 и определяли в полученной смеси тромбиновое время. Представлены средние значения из 3 экспериментов.
Как видно из фиг.6 эффекты немодифицированного базового аптамера RE31 на тромбиновое время удается регистрировать лишь через 5 минут после введения в кровоток крысе, а через 15 мин тромбиновое время уже не отличалось от контрольного (до введения аптамера). При введении всех модифицированных аптамеров удлинение тромбинового времени через 5 минут было более выражено, чем при введении аптамера RE31 - в 2-2,5 раза по сравнению с 60-70% соответственно. В отличие от RE31 все модифицированные аптамеры сохраняли свое действие через 15 мин и 30 мин после введения (удлинение тромбинового времени на 40-60% и 15-40% соответственно) и лишь через 60 мин показатели сравнивались с контрольным уровнем. Наиболее выраженные эффекты через 15 и 30 минут были зарегистрированы для аптамера NH2-RE-PEG.
Необходимо отметить, что более длительное действия модифицированных аптамеров на тромбиновое время отмечалось, несмотря на то, что в условиях in vitro степень ингибирования ими активности тромбина была несколько ниже по сравнению с базовым аптамером RE31 (см. пример 1). Полученные результаты указывают на то, что проведенные модификации позволили существенно - не менее чем в 3-5 раз (для разных вариантов модификации) увеличить время жизни аптамеров в кровотоке in vivo.
Модифицированный аптамерный олигонуклеотид, обладающий способностью ингибировать реакции тромбина с увеличенным временем жизни в кровотоке, представляющий собой олигодезоксирибонуклеотид ДНК - аптамер, характеризующийся нуклеотидной последовательностью GTGACGTAGGTTGGTGTGGTTGGGGCGTCACи конъюгированный по 5′ или 3′ концу с NH2 группой этерификацией аминогексанолом фосфатной группы на 5′ или 3′ конце и/или с полиэтиленгликолем (PEG), присоединенным по 5′ и/или 3′ концу, при этом как минимум один из присоединенных по 5′ или 3′ концу заместителей представляет собой полиэтиленгликоль (PEG), и отвечающий общей формулеd R-GTGACGTANGGTTGGTGTGGTTGGGGCGTCAC-R,где d - дезоксирибоза, при этом олигонуклеотид содержит дезоксирибозу во всех позициях, R - химические заместители - NH2 группа и/или полиэтиленгликоль (PEG).