Новое применение рекомбинанта аденовируса р53 для лечения раковых пациентов
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и здравоохранения. Рекомбинант аденовируса р53 способен снизить побочные эффекты типа побочных эффектов, вызванных противоопухолевой химиотерапией и радиотерапией. У раковых пациентов рекомбинант аденовируса р53 способен восстановить деятельность органов, включая анализ крови, функцию печени, функцию почек и т.д., в целях улучшения качества жизни пациентов, например улучшение аппетита, улучшение ментального статуса и им подобные. Изобретение может быть использовано в медицине. 2 н. и 17 з.п. ф-лы, 7 ил., 4 табл.
Реферат
Область применения настоящего изобретения
Настоящее изобретение касается способов улучшения качества жизни субъектов, страдающих раковыми заболеваниями, а также снижения побочных эффектов, вызванных противоопухолевой терапией, типа химиотерапии, радиотерапии, и других видов терапии, воздействиям которых подвергают указанных субъектов.
Предпосылки настоящего изобретения
Рак является основной причиной смертности животных и людей. Стандартные типы современного противоопухолевого лечения включают хирургию, радиотерапию и химиотерапию. Несмотря на успехи в области лечения рака каждый из способов лечения имеет серьезные побочные эффекты. Например, хирургия уродует пациента или нарушает нормальное функционирование организма. Химиотерапия или радиотерапия могут вызвать у пациента симптомы, ослабляющие его, например тошноту, диарею, гиперчувствительность к свету, выпадение волос и т.д. Побочные действия этих цитотоксичных соединений часто ограничивают частоту и дозировку, в которой их можно применять.
В биохимических и физиологических анализах индикаторами этих побочных эффектов могут быть лейкоциты, гемоглобин, аспартат-аминотрансфераза, аланинаминотрансфераза. Результаты этих анализов показывают, что биохимические и физиологические параметры пациентов, получавших химиотерапию и радиотерапию, достигают нижней границы аналогичных параметров для контрольных пациентов, не получавших противоопухолевой терапии. Часто раковые пациенты сильно страдают от побочных эффектов химиотерапии или радиационной терапии. В некоторых случаях боль и страдания пациента вызваны этими побочными эффектами даже в большей степени, чем собственно раковым заболеванием.
В настоящее время делались многочисленные попытки снижения серьезных побочных эффектов противоопухолевого лечения.
Патент США №6,479,500 раскрывает структуру и эффективность химического средства, которое может снизить побочные действия, вызванные противоопухолевым агентом.
Патент США №5,017,371 описывает применение интерферона для снижения побочных токсических эффектов, связанных с радиационной терапией или химиотерапией.
В патенте США №6,462,017 описываются способы снижения тяжести побочных эффектов у раковых больных путем использования при химиотерапии α-тимозина. Таким образом, очевидно, что существует большая необходимость разработки новых и эффективных способов снижения побочных эффектов противоопухолевого лечения в целях улучшения качества жизни раковых больных и помощи им выдерживать полный курс химиотерапии или радиационной терапии.
Краткое содержание настоящего изобретения
Согласно настоящему изобретению способ введения эффективного количества рекомбинанта аденовируса р53 в сочетании с традиционным противоопухолевым лечением способен эффективно снизить побочные эффекты противоопухолевого лечения (типа химиотерапии и радиотерапии) у пациентов, получающих его. Ослабление побочного действия должно улучшить качество жизни таких пациентов. Результаты биологического, физиологического и биохимического анализов могут доказать это улучшение.
Согласно настоящему изобретению способ введения только рекомбинанта аденовируса р53 способен улучшить качество жизни раковых больных. Показатели этого улучшения раковые больные могут выявить по улучшению аппетита и сна, большей энергичности, уменьшению болей и по необходимой прибавке веса.
Краткое описание чертежей
Для дальнейшего описания характеристик, преимуществ, целей и других аспектов настоящего изобретения подробности приведенного выше его краткого содержания будут проиллюстрированы прилагаемыми чертежами, входящими в настоящее изобретение. Однако необходимо понимать, что эти чертежи являются только иллюстративными и не предназначены для ограничения объема настоящего изобретения.
Фиг.1 схематически представляет процесс построения рекомбинанта аденовируса р53 по настоящему изобретению.
Фиг.2 представляет технологическую схему протоколов получения рекомбинанта аденовируса р53.
Фиг.3 приводит результаты электрофореза на агарозном геле продукта ПЦР-амплификации генной формы р53. В качестве матрицы использовали кДНК р53, а в качестве праймеров - 5'CCACGACGGTGACACGCTTC и 5'CAAGCAAGGGTTCAAAGAC, что иллюстрирует стабильность рекомбинанта аденовируса р53. ДНК-фрагмент, содержащий 1400 пар нуклеотидов, был получен в результате ПЦР-амплификации гена р53. Полоса 1: стандартные маркеры молекулярного веса ДНК; полосы 2,3,4: результаты ПЦР-амплификации кДНК р53.
Фиг.4 представляет результаты вестерн-блоттинга рекомбинанта аденовируса р53, экстрагированного 36 ч ранее из подвергнутых лизису клеток, претерпевших трансфекцию рекомбинантом аденовируса р53. Клетками, прошедшими трансфекцию, были раковые клетки гортани человека Нер-2, а также немелкие раковые клетки H1299. Полоса 1: стандартные маркеры молекулярного веса протеина; полосы 2 и 3: отрицательный контроль клеток Нер-2 и H1299 соответственно, которые не были подвергнуты трансфекции рекомбинантом аденовируса р53 (Ad-p53); полосы 4 и 5: клетки Нер-2 и H1299 соответственно, которые были подвергнуты трансфекции рекомбинантом аденовируса р53 (Ad-p53).
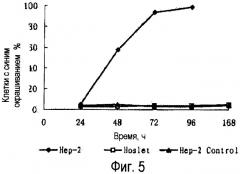
Фиг.5 представляет кривую, демонстрирующую эффект цитолиза рекомбинанта аденовируса р53 на клетки Нер-2. Клетки Нер-2 культивировали на 6-ячейковых пластинах вплоть до достижения ими плотности, составляющей на ячейку 1×106. В целях трансфекции этих клеток в различные моменты времени (24, 48, 72 и 96 ч) вводили Ad-p53; множественность заражения составила 100. Окрашивание клеток проводили трипановым синим и затем подсчитали процентное количество синих (погибших) клеток.
Фиг.6 демонстрирует схему клинических наблюдений воздействия рекомбинанта аденовируса р53 на противоопухолевое лечение и способы оценки этого воздействия.
Подробное описание настоящего изобретения
В клинических испытаниях пациентам с опухолями различных видов (типа чешуевидного рака головы и шеи, немелких раковых клеток, рака легких, рака щитовидной железы, рака яичника и т.д.) вводили рекомбинант аденовируса р53. Независимо от его способности подавлять рак, было обнаружено, что рекомбинант аденовируса р53 способен также уменьшать побочные эффекты, вызванные традиционной химиотерапией и радиационной терапией, а также улучшить качество жизни раковых больных. Далее опишем строение рекомбинанта аденовируса р53 и его клиническое применение. Выбранным рекомбинантом аденовируса р53 является коммерчески доступный продукт под торговой маркой Гендицин (Gendicine).
1. р53 и мутации р53 при раке
В настоящее время р53 признают геном-супрессором рака (Montenarh, М., 1992). Повышенный уровень экспрессии был обнаружен во многих клетках, трансформированных химическим карциногенезом, УФ-облучением, а также некоторыми вирусами, включая SV40. Ген р53 представляет собой частную мишень мутационной инактивации разнообразных форм рака человека, и к настоящему времени уже имеются сообщения о нем как о гене, наиболее часто мутирующем в раковых клетках человека (Mercer, 1992). Мутация р53 происходит в более чем 50% немелких клетках рака легкого (Hollestein et al., 1991).
Ген р53 кодирует фосфорилированный белок с 293 аминокислотными остатками, которые могут связывать крупный Т-антиген и белок Е1В. Экспрессия белка р53 обнаруживается в здоровых тканях и клетках, но в них она ниже, чем в трансформированных клетках или в раковых клетках. Интересно, что р53 немутантного типа играет важную роль в регуляции роста и делении клеток. На некоторые линии раковых клеток избыточная экспрессия р53 немутантного типа продемонстрировала действие, препятствующее их пролиферации. Таким образом, р53 может действовать как негативный регулятор роста клеток (Weinberg,1991) и может непосредственно подавлять неконтролируемый рост клеток или подавлять его косвенно, активируя целевые гены, расположенные ниже выбранного участка. Таким образом, отсутствие немутантного р53 или его инактивация может внести вклад в непрерывную трансформацию. Однако некоторыми исследованиями было показано, что присутствие мутантного р53 может быть необходимым для полной экспрессии трансформирующей возможности гена.
Немутантный р53 определяют как очень важный регулятор роста во многих типах клеток благодаря роли его генетических и биохимических признаков. Для гена р53 обычны мутации с изменением смысла, и они важны для трансформирующей способности онкогена. Единичное генетическое изменение, управляемое точечной мутацией, может создать карциогенный р53. Однако известно, что в отличие от других онкогенов, точечные мутации р53 происходят по меньшей мере в 30 кодонах, и они представляют собой доминирующие мутации, которые могут осуществить сдвиг клеточного фенотипа без интегрирования в гомозиготные мутации. Помимо этого, оказалось, что многие из этих доминантных негативных аллелей толерантны к организму и переносятся в зародышевую линию клеток. Были обнаружены различные мутантные аллели р53 с функциональными изменениями от минимально дисфункциональных до доминантных (Weinberg,1991).
Casey с коллегами сообщили, что трансфекция ДНК, кодирующей немутантный тип р53, в две клеточные линии рака молочной железы восстановила подавление роста в таких клетках (Casey et al., 1991). Аналогичный эффект был продемонстрирован на трансфекции немутантного типа р53 в клеточные линии рака гортани человека (Takahashi, et al., 1992). Немутантный тип р53 оказался доминирующим над мутантным геном, и при трансфекции в клетки с мутантным геном р53 должен специфически подавлять пролиферацию клеток. В клетках с эндогенным р53 наблюдалась нормальная экспрессия подвергшегося трансфекции немутантного типа р53, и не оказывалось влияния на рост таких клеток. Таким образом, согласно настоящему изобретению такие конструкты могут без побочных эффектов быть использованы здоровыми клетками.
Следовательно, рак, связанный с мутацией р53, можно лечить с использованием немутантного типа р53 в целях снижения количества злокачественных клеток. Однако приведенные выше исследования далеки от достижения этой цели по меньшей мере из-за того, что трансфекция ДНК не может быть использована для введения ДНК в раковые клетки пациента in vivo.
2. Способ генной терапии
До настоящего времени было предложено несколько экспериментальных подходов к генной терапии. Однако, как оказалось, у каждого из них имелись определенные недостатки (Milligan, 1993). При упомянутом выше базисном способе трансфекции фрагмент ДНК, содержащий интересующий ген, вводили в клетку не биологическим способом, например путем проникновения через клеточную мембрану физически или химически. Следовательно, этот подход ограничен лечением таких клеток, как лимфоциты, которые могут быть временно выделены из организма и способны быть толерантными к цитотоксичности, вызванной этим лечением. Липосомы или белки, слитые с определенными липидами и амфофильными пептидами, можно использовать для трансфекции, однако эффективность интеграции гена остается очень низкой, составляющей порядка одну интеграцию на 1000-100000 клеток, а экспрессия претерпевших трансфекцию генов часто ограничена днями (в быстро разрастающихся клетках) или неделями (в клетках, не разрастающихся быстро). Очевидно, что трансфекция ДНК не является способом, пригодным для лечения рака.
Второй подход использует природную способность вирусов, входящих в клетку и вносящих в нее целевой ген вместе с некоторым количеством собственного генетического материала. Ретровирус, благодаря способности интегрировать свои гены в ДНК генома хозяина, перенося большое количество чужеродного генного материала, инфицирует при этом широкий спектр видов и клеток и использует упаковку клеточных линий для их продуцирования и упаковки; он рассматривается в качестве вектора доставки ожидаемого гена. Однако практическое применение ретровируса затрудняют три проблемы. Во-первых, ретровирусная инфективность зависит от доступности вирусных рецепторов на поверхности клеток-мишеней. Во-вторых, ретровирусы эффективно интегрируются только в ауторепродуцирующие клетки. И, в заключение, концентрировать и очищать ретровирусы трудно.
3. Построение аденовируса для генной терапии
Аденовирус человека представляет собой вирус с двойной спиралью ДНК, размеры его генома составляют приблизительно 36 кб (Tooza,1981). Аденовирусы широко использовались и удовлетворительно описаны в качестве модели для исследования экспрессии эукариотного гена; это делает их привлекательным кандидатом для разработки системы передачи гена. Эту группу вирусов просто выращивать и с ней легко манипулировать, они обладают широким кругом хозяев in vivo и in vitro. В литически инфицированных клетках аденовирусы способны выключать синтез «хозяйского» белка, направляя при этом клеточный механизм на синтез больших количеств вирусного белка и реплицируя обильные количества вируса.
Область Е1 аденовирусного генома содержит гены Е1А и Е1В, которые кодируют белки, способные к транскрипции регуляции вирусного генома, а также и нескольких генов клеток-хозяина. Область Е2 содержит гены Е2А и Е2В и кодируемые ей белковые продукты (типа ДНК-связывающего белка), ДНК-полимеразы и терминальных белков в качестве праймеров репликации, способные к репликации вируса. Продукты гена ЕЗ содержат иммунный выброс аденовирусов и препятствуют атаке клеток-хозяина цитотоксичными Т-клетками и происходящему в результате этого разрушению; поэтому играют важную роль в выживании вируса и его распространении. В итоге, функции различных Е белков связаны с репликацией ДНК, поздней экспрессией гена и выключением некоторых функций клеток-хозяина. Продукты поздней экспрессии гена включают большинство вирионов капсидных белков, которые подвергаются экспрессии только после того, как репликация аденовируса в существенной степени завершена, а примируются промотором MLP. MLP демонстрирует высокую эффективность по инициированию транскрипции на поздней фазе аденовирусной инфекции (Stratford-Perricaudet and Perricaudet, 199la).
Поскольку для цис-активирования необходима лишь небольшая часть вирусного генома (Tooza, 1981), то векторы, являющиеся производными аденовируса, могут предложить инсерционное пространство для замещения крупных фрагментов ДНК, продуцированных в 293 клетках. Линия 293 клеток почки эмбриона человека, прошедшая Ad5-трансформацию, (Graham et al., 1977) способна обеспечить транс-активирующие элементы для репликации и упаковки аденовирусных векторов. Следовательно, характеристики аденовируса делают его хорошим кандидатом для генной терапии опухолей in vivo (Grunhaus and Horwitx, 1992).
Особые преимущества системы аденовируса при доставке чужеродных белков к клетке состоят в том, что: (i) она обладает способностью замещать сравнительно крупные участки вирусной ДНК чужеродной ДНК; (ii) структура рекомбинантного аденовируса стабильна; iii) она безопасна для инъекции аденовируса человеку; (iv) не имеется никаких сведений о взаимодействии аденовирусной инфекции с раком или злокачественными новообразованиями; (v) возможно продуцирование аденовируса с высокими титрами; (vi) аденовирус обладает высокой инфективностью.
Аденовирусный вектор обладает более высоким уровнем экзогенной экспрессии по сравнению с вектором ретровируса, а репликация аденовируса не зависит от репликации гена хозяина. Поскольку трансформированные гены области Е1 аденовируса могут быть легко уничтожены и не обладают никаким влиянием на эффективную экспрессию экзогенных генов, то предполагают, что онкогенный риск вектора аденовируса ничтожен (Grunhaus and Horwitx, 1992).
Обычно система передачи гена аденовируса представляет собой рекомбинантный аденовирус, построенный методом генной инженерии и приводимый в состояние репликации-компетентное состояние путем делеции области Е1 его генома, все еще сохраняя свою компетентность в отношении инфекций. Когда в геноме аденовируса произошли дальнейшие делеции, то может быть произведена экспрессия относительно крупных экзогенных генов. Например, аденовирусы с делецией и в области Е1, и в области ЕЗ способны к переносу до 10кб экзогенной ДНК, и их можно культивировать до высоких значений титра в 293 клетках (Stratford-Perricaudet and Perricaudet. 199la). Сообщалось также об удивительно устойчивой экспрессии экзогенных генов после аденовирусной инфекции.
Опосредованный аденовирусом генный перенос недавно был оценен как средство опосредования переноса гена в эукариотные клетки и в лабораторных животных. Например, было обнаружено, что при лечении мышей, страдающих дефицитом орнитинтранскарбамилазы (ОТС) (заболевание, представляющее собой редкое рецессивное генетическое нарушение), вектор аденовируса можно использовать для доставки нормального гена фермента ОТС. К сожалению, ОТС достигала цели только в 4 случаях из 17 (Stratford-Perricaudet and Perricaudet. 199la). Следовательно, у большинства лабораторных животных этот дефект корректировался лишь частично и не приводил ни к каким физиологическим или фенотипическим изменениям. Эти результаты, очевидно, незначительно стимулируют к использованию векторов аденовируса в лечение опухолей.
Исследования по использованию аденовируса в целях преобразования гена регулятора цистной фиброзной трансмембранной проводимости (CFTR) эпителия легких крыс для лечения цистного фиброза были лишь частично успешными, однако оценить биологическую активность гена, перенесенного в эпителий животных, не было возможным (Rosenfeld et al., 1992). Эти исследования вновь показали, что экспрессия белка CFTR в клетки дыхательных путей легких не дала никакого физиологического эффекта.
Эти результаты не показывают, что аденовирус способен направлять достаточную эндогенную экспрессию в инфицированные клетки с целью достижения физиологического эффекта; и поэтому исследователи не предполагают использовать системы аденовируса в противоопухолевой терапии. Кроме того, до настоящего изобретения существовало общее мнение, что р53 может не включаться в упаковку клетки, используемой при получении рекомбинантного аденовируса, поскольку он будет токсичен для этих клеток. Так как прошедший более раннюю экспрессию белок Е1 аденовируса связывается с белком р53, то предполагалось, что должна существовать техническая причина, по которой вектор аденовируса и ген р53 не могут соединяться.
4. Построение Ad-p53 и подавление опухоли
Настоящее изобретение обеспечивает новый и более эффективный супрессор опухолей, а также вектор для генной терапии опухолей. Этот рекомбинантный вирус использует преимущества аденовирусных векторов, такие как высокой титр, широкий диапазон мишеней, эффективная трансдукция, а также невключаемость в клетки-мишени. В частности, настоящее изобретение обеспечивает независимую клетку-помощник аденовируса с дефектной репликацией, которая осуществляет экспрессию немутантного типа р53 (Ad5SV-p53), процесс проходит под контролем вируса саркомы Рауса (Rous Sarcoma Virus) в качестве промотора.
Регулирующие функции векторов экспрессии часто получают от вирусов, если требуется экспрессия экзогенных генов в клетки млекопитающих. Например, стандартные промоторы получают из полиомы, аденовируса 2 и вируса обезьяны (SV-40). Возможно также применение более мелких или более крупных фрагментов вируса SV-40, при условии что они содержат последовательность из приблизительно 250 нуклеотидных оснований с сайта HindIII в направлении сайта BgII, расположенного в исходной репликации. Эти 250 нуклеотидных оснований могут быть сохранены или при необходимости уничтожены. Помимо этого, также возможно и часто желательно использовать промотор или контролируемые последовательности, обычно связанные с избранным геном-мишенью, при условии что такие контрольные последовательности совместимы с системой клетки-хозяина.
Исходная репликация может быть обеспечена из экзогенного источника, полученного от SV40 или других источников (например, полиомы, аденовируса, вируса герпетического стоматита VSV, вируса бычьей паппиломы BPV), или получена с помощью хромосомального репликационного механизма клетки-хозяина. Если вектор интегрируется в хромосому клетки-хозяина, то часто это бывает существенным.
На фиг.1 показан рекомбинантный аденовирус р53. В связи с этим был разработан усовершенствованный протокол построения и идентификации такого рекомбинантного аденовируса. После идентификации структуру рекомбинантного аденовируса р53 подтвердили методом ПЦР. После выделения и подтверждения его структуры аденовирус р53 использовался для инфицирования раковых клеток Нер2 гортани и немелких раковых клеток H1299 легких, которые имеют «выбитый» гомологичный ген р53. Результаты вест-блоттинга показали, что экзогенный белок р53 подвергается высокой степени экспрессии.
Описанные здесь исследования показывают, что рекомбинантный аденовирус р53 обладает свойствами опухолевого супрессора, которые проявляются в восстановлении в опухолевых клетках функции р53. Эти результаты могут поддержать использование вириона Ad5RSV-p53 в качестве терапевтического средства при противоопухолевой терапии.
В качестве новой системы передачи генов рекомбинантный аденовирус имеет большое количество потенциальных приложений в генной терапии, а также при разработке вакцин. Поэтому размножение рекомбинантного аденовируса является важным средством молекулярной биологии. Современные способы размножения рекомбинантного аденовируса включают трансфекцию 293 клеток, опосредованную преципитацией фосфата кальция с последующим анализом бляшкообразования на клетках, претерпевших трансфекцию. Трансфекция, эффективно связанная с этим способом, нуждается в усовершенствовании, а ее методика требует упрощения.
5. Усовершенствованный протокол ослабления побочных эффектов, вызванных химиотерапией и радиотерапией
За последние 20 лет были сделаны существенные исследования в области лечения опухолей. Разработаны многочисленные подходы к лечению опухолей. В качестве практических способов они включают применение многих методов, включая хирургию, радиотерапию, химиотерапию, трансплантацию костного мозга (для лечения пациентов с некоторыми видами гематологических злокачественных образований, в частности острой гранулоцитной лейкемии), традиционное китайское траволечение и т.д. Протокол, используемый для лечения конкретного вида злокачественного новообразования, зависит от его природы, локализации и вида заболевания. Для лечения новообразований самым предпочтительным способом лечения остается хирургия, и ее используют как основной вид терапии почти для 60% опухолей. Однако для полного выполнения лечебного протокола хирургическое иссечение часто сочетают с радиационной терапией и/или химиотерапией. В случае, если злокачественное новообразование не является локализованным, или если его локализация снижает возможность успешного удаления или иссечения хирургическим образом, то часто используют сочетание химиотерапии и радиотерапии.
Химиотерапия продемонстрировала свою эффективность для лечения некоторых видов рака, включая болезнь Ходгкина, острую лейкоцитарную и гранулоцитарную лейкемию, тестикулярный рак, лимфомы, отличную от лимфомы Ходгкина, и им подобные. При других типах опухолей химиотерапию эффективно использовали перед хирургическим вмешательством для уменьшения размера опухолей. При химиотерапии часто используют сочетание химиотерапевтических средств. Медицинским сообществом непрерывно разрабатываются и испытываются новые протоколы лечения.
Однако противоопухолевые агенты представляют собой лекарственные средства, которые, помимо уничтожения раковых опухолей, могут нанести вред здоровым тканям. Даже при интенсивных исследованиях, проводимых с целью определения дозировки и графика введения лекарственных средств, химиотерапия часто приводит к неприятным, а иногда и опасным побочным эффектам, вызванным токсичностью препаратов. Аналогичные проблемы возникают при радиационной терапии. Наиболее типичными побочными эффектами являются тошнота, потеря аппетита, алопеция и подавление деятельности костного мозга. Обычно, но не всегда, такие побочные эффекты обратимы. Некоторые противоопухолевые лекарственные средства могут постоянно быть вредными для нервной системы, сердца, легких, печени, почек, половых желез и других органов. Некоторые из химиотерапевтических средств карциногенны сами по себе. Пациенты, получающие радиотерапию или химиотерапию, могут также одновременно принимать профилактические средства или средства, предназначенные для предотвращения опасных для жизни инфекций, являющихся результатом иммунодепрессивного состояния, вызванного противоопухолевой терапией.
Были разработаны некоторые стратегии лечения в целях нейтрализации побочных эффектов радиотерапии и химиотерапии. Например, для некоторого ослабления тошноты можно использовать некоторые лекарственные средства, борьбе с инфекциями могут помочь антибиотики или нахождение в ламинарных воздушных средах, для увеличения числа гемоцитов и тромбоцитов может быть произведена трансфузия, и т.п.
Возможна широкая классификация химиотерапевтических средств, играющих важную роль при лечении новообразований у человека. Такие химиотерапевтические средства включают, но ими не ограничиваются, алкилирующие средства, антиметаболиты (например, аналоги пиримидина), радиоактивные изотопы (например, фосфор и йод), гормоны (эстрогены и аденокортикостероиды), смешанные средства (например, гидроксимочевина) и природные продукты (например, пацилитаксел, винкалейкобластин и антибиотики). Несмотря на то, что указанные средства не являются лечебными, однако в медицине они признаются полезными для подавления, маскировки, торможения и контроля злокачественных новообразований. Поскольку было обнаружено, что эти соединения эффективны, и обычно они находят клиническое применение в качестве средств, препятствующих пролиферации, то недостатки, связанные с их введением в качестве противоопухолевых средств, хорошо распознаваемы. Алкилирующие средства имеют заметное цитотоксическое воздействие, а способность этих лекарственных средств препятствовать митозу и пролиферации здоровых клеток может быть летальным фактором. Антиметаболиты могут привести к анорексии, прогрессивной потере веса, депрессии и коме. Длительное введение антиметаболитов способно привести к серьезному подавлению работы костного мозга. Как алкилирующие средства, так и антиметаболиты обычно оказывают угнетающее действие на иммунную систему. Длительное применение природных продуктов также может вызвать подавление работы костного мозга. Гидроксимочевина и другие химические производные могут привести к быстрому восстановлению уровня аденокортикостероидов и их метаболитов. Введение гормональных соединений или радиоактивных изотопов также нежелательно с точки зрения причинения вреда иммунной системе, а следовательно, лишения организма способности противостоять обычным инфекциям. В большинстве случаев было бы предпочтительно использование химиотерапевтических средств, которые были бы эффективными для контроля, задержки или подавления злокачественных новообразований, при этом одновременно стимулируя иммунную систему пациента и оказывая ей помощь.
Средства химиотерапии можно давать или в виде единичной дозы, или в виде нескольких крупных доз, или, чаще, их можно давать небольшими дозами 1-4 раз в день и продолжать в течение до нескольких недель или месяцев. Для лечения рака используют много цитотоксичных средств, но механизм их действия обычно не очень понятен.
Вне зависимости от механизма известных химиотерапевтических средств известно, что они повреждают и уничтожают клетки как опухолевых, так и здоровых тканей. Успешность применения химиотерапевтических средств в лечении новообразования зависит от дифференциального уничтожения указанным средством опухолевых клеток по сравнению с его побочными действиями на здоровые ткани. Уничтожение гепатоцитов и лимфоцитов может вызвать инфекцию. Острая и хроническая токсичность разрушения костного мозга также представляют собой главные факторы, лимитирующие применение химиотерапевтических средств при лечении опухолей. Оба они связаны с сокращением числа кроветворных клеток, вызванным и уничтожением этих клеток цитотоксичными средствами или облучением. Такие эффекты приводят к истощению компонентов костного мозга, при этом способствуя дифференциации стволовых клеток по обратному механизму и тем самым уменьшая их общее число (патент США №5,595,973). Стимуляторы и ингибиторы кинетики костного мозга играют важную роль в индуцировании процессов разрушения и восстановления (Tubiana et al., Radiotherapy and Oncology, 29:1,1993).
Предотвращение побочных эффектов химиотерапии или защита от них были большим успехом для раковых больных. Однако многочисленные попытки снижения этих побочных эффектов не были успешными. В отношении опасных для жизни побочных эффектов усилия были сконцентрированы на снижении дозы и графика введения. В целях увеличения количества здоровых клеток перед началом химиотерапевтического лечения доступными становятся другие возможности, типа применения колониестимулирующего фактора гранулоцитов (G-CSF), фактора роста гранулоцитов-макрофагов-CSF (GM-CSF), эпидермального фактора роста (EGF), интерлейкина 11, эритропоэтина, тромбопоэтина, фактора размножения и роста мегакариоцитов, фактора роста стволовых клеток, FLT-лиганда, а также интерлейкинов 1,3,6 и 7 (Jimenez and Yunis, Cancer Research, 52:413-415; 1992). Механизмы защиты с помощью этих факторов пока еще не вполне понятны, но скорее всего они связаны с увеличением количества здоровых клеток-мишеней перед химиотерапией, но не с увеличением жизнеспособности клеток после химиотерапии.
При противоопухолевом лечении часто вследствие цитотоксичной химиотерапии наблюдается острая миелосупрессия, и ее определяют как фактор, лимитирующий дозу такого лечения (патент США №5,595,973). Несмотря на то, что неблагоприятное воздействие может быть оказано и на здоровые ткани, костный мозг особенно чувствителен к специфическому лечению (типа химиотерапии и радиотерапии), противодействующему пролиферации. Для некоторых раковых больных токсичность гемопоэза, вызванная химиотерапевтическими средствами, часто ограничивает возможность увеличения доз химиотерапии. Повторяемые циклы химиотерапии или ее высокие дозы могут быть ответственны за сильное истощение стволовых клеток, приводящее к длительной гипофункции гемопоэза и разрежению костного мозга.
Способы, раскрываемые в настоящем изобретении, пригодны для применения вместе с химиотерапевтическими средствами. Указанные средства могут представлять собой любое лекарственное средство, включая (но ими не ограничиваясь) циклофосфамид, таксол, 5-фторурацил, цисплатин, метотрексат, цитозинарабинозид, митомицин С, преднизон, виндестин, карбаплатин и винкристин. Цитотоксичным средством также может быть противомикробное средство, способное разрушать разросшиеся клетки. Обсуждение используемых в химиотерапии цитотоксичных средств содержится в работе Sathe, M., et al., Cancer Chemotherapeutic Agents : Handbook of Clinical Data (1978).
Способы по настоящему изобретению также особенно пригодны для таких пациентов, которые нуждаются в повторных или в высоких дозах химиотерапии или радиотерапии. Для некоторых раковых больных токсичность, вызванная химиотерапевтическими средствами, часто ограничивает возможность увеличения доз химиотерапии. Повторяемые циклы химиотерапии или ее высокие дозы могут быть ответственны за сильное истощение стволовых клеток, приводящее к длительной гипофункции гемопоэза и разрежению костного мозга. Способы по настоящему изобретению в сочетании с применением вместе с химиотерапией обеспечивают снижение смертности, а также увеличение количества гемоцитов.
Активный препарат может быть введен любыми удобными способами, включая (но ими не ограничиваясь) местную внутриопухолевую инъекцию, интраперитонеальную инъекцию, внутриполостную инфузию, интрабронхиальную инсталляцию, инъекцию в печеночную артерию, инсталляцию в периферическую вену и т.д. Все способы введения безопасны и эффективны. Рекомендованным в настоящее время способом введения является местная внутриопухолевая инъекция. В составе этой инъекции могут быть использованы стандартные векторы, фармацевтические разбавители и наполнители.
Активный препарат может быть приготовлен в виде твердой формы (гранулы, порошки или суппозитории, и т.п.) или жидкой формы (раствор, суспензия или эмульсия и т.п.), и его можно растворить в различных растворах, которые должны быть асептическими и содержать достаточное количество пептидов, быть безвредными для рекомендованных применений, быть в высшей степени стабильными в данных условиях, однако могут разрушаться под действием сильных кислот или оснований.
Дозировки активного препарата зависят от многих факторов, таких как тип опухоли, возраст, вес, пол и общее состояние здоровья субъекта, степени его заболевания, способа введения лекарственного средства и его состава.
Наиболее предпочтительна местная внутриопухолевая инъекция в дозировке от 1×107 VP до 7×107 VP (максимальная толерантная доза не определена). В настоящее время в клинических экспериментах обычно используемая недельная доза составляет 1×1012 VP. Эта дозировка достаточна для того, чтобы препарат оказывал максимальный лечебный эффект при минимальной дозе агониста. Такой режим может минимизировать стоимость лечения и потенциальные побочные эффекты.
В наиболее предпочтительных вариантах местная инъекция с недельной дозой 1×1012 VP может быть применена за 72 ч до проведения химиотерапии или радиотерапии. В других вариантах препарат можно повторно использовать в многократных курсах лечения. Предпочтительно, чтобы элементы крови (лейкоциты, тромбоциты и нейтрофилы) восстанавливались до уровня, необходимого для проведения следующего химиотерапевтического курса лечения, и чтобы следующий курс начинался сразу же по завершении предыдущего.
Помимо активных ингредиентов фармацевтический состав может также содержать фармацевтически пригодные носители, включая наполнители и вспомогательные вещества, облегчающие включение активных соединений в применяемую рецептуру. Другие детали методики получения препарата можно найти в самом последнем издании Remington's Pharmaceutical Sciences (Maack Publishing Co., Easton, Pa).
Приведенные далее примеры более подробно описывают и иллюстрируют настоящее изобретение, но их не следует рассматривать ограничивающими объем настоящего изобретения.
Примеры
Пример 1. Получение гендицина (Gendicine) - препарата рекомбинанта аденовируса р53
Был приготовлен рекомбинант аденовируса р53, который использовали в клинических испытаниях. Его торговое название - гендицин (Gendicine). Подробное описание получения этого препарата сделано в патенте Китая №ZL 02115228.4, его полное содержание приведено здесь в виде ссылки.
Рекомбинант аденовируса человека р53 был сконструирован и получен так, как это описано на фиг.1 и фиг.2. В E.coli были совместно введены вектор аденовируса и «челночный» вектор, содержащий ген р53; для получения позитивных рекомбинантных клонов был отобран рекомбинантный аденовирус. Рекомбинантные клоны были амплифицированы в 293 клетках, и после многочисленных стадий очистки был собран рекомбинантный клинически чистый аденовирус р53 человека. Фиг.3 демонстрирует результаты определения структурной стабильности рекомбинантного аденовируса р53 человека. На этой фигуре показано, что структурная стабильность указанного рекомбинантного аденовируса сохранялась после большого количества генераций.
Фиг.4 представляет результаты вестерн-блоттинга рекомбинанта аденовируса р53, по которым указанный рекомбинант можно подвергнуть высокой степени экспрессии в раковые клетки гортани человека Нер-2, а также немелкие раковые клетки H1299. На фиг.5 показан эффект уничтожения рекомбинанта аденовируса р53 на клетки Нер-2. Клетки окрашивали трипановым синим, а затем подсчитали процентное количество синих (погибших) клеток; результаты показаны на фиг.5.
Пример 2
Материал: рекомбинантный аденовирус человека р53 гендицин (Gendicine) в инъекциях