Способ абляции целевой днк с поверхности днк-биочипов
Иллюстрации
Показать всеИзобретение относится к биотехнологии, лазерной технике и медицине. Предложен способ абляции целевой ДНК с поверхности ДНК-биочипов, включающий иммобилизацию ДНК-пробы на подложку, гибридизацию иммобилизованной ДНК-пробы с целевой ДНК, абляцию целевой ДНК с гибридизованного биочипа путем воздействия лазерного излучения с последующим определением структуры продуктов абляции с помощью ПНР. При этом абляцию осуществляют терагерцовым излучением лазера на свободных электронах с длиной волны 120-135 мкм, интенсивностью 20-40 Вт/см2, частотой следования импульсов 5.6 МГц, длительностью импульсов 50 нс при минимальнай относительной ширине линии воздействия 3×10-3. В качестве подложки используют предварительно отполированные и активированные пластины из высокоомного кремния или пористого оксида алюминия «silufol». Способ обеспечивает неразрушающую ДНК «мягкую» абляцию и позволяет анализировать целевую ДНК по специфической первичной структуре и функциональной биологической активности. 2 з.п. ф-лы, 5 ил.
Реферат
Изобретение относится к биотехнологии и медицине и может быть использовано для повышения эффективности (результативности, точности, качества) аналитических и диагностических операций с использованием твердых подложек (чипов) с нанесенными на них дезоксирибонуклеиновыми кислотами (ДНК) (ДНК-биочипов).
В последние годы лавинообразно возросло количество исследований с использованием биочипов (gene arrays), которые представляют собой небольшого размера стеклянные, полимерные, керамические пластинки или нейлоновые мембраны, несущие на своей поверхности биополимеры, например белки, ДНК, фрагменты ДНК.
Существенным преимуществом биочипов по сравнению с традиционными методами анализа биологического материала является возможность одновременного анализа огромного (до 100 тыс.) количества проб. Появление ДНК-биочипов позволило использовать их для комплексной диагностики генетических, инфекционных и онкогенных заболеваний человека в лечебных учреждениях. Возможность определения уровня экспрессии 42 тыс. генов и белков человека позволяет биотехнологическим компаниям использовать биочипы для разработки и апробации новых лекарственных препаратов для быстрого выявления болезнетворных бактерий и вирусов в организме человека.
В последние годы количество данных по применению биочипов в научных и клинических исследованиях экспоненциально возросло в связи с высокой эффективностью их использования в реальной практике. Соответственно этому существенно выросло количество производителей биочипов и методов их производства. Необходимость сравнивать результаты анализа в разных экспериментах, между разными лабораториями и базами данных стала весьма насущной. В связи с этим к настоящему времени многие исследователи активно заинтересовались сравнением разных платформ и анализом результатов применения биочипов различных производителей на идентичных смесях нуклеиновых кислот (Harbig J, Sprinkle R, Enkemann SA. A sequence-based identification of the genes detected by probesets on the Affymetrix U133 plus 2.0 array. Nucleic Acids Res 2005; 33 (3): e31). К 2003 году стало ясно, что результаты идентификации последовательностей ДНК на биочипах различных производителей имеют общую сходимость всего около 4% при анализе идентичных смесей ДНК (E.Marshall SCIENCE 2004, V.306, 22, OCTOBER, рр.630-631). Исследователи и производители биочипов во всем мире предприняли гигантские усилия для решения этой проблемы и уже к 2007 году сходимость результатов существенно повысилась до 23%. Один из аспектов проблемы состоит в том, что для идентификации экспрессии одного и того же гена разные производители биочипов используют пробы с разной последовательностью нуклеотидов. Использование для сравнения только той части проб, которая имеет сходную последовательность, повышает сходимость результатов, однако существенно ограничивает информативность анализа. Только постоянный мониторинг экспрессии и последующее применение методов статистической обработки gene set enrichment analysis (GSEA) и parametric analysis of gene enrichment (PAGE) позволило получить приемлемую повторяемость результатов. Таким образом, вопрос о том, что же за последовательность на самом деле гибридизуется на биочипе, все также является актуальной.
Сегодня и в России формируется рынок биочипов отечественного производства. Впервые в мире в России были разработаны биочипы для быстрой идентификации лекарственно-устойчивых форм туберкулеза. Ведутся работы по созданию биочипов для типирования вируса гриппа, тестирования гельминтозов, идентификации и опознания личности, для исследования специфичности ДНК-белковых взаимодействий.
Однако до сих пор не существует возможности напрямую сравнивать результаты гибридизации целевых ДНК на микроячейках биочипов. Это оставляет открытой проблему идентификации целевых ДНК, гибридизованных на микроячейки биочипов. Поэтому задача диагностики идентичности ДНК-биочипов разного производства, созданных по сходным технологиям, является актуальной.
В настоящее время для абляции (удаления) биополимеров с поверхности чипов, в частности биочипов, используют различные химические, физические и физико-химические методы. В патентной заявке JP 2004212215 A, оп. 29.07.2004 описан способ абляции с поверхности биочипов, таких биополимеров, как нуклеиновые кислоты, пептиды, полисахариды, посредством сфокусированного лазерного импульсного излучения с последующим анализом биополимеров на квадрупольном масс-спектрометре. Аналогичный подход использован в патентной заявке US 20030469160 A1, оп. 21.02.2002 для абляции РНК, ДНК, пептидов и сахаров ультракороткими импульсами лазерного излучения для ионизации и перевода биополимеров в атомарное состояние с последующей масс-спектрометрией. В патентной заявке US 2005185260 A1, оп 24.02.2005, описано использование оптиковолоконного устройства для облучения биочипов пикосекундным и наносекундным импульсным террагерцовым излучением и абляции биополимеров. В патентной заявке US 2003180720 A1, оп. 25.09.2003, для абляции биомолекул, в частности протеинов и нуклеиновых кислот, с поверхности биочипов, используют раман-спектроскопию. В патентной заявке US 2003162216 Al, оп. 28.08.2003 для анализа коньюгированных с поверхности биочипа исследуемых протеинов (клеток, вирусов, бактерий), а также ДНК, гормонов, сахаров, кофакторов, продуктов метаболизма, лекарственных препаратов и токсинов используют специфические для каждого объекта реагенты. В патентной заявке US 2006443639 A1, оп. 30.05.2006 описан способ связывания биополимеров с поверхностью биочипов с помощью террагерцового и гигагерцового излучения с длиной волны от 3 мм до 3 мкм и частотой следования импульсов в диапазоне от 0,1 до 100 ТГц. Детекцию связывания анализируемых биомолекул с биочипом, на поверхности которого иммобилизован специфически связывающий компонент, осуществляют по соотношению уровней интенсивности вибрационных спектров гигагерцового и терагерцового излучения до и после образования биомолекулярных комплексов. Способ позволяет с высокой точностью зафиксировать специфическое связывание анализируемых биомолекул.
Все описанные способы абляции биологических макромолекул (биополимеров) с поверхности твердых подложек (биочипов), в том числе и лазерные, не позволяют детектировать исследуемые объекты по их специфической первичной структуре, а функциональная биологическая активность (ферментативная, регуляторная, рецепторная и т.д.) биополимеров полностью утрачивается за счет «жесткого» воздействия на функциональные макромолекулы, приводящего к изменению конформации макромолекул, активных центров, вторичной и третичной структуры.
Наиболее близким к заявляемому способу - прототипом является способ абляции биополимеров с твердой подложки с помощью эксимерного лазера (прибор ProteinChip Reader Model PBS II) с последующим определением структуры и специфической активности продуктов абляции (He Z, Zhong H, Hu Y, Xiao S, Xu J. Analysis of differential protein expression in Acidithiobacillus ferrooxidans grown under different energy resources respectively using SELDI-ProteinChip technologies, Anal Biochem. 2005 May 15; 340 (2): 317-29). Однако известный способ не позволяет осуществить неразрушающую «мягкую» абляцию биополимера.
Недостатком прототипа, а также всех известных лазерных способов абляции биополимеров является то, что они не позволяют достичь «мягкой» абляции с поверхности биочипа биополимеров с сохранением их структуры и специфической биологической функциональной активности, что снижает информативность и качество анализа биологических объектов, у которых специфическая активность (ферментативная, регуляторная, рецепторная) является основным критерием их биоспецифичности.
В современной научно-технической литературе не описаны способы «мягкой» абляции биополимеров, в частности ДНК, с поверхности твердых подложек, в том числе биочипов, которые позволяют сохранить специфические виды их биологической активности.
Технической задачей настоящего изобретения является расширение функциональных возможностей способа и повышение его информативности.
Поставленная техническая задача достигается посредством неразрушающей («мягкой») абляции целевой ДНК с поверхности ДНК-биочипа с помощью терагерцового излучения лазера на свободных электронах (ЛСЭ) с длиной волны 120-135 мкм.
Сущность предлагаемого способа заключается в следующем. На полированную и активированную пластину из высокоомного кристаллического кремния или оксида алюминия иммобилизуют ДНК-пробу, проводят гибридизацию иммобилизованной ДНК-пробы с целевой ДНК (образец), далее осуществляют мягкую абляцию целевой ДНК с гибридизованного биочипа с последующей оценкой результатов мягкой абляции с помощью ПЦР. При этом абляцию ДНК осуществляют терагерцовым излучением лазера на свободных электронах с длиной волны 120-135 мкм, с интенсивностью 20-40 Вт/см2, частотой следования импульсов 5.6 МГц, длительностью импульсов 50 нс при минимальнай относительной ширине линии воздействия 3×10-3.
Абляция с использованием терагерцового излучения ЛСЭ представляет собой перевод молекул в аэрозольную фазу из твердой или жидкой фазы без изменения молекулярной структуры, при этом сохраняются полная идентичность последовательности нуклеотидов исходной целевой ДНК и аблированного после гибридизации олигонуклеотида.
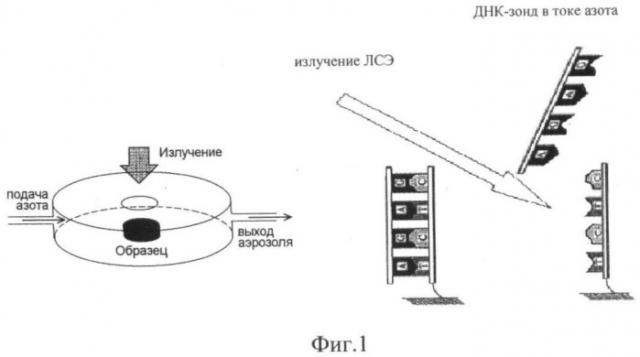
Для проведения "мягкой" лазерной абляции биомакромолекул без их деструкции использовали анализатор для анализа ДНК-биочипов.
На фиг.1 представлена принципиальная схема действия такого анализатора. Под действием излучения водородные связи, стабилизирующие молекулы ДНК-ДНК гибрида, разрушаются и ДНК зонд аблирует и попадает в ток азота. ДНК-зонд, попавший в поток азота, собирается на мембрану-ловушку и затем проводится его анализ методом ПЦР.
Для подтверждения эффективности "мягкой" лазерной абляции ДНК электрофоретическими методами были препаративно выделены отдельные фрагменты ДНК фага лямбда, гидролизованного рестриктазой HindIII и проведена мягкая лазерная абляция фрагментов ДНК размером 3000 нуклеотидных пар (нп), 9000 нп и 23000 нп.
На фиг.2 представлены результаты измерений диффузионного размера аэрозольных частиц, полученных при мягкой абляции под действием ТГц-излучения с длиной волны 128 мкм заявляемым способом.
Из фиг.2 видно, что диффузионные размеры частиц, получаемых при воздействии ТГц-излучения, достаточно хорошо соответствуют линейным размерам полимерных цепей ДНК, взятых в эксперимент. Полученные данные свидетельствуют о том, что методика неразрушающей мягкой абляции применима к анализу ДНК-гибридов.
Таким образом, впервые показана возможность «мягкой» лазерной абляции молекул ДНК при сохранении их молекулярной структуры.
Заявляемое изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1
А) Активация кремниевой поверхности подложки (чипа)
В качестве подложки для иммобилизации образцов ДНК использовали круглую, диаметром 20 мм и толщиной 1 мм, пластинку из высокоомного (6-8 кОм/см) кремния.
После изготовления пластинку полировали, так как полированная кремневая пластинка не дает аэрозольных частиц при абляции и имеет высокий коэффициент пропускания в рабочей области спектра излучения ЛСЭ, следовательно, мало нагревается при облучении и не приводит к тепловой деструкции биополимера.
Для активации кремниевой поверхности чипа (создание эпокси-покрытия) кремниевую пластину вымачивали в растворе 0.1% GPS (glycidoxypropyltrimethoxysilane) в толуоле (Aldrich, 244511-1L) в течение 30 мин при 40°C, промывали трижды в толуоле и затем высушивали при температуре 110°C.
Б) Иммобилизация ДНК-пробы на подложку (чип)
Для фиксации ДНК-пробы на поверхности чипа использовали олигонуклеотид заданной длины с ковалентно пришитой молекулой линкера к 5'-концу.
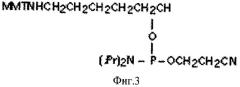
Структура пробы: линкер (L1)-5'-ATATCAGATCGCAGTGT-3'
На фиг.3 представлена химическая структура линкера 1 с разветвленной структурой.
На активированную поверхность чипа, в центральную часть, был нанесен раствор ДНК-пробы (2 наномоля в 2 мкл 3×SSC). После нанесения пробы на эпокси-поверхность для увеличения эффективности его иммобилизации использовали следующую процедуру: чип в чашке Петри оставляли на ночь в эксикаторе с насыщенным раствором NaCl (для обеспечения 50% влажности) при температуре 42°C, затем промывали в 0,2% SDS 2 мин на шейкере (Eppendorf) и затем трижды промывали бидистиллированной водой, инкубировали в бидистиллированной воде (50°C) 20 минут и высушивали.
В) Гибридизация образца с пробой, отмывка и сушка чипа
В качестве целевой ДНК (образец 1) был использован фрагмент ДНК длиной 50 нуклеотидов с флуоресцентной меткой по 5'-концу. В качестве флуоресцентного красителя (метки) использовали Fluorescein-6 (FAM6). Структура гибридизуемого образца 1:
5'-6FAM-TCCCTCCTGAGTTCCCCTGCACACACAACGGCACACTGCGATCTGATAT-3'
Гибридизационный буфер содержал раствор 3×SSC с добавлением 0.5% SDS. Для гибридизации использовали 2 наномоля образца 1. Гибридизацию проводили в течение ночи в гибридизационной камере Corning при 50°C с постепенным понижением температуры до 37°C.
После гибридизации чипы промывали в водном растворе 1×SSC 2 раза по 30 с при 37°C. Сушку чипов проводили при комнатной температуре.
Г) Проведение мягкой абляции целевой ДНК гибридизованного биочипа.
На поверхность гибридизованного биочипа с молекулой целевой ДНК подавалось терагерцовое излучение, генерируемое на ЛСЭ со следующими параметрами:
| Длина волны, мкм | 120 |
| Длительность импульса, нс | 50 |
| Частота следования импульсов, МГц | 5.6 |
| Инстенсивность, Вт/см2 | 20 |
| Минимальная относительная ширина линии | 3·10-3 |
После «мягкой» абляции молекулу целевой ДНК, переведенную в аэрозольную фазу током азота, собирали на нитроцеллюлозный фильтр (Millipore, 0.22 мкм). Собранные на фильтр частицы целевой ДНК элюировали 200 мкл ТЕ буфера (10 мМ Трис-HCl (pH 8), 1 мМ ЭДТА (pH 8)), 15 минут при 65°С, и определяли последовательность собранной ДНК с помощью ПЦР.
Д) Оценка результатов мягкой абляции с помощью ПЦР
Для идентификации структуры и целостности молекулы целевой ДНК, смытой с фильтра после проведения процедуры мягкой абляции, были использованы следующие праймеры:
For: 5'-TTCCCTCCTGAGTTCCCC-3'
Rev: 5'-ATATCAGATCGCAGTGTGCC-3'
Были использованы следующие условия ПЦР:
32 цикла в режиме: денатурация 0.5 мин при 95°C; отжиг 0.5 мин при 53°C; синтез 0.5 мин при 7°C. Реакционная смесь объемом 15 мкл содержала: 1 мкл образца 1 с концентрацией 5×105 молекул/мкл, по 0,25 мкМ праймеров, 0,2 мМ каждого из дезоксинуклеозидтрифосфатов dNTP, ПЦР-буфер (75 мМ Трис-HCl (pH 9), 1,5 мМ MgCl2, 20 мМ (NH4)2SO4, 0,01% Tween-20) и 0,4 ед. Taq-полимеразы. Установлено, что последовательности нуклеотидов исходной целевой ДНК и аблированного после гибридизации олигонуклеотида идентичны.
Пример 2
Эксперимент проводили аналогично примеру 1, кроме следующего.
В качестве подложки для нанесения исследуемого биополимера использовали круглую, отполированную и активированную пластинку из пористого оксида алюминия «silufol» диаметром 20 мм и толщиной 1 мм.
В качестве целевой ДНК (образец 2) был использован фрагмент ДНК длиной 90 нуклеотидов, без флуоресцентной метки по 5'-концу. Структура гибридизуемого образца 2:
5'TTCCCTCCTGAGTTCCCCTACACACACAACCACACACAACCACACACAACCACACACAACCACACACAACGGCACACTGCGATCTGATAT-3'
В качестве ДНК-пробы на поверхности биочипа был закреплен комплементарный образцу 2 олигонуклеотид длиной 17 н.п.
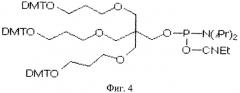
Структура пробы: линкер (L2)-5'-ATATCAGATCGCAGTGT-3'
На фиг.4 представлена химическая структура линкера 2 с линейной структурой.
Абляцию целевой ДНК с поверхности гибридизованного биочипа проводили с помощью терагерцового излучения, генерируемого на ЛСЭ со следующими параметрами:
| Длина волны, мкм | 135 |
| Длительность импульса, нс | 50 |
| Частота следования импульсов, МГц | 5.62 |
| Интенсивность, Вт/см2 | 40 |
| Минимальная относительная ширина линии | 3·10-3 |
После «мягкой» абляции молекулу целевой ДНК, переведенную в аэрозольную фазу током азота, собирали на нитроцеллюлозный фильтр (Millipore, 0.22 мкм). Собранные на фильтр частицы целевой ДНК элюировали 200 мкл ТЕ буфера (10 мМ Трис-HCl (pH 8), 1 мМ ЭДТА (pH 8)), 15 минут при 65°C.
Аблированная с поверхности биочипа ДНК была амплифицирована методом ПЦР-реакции. После чего ее последовательность была определена с использованием Big Dye®-технологии (Applied Biosystems). Результаты представлены на фиг.5. Взаимокомплементарные последовательности целевой ДНК (образец 2) и ДНК-пробы отмечены фигурной скобкой.
Из фиг.5 видно, что последовательности нуклеотидов исходной целевой ДНК и аблированного после гибридизации олигонуклеотида идентичны.
Таким образом, в результате мягкой неразрушающей абляции удалось перевести в аэрозольную фазу, собрать и амплифицировать целевую ДНК (образцы 1 и 2) с поверхности биочипа под действием терагерцового излучения ЛСЭ и установить идентичность структуры аблированного после гибридизации олигонуклеотида структуре целевой ДНК.
Использование «мягкой» абляции целевой ДНК с поверхности биочипов при использовании терагерцового излучения, генерируемого на ЛСЭ, позволяет сохранить исходную структуру молекулы ДНК и повысить информативность и качество анализов с использованием биочипов.
1. Способ абляции целевой ДНК с поверхности ДНК-биочипов, включающий иммобилизацию тест-пробы на подложку, специфическое связывание иммобилизованной тест-пробы с целевой пробой, абляцию целевой пробы с биочипа путем воздействия лазерного излучения с последующим определением структуры продуктов абляции, отличающийся тем, что воздействие осуществляют терагерцовым излучением лазера на свободных электронах с длиной волны 120-135 мкм, интенсивностью 20-40 Вт/см2.
2. Способ по п.1, отличающийся тем, что в качестве подложки используют предварительно отполированные и активированные пластины из высокоомного кремния или пористого оксида алюминия «silufol».
3. Способ по п.2, отличающийся тем, что для активации пластины вымачивают в растворе 0,1% GPS в толуоле в течение 30 мин при 40°С, промывают трижды в толуоле и высушивают при температуре 110°С.