Способ и набор для детектирования микроорганизма
Иллюстрации
Показать всеИзобретение относится к микробиологии. Описан способ детектирования живой клетки микроорганизма в тест-пробе, предусматривающий добавление к этой тест-пробе сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм; облучение светом, имеющим длину волны 350 нм-700 нм; удаление сшивающего агента; добавление среды и дальнейшее инкубирование; добавление опять сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, к инкубируемой тест-пробе; повторное облучение светом, имеющим длину волны 350 нм-700 нм; экстракцию ДНК из этой тест-пробы и амплификацию района-мишени экстрагированной ДНК; и анализ амплифицированного продукта. Предложен способ детекции живой клетки микроорганизма в тест-пробе, который включает использование набора, содержащего следующие компоненты: сшивающий агент, способный сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм; среду и праймер (праймеры) для амплификации района-мишени ДНК микроорганизма, который является мишенью детектирования, способом амплификации нуклеиновых кислот. Изобретение позволяет детектировать живые клетки микроорганизмов в тест-пробе. 2 н. и 24 з.п. ф-лы, 5 ил., 17 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу и набору для детектирования микроорганизма, содержащегося в пищевом продукте, биологической пробе и пробе окружающей среды, такой как промышленная вода и водопроводная вода. Более точно, настоящее изобретение относится к способу и набору для детектирования микроорганизма, которые позволяют селективно детектировать живые клетки микроорганизма, содержащиеся в пищевом продукте, биологической пробе и пробе окружающей среды, такой как промышленная вода и водопроводная вода.
Уровень техники
Способ культуры на чашках обычно использовали для измерения общих количеств живых бактерий в пищевых продуктах, биологических пробах или пробах окружающей среды. Однако способ культуры на чашках требует времени около двух дней для получения результата.
Благодаря усовершенствованию способов стерилизации и способов обработки пищевых продуктов потребность в отличении живых состояний микроорганизмов от мертвых состояний микроорганизмов, существующих в тест-пробах, является увеличивающейся даже для случаев, в которых эти клетки существуют в чрезвычайно малом количестве. В частности, в областях санитарного надзора и клинического испытания в качестве быстрого способа детектирования бактерий делаются попытки определения присутствия или отсутствия бактерий или определения количества бактерий амплификацией генов, специфических для этих бактерий, при помощи ПЦР до такого количества, что эти гены могут наблюдаться визуально. Однако, если мишенью является бактериальная ДНК, фон мертвых бактерий, первоначально содержащихся в тест-пробе, также детектируется, и, следовательно, положительный результат, полученный при помощи ПЦР, необязательно предполагает присутствие живых бактерий. Таким образом, существующая ситуация в областях санитарного надзора и клинического испытания такова, что ПЦР не используется широко, хотя она является высокочувствительным и быстрым способом.
В настоящее время предпринимается попытка детектирования и количественного определения только живых клеток микроорганизма в тест-пробе получением кДНК с использованием обратной транскриптазы для мРНК в качестве мишени и выполнением ПЦР с праймерами, специфическими в отношении различных бактерий. Однако в этом способе сама обратная транскрипция мРНК мертвых клеток не ингибируется, и, когда в тест-пробе содержатся 104 КОЕ/мл или 104 КОЕ/г или более мертвых клеток, детектируется фон этих мертвых клеток. Таким образом, этот способ не может быть назван достаточным в качестве способа определения живых и мертвых состояний.
Конкретно, в качестве способа различения живого состояния и мертвых состояний микроорганизмов, таких как бактерии, с использованием способа ПЦР, были описаны способы, описанные в патентных документах 1 и 2. Однако с использованием этого способа ПЦР остаются следующие проблемы в этих способах различения живого и мертвого состояний микроорганизмов.
Что касается способа, описанного в патентном документе 1, упоминаются примеры различения мертвых клеток, содержащихся в прокипяченных пищевых продуктах, подвергнутых продолжительной стерилизации при высокой температуре при 100°С в течение 10-30 минут, и микроорганизмов, содержащихся в пищевых продуктах, подвергнутых стерилизации этанолом или стерилизации формальдегидом. Однако, особенно в случае обработки последнего типа, нет пищевых продуктов, действительно подвергаемых таким обработкам пастеризации. Кроме того, не предполагается детектирование только живых микроорганизмов, подвергнутых существующему основному способу стерилизации в пищевой промышленности, низкотемпературной длительной пастеризации (LTLT-пастеризации), высокотемпературной кратковременной пастеризации (HTST-пастеризации) или ультравысокотемпературной пастеризации (UHT-пастеризации), и детектирование только живых специфических патогенных бактерий в клинических образцах пациентов с инфекционным заболеванием, которым вводят антибиотики. Кроме того, в случае тест-пробы пищевого продукта или клинического образца, содержащих фон мертвых клеток при концентрации 104 КОЕ/мл или выше, количества конечных продуктов ПЦР-амплификации, полученных из мертвых клеток, превышают предел детектирования способа патентного документа 1, и, следовательно, невозможно определить, происходит ли положительная реакция тест-пробы, полученная при помощи ПЦР, из живых клеток или мертвых клеток.
Далее, в качестве патентного документа 2 описан способ различения живых клеток и мертвых клеток с использованием относительного уменьшения молярного отношения РНК/ДНК мертвых клеток в сравнении с молярным отношением РНК/ДНК живых клеток. В этом способе экстрагируют тотальную РНК, получают комплементарную кДНК с использованием реакции обратной транскрипции, затем выполняют ПЦР для расчета ее величины Ct и молярную концентрацию РНК получают с использованием отдельно полученной калибровочной кривой. Отдельно район хромосомной ДНК, соответствующий этой РНК, амплифицируют при помощи ПЦР для получения ее величины Ct и молярную концентрацию этой хромосомной ДНК рассчитывают на основе этой калибровочной кривой для получения молярного отношении РНК/ДНК. То есть описанная выше процедура требует трудоемкой экстракции общей РНК и выполнения двухстадийной обратной реакции транскрипции и ПЦР. Таким образом, этот способ является худшим относительно обычной ПЦР, нацеленной на ДНК, в определении количества и быстроте выполнения. Далее, РНК непрерывно продуцируется в живых клетках, тогда как РНК, полученная из мертвых клеток, разрушается на ранней стадии. Таким образом, этот способ лишен стабильности. Кроме того, в пищевом продукте или клиническом образце, содержащем мертвые клетки в высокой концентрации, только живые клетки 1/10 этой концентрации могут быть детектированы этим способом. Таким образом, этот способ трудно применять в областях санитарного контроля пищевых продуктов и в клиническом испытании, которые требуют быстроты, высокой чувствительности и точности.
Патентный документ 1: отечественная выложенная публикация японского перевода заявки РСТ (KOHYO) № 2003-530118.
Патентный документ 2: международная патентная публикация WO 2002/052034.
Описание изобретения
Проблемы, подлежащие решению этим изобретением
Задачей настоящего изобретения является обеспечение способа селективного детектирования живых клеток (жизнеспособных и культивируемых клеток) микроорганизма, содержащегося в пищевом продукте или биологической пробе, в противоположность мертвым клеткам или поврежденным клеткам (поврежденным клеткам или жизнеспособным, но не культивируемым клеткам (VNC-клеткам)) микроорганизма, то есть способа быстрого детектирования, альтернативного способу культивирования, но достигающего существующих характеристик способа культивирования, и набора для выполнения этого способа.
Средства решения этих проблем
Авторы настоящего изобретения провели экстенсивные исследования в отношении способа различения между жизнью и смертью микроорганизмов, который применим к различным способам стерилизации и пригоден для санитарного контроля пищи с высокой чувствительностью детектирования, и в отношении способа детектирования конкретного патогена в пациенте с инфекцией в больнице или в клинической практике. В результате авторы настоящего изобретения обнаружили, что эта оценка может выполняться быстро при помощи способа различения живых клеток микроорганизма и поврежденных клеток микроорганизма в тест-пробе, который предусматривает: обработку тест-пробы сшивающим агентом, способным сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм; облучение этой пробы светом, имеющим длину волны 350 нм-700 нм; удаление сшивающего агента; добавление среды, пригодной для культуры для микроорганизма, содержащегося в этой тест-пробе, и инкубирование этой тест-пробы в течение определенного периода времени; обработку этой пробы опять сшивающим агентом; облучение этой пробы светом, имеющим длину волны 350 нм-700 нм, и селективную амплификацию хромосомной ДНК этого микроорганизма реакцией амплификации нуклеиновых кислот. Таким образом, было завершено настоящее изобретение.
То есть настоящее изобретение обеспечивает способ детектирования живой клетки микроорганизма в тест-пробе, предусматривающий стадии:
а) добавления сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, к этой тест-пробе;
b) облучения тест-пробы, к которой добавлен сшивающий агент, светом, имеющим длину волны 350 нм-700 нм;
с) удаления сшивающего агента, содержащегося в тест-пробе, облученной светом;
d) добавления среды к тест-пробе, из которой удален сшивающий агент, и инкубирования этой тест-пробы;
е) добавления опять сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, к инкубированной тест-пробе;
f) облучения тест-пробы, к которой добавлен сшивающий агент, светом, имеющим длину волны 350 нм-700 нм;
g) экстракции ДНК из этой тест-пробы и амплификации района-мишени экстрагированной ДНК при помощи способа амплификации нуклеиновых кислот; и
h) анализа амплифицированного продукта.
В этом способе предпочтительно анализировать амплифицированный продукт на основе калибровочной кривой, которая получена с использованием стандартной пробы этого микроорганизма и показывает зависимость между количеством этого микроорганизма и амплифицированного продукта.
Далее, в этом способе предпочтительно использовать способ ПЦР, LAMP, SDA, LCR или способ микроматрицы ДНК в качестве способа амплификации нуклеиновых кислот.
В предпочтительном варианте осуществления вышеуказанного способа ПЦР выполняют с использованием ПЦР реального времени и выполняют одновременно ПЦР и анализ амплифицированного продукта.
Далее, в этом способе тест-пробой является предпочтительно пищевой продукт, проба крови, проба мочи, проба спинальной жидкости, проба синовиальной жидкости, проба плеврального выпота, промышленная вода, водопроводная вода, грунтовая вода, речная вода или дождевая вода.
Кроме того, в этом способе предпочтительно выбирать сшивающий агент из группы, состоящей из моноазида этидия, диазида этидия, псоларена, 4,5',8-триметилпсоларена и 8-метоксипсоралена.
Далее, в этом способе район-мишень предпочтительно имеет длину 50-5000 оснований.
Далее, в этом способе микроорганизм является предпочтительно патогенной бактерией. В этом аспекте предпочтительно районом-мишенью является патогенный ген.
Кроме того, настоящее изобретение обеспечивает набор для детектирования живой клетки микроорганизма в тест-пробе способом амплификации нуклеиновых кислот, содержащий следующие компоненты:
сшивающий агент, способный сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм;
среду; и
праймер (праймеры) для амплификации района-мишени ДНК микроорганизма, который является мишенью детектирования, способом амплификации нуклеиновых кислот.
В этом наборе предпочтительно способ ПЦР, LAMP, SDA, LCR или способ микроматрицы ДНК представляет собой способ амплификации нуклеиновых кислот.
В этом наборе предпочтительно выбирать сшивающий агент из группы, состоящей из моноазида этидия, диазида этидия, псоларена, 4,5',8-триметилпсоларена и 8-метоксипсоларена.
Краткое описание фигур
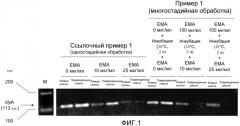
[Фиг.1] Изображение электрофореза, иллюстрирующее интенсивности полос конечных амплифицированных продуктов hlyA-ПЦР Listeria (живых клеток и поврежденных клеток), обработанных одностадийной обработкой и многостадийной обработкой сшивающим агентом (ЕМА).
Живые: живые клетки Listeria.
Поврежденные: поврежденные клетки Listeria.
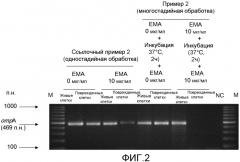
[Фиг.2] Изображение электрофореза, иллюстрирующее интенсивности полос конечных амплифицированных продуктов ompA-ПЦР Enterobacter sakazakii (живых клеток и поврежденных клеток), обработанных одностадийной обработкой и многостадийной обработкой сшивающим агентом (ЕМА).
Живые: живые клетки Enterobacter sakazakii.
Поврежденные: поврежденные клетки Enterobacter sakazakii.
[Фиг.3] Изображение электрофореза, иллюстрирующее интенсивности полос конечных амплифицированных продуктов MMS-ПЦР Enterobacter sakazakii (живых клеток и поврежденных клеток), обработанных одностадийной обработкой и многостадийной обработкой сшивающим агентом (ЕМА).
Живые: живые клетки Enterobacter sakazakii.
Поврежденные: поврежденные клетки Enterobacter sakazakii.
[Фиг.4] Изображение электрофореза, иллюстрирующее интенсивности полос конечных амплифицированных продуктов invA-ПЦР Salmonella (живых клеток и поврежденных клеток), обработанных одностадийной обработкой и многостадийной обработкой сшивающим агентом (ЕМА).
Живые: живые клетки Salmonella.
Поврежденные: поврежденные клетки Salmonella.
[Фиг.5] Изображение электрофореза, иллюстрирующее интенсивности полос конечных амплифицированных продуктов энтеротоксин-ПЦР Salmonella (живых клеток и поврежденных клеток), обработанных одностадийной обработкой и многостадийной обработкой сшивающим агентом (ЕМА).
Живые: живые клетки Salmonella.
Поврежденные: поврежденные клетки Salmonella.
Описание предпочтительных вариантов осуществления
Далее подробно описываются предпочтительные варианты осуществления настоящего изобретения. Однако настоящее изобретение не ограничивается следующими предпочтительными вариантами осуществления и может быть модифицировано в объеме настоящего изобретения. Процент в настоящем описании выражен в виде масс. процента, если нет другого указания.
Мишень, подлежащая детектированию способом настоящего изобретения, включает в себя все типы нуклеиновых кислот, в частности одноцепочечную ДНК, двухцепочечную ДНК, одноцепочечную РНК и двухцепочечную РНК, пока эта мишень может в конечном счете амплифицироваться. Из этих мишеней мишенью, подлежащей детектированию, предпочтительно является ДНК, еще более предпочтительно двухцепочечная ДНК.
<1> Способ настоящего изобретения
Способ детектирования живой клетки микроорганизма в тест-пробе, предусматривающий стадии:
а) добавления сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, к этой тест-пробе;
b) облучения тест-пробы, к которой добавлен сшивающий агент, светом, имеющим длину волны 350 нм-700 нм;
с) удаления сшивающего агента, содержащегося в тест-пробе, облученной светом;
d) добавления среды к тест-пробе, из которой удален сшивающий агент, и инкубирования этой тест-пробы;
е) добавления опять сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, к инкубированной тест-пробе;
f) облучения тест-пробы, к которой добавлен сшивающий агент, светом, имеющим длину волны 350 нм-700 нм;
g) экстракции ДНК из этой тест-пробы и амплификации района-мишени экстрагированной ДНК при помощи способа амплификации нуклеиновых кислот; и
h) анализа амплифицированного продукта.
В описании настоящего изобретения термин «тест-проба» относится к объекту, содержащему живые клетки микроорганизма, подлежащие детектированию. Тест-проба не ограничивается конкретно, пока присутствие микроорганизма может быть детектировано амплификацией специфического района хромосомной ДНК способом амплификации нуклеиновых кислот. Предпочтительные примеры тест-пробы включают в себя пищевые продукты, пробы крови, пробы мочи, пробы спинальной жидкости, пробы синовиальной жидкости, пробы плеврального выпота, промышленную воду, водопроводную воду, грунтовую воду, речную воду и дождевую воду. В частности, предпочтительные примеры пищевых продуктов включают в себя: напитки, такие как безалкогольные напитки, газированные безалкогольные напитки, обогащенные напитки, содержащие фруктовые соки напитки и содержащие Lactobacillus напитки (включая концентраты и порошки этих напитков); замороженные кондитерские продукты, такие как мороженое, фруктовое мороженое и ледяная стружка; молочные продукты, такие как подвергшееся технологической обработке молоко, молочные напитки, кисломолочные продукты и масло; энтеральные пищевые продукты, жидкие пищевые рационы, молоко для новорожденных, напитки для спортсменов; и функциональные пищевые продукты, такие как пищевые продукты диетического питания и диетические добавки. В настоящем изобретении тест-пробой может быть любой из таких продуктов или самих биологических проб или может быть любой из их разбавленных или концентрированных продуктов, полученных другой предобработкой, отличающейся от способа настоящего изобретения. Примеры такой предобработки включают в себя обработку нагреванием, фильтрацию и центрифугирование.
Кроме того, чужеродные вещества, такие как клетки, другие, чем микроорганизмы, коллоидные белковые частицы и липиды, в тест-пробе могут быть удалены или уменьшены обработкой ферментами или т.п. В случае когда эта тест-проба является любой из молока, молочных продуктов и пищевых продуктов, полученных из молока или молочных продуктов, примеры клеток, других, чем микроорганизмы, в этой тест-пробе включают в себя бычьи лейкоциты и эпителиоциты молочной железы. Между тем, в случае когда эта тест-проба является любой из биологических проб, таких как пробы крови, пробы мочи, пробы спинальной жидкости, пробы синовиальной жидкости, пробы плеврального выпота, примеры этих клеток включают в себя эритроциты, лейкоциты (такие как гранулоциты, нейтрофилы, базофилы, моноциты и лимфоциты) и тромбоциты.
Этот фермент не ограничивается конкретно, пока он может деградировать эти чужеродные вещества и не повреждает живые клетки подлежащего детектированию микроорганизма, и примеры его включают в себя липид-деградирующие ферменты и белок-деградирующие ферменты. Из них могут быть использованы один фермент или два или более ферментов, но предпочтительно используют липид-деградирующий фермент и белок-деградирующий фермент.
Примеры липид-деградирующих ферментов включают в себя липазу и фосфатазу, и примеры белок-деградирующих ферментов включают в себя протеиназу К и проназу.
«Микроорганизм» является объектом, подлежащим детектированию способом настоящего изобретения, и не ограничивается конкретно, пока он может быть детектирован способами амплификации нуклеиновых кислот, и сшивающий агент действует на живые клетки этого микроорганизма иным образом, чем на мертвые клетки и поврежденные клетки этого микроорганизма. Предпочтительные примеры включают в себя бактерии, грибы, дрожжи и т.п. Бактерии включают в себя как грамположительные бактерии, так и грамотрицательные бактерии. Примеры грамположительных бактерий включают в себя бактерии Staphylococcus, такие как Staphylococcus epidermifis, бактерии Streptococcus, бактерии Listeria, такие как Listeria monocytogenes, бактерии Bacillus, такие как Bacillus cereus, бактерии Mycobacterium, бактерии Clostridium, такие как Clostridium botulinum и Clostridium perfringens и т.д. Примеры грамотрицательных бактерий включают в себя бактерии Escherichia, такие как Escherichia coli, бактерии Enterobacter, такие как Enterobacter sakazakii, бактерии Citrobacter, такие как Citrobacter kozeri, и бактерии Klebsiella, такие как Klebsiella oxytoca, бактерии Salmonella, бактерии Vibrio, бактерии Pseudomonas, и т.д.
В настоящем изобретении термин «живая клетка» относится к клетке в таком состоянии, что эта клетка пролиферирует и проявляет метаболические активности этого микроорганизма (жизнеспособном и культивируемом состоянии), когда ее культивируют обычно при предпочтительных условиях культивирования, и является клеткой, по существу не имеющей повреждения клеточной стенки. Что касается вышеупомянутых метаболических активностей, примерами могут быть АТФ-активность, эстеразная активность и т.д.
«Мертвая клетка» является клеткой в таком состоянии, что она не может пролиферировать и не проявляет метаболические активности (мертвом состоянии), даже если ее культивируют при оптимальных условиях культивирования. Кроме того, она находится в таком состоянии, что, хотя структура клеточной стенки сохраняется, сама эта клеточная стенка является сильно поврежденной и ядерный агент-краситель, проявляющий слабую проникаемость, такой как иодид пропидия, может проникать или увеличивать проницаемость этой клеточной стенки.
«Поврежденная клетка» (поврежденная клетка или жизнеспособная, но не культивируемая клетка) является клеткой в таком состоянии, что даже при культивировании при обычно предпочтительных условиях культивирования она едва ли пролиферирует, так как она повреждена вследствие искусственного стресса или связанного с окружающей средой стресса, и она обнаруживает метаболические активности на более низком уровне в сравнении с живой клеткой, но на значимом уровне в сравнении с мертвой клеткой.
Детектирование бактерий, проявляющих состояние поврежденной клетки вследствие обработки слабым нагреванием или введением антибиотиков, привлекает внимание, в частности, в области санитарного контроля пищевых продуктов и клинического исследования, и настоящее изобретение обеспечивает способ детектирования микроорганизма, который позволяет не только детектирование живых клеток, но также различение живых клеток и мертвых клеток или поврежденных клеток.
Единицей количества клеток является обычно количество клеток/мл для всех живых клеток, поврежденных клеток и мертвых клеток. Количество живых клеток может быть аппроксимировано количеством образованных колоний (КОЕ/мл (колониеобразующих единиц/мл)), получаемых культивированием этих клеток при оптимальных условиях на подходящей среде для чашек. Стандартная проба поврежденных клеток микроорганизма может быть приготовлена, например, подверганием суспензии живых клеток обработке нагреванием, например обработке нагреванием в кипящей воде. Количество поврежденных клеток в такой пробе может быть аппроксимировано КОЕ/мл в суспензии живых клеток перед обработкой нагреванием. Хотя время обработки нагреванием в кипящей воде для получения поврежденных клеток варьируется в зависимости от типа микроорганизма, поврежденные клетки бактерий, описанных в примерах, например, могут быть получены обработкой нагреванием приблизительно 50 секунд. Кроме того, стандартная проба поврежденных клеток микроорганизма может быть также приготовлена обработкой антибиотиком. В таком случае количество поврежденных клеток может быть аппроксимировано на основе количества образованных колоний (КОЕ/мл), наблюдаемых при культивировании этих клеток при оптимальных условиях на подходящей среде для чашек, т.е. суспензию живых клеток обрабатывают антибиотиком, затем антибиотик удаляют, измеряют коэффициент пропускания видимого света (длина волны: 600 нм) через эту суспензию, т.е. мутность этой суспензии, и измеренная мутность может сравниваться с мутностью суспензии живых клеток с известной плотностью живых клеток для расчета количества поврежденных клеток, обработанных антибиотиком.
Способ настоящего изобретения предназначен для детектирования живых клеток микроорганизма, и клетками этого микроорганизма, отличаемыми от живых клеток, могут быть поврежденные клетки или мертвые клетки.
В настоящем изобретении «детектирование живых клеток» включает в себя как определение присутствия или отсутствия живых клеток в тест-пробе, так и определение количества живых клеток в тест-пробе. Это количество живых клеток не ограничивается абсолютным количеством и может быть относительным количеством относительно количества живых клеток в контрольной пробе.
Далее способ настоящего изобретения будет объяснен для каждой стадии.
(1) Стадия а)
Тест-пробу обрабатывали сшивающим агентом, способным сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм.
Сшивающим агентом, который должен быть использован в настоящем изобретении, является сшивающий агент, который может интеркалироваться в хромосомную ДНК и связываться ковалентно с хромосомной ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, для сшивания посредством этого молекул ДНК.
Этот сшивающий агент предпочтительно имеет различные действия на живые клетки микроорганизма в сравнении с поврежденными или мертвыми клетками микроорганизма и соматическими клетками, такими как бычьи лейкоциты, лейкоциты или тромбоциты. Более конкретно, этим сшивающим агентом является предпочтительно сшивающий агент, который более легко проходит через клеточные мембраны соматических клеток, таких как бычьи лейкоциты, лейкоциты или тромбоциты, в сравнении с клеточными стенками живых клеток микроорганизма.
Примеры этого сшивающего агента включают в себя моноазид этидия, диазид этидия, псоларен, 4,5',8-триметилпсоларен (PMA) и 8-метоксипсоларен. Один тип этих сшивающих агентов может использоваться отдельно, или могут быть использованы два или более их типа в комбинации.
Условия обработки сшивающим агентом могут быть установлены подходящим образом. Например, условия для легкого различения живых клеток микроорганизма и мертвых или поврежденных клеток микроорганизма могут быть определены: добавлением различных концентраций сшивающего агента к суспензиям живых клеток подлежащего детектированию микроорганизма и мертвых и поврежденных клеток микроорганизма; оставлением этих суспензий стоять в течение различных периодов времени; разделением этих клеток центрифугированием и анализом этих клеток при помощи способа амплификации нуклеиновых кислот. Кроме того, условия легкого различения живых клеток микроорганизма и разнообразных клеток могут быть определены: добавлением различных концентраций сшивающего агента к суспензиям живых клеток подлежащего детектированию микроорганизма и соматических клеток, таких как бычьи лейкоциты или тромбоциты; оставлением этих суспензий стоять в течение различных периодов времени; разделением этих клеток и разнообразных клеток центрифугированием и анализом этих клеток при помощи способа амплификации нуклеиновых кислот. Конкретно: примерами условий являются условия обработки моноазидом этидия при конечной концентрации 1-100 мкг/мл в течение 5 минут-48 часов при 4-10°С; условия обработки диазидом этидия при конечной концентрации 1-100 мкг/мл в течение 5 минут-48 часов при 4-10°С; условия обработки псолареном при конечной концентрации 1×10-5-10 мкг/мл в течение 5 минут-48 часов при 25-37°С; условия обработки 4,5',8-триметилпсолареном при конечной концентрации 1×10-5-10 мкг/мл в течение 5 минут-48 часов при 25-37°С; и условия обработки 8-метоксипсолареном при конечной концентрации 1×10-5-10 мкг/мл в течение 5 минут-48 часов при 25-37°С.
(2) Стадия b)
Затем каждую тест-пробу, содержащую сшивающий агент, облучают светом, имеющим длину волны 350 нм-700 нм.
Этот сшивающий агент может легко проходить через клеточные стенки мертвых клеток и поврежденных клеток в сравнении с клеточными стенками живых клеток микроорганизма. Таким образом, предполагается, что этот сшивающий агент по существу не проходит через клеточные стенки живых клеток микроорганизма, но проходит через клеточные стенки поврежденных или мертвых клеток микроорганизма или мертвых соматических клеток, при условии, что эту обработку выполняют в пределах вышеупомянутых периодов времени. Между тем, живые соматические клетки имеют только клеточные мембраны и не имеют клеточных стенок, и, следовательно, предполагается, что этот сшивающий агент проходит через соматические клетки. В результате сшивающий агент перемещается в мертвые соматические клетки, мертвые и поврежденные клетки микроорганизма и случайным образом связывается ковалентным присоединением с хромосомной ДНК или интеркалируется в хромосомную ДНК. Затем этот сшивающий агент облучается светом, имеющим длину волны 350 нм-700 нм, для сшивания молекул ДНК и вызывает большую деформацию в хромосомной ДНК, приводя к разрыванию (фрагментации/расщеплению) хромосомной ДНК.
Свет, имеющий длину волны 350 нм-700 нм, может включать в себя по меньшей мере свет, имеющий длину волны 350 нм-700 нм, и этот свет может быть светом единственной длины волны или светом множественных длин волн. Кроме того, все компоненты света могут находиться в диапазоне 350 нм-700 нм или этот свет может включать в себя коротковолновый свет, имеющий длину волны, более короткую чем 350 нм, и/или длинноволновый свет, имеющий длину волны, более длинную чем 700 нм. Пик в распределении интенсивности находится предпочтительно в диапазоне 350 нм-700 нм. Предпочтительно этот свет не включает в себя компонент с короткой длиной волны в такой степени, что хромосомная ДНК микроорганизма расщепляется только облучением светом.
Когда хромосомная ДНК поврежденных или мертвых клеток разрывается, что более предпочтительно, чем хромосомная ДНК живых клеток микроорганизма, район-мишень хромосомной ДНК живых клеток амплифицируют способом амплификации нуклеиновых кислот, в то время как район-мишень поврежденных или мертвых клеток разрывается (расщепляется), приводя к ингибированию реакций амплификации нуклеиновой кислоты. В результате живые клетки микроорганизма могут быть детектированы более селективно, чем поврежденные или мертвые клетки.
В предпочтительном варианте осуществления настоящего изобретения сшивающим агентом является моноазид этидия, и этот способ включает в себя стадию облучения тест-пробы, к которой добавлен моноазид этидия, светом, имеющим длину волны 350 нм-700 нм. Моноазид этидия (ЕМА) может легко проходить через клеточные стенки поврежденных или мертвых клеток в сравнении с клеточными стенками живых клеток микроорганизма. Таким образом, предполагается, что ЕМА по существу не проходит через клеточные стенки живых клеток микроорганизма, но проходит через клеточные стенки поврежденных или мертвых клеток микроорганизма или клеточные мембраны мертвых соматических клеток. Следует обратить внимание на то, что, в случае когда живыми клетками являются лейкоциты и тромбоциты в крови, ЕМА может легко проходить через клеточные стенки этих клеток в стерилизованной воде или гипотоническом солевом растворе. ЕМА перемещается в мертвые соматические клетки и поврежденные и мертвые клетки и интеркалируется случайным образом в ядерную ДНК, и только ЕМА, интеркалируемый при облучении светом, имеющим длину волны 350 нм-700 нм, превращается в нитрен и связывается ковалентно с ядерной ДНК со сшиванием ДНК-молекул. Затем предполагается, что ЕМА, который связывается ковалентно с основаниями и дезоксирибозами в хромосомной ДНК во многих точках, вызывает большую деформацию в хромосомной ДНК, приводя к разрыванию (фрагментированию) этой хромосомной ДНК.
Даже если сшивающий агент является другим, чем моноазид этидия, сшивающий агент может быть использован в настоящем изобретении, пока этот сшивающий агент может более легко проходить через клеточные стенки поврежденных или мертвых клеток в сравнении с клеточными стенками живых клеток микроорганизма и может сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм (длинноволновым ультрафиолетовым светом или видимым светом), для разрывания посредством этого хромосомной ДНК.
Условия для обработки ЕМА могут быть определены подходящим образом. Например, условия, которые позволяют легкое различение между живыми клетками микроорганизма и мертвыми клетками и поврежденными клетками, могут быть определены добавлением ЕМА при различных концентрациях к суспензиям живых клеток и поврежденных клеток или мертвых клеток микроорганизма, являющегося объектом детектирования, оставлением их в течение различных периодов времени, затем облучением их видимым светом, удалением этих клеток центрифугированием или т.п., при необходимости, и выполнением анализа при помощи способов амплификации нуклеиновых кислот. Предпочтительные условия для облучения видимым светом могут быть подходящим образом определены выполнением такого эксперимента, какой упомянут выше, с использованием различных периодов времени облучения. Конкретные примеры условий для облучения видимым светом включают в себя облучение видимым светом 100-750 ватт в течение 5 минут-2 часов с расстояния 10-50 см от тест-пробы. Облучение видимым светом предпочтительно выполняют при низкой температуре, например с охлаждением этой пробы на льду.
(3) Стадия с)
Непрореагировавший сшивающий агент, содержащийся в тест-пробе, обработанной облучением светом, удаляют из тест-пробы.
Эту стадию предпочтительно выполняют сразу же после стадии b). Примеры способа удаления сшивающего агента включают в себя способ, предусматривающий: центрифугирование тест-пробы для отделения осадков, содержащих микроорганизмы, от супернатанта, содержащего сшивающий агент; и удаление этого супернатанта. Этот способ может дополнительно включать в себя, после удаления сшивающего агента, стадию промывания микроорганизмов агентом очистки.
(4) Стадия d)
Затем к тест-пробе, из которой удален сшивающий агент, добавляют среду и полученную смесь инкубируют.
Эта среда является предпочтительно средой, подходящей для культивирования микроорганизма, содержащегося в этой тест-пробе, и особенно предпочтительно используют жидкую среду. Ее конкретные примеры включают в себя бульонную среду, пептонную среду, инфузионный мясопептонный бульон с сердечно-мозговым экстрактом (BHI). Инкубирование предпочтительно выполняют при температуре, подходящей для пролиферации детектируемого микроорганизма, например при оптимальной температуре культивирования микроорганизма или при температуре, сходной с оптимальной температурой культивирования. Оптимальная температура культивирования микроорганизма может быть определена: культивированием микроорганизма при различных температурах и выбором температуры, при которой этот микроорганизм может наиболее активно пролиферировать. Например, в случаях вышеупомянутых бактерий, температура обычно равна 20°С-43°С, предпочтительно 25°С-37°С, более предпочтительно 30°С-37°С. Время инкубирования конкретно не ограничивается, пока микроорганизм в пробе может пролиферировать. Конкретно, это время равно, например, 0,5-48 часам, предпочтительно 1-24 часам, более предпочтительно 2-3 часам. При инкубировании тест-пробы, содержащей микроорганизм, в среде живые клетки микроорганизма, не имеющего сшивающего агента и не имеющего разорванной хромосомной ДНК, могут пролиферировать при культивировании в этой среде, что может улучшать чувствительность детектирования в различении между присутствием и отсутствием живых клеток микроорганизма в тест-пробе и в определении количества живых клеток микроорганизма.
(5) Стадии е) и f)
Стадии е) и f) выполняют таким же образом, что и стадии а) и b) соответственно.
Ожидается, что живые клетки микроорганизма в тест-пробе пролиферируют выполнением стадии d), так что может увеличиваться различие между чувствительностью детектирования живых клеток и чувствительностью детектирования других клеток посредством выполнения стадий е) и f) после стадии d). Это может разительно улучшать чувствительность детектирования в различении между присутствием и отсутствием живых, поврежденных или мертвых клеток в тест-пробе и в определении количества живых клеток микроорганизма. Сшивающий агент, добавляемый в стадии е), и сшивающий агент в стадии а) могут быть одинаковыми или отличающимися друг от друга.
Особенно предпочтительным аспектом настоящего изобретения является последовательное выполнение: добавления сшивающего агента к тест-пробе и обработки облучения светом; удаления сшивающего агента центрифугированием; добавления и инкубирования среды; дополнительного добавления сшивающего агента и обработки облучением светом. После вышеупомянутых последовательных обработок следующий процесс может быть повторен несколько раз для дополнительного улучшения чувствительности детектирования: удаление сшивающего агента; добавление и инкубирование среды; и дополнительное добавление сшивающего агента и обработка облучением светом. Конкретно, стадии с), d) и f) могут повторяться два или более раз после стадий а) и b).
В примерах и сравнительных примерах ниже процесс, который включает в себя только стадии а) и b) и не включает в себя стад