Способ профилактики токсического действия кадмия у экспериментальных животных
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной токсикологии, и может быть использовано для профилактики токсического действия кадмия у экспериментальных животных. Для этого животным ежедневно вводят раствор сульфата кадмия подкожно в дозе 0,1 мг/кг. Предварительно, за 30 минут до введения сульфата кадмия, ежедневно один раз в сутки через зонд в желудок вводят ацизол в дозе 30 мг/кг. Способ обеспечивает эффектное снижение и коррекцию токсического действия кадмия при хроническом отравлении его соединениями. 2 табл., 7 ил.
Реферат
Изобретение относится к экологии, медицине, токсикологии, экспериментальной биологии и может быть использовано при исследовании механизмов профилактики токсического действия тяжелых металлов, в частности кадмия.
Влияние тяжелых металлов - эта тема стала широко обсуждаемой в научных кругах и популярной литературе в связи с известной экологизацией этого вопроса. Массовый выброс такого металла, как кадмий, в экосферу, а также избыточное включение его в процессы жизнедеятельности в итоге приводит к целому ряду патологических состояний. Высокая токсическая опасность кадмия усиливается его кумулятивными свойствами, поскольку он накапливается в течение жизни и к 50 годам может достигать 20-30 мг, в то время как период полувыведения его составляет - от 17 до 30 лет (I.Franchini et al., 1990).
При избыточном накоплении в организме он оказывает патологическое влияние на различные уровни обмена веществ: так на молекулярном уровне кадмий способен соединяться с меркаптогруппами различных энзимов; разобщать процессы окислительного фосфорилирования; замещать цинк в ряде металлоэнзимов, изменяя их активность; усиливать активность перекисного окисления липидов (C.R.Angle et al., 1993; В.Н.Кухта и соавт., 2000; Е.Casalino et аl., 2002). Введение животным больших доз солей кадмия, приводит к гиперпродукции супероксидных анионов и накоплению метаболитов окислительной реакции (I.Ambrosi et al., 1990; S.Sarkar et al., 1994). Наиболее интенсивно (В.O.Lund, D.M.Miller, 1993) перекисное окисление, усиленное действием соли кадмия, протекает в митохондриях, вызывая нарушение их функций, что могло быть связано с преимущественным распределением металла в митохондриальной фракции клеток (J.Martel et al., 1990; C.R.Angle et al., 1993).
Также кадмий приводит к повреждению (нарушению) нормальной цепи процесса дыхания как на уровне тканевого дыхания, связываясь с белковыми структурами митохондриального матрикса и повреждая ее мембрану (Коротков С.М. и соавт., 1996; Трахтенберг И.М., Иванова Л.А., 1999), а также ингибируя ферментные системы окислительного фосфорилирования (сукцинатдегидрогеназу, АТФ-азу и др.), так и на уровне захвата и переноса кислорода в крови, при накоплении в эритроцитах в связи с гемоглобином (Авцин А.П., 1991), вызывая гемолиз и приводя к выраженной анемии с прогрессивным снижением уровня гемоглобина. В свою очередь, гипоксия может стать еще одним фактором, провоцирующим активацию перекисного окисления липидов.
Вышеописанные эффекты могут лежать в основе целого ряда патологических состояний, связанных с избытком кадмия в организме, что и натолкнуло авторов на необходимость экспериментального исследования влияний металлокомплекса соли цинка с 1-винилимидазолом - ацизола на прооксидантные эффекты кадмия. Известно, что препарат ацизол, разработанный в Иркутском институте органической химии им. А.Е.Фаворского, является самым мощным и единственным в мире противогипоксическим средством, способным защитить организм при низком парциальном давлении кислорода и недостаточной оксигенации гемоглобина, снижать потребность организма в кислороде. Препарат способствует повышению устойчивости к гипоксии органов, чувствительных к недостатку кислорода. По мнению разработчиков, он может применяться также с целью защиты клеточных мембран от воздействия продуктов перекисного окисления липидов. Кроме того, содержащийся в ацизоле цинк, устраняя его дефицит в организме, нормализует каскады метаболических процессов, связанных с работой цинкзависимых ферментных систем.
Таким образом, целью исследования было выявить профилактическое влияние ацизола на некоторые гематологические показатели и маркеры активности перекисного окисления липидов в условиях токсического действия сульфата кадмия при длительном подкожном введении последнего.
Известно множество детоксикантов, способных снижать токсическое действие тяжелых металлов на организм. К ним относятся тиоловые соединения - тетацин кальций, унитиол, тиосульфат натрия, различные комплексообразующие соединения - пентацин, динатриевая соль этилендиаминтетрауксусной кислоты, дефероксамин, пеницилламин и др. (Машковский М.Д. Лекарственные средства: в 2-х томах. Т. 2. - Харьков «Торсинг», 1998. С.212-220). Применение, особенно длительное, этих синтетических препаратов способно вызвать различные побочные эффекты: расстройства ЖКТ, аллергические реакции, анемию, лейкопению, тромбоцитопению, острый некроз проксимальных канальцев нефронов и др. Также наряду с токсинами они способны выводить из организма микроэлементы и такие жизненно важные ионы, как железо, кальций, цинк и др., и вызывать нарушение обменных процессов, что затрудняет их длительное и профилактическое применение.
Известны также средства, понижающие токсическое действие тяжелых металлов, в том числе и кадмия, например ксидифон и сукцимер (Машковский М.Д. Лекарственные средства: в 2-х томах. Т.2. - Харьков «Торсинг», 1998. С.212-220).
Недостатком этого способа является то, что препараты вызывают побочные эффекты, а профилактическое их влияние мало изучено. Сукцимер (унитиол) наряду с побочными действиями может оказывать мембранотоксический эффект, вследствие чего ограничена возможность его длительного профилактического использования. Ксидифон при длительном применении может изменять обмен жизненно важных электролитов, таких как кальций и магний, баланс которых в организме и без того меняется при кадмиевой интоксикации.
Заявляемое изобретение направлено на решение задачи, заключающейся в разработке способа профилактики токсического действия кадмия при хроническом отравлении.
Решение этой задачи обеспечивает значительное снижение токсического действия кадмия на органы и ткани при хроническом отравлении путем снижения повреждающего действия кадмия на клетки за счет цитопротекторного действия, основанного на предупреждении развития гипоксической активации перекисного окисления липидов клеток, и снижения активности ферментных систем за счет конкуренции между ионами кадмия и цинка в зоне связывания их в молекуле ферментов.
Для достижения этого технического результата заявляемое изобретение способа профилактики токсического кадмия у экспериментальных животных при хроническом отравлении имеет следующие отличительные признаки: животным ежедневно, один раз в сутки, вводят ацизол в дозе 30 мг/кг через зонд в желудок, предварительно, за 30 минут перед ежедневным введением раствора сульфата кадмия подкожно в дозе 0,1 мг/кг.
Ацизол вводится в те же сроки (в пределах - 2 месяцев) с сульфатом кадмия, что позволяет оценить его профилактический эффект при хронической интоксикации. Ацизол обладает комбинированным полезным действием при хронической кадмиевой интоксикации - является мощным антигипоксантом и донатором ионов цинка.
Профилактическое предварительное ежедневное введение ацизола, один раз в сутки, через зонд в желудок в дозе 30 мг/кг за 30 минут перед ежедневным введением раствора сульфата кадмия подкожно приводит к уменьшению патологического воздействия тяжелого металла у экспериментальных животных. Заявленный способ является эффективным, экономически выгодным и легко воспроизводимым.
По имеющимся у авторов сведениям совокупность существенных признаков, характеризующих сущность заявляемого изобретения, не известна, что позволяет сделать вывод о соответствии изобретения критерию «новизна».
По мнению авторов, сущность заявляемого изобретения не следует для специалистов явным образом из известного уровня медицины, так как из него не выявляется вышеуказанная возможность получения способа профилактики токсического действия кадмия у экспериментальных животных при хроническом отравлении, отличающегося тем, что животным ежедневно вводят ацизол в дозе 30 мг/кг через зонд в желудок, предварительно, за 30 минут перед введением раствора сульфата кадмия подкожно в дозе 0,1 мг/кг, что позволяет сделать вывод о соответствии критерию «изобретательский уровень».
Совокупность существенных признаков, характеризующих сущность изобретения, в принципе может быть многократно использована в медицине с получением результата, заключающегося в эффективном и легко воспроизводимом способе профилактики токсического действия кадмия путем снижения повреждающего действия кадмия на клетки за счет цитопротекторного действия, основанного на предупреждении развития гипоксической активации перекисного окисления липидов клеток, и снижения активности ферментных систем за счет конкуренции между ионами кадмия и цинка в зоне связывания их в молекуле ферментов, что позволяет сделать вывод о соответствии изобретения критерию «промышленная применимость».
Данный способ осуществляется следующим образом.
Для получения токсического вещества сульфат кадмия растворяется в стерильной дистиллированной воде таким образом, что на единицу раствора, равную 1 мл, приходится 0,1 мг кадмия (в пересчете на металл). На каждые 100 г веса крысы ежедневно, один раз в сутки, вводится подкожно 0,1 мл токсического раствора в течение двух месяцев. Путем растворения 3 г ацизола в 100 мл дистиллированной воды получаем раствор ацизола с содержанием 30 мг в 1 мл. Раствор ацизола вводим ежедневно, один раз в сутки, в те же сроки, в течение двух месяцев, через зонд в желудок при помощи шприца со специально изогнутой иглой, на которую надет зонд в количестве 0,1 мл на каждые 100 г, за 30 минут перед введением сульфата кадмия.
В конце первого и второго месяца эксперимента определяли показатели, характеризующие активность перекисного окисления липидов, и некоторые гематологические показатели.
Для гистологических исследований образцы тканей (печень, почка, сердце) фиксировали в 10% нейтральном формалине, после чего подвергали заливке в парафин с последующим приготовлением срезов толщиной 7-8 микрон. Срезы окрашивались гематоксилином и эозином. Изучение срезов проводилось в проходящем свете при помощи микроскопа Микмед-1 под увеличением 80×200×400.
Сущность способа подтверждается морфологически, что отображается на прилагаемых чертежах, где:
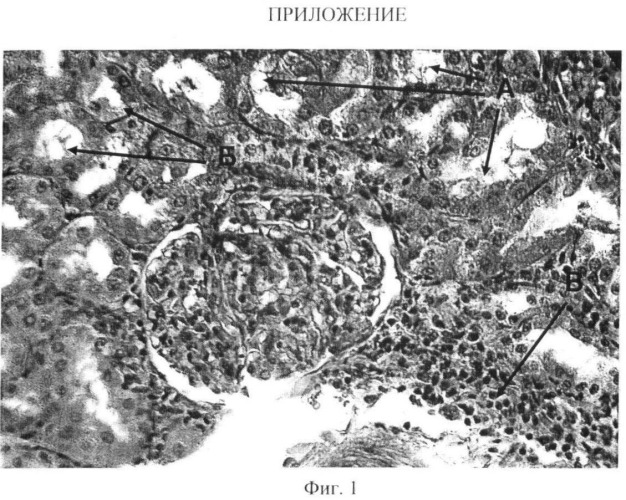
Фигура 1 отображает ткань почек крыс при подкожном введении соли кадмия в дозе 0,1 мг/кг с явлениями токсического кадмиевого тубуло-интерстициального нефрита;
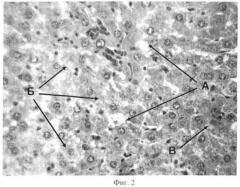
Фигура 2 отображает ткань печени крыс при подкожном введении соли кадмия в дозе 0,1 мг/кг с явлениями кадмиевого токсического гепатоза;
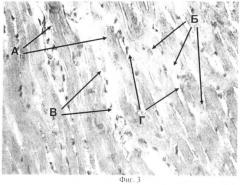
Фигура 3 - миокард крыс при подкожном введении соли кадмия в дозе 0,1 мг/кг с явлениями кадмиевого токсического миокардита;
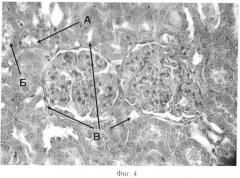
Фигура 4 отображает ткань почек крыс при профилактическом введении ацизола на фоне кадмиевой нефропатии;
Фигура 5 - ткань печени крыс при профилактическом введении ацизола на фоне кадмиевого токсического гепатоза;
Фигура - 6 миокард крыс при профилактическом введении ацизола на фоне кадмиевого токсического миокардита.
У животных с изолированным ежедневным введением сульфата кадмия отмечаются гистологические изменения, представленные проявлениями дистрофии, некроза, дисциркуляторных процессов и воспалительной реакции. Так дистрофические процессы в ткани почек (Фиг.1) представлены гидропической дистрофией, проявления которых варьируют от частичной вакуолизации цитоплазмы эпителия канальцев и эндотелия капилляров до тотального колликвационного некроза клетки (А). Некроз проявляется наличием групп клеток, занимающих местами целиком поле зрения. Местами подобные изменения захватывали не только эпителий канальцев, но и клубочек. Альтеративные изменения встречаются преимущественно в корковом веществе. За счет дистрофических и некротических изменений просвет канальцев по большей части отсутствует, местами просвет канальцев вакуолизирован (Б), клубочки набухшие, местами гиалинизированы. Собирательные трубочки в мозговом веществе в просвете с белковыми массами, интенсивно окрашенными эозином. Воспаление представлено крайне скудными смешанными периваскулярными инфильтратами, редко встречающимися на препарате (В). Дисциркуляторные изменения представлены полнокровием сосудов, преимущественно коркового вещества. Сосуды с утолщенной стенкой, отечны, местами гиалинизированы.
Изменения в ткани печени (Фиг.2) представлены проявлениями дистрофии, апоптоза и воспалительной реакции. Дистрофические процессы представлены гидропической дистрофией (А) с вакуолизацией цитоплазмы гепатоцитов, местами до фокального колликвационного некроза. Некротический процесс распознается по наличию групп клеток с признаками кариолизиса (Б). Группы подобных клеток (подвергшихся гидропической дистрофии и некрозу) обнаруживались по всей площади долек, местами располагаясь в непосредственной близости от центральной вены, в основном же по периферии долек ближе к портальному тракту. Апоптоз диагностируется по наличию апоптоидных телец на разной стадии их формирования. Начиная от фрагментации ядра внутри клетки, при этом фрагменты распадающегося ядра гиперхромированы и имеют округлые очертания, и заканчивая образованием апоптозных телец, имеющих вид мелких клеток с гиперхромным ядром, заполняющим практически всю клетку и оттесняющим к периферии резко эозинофильную цитоплазму. Количество апоптоидных телец на разной стадии формирования оценивается как большое. Воспалительная реакция проявилась во всех случаях периваскулярной лимфогистиоцитарной инфильтрацией. Отмечены очаговые кровоизлияния (В).
В препаратах миокарда крыс (Фиг.3), подверженных изолированному воздействию кадмия, отмечено наличие участков повышенной эозинофилии кардиомиоцитов (А), в тех же участках с их фрагментацией и исчезновением поперечной исчерченности (Б). Сосуды полнокровны с явлениями периваскулярного отека. Отмечается жировая дистрофия кардиомиоцитов (В), а также отек стромы (Г).
Морфологические отличия между группами с изолированным введением соли кадмия и сочетанным введением сульфата кадмия и ацизола (Фиг.4, 5, 6) заключаются в уменьшении степени выраженности проявлений всех вышеуказанных патологических процессов.
Количество нефроцитов (Фиг.4) с признаками кариолизиса, по сравнению с группой с изолированным введением соли кадмия, небольшое (А). Количество гиалинизированных клубочков, а также клубочков с выраженной гидропической дистрофией эндотелиоцитов крайне незначительно. Также уменьшено количество клеток эпителия канальцев, в которых гидропическая дистрофия достигает перехода в тотальный колликвационный некроз (Б). Количество канальцев с сохраненным просветом также значительно больше, чем в группе с изолированным введением сульфата кадмия (В).
В ткани печени, при сочетанном введении соли кадмия с ацизолом (Фиг.5), выраженность таких процессов, как дистрофия и некроз, снизилась. При этом клетки, имеющие признаки подобного рода поражения, располагались не ближе, чем на 1/3 по направлению к центральной вене, т.е. альтеративные изменения захватывали только 2/3 площадей долек, ближних к портальному тракту. Количество апоптоидных телец, по сравнению с препаратами печени животных из группы с изолированным введением кадмия, резко уменьшено и носит очаговый характер по периферии долек (А). Отмечены компенсаторно-приспособительные процессы в виде регенераторных процессов в паренхиме, проявляющихся в появлении большого количества многоядерных гепатоцитов (Б). Воспалительная реакция выражена крайне слабо и проявляется также в виде пролиферации эндотелиоцитов. Неоднородное восприятие окраски эозина различными участками цитоплазмы гепатоцитов свидетельствует об изменении содержания гликогена в гепатоцитах, поскольку эти участки не имеют четких границ, что отличает их от проявлений гидропической и жировой дистрофии гепатоцитов.
В миокарде (Фиг.6) отмечены крайне редкие участки эозинофилии и фрагментации кардиомиоцитов (А). Уменьшено явление полнокровия и периваскулярных отеков. Практически по всему препарату в волокнах сохраняется поперечная исчерченность (Б). Жировая дистрофия кардиомиоцитов также гораздо реже встречается, чем в препаратах с изолированным введением соли кадмия.
Пример 1. Двум группам крыс-самцов (№ 1 - контроль, № 2 - опыт с ацизолом) линии Вистар массой 200-300 г вводили подкожно раствор сульфата кадмия в дозе 0,1 мг/кг каждый день в течение двух месяцев один раз в сутки.
Ацизол вводили через зонд в желудок ежедневно в дозе 30 мг/кг группе № 2 один раз в сутки, за 30 минут перед введением сульфата кадмия. Через 1 месяц и через 2 месяца определяли такие показатели активности перекисного окисления липидов (ПОЛ), как уровень малонового диальдегида и гидроперекисей, а также компонентов антиоксидантной системы: активность каталазы и супероксиддисмутазы. Наряду с прямыми «участниками» этой цепи реакций была исследованы некоторые гематологические показатели - содержание гемоглобина, гематокрит и наличие метгемоглобина, а также осмотическая стойкость эритроцитов, как косвенный признак активации ПОЛ.
Анализ результатов исследования показал, что изолированное введение сульфата кадмия (в группе № 1) через один месяц эксперимента (табл.1) привело к достоверному увеличению концентрации гидроперекисей в сыворотке крови, уровень же МДА в этот срок достоверно не изменился, при этом показатели антиоксидантной защиты увеличились в значительной степени, что, вероятно, есть проявление компенсаторной реакции этой системы. Так активность каталазы возросла более чем в три раза, наряду с увеличением СОД. В эти же сроки исследования у животных группы № 2 с сочетанным введением соли кадмия и ацизола не отмечалось достоверных отличий как в уровне МДА, так и ГП, при этом уровень гидроперекисей в сыворотке крови отличался от такового в группе № 1.
Активность каталазы в плазме у животных группы № 2 не изменилась по отношению к фону, что отличало ее от показателей группы с изолированным введением соли кадмия. В то же время активность фермента (Таблица 1) СОД увеличилась в той же степени, что и в группе № 1.
| Таблица 1 | |||||
| Влияние ацизола на некоторые показатели активности ПОЛ в условиях подкожного введения сульфата кадмия в дозе 0.1 мг/кг (М±м) | |||||
| Фон | Группа №1 | Группа №2 | |||
| 1 месяц | 2 месяц | 1 месяц | 2 месяц | ||
| Гидроперекиси, мкмоль/л | 2,039±0,148 | 3,31±0,061* | 3,67±0,087* | 2,46±0,21*) | 2,75±0,20**) |
| МДА, мкмоль/л | 9,34±0,32 | 10,05±0,37 | 11,79±0,48* | 10,07±0,27 | 9,94±0,37*) |
| Каталаза, мкат/л | 15,25±1,66 | 58,07±1,17* | 59,20±1,92* | 16,13±2,13*) | 28,12±2,13**) |
| СОД, % ингибирования | 28,44±0,95 | 40,91±1,09* | 38,5±1,15* | 42,21±0,41* | 46,17±0,69**) |
| * - р относительно фона | |||||
| *) - р относительно опыта |
Через два месяца эксперимента в группе с введением соли кадмия все исследуемые показатели достоверно отличались от фоновых (табл.1), увеличилась концентрация МДА и ГП, а также маркеры антиоксидантной активности - каталаза и СОД. Введение ацизола на фоне кадмиевой интоксикации в эти сроки исследования у животных группы № 2 привело к нивелированию изменения уровня МДА, наблюдавшегося в группе № 1, достоверно уменьшило степень изменения концентрации гидроперекисей в сыворотке крови. Также через 2 месяца в этой группе было отмечено увеличение активности каталазы и СОД, однако уровень активности каталазы был достоверно ниже, чем у крыс с изолированным введением соли кадмия, а активность супероксиддисмутазы была выше таковой у животных в группе №1.
В конце эксперимента сравнивали показатели осмотической резистентности эритроцитарных мембран (фиг.7) в исследуемых группах, что выявило значительное снижение последней в обеих группах (№ 1 и № 2), однако выраженность снижения была более значительной в группе с изолированным введением сульфата кадмия.
Уровень гемоглобина и гематокрит (табл.2) в опытной группе №1 через один месяц оставались без достоверных изменений. Достоверно снизилась концентрация гемоглобина в крови в этой группе животных относительно фона через два месяца, наряду с процентной массой эритроцитов - гематокритом. У животных с профилактическим введением ацизола достоверного изменения концентрации гемоглобина относительно фона не было ни в один из сроков определения и, соответственно, этот показатель через два месяца эксперимента достоверно отличался от значения в группе с изолированным введением сульфата кадмия. Показатели гематокрита в группе № 2 не только не снизились относительно фона, как в группе № 1, а напротив, нерезко, но достоверно увеличились и, следовательно, были больше таковых в группе с введением сульфата кадмия.
Наличие метгемоглобина в крови было отмечено в обеих исследуемых группах (табл.2) в значительно более высоких концентрациях, чем у фоновых животных во все сроки исследования с увеличением от первого месяца ко второму, однако у животных, которым вводили одновременно с солью кадмия и ацизол, концентрация метгемоглобина в каждый срок была достоверно меньше, чем у животных группы №1. Одной из возможных причин увеличения концентрации метгемоглобина в крови могло быть окисление двухвалентного железа с переходом в трехвалентное в ходе целого каскада реакции активации процессов ПОЛ, что мы попытались проследить в нижеописанном разделе исследования.
| Таблица 2 | |||||
| Влияние ацизола на некоторые гематологические показатели в условиях подкожного введения сульфата кадмия в дозе 0,1 мг/кг (М±м). | |||||
| Ионы | Фон | Группа №1 | Группа №2 | ||
| 1 месяц | 2 месяц | 1 месяц | 2 месяц | ||
| Гемоглобин, г/л | 130,5±3,67 | 135,6±2,08 | 114,6±3,38* | 129,0±3,06 | 132,6±6,58*) |
| Гематокрит, % | 40,28±0,78 | 40,7±0,74 | 35,95±0,7* | 41,9±0,66 | 43,2±1,09**) |
| Метгемоглобин, % | 0,269±0,13 | 2,23±0,24* | 2,66±0,32* | 1,34±0,08**) | 1,63±0,19**) |
| * - р относительно фона | |||||
| *) - р относительно опыта |
Выявленные гистологические изменения демонстрируют уменьшение проявлений токсического действия кадмия на ткани почек, печени и миокарда у животных с профилактическим применением ацизола по сравнению с крысами с изолированным введением сульфата кадмия.
Таким образом, заметны четкие патологические эффекты кадмия почти на все исследованные гематологические показатели - концентрацию гемоглобина, гематокрит, уровень метгемоглобина, активации процессов ПОЛ, и отмечено свойство ацизола снижать выраженность этих изменений, даже нивелируя изменения концентрации гемоглобина в сроки исследования в опытной группе животных (№2). Способность ацизола уменьшать потребность в кислороде и его положительные влияния на процессы дыхания, возможно, предотвращает или ослабляет гипоксическую активацию процессов перекисного окисления липидов в клетках организма и снижает повреждающее действие кадмия. Помимо этого ацизол, являясь донатором ионов цинка, вероятно, ослабляет способность кадмия вытеснять последний из многих металлоэнзимов, участвующих как в процессах тканевого дыхания, так и во многих других жизненно важных процессах в организме, что также может способствовать его профилактическому действию.
Из вышеизложенного видно, что профилактическое введение ацизола является эффективным способом снижения и коррекции токсического действия кадмия при хроническом отравлении его соединениями.
Способ профилактики токсического действия кадмия у экспериментальных животных, отличающийся тем, что животным ежедневно вводят ацизол один раз в сутки в дозе 30 мг/кг через зонд в желудок, предварительно, за 30 мин перед введением раствора сульфата кадмия подкожно в дозе 0,1 мг/кг.