Фармацевтические композиции пиримидин-2,4,6-трионов
Иллюстрации
Показать всеИзобретение относится к области фармакологии и медицины и касается комплекса триоксопиримидин-циклодекстрин, образованного из производного триоксопиримидина или его соли и растворимого в воде производного циклодекстрина, обладающего улучшенной растворимостью, и фармацевтической композиции на его основе, являющейся ингибитором матриксных металлопротеаз. 2 н.з. и 8 з.п. ф-лы, 9 ил., 11 табл.
Реферат
Настоящее изобретение относится к фармацевтической композиции пиримидин-2,4,6-трионов (триоксопиримидинов), способам ее получения и применения.
Матриксные металлопротеазы (ММП) являются семейством цинк- и кальцийзависимых протеаз, которые способны разрушать внеклеточный матрикс (ВКМ) и базальную мембрану (Egeblad, M. and Werb, Z., Nat. Rev. Cancer 2 (2002) 161-174; Overall, C.M. and Lopez-Otin, С., Nat. Rev. Cancer 2 (2002) 657-672). Предполагается, что они играют главную роль в эмбриональном развитии и росте (Holmbeck, К., et al., Cell 99 (1999) 81-92; Vu, Т.Н., et al., Cell 93 (1998) 411-422), а также в ремоделировании и восстановлении ткани (Shapiro, S.D., Curr. Opin. Cell Biol. 10 (1998) 602-608; Lund, L.R., et al., EMBO J. 18 (1999) 4645-4656). Поэтому чрезмерное или неадекватное экспрессирование ММП может способствовать патогенезу многих процессов ремоделирования ткани, включая прогрессирование опухоли (Egeblad, M., and Werb, Z., Nat. Rev. Cancer 2 (2002) 161-174; Overall, C.M. and Lopez-Otin, С., Nat. Rev. Cancer 2 (2002) 657-672) и образование аневризмы (Carmeliet, P., et al., Nat. Genet. 17 (1997) 439-444). Воздействие ММП не ограничивается только разложением ВКМ (Chang, С. and Werb, D., Trends Cell Biol. 11 (2001) S.37-43). После разложения посредством ММП-9 становятся доступными пептидные факторы роста, которые секвестированы белками ВКМ (Manes, S., et al., J. Biol. Chem. 274 (1999) 6935-6945). ММП может увеличивать биологическую доступность VEGF (эндотелиального фактора роста сосудов) (Bergers, G., et al., Nat. Cell Biol. 2 (2000) 737-744), но также генерируют ингибиторы ангиогенеза, такие как ангиостатин, путем расщепления плазминогена (Dong, Z., et al., Cell 88 (1997) 801-810). Предполагается, что ММП участвуют в активации стволовых клеток костного мозга (Janowska-Wieczorek A., et al., Blood 93 (1999) 3379-3390). Высокая концентрация ММП-9 наблюдалась при индуцированной G-CSF активации НРС (Carstanjen, D., et al., Transfusion 42 (2002) 588-596).
Триоксопиримидины являются соединениями хорошо известного структурного класса. Такие соединения описаны, например, в патентах US №№ 6242455 и 6110924; WO 97/23465; WO 98/58915; WO 01/25217, которые включены в настоящее изобретение в качестве ссылки, и в публикации Grams, F., et al., Biol. Chem. 382 (2001) 1277-1285, и являются эффективными и высокоселективными по отношению к ММП-2, ММП-9 и ММП-14.
Циклодекстрины являются циклическими углеводами, образованными из крахмала. Они отличаются друг от друга количеством глюкопиранозных звеньев в структуре. Исходные циклодекстрины содержат 6, 7 и 9 глюкопиранозных звеньев и называются альфа-, бета- и гамма-циклодекстринами соответственно. α-, β- и γ-Циклодекстрины, полученные ферментативным превращением крахмала, различаются диаметром своей гидрофобной полости и обычно пригодны для включения многочисленных липофильных веществ.
Триоксопиримидины, которые являются высокоактивными ингибиторами ММП, плохо растворимы в воде и водных растворителях. Поэтому объектом настоящего изобретения является водная композиция, в которой растворим такой триоксопиримидин, причем такую водную композицию такого триоксопиримидина можно использовать в качестве фармацевтической композиции.
Краткое содержание изобретения
Согласно изобретению неожиданно было установлено, что комплекс триоксопиримидин-циклодекстрин, образованный производным триоксопиримидина, характеризующимся описанной ниже формулой (I), и растворимым в воде циклодекстрином (далее обозначаемым, как ЦД), обладает повышенной растворимостью в воде, превосходной стабильностью и оказывает слабое местное раздражающее воздействие и применим в качестве терапевтического средства.
Также установлено, что такой комплекс триоксопиримидина с циклодекстрином и вспомогательным веществом, таким как L-лизин или L-аргинин, обладает улучшенной растворимостью в воде и биологической доступностью и оказывает слабое местное раздражающее воздействие и применим в качестве терапевтического средства. Соответственно настоящее изобретение относится к комплексу триоксопиримидин-циклодекстрин, образованному производным триоксопиримидина или его солью и циклодекстрином, предпочтительно - α-, β- или γ-циклодекстрином или растворимым в воде производным циклодекстрина (растворимый в воде определяется, как обладающий растворимостью, составляющей не менее 0,5 г/100 мл воды при 25°С), в котором производное триоксопиримидина описывается формулой (I).
Кроме того, настоящее изобретение относится к комплексу триоксопиримидин-циклодекстрин, образованному производным триоксопиримидина, описываемым формулой (I), или его солью и циклодекстрином, предпочтительно - α-, β- или γ-циклодекстрином или растворимым в воде производным циклодекстрина (растворимый в воде определяется, как обладающий растворимостью, составляющей не менее 0,5 г/100 мл воды при 25°С), в присутствии вспомогательного вещества, такого как L-лизин или L-аргинин, предпочтительно - L-лизин.
Такой комплекс, предлагаемый в настоящем изобретении, является комплексом включения триоксопиримидин-циклодекстрин и находится в жидкой или твердой форме.
В комплексе, предлагаемом в настоящем изобретении, предпочтительно, если 1 моль триоксопиримидина образует комплекс с количеством циклодекстрина, предпочтительно - β- или γ-циклодекстрина или его производного, составляющим примерно от 1 до 2 моль, и включается в него.
Настоящее изобретение также относится к фармацевтическому средству, предназначенному для лечения нуждающегося в нем пациента, предпочтительно для лечения воспалительных заболеваний бронхов, содержащему в качестве активного компонента в фармацевтически эффективном количестве комплекс триоксопиримидин-циклодекстрин, предлагаемый в настоящем изобретении.
Фармацевтическое средство, предлагаемое в настоящем изобретении, применимо для лечения, профилактики или предупреждения патологий, обусловленных очень значительным или неприемлемым экспрессированием ММП. Предпочтительно, если такое лечение является терапевтическим, профилактическим или предупредительным лечением ревматоидного артрита, опухолей, метастатической инвазии, остеопороза, дегенерации желтого пятна, диабетической ретинопатии, изъязвления роговицы, атеросклероза, воспалительных заболеваний бронхов, таких как астма, хроническое обструктивное заболевание легких или эмфизема.
Настоящее изобретение также относится к композиции для инъекции, содержащей комплекс триоксопиримидин-циклодекстрин, предлагаемый в настоящем изобретении, в фармацевтически эффективном количестве.
Другим объектом настоящего изобретения является жидкая водная композиция комплекса, предлагаемого в настоящем изобретении, в которой фармацевтически приемлемым носителем является вода, и композиция для введения представляет собой водный раствор. Активное вещество, предлагаемое в настоящем изобретении, находится в виде комплекса, образованного включением в циклодекстрин в водном растворе.
Другим объектом настоящего изобретения является жидкая водная композиция комплекса, предлагаемого в настоящем изобретении, в присутствии L-лизина (концентрация L-лизина равна от 10 до 1000 мМ, предпочтительно - от 10 до 500 мМ и более предпочтительно - от 10 до 100 мМ), в которой фармацевтически приемлемым носителем является вода, и композиция для введения представляет собой водный раствор. Активное вещество, предлагаемое в настоящем изобретении, находится в виде комплекса, образованного включением в циклодекстрин в водном растворе в присутствии L-лизина.
Другим объектом настоящего изобретения является комплекс, предлагаемый в настоящем изобретении, в твердом состоянии, комплекс находится в форме порошка, растворимого в воде, предназначенного для растворения перед введением или введения в таком виде, в котором он находится.
Другим объектом настоящего изобретения является комплекс, включенный в различные галеновы формы, соответствующие необходимой форме введения, которыми могут быть таблетки, капсулы, гранулированные системы, растворы для перорального введения, суспензии для перорального введения, растворы, суспензии и имплантаты для парентерального введения, растворы или порошки для ингаляции, кремы и мази гидрофильного или липофильного типа, водные или водно-спиртовые гели, лосьоны для местного, чрескожного или вагинального применения, внутриматочные устройства, растворы, суспензии, имплантаты для применения в офтальмологии, суппозитории, суспензии, аэрозольные препараты, растворы и вспененные препараты для ректального применения.
Настоящее изобретение также относится к применению такого фармацевтического средства в фармацевтически эффективном количестве для лечения таких заболеваний у пациента, страдающего от такого заболевания, предпочтительно - воспалительных заболеваний бронхов. Комплекс, предлагаемый в настоящем изобретении, предпочтительно вводить местно, подкожно, чрескожно, перорально или патентерально.
Настоящее изобретение также относится к способу получения фармацевтического средства, предпочтительно - предназначенного для лечения таких заболеваний, предпочтительно - воспалительных заболеваний бронхов, представляющего собой комплекс триоксопиримидина с циклодекстрином в фармацевтически эффективном количестве в воде или забуференном водном растворе, предпочтительно - дополнительно содержащего вспомогательное вещество, буферное вещество, консервант, растворитель и/или изменяющий вязкость агент.
Предпочтительными циклодекстринами являются
- альфа-циклодекстрин и его синтетические производные, такие как ГПαЦД, метилированный αЦД, гидроксибутил-αЦД, мальтозил-αЦД, глюкозил-αЦД.
- бета-циклодекстрин и его синтетические производные, такие как ГПβЦД, СБОβЦД, СМβЦД, ДИМЕβЦД, ТРИМЕβЦД, гидроксибутил-βЦД, глюкозил-РЦД, мальтозил-βЦД
- гамма-циклодекстрин и его синтетические производные, такие как ГПγЦД, СМγЦД и ДИМЕγЦД, гидроксибутил-γЦД, глюкозил-γЦД, мальтозил-γЦД.
Настоящее изобретение также относится к применению фармацевтической композиции, включающей терапевтически эффективное количество пиримидин-2,4,6-триона и по меньшей мере одного циклодекстрина, а также, возможно, фармацевтически приемлемый носитель для приготовления лекарственного средства, предназначенного для терапевтического, профилактического или предупредительного лечения указанных выше заболеваний.
Настоящее изобретение также относится к применению фармацевтической композиции, включающей терапевтически эффективное количество, а) пиримидин-2,4,6-триона, b) по меньшей мере одного циклодекстрина, с) L-лизина или L-аргинина, предпочтительно - L-лизина, а также, d) возможно, фармацевтически приемлемый носитель для приготовления лекарственного средства, предназначенного для терапевтического, профилактического или предупредительного лечения указанных выше заболеваний.
Подробное описание изобретения
Пиримидин-2,4,6-трионами (триоксопиримидинами), предлагаемыми в настоящем изобретении, являются описываемые формулой (I)
в которой
R1 обозначает С3-С20алкил, которые необязательно может включать одну или несколько групп -S-, -О- или -NH-; или
группу W-V, в которой
W обозначает химическую связь или фенил; и
V обозначает фенил, фенилоксигруппу, фенилтиогруппу, фенилсульфинил, фенилсульфонил или фениламиногруппу, и эти фенильные фрагменты могут быть незамещенными или один или несколько раз замещенными галогеном, гидроксигруппой, С1-С6алкилом, С1-С6алкоксигруппой, С1-С6-алкилтиогруппой, С1-С6алкилсульфинилом, С1-С6-алкиламиногруппой, цианогруппой, нитрогруппой или С1-С6-алкилсульфонилом; и
R2 обозначает С1-С10алкил, и эта алкильная группа является незамещенной или один или два раза замещенной гидроксигруппой или аминогруппой и необязательно может включать одну или несколько групп -S-, -О- или -NH-; бензоильную группу, которая может быть незамещенной или один или несколько раз замещенной галогеном, гидроксигруппой, нитрогруппой, С1-С6-алкоксигруппой, С1-С6-алкиламиногруппой, С1-С6-алкилтиогруппой, С1-С6-алкилсульфинилом, С1-С6-алкилсульфонилом, амидосульфонилом, С1-С6-алкиламидосульфонилом, бис-С1-С6-алкиламидосульфонилом; гетероароматическую ацильную группу; или
фенильную или гетероарильную группу, которые являются незамещенными или один или несколько раз замещенными галогеном, гидроксигруппой, С1-С6-алкоксигруппой, С1-С6-алкиламиногруппой, С1-С6-диалкиламиногруппой, цианогруппой, С1-С6-алкилом, С1-С6-алкенилом, С1-С6-алкинилом, С1-С6-ацилом, С1-С6-алкилтиогруппой, С1-С6-алкилсульфонилом, С1-С6-алкилсульфинилом, С1-С6-алкиламинокарбонилом, аминокарбонилом, С1-С6-алкиламидосульфонилом, амидосульфонилом, бис-С1-С6-алкиламидосульфонилом, нитрогруппой, С1-С6-алкоксикарбонилом, карбоксигруппой.
Объектом настоящего изобретения является применение соединений формулы (I), а также их фармацевтически приемлемых солей, энантиомерных форм, диастереоизомеров и рацематов для приготовления новых фармацевтических препаратов.
При использовании в настоящем изобретении для R1 термин "С3-С20-алкил" означает линейный или разветвленный насыщенный углеводородный радикал, содержащий от 3 до 20, предпочтительно - от 4 до 12 и более предпочтительно - от 8 до 12 атомов углерода. Примерами являются бутил, гексил, октил, децил, 2-этилгексил, 2-этилоктил. Предпочтительными С3-С20алкильными остатками являются н-октил и н-децил. С3-С20Алкильная группа может включать одну или несколько групп -S-, -О- или -NH-, предпочтительно - -O-. Примерами таких С3-С20алкильных групп являются 5-этокси-н-пентил, 9-метокси-н-октил.
Заместители в фенильных фрагментах в "V" предпочтительно расположены в п- или м-положении.
Предпочтительной группой "W-V" являются п-бутоксифенил, бифенил, феноксифенил, п-хлорфеноксифенил, п-бромфеноксифенил, 3,4-дихлорфеноксифенил.
Термин "C1-С10-алкил" при использовании для R2 означает линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 10, предпочтительно - от 1 до 6 и более предпочтительно - от 1 до 4 атомов углерода. Указанный C1-С10-алкил может включать одну или несколько групп -S-, -О- или -NH-, предпочтительно - -О- и более предпочтительно - таким образом, чтобы образовывалась группа, состоящая из этиленоксильных фрагментов. Предпочтительными примерами C1-С10-алкильных групп являются гидроксиэтил; гидроксипропил; этоксиэтил; 1,2-бисэтоксиэтил; 1,2-бисгидроксиэтил.
Термин "гетероароматическая" при использовании в выражении "гетероароматическая ацильная группа" для R2 означает 5- или 6-членное ароматическое кольцо, в котором 1, 2 или 3 атома кольца представляют собой кислород, азот или серу, а остальными атомами кольца являются атомы углерода. Указанная гетероароматическая группа может быть сконденсирована с другим фенильным кольцом. Примерами таких гетероароматических ацильных групп являются фуранкарбоксильная, тиофенкарбоксильная, имидазолилкарбоксильная, 3-бензтиофенкарбоксильная, пиридилкарбоксильная. Предпочтительными примерами являются фуранкарбоксильная и тиофенкарбоксильная.
Термин "гетероарил" при использовании в настоящем изобретении означает гетероароматическую группу, определенную выше. Примерами гетероарильных групп являются электронно-дефицитные остатки, такие как азотсодержащие 6-членные кольца, такие как пиридин, пиримидин, пиразин и 1,3,5-триазин. Особенно предпочтительными гетероарильными группами являются пиримидинильная и пиразинильная.
Заместители, которые могут содержаться в фенильных или гетероарильных группах в R2, в основном расположены в любом положении, пригодном для проведения соответствующей реакции замещения. Предпочтительно, чтобы 1 или 2 заместителя находились в пара- и/или мета-положении.
Термин "С1-С6-алкил" при использовании в настоящем изобретении по отдельности или в комбинации с С1-С6-алкоксигруппой, С1-С6-алкиламиногруппой, С1-С6-диалкиламиногруппой, С1-С6-ацилом, С1-С6-алкилтиогруппой, С1-С6-алкилсульфонилом, С1-С6-алкилсульфинилом С1-С6-алкиламинокарбонилом, С1-С6-алкиламидосульфонилом, бис-С1-С6-алкиламидосульфонилом или С1-С6-алкоксикарбонилом означает линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6, предпочтительно - от 1 до 4 атомов углерода. Предпочтительными примерами являются метил, этил, пропил, изопропил и трет-бутил.
Термин "С1-С6-алкенил" при использовании в настоящем изобретении означает линейный или разветвленный ненасыщенный углеводородный радикал, содержащий от 2 до 6, предпочтительно - от 2 до 5 атомов углерода и 1 или 2 двойных связи. Если содержатся 2 двойных связи, то они могут быть изолированными или сопряженными двойными связями, предпочтительно - сопряженными двойными связями. Предпочтительными примерами являются аллил и пентадиенил.
Термин "С2-С6-алкинил" при использовании в настоящем изобретении означает линейный или разветвленный углеводородный радикал, содержащий от 2 до 6, предпочтительно - от 2 до 4 атомов углерода. Предпочтительным примером является пропаргил.
Термин "галоген" означает фтор, хлор, бром, йод, предпочтительно - хлор или бром.
Выражение "несколько раз" при использовании в настоящем изобретении означает 1, 2, 3 или 4 раза, предпочтительно - 1 или 2 раза.
Термин "фармацевтически приемлемая соль" при использовании выше в настоящем изобретении означает обычные молекулярные соли с кислотами или молекулярные соли с основаниями, которые сохраняют биологическую эффективность и характеристики соединений формулы (I) и образуются из подходящих нетоксичных органических или неорганических кислот или органических или неорганических оснований. Примеры молекулярных солей с кислотами включают соли, полученные из неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и соли, полученные из органических кислот, таких как п-толуолсульфоновая кислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота и т.п. Примеры молекулярных солей с основаниями включают соли, полученные из гидроксидов аммония, калия, натрия и четвертичного аммония, такого как, например, тетраметиламмонийгидроксид. Химическое превращение фармацевтического соединения (т.е. лекарственного средства) в соль является методикой, хорошо известной химикам-фармацевтам и использующейся для обеспечения лучшей физической и химической стабильности, гигроскопичности, сыпучести и растворимости соединений (см., например, Ansel, H., et. al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 6th ed., (1995), pp.196 and 1456-1457).
Соединения, предлагаемые в настоящем изобретении, можно получить так, как это описано в ЕР 0869947 и WO 01/25217.
В контексте настоящего изобретения особенно предпочтительными являются следующие соединения:
5-бифенил-4-ил-5-[4-(4-нитрофенил)-пиперазин-1-ил]пиримидин-2,4,6-трион
(соединение I)
5-(4-феноксифенил)-5-(4-пиримидин-2-илпиперазин-1-ил)-пиримидин-2,4,6-трион
(соединение II)
5-[4-(4-хлорфенокси)-фенил]-5-(4-пиримидин-2-илпиперазин-1-ил)-пиримидин-2,4,6-трион
(соединение III)
5-[4-(3,4-дихлорфенокси)-фенил]-5-(4-пиримидин-2-илпиперазин-1-ил)-пиримидин-2,4,6-трион
(соединение IV)
5-[4-(4-бромфенокси)-фенил]-5-(4-пиримидин-2-илпиперазин-1-ил)-пиримидин-2,4,6-трион
(соединение V).
Также очевидно, что, если производное триоксопиримидина (I) содержит кислотный фрагмент, такой как карбоксильную группу или сульфонильную группу, то с помощью кислотного фрагмента производное может образовать соль с основанием.
В дополнение к описанным выше молекулярным солям триоксопиримидин может образовать гидратированную или сольватированную форму. Гидраты и сольваты включают и свободное основание соединения формулы (I), и соль соединения формулы (I). Они также включают таутомеры соединения формулы (I).
Циклодекстрины (ЦД), предлагаемые в настоящем изобретении, являются циклическими олигосахаридами, полученными ферментативным разложением крахмала, которые содержат разное количество глюкопиранозных звеньев, чаще всего 6, 7 или 8: эти циклодекстрины соответственно называются α-, β- и γ-циклодекстринами (αЦД, βЦД и γЦД). Циклодекстрины, предлагаемые в настоящем изобретении, представляют собой сами циклодекстрины или производные циклодекстрина, которые растворимы в воде по меньшей мере в количестве, равном 0,5 г/100 мл при 25°С.
Растворимый в воде циклодекстрин, предпочтительно применяющийся в настоящем изобретении, означает циклодекстрин, обладающий растворимостью в воде, по меньшей мере такой же, как β-циклодекстрин. Примерами таких растворимых в воде циклодекстринов являются сульфобутилциклодекстрин, гидроксипропилциклодекстрин, мальтозилциклодекстрин и их соли. Предпочтительными являются сульфобутил-β-циклодекстрин, гидроксипропил-β-циклодекстрин, мальтозил-β-циклодекстрин и их соли.
Предпочтительными циклодекстринами, предлагаемыми в настоящем изобретении, также являются метилциклодекстрины (продукты метилирования циклодекстринов), диметилциклодекстрины (ДИМЕЦД) (предпочтительно - замещенные в положениях 2 и 6), триметилциклодекстрины (предпочтительно - замещенные в положениях 2, 3 и 6), "статистически метилированные" циклодекстрины (предпочтительно - статистически замещенные в положениях 2, 3 и 6, но содержащие от 1,7 до 1,9 метальных групп в пересчете на глюкопиранозное звено, СМβЦД), гидроксипропилциклодекстрины (ГПЦД, гидроксипропилированные циклодекстрины предпочтительно - статистически замещенные в основном в положениях 2 и 3 (ГП-βЦД, ГП-γЦД)), сульфобутоксициклодекстрины (СБОЦД), гидроксиэтилциклодекстрины, карбоксиметилэтилциклодекстрины, этилциклодекстрины, амфифильные циклодекстрины, полученные прививкой углеводородных цепей к гидроксигруппам и способные образовывать наночастицы, холестеринциклодекстрины и триглицеридциклодекстрины, полученные прививкой моноаминированных циклодекстринов (со спейсерной группой).
Вспомогательными веществами, предлагаемыми в настоящем изобретении, являются L-лизин или L-аргинин, предпочтительно - L-лизин. Такие вспомогательные вещества можно использовать для увеличения растворимости кислотных компонентов за счет образования тройного комплекса. Комплекс триоксопиримидин-циклодекстрин, предлагаемый в настоящем изобретении, можно получить путем приготовления водного раствора, содержащего триоксопиримидин или его соль и растворимый в воде циклодекстрин. Растворимый в воде циклодекстрин используют в количестве, предпочтительно составляющем 1 моль или более в пересчете на 1 моль триоксопиримидина или его соли, более предпочтительно - 1-10 моль и особенно предпочтительно - 1-2 моль циклодекстрина на 1 моль триоксопиримидина.
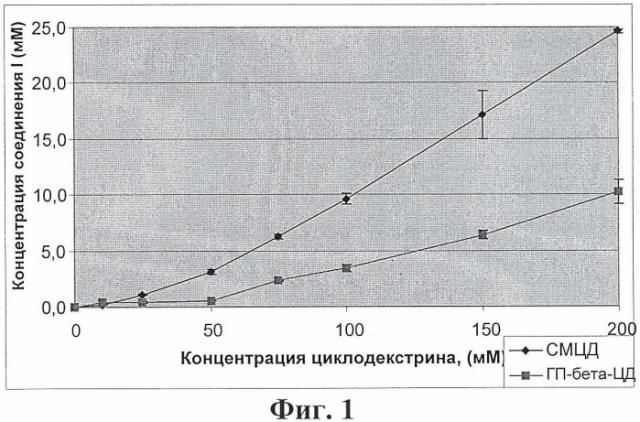
Чем выше концентрация растворимого в воде циклодекстрина, тем сильнее увеличивается растворимость триоксопиримидина. На методику приготовления водного раствора не налагается каких-либо специальных ограничений и, например, его готовят путем использования воды или буферного раствора в температурном диапазоне, составляющем примерно от -5 до 35°С.
Когда водный раствор циклодекстрина перемешивают с избытком триоксопиримидина формулы I, то происходит образование комплекса этих двух молекул. Однако установление равновесия требует по меньшей мере примерно нескольких дней, так что через несколько часов или даже через один день улучшенная растворимость триоксопиримидинов, предлагаемых в настоящем изобретении, не обнаруживается. Фильтрование раствора позволяет извлечь комплекс, растворенный в фильтрате, поскольку комплекс растворим в воде. Комплекс также можно получить путем смешивания известного количества солюбилизованного триоксопиримидина формулы I в водном растворе с известным количеством солюбилизованного ЦД, соотношение которых рассчитано заранее.
Другая методика получения комплекса заключается в прибавлении раствора триоксопиримидина формулы I в растворителе (например, спирте, ацетоне и т.п.) к водному раствору циклодекстрина. Комплекс может образоваться после достаточно длительного перемешивания, или после выпаривания растворителя, или даже в присутствии растворителя.
Во всех этих методиках получения комплекса триоксопиримидин-ЦД в качестве вспомогательного вещества можно использовать раствор L-лизина или L-аргинина (при концентрации аминокислоты, составляющей от 10 до 1000 мМ, предпочтительно - от 10 до 500 мМ и более предпочтительно - от 10 до 100 мМ). В качестве вспомогательного вещества предпочтительно использовать раствор L-лизина.
Лиофилизация или распыление растворов комплекса, предлагаемого в настоящем изобретении, позволяет получить комплекс в твердой форме. Таким образом можно получить комплекс в форме аморфного порошка. Комплекс в твердом состоянии также можно получить после растворения ЦД и триоксопиримидина формулы I в подходящем органическом растворителе с последующим выпариванием растворителя.
Для получения твердых комплексов можно использовать другие методики, например, энергичное перемешивание суспензии триоксопиримидина формулы I и ЦД в очень небольшом количестве воды, последующий сбор комплекса после сушки, или использование СО2 в надкритическом состоянии для смешивания триоксопиримидина формулы I и ЦД в присутствии СО2 в надкритическом состоянии.
Комплекс, предлагаемый в настоящем изобретении, можно получить, например, по методике, которая сама по себе известна, из раствора или с использованием пасты, при которой отношение массы циклодекстрина к массе триоксопиримидина составляет от 2 (2:1) до 540 (540:1) и предпочтительно - от 2 до 25, особенно предпочтительно - в диапазоне от 2,6 до 3,5 (для комплекса с циклодекстрином состава 1:1) или от 5,2 до 6,2 (для комплекса с циклодекстрином состава 1:2) при молекулярной массе циклодекстрина, равной примерно 1300.
Предпочтительно готовить комплекс из концентрированного водного препарата циклодекстрина. Концентрация циклодекстрина в препарате предпочтительно равна от 50 до 400 мМ. Предпочтение отдается концентрации циклодекстрина, равной от 100 до 250 мМ. В зависимости от консистенции смеси интенсивно перемешивают или замешивают. Содержание циклодекстрина в мас.% приводится в пересчете на полную массу водного препарата циклодекстрина.
Также предпочтительно готовить комплекс из концентрированного водного препарата циклодекстрина в присутствии раствора L-лизина (концентрация L-лизина равна от 10 до 1000 мМ, предпочтительно - от 10 до 500 мМ и более предпочтительно - от 10 до 100 мМ). Концентрация циклодекстрина в препарате предпочтительно равна от 50 до 400 мМ. Предпочтение отдается концентрации циклодекстрина, равной от 100 до 250 мМ. В зависимости от консистенции смеси интенсивно перемешивают или замешивают. Содержание циклодекстрина в мас.% приводится в пересчете на полную массу водного препарата циклодекстрина.
Температура проведения реакции обычно равна от 20 до 80°С, предпочтительно - от 20 до 60°С, особенно предпочтительно - от 25 до 45°С. Длительность проведения реакции зависит от температуры и составляет по меньшей мере несколько дней. Предпочтение отдается длительности проведения реакции, равной не менее 7 дней, чтобы установилось равновесие комплексообразования. Затем реакционную смесь фильтруют, если еще имеется нерастворившееся вещество, или используют непосредственно, если растворение прошло до конца. При необходимости комплекс может выделить, например, с помощью хроматографических методик. Предпочтительно, чтобы концентрации и соотношения количеств триоксопиримидина и циклодекстрина были такими, чтобы образование комплекса прошло до конца (было достигнуто равновесие) и не обнаруживался нерастворенный и не образовавший комплекс триоксопиримидин.
Согласно изобретению было установлено, что комплексы триоксопиримидина формулы I и циклодекстрина резко повышают растворимость триоксопиримидина в воде. Также установлено, что образование комплекса не оказывает неблагоприятного влияния на фармакологические характеристики триоксопиримидина.
Согласно изобретению было установлено, что комплексы триоксопиримидина формулы I, циклодекстрина и вспомогательного вещества, такого как L-лизин или L-аргинин, резко повышают растворимость триоксопиримидина в воде. Также установлено, что образование комплекса не оказывает неблагоприятного влияния на фармакологические характеристики триоксопиримидина.
Все эти характеристики позволяют приготовить жидкие препараты в виде растворов для инъекции или для распыления и позволяют улучшить биологическую доступность, особенно пероральную. Комплекс триоксопиримидин-циклодекстрин, предлагаемый в настоящем изобретении, можно применять в том виде, в котором он получен, или в порошкообразной форме, которую получают путем удаления содержащейся в нем воды. Примеры методик удаления воды включают лиофилизацию и сушку при пониженном давлении. Особенно предпочтительным является препарат, полученный лиофилизацией.
Комплекс триоксопиримидин-циклодекстрин, предлагаемый в настоящем изобретении, оказывает свое воздействие при пероральном или парентеральном введении и его предпочтительно готовить в виде препарата для парентерального введения, предпочтительно - в виде композиции для инъекции, или препарата для местного применения, предпочтительно - в виде аэрозольного препарата.
Дозу комплекса, предлагаемого в настоящем изобретении, можно менять в соответствии с возрастом, массой тела и тяжестью симптомов, проявляющихся у пациента, и комплекс можно вводить в виде одной дозы или разделенных доз. Примеры форм препаратов включают таблетки, капсулы, порошки и гранулы. Их можно приготовить по известным технологиям с использованием типичных добавок, таких как инертные наполнители, смазывающие вещества и связующие.
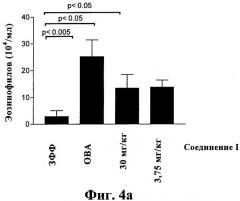
Настоящее изобретение относится к способу, применяющемуся для лечения воспалительных заболеваний бронхов у страдающего ими млекопитающего, нуждающегося в таком лечении, например, предпочтительно - астмы и хронического обструктивного заболевания легких (ХОЗЛ), путем введения пациенту комплекса, предлагаемого в настоящем изобретении, в фармацевтически эффективном количестве. Астма является воспалительным заболеванием бронхиального дерева, связанным или не связанным с воздействием аллергена. Это воспаление провоцирует у пациентов симптомы, стимулируя сокращения гладких мышц бронхов, усиливая секрецию слизи и вызывая морфологические изменения бронхов, что считается факторами, осложняющими течение этого заболевания. Гиперчувствительность дыхательных путей является отличительным признаком этого заболевания и она приводит к большинству симптомов. Бронхиальное дерево является очень сложной тканью, содержащей множество типов клеток (эпителиальные клетки, гладкомышечные клетки, воспалительные клетки, нервные клетки, клетки, вырабатывающие слизь, фибробласты и т.п.), и ремоделирование бронхов, которое включает множество аспектов, в основном заключается в осаждении компонентов внеклеточного матрикса на стенках бронхов и гиперплазию клеток, вырабатывающих слизь. Применение комплексов, предлагаемых в настоящем изобретении, подавляет приток воспалительных клеток в области смывания альвеол бронхов и перибронхиальную ткань и подавляет гиперчувствительность, которая определяется, как аномальная реакция на стимулирующие агенты, такие как метахолин. Обзор по этому заболеванию и современным методикам его лечения приведен, например, в публикации: GINA Workshop Report, Global Strategy for Asthma Management and Prevention (NIH Publication No. 02-3659).
Поэтому настоящее изобретение также относится к способу лечения или предупреждения хронических обструктивных заболеваний легких у страдающего ими млекопитающего, нуждающегося в таком лечении, путем применения комплексов, предлагаемых в настоящем изобретении. При таком заболевании бронхи воспалены и слизистые железы гиперплазированы и продуцируют большое количество слизи. Стенки бронхов являются аномальными и осаждение аномальных компонентов внеклеточного матрикса увеличивает сопротивление потоку воздуха. Это заболевание и современные методики его лечения описаны, например, в публикации Fabbri, L.M., and Hurd, S.S., Eur. Respir. J. 22 (2003) 1-2.
Поэтому настоящее изобретение также относится к способу лечения или предупреждения эмфиземы у страдающего ею млекопитающего, нуждающегося в таком лечении, путем применения комплексов, предлагаемых в настоящем изобретении. При таком заболевании стенки альвеол разрушаются вследствие протекания протеолитических процессов и это разрушение нарушает перенос кислорода в кровь. Патофизиологические нарушения также возникают вследствие чрезмерного расширения, которое приводит к аномалиям газообмена вследствие нарушения функции дыхательных мышц и вследствие гипертензии в легочных артериях, что в поздних стадиях заболевания приводит к сердечной недостаточности.
В контексте настоящего изобретения комплексы триоксопиримидин-циклодекстрин предпочтительно вводить пациенту, нуждающемуся в таком лечении, в течение нескольких месяцев или лет. Комплексы предпочтительно вводить в виде аэрозолей жидкостей или порошков в нетоксичных дозах, составляющих микро- или макромоли в пересчете на килограмм массы тела в сутки.
Точная дозировка комплексов, предлагаемых в настоящем изобретении, будет меняться, но ее легко определить. Обычно суточная доза комплексов будет находиться в диапазоне от 1 мкмоль/кг в сутки до 100 нмоль/кг в сутки (концентрация триоксопиримидина в комплексе).
Предпочтительно, если фармацевтические композиции представляют собой водные композиции, являющиеся физиологически совместимыми. Предпочтительно, если композиции дополнительно включают фармацевтически приемлемую добавку, такую как буферную систему, консервант и/или вспомогательное вещество. Подходящие буферные системы основаны на фосфате натрия, ацетате натрия или борате натрия. Консерванты необходимы для предотвращения микробного загрязнения фармацевтической композиции при ее применении. Подходящими консервантами являются, например, бензалконийхлорид, хлорбутанол, метилпарабен, пропилпарабен, фенилэтиловый спирт, сорбиновая кислота. Такие консерванты обычно используют в количестве, составляющем от 0,01 до 1% мас./об.
Подходящие вспомогательные вещества и фармацевтические препараты описаны в публикации Remington's Pharmaceutical Sciences, 16th ed., 1980, Mack Publishing Co., edited by Oslo et al. Обычно в препарате используют количество фармацевтически приемлемой соли, необходимое для того, чтобы препарат стал изотоническим. Примеры фармацевтически приемлемых веществ включают физиологический раствор, раствор Рингера и раствор декстрозы. Значение рН раствора предпочтительно составляет от примерно 5 до примерно 8 и более предпочтительно - от примерно 7 до примерно 7,5.
Если в качестве вспомогательных веществ для образования комплекса используют L-лизин или L-аргинин, то значение рН раствора предпочтительно составляет от примерно 6 до примерно 8,5 и более предпочтительно - от примерно 7,5 до примерно 8,5.
Предпочтительный препарат, предлагаемый в настоящем изобретении, представляет собой препарат для инъекции или распыления, предпочтительно приготовленный из ЦД и триоксопиримидина в молярном отношении, составляющем от 1 до 500.
Комплекс получают путем растворения ЦД в воде, прибавления триоксопиримидина формулы I и нагревания на водяной бане, пока последний полностью не растворится. Раствор предпочтительно стерилизовать путем фильтрования. Предпочтительно, если раствор обладает осмоляльностью, равной 200-400, предпочтительно - примерно 300 мОс/кг. Значение рН равно примерно 7,2. В зависимости от требований концентрацию триоксопиримидина и/или ЦД можно менять. Предпочтительно регулировать тоничность путем прибавления NaCl.
Предпочтительный