Способ очистки шахтных вод от железа
Иллюстрации
Показать всеИзобретение относится к способам очистки шахтных вод от железа и может быть также использовано для очистки подземных вод. Для осуществления очистки в обрабатываемую воду одновременно вводят пероксид водорода и кальцинированную соду, причем водный раствор пероксида водорода добавляют в эквимолярном количестве по отношению к концентрации железа, а кальцинированную соду добавляют в эквимолярном количестве для достижения нейтрального уровня pH среды. При этом содержащееся в воде железо образует смесь труднорастворимых соединений - Fe(ОН)3, FeSO4(OH), Fe2O3·nH2O, которые быстро коагулируют, выпадают в осадок и могут быть успешно удалены даже без фильтрации. Происходящее снижение pH воды компенсируется добавлением в нее кальцинированной соды (Na2CO3). Технологический эффект от использования данного способа заключается в повышении степени и скорости очистки воды от железа, нормализции уровня pH и удешевлении процесса. 3 ил., 1 табл.
Реферат
Изобретение относится к способам очистки подземных и шахтных вод от железа.
Известен способ глубокой очистки подземных вод, включающий дегазацию, двухстадийное фильтрование с постадийной промывкой и использованием в качества фильтрующей загрузки на первой стадии инертного материала, а на второй - сорбента и обеззараживание. Дегазацию осуществляют путем барботажа, фильтрование на первой стадии ведут с воздушной промывкой фильтрующей загрузки, а на второй стадии фильтрование ведут сверху вниз через фильтрующую загрузку, выполненную из двух слоев в последовательности: сорбент, ионообменный материал. Промывку ведут противотоком в последовательности: ионообменный материал, сорбент, ионообменный материал регенерируют раствором хлористого натрия, а обеззараживание ведут ультрафиолетом (пат. РФ 2087427, C02F 9/00).
Недостатком этого способа очистки воды от железа является сложная дорогостоящая технология, недоступная к применению при больших объемах поступающей воды с большим содержанием железа.
Известен способ удаления железа из подземных вод, включающий фильтрование через загрузку, обработанную раствором марганцово-кислого калия, с целью повышения степени очистки, загрузку предварительно обрабатывают 0,1-3%-ным водным раствором сернокислого закисного железа (а.с. 685630, С02В 1/26).
Недостатком этого способа является возможность применения его только при небольших объемах воды и содержаниях в ней железа.
Известен способ осаждения поливалентных металлов из водных растворов путем обработки химическим реагентом с целью повышения эффективности осаждения за счет уменьшения остаточного содержания ионов металлов в растворе и экономичности процесса, обработку осуществляют водным раствором натриевой соли карбоксилметилцеллюлозы (а.с. 808377, C02F 1/58).
Недостатком этого способа является большой расход реагента и неспособность вывода из раствора двухвалентного железа.
Известен способ очистки подземных вод от железа, включающий их аэрирование и фильтрацию, аэрирование осуществляют барботированием воды сжатым воздухом, осуществляют доокисление железа до трехвалентного во взвешенном слое концентрата при разрыве потоков последнего и воды в сборной емкости, очистке на активированных наработанным гидроксидом железа пористых коаксиальных цилиндрических поверхностях элементов из полимера пространственно-глобулярной структуры при тангенциальной фильтрации пульсирующего турбулентного потока и гидродинамическом сжатии диффузного слоя в их зазоре с наведением дзета-потенциалов, а регенерацию фильтра осуществляют чередующимися импульсными отдувками сжатым воздухом и промывками обратным током воды с частичным перекрытием пористых поверхностей элементов по продольным образующим подвижными экранами (пат. РФ 2181 ПО, C02F 1/64).
Недостатком данного способа являются худшие результаты очистки воды от железа при больших объемах ее поступления. Так, на очистных сооружениях шахты им. Кирова в г.Новошахтинске Ростовской области, на которых применялся предлагаемый способ, получены результаты при содержании общего железа в воде, поступающей из водовыпускных скважин - 150-180 мг/л, после аэрации и фильтрации - 101-118 мг/л.
Приток шахтной воды при этом составлял 600 м /час.
Наиболее близким по технической сущности к предложенному является способ очистки сточных вод от органических и неорганических соединений, включающий обработку перекисью водорода и одновременно с этим в сточные воды вводится озон (а.с. 648530, С02С 5/02).
Перекись водорода и озон вводят в количестве соответственно 0,03-1,0 г/л и 0,15-1,5 г/л соответственно.
Недостатком данного способа является очень большой расход реагентов, при потоке воды 1000 м3/час необходимо соответственно перекиси водорода и озона до 1000 и 1500 кг/час. Кроме этого, окисление двухвалентного железа сопровождается снижением уровня pH, что тормозит процесс выпадения железа в осадок и делает воду не пригодной для сброса в природные водотоки.
Технологический эффект от использования предлагаемого способа заключается в повышении степени и скорости очистки воды от железа, нормализации уровня pH, осаждении соединений железа и снижении затрат на очистку воды.
Задача очистки шахтных вод от железа с использованием перекиси водорода решается следующим образом: в воду одновременно вводят пероксид водорода и кальцинированную соду, при этом водный раствор пероксида водорода добавляют в эквивалентном количестве по отношению к концентрации железа, а кальцинированную соду добавляют в эквимолярном количестве для достижения нейтрального уровня pH среды.
Окисление двухвалентного железа и выпадение в осадок продуктов реакции будет приводить к изменению pH среды. В условиях, когда значение pH среды близко к нейтральной, окисление Fe2+ перекисью водорода можно описать реакциями:
Fe2++H2O2→Fe3++OH0+OH-
Fe2++OH0→Fe3++OH-
Исходное железо в виде FeSO4 под действием перекиси водорода окисляется и выпадает в осадок в результате реакции:
2FeSO4+H2O2+4Н2О→2Fe(OH)3↓+2H2SO4
Таким образом, окисление Fe в нейтральной среде по реакции приводит к уменьшению pH среды.
В воде железо в виде гидрокарбонатов окисляется по реакции:
2Fe(НСО3)2+H2O→2Fe(ОН)3↓+HCO2↑
При этом pH среды будет увеличиваться за счет удаления из раствора соли угольной кислоты.
Если гидрокарбонатов окажется недостаточно и в процессе реакции раствор стал кислым, то при избытке сульфатов (под избытком сульфатов подразумевается, что [Fe2+]<[SO4 2-]) реакция окисления двухвалентного железа перекисью водорода будет протекать по другому механизму с образованием стабильного в кислой среде растворимого соединения
2FeSO4+H2O2+H2SO4→Fe2(SO4)3+2H2O
Для сохранения pH среды на нейтральном уровне в воду вводится раствор кальцинированной соды (Na2CO3), где протекает реакция:
Na2CO3+H2SO4→Na2SO4+Н2СО3→Na2SO4+H2O+CO2↑
Образующаяся в этих реакциях угольная кислота нестабильна и разлагается при pH меньше 7, тем самым будет обеспечиваться стабилизация pH около значения 1.
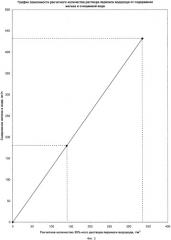
При pH воды, равном 4, для увеличения pH среды до 7 необходим эквивалент Э=10-4-10-7≈10-4 моль/л или ОД моль/м3. Эквивалент Na2CO3 равен 2, поэтому нужно вводить 0,05 моль/м3. Молекулярный вес M(Na2CO3)=106. Расход кальцинированной соды составит 0,05·106=5,3 г/м3.
Расход перекиси водорода на объем воды стехиометрически можно рассчитать па основе реакции 2Fe2++Н2О2→2Fe3++2OH-. Согласно этому уравнению на окисление двух молекул закисного железа расходуется одна молекула перекиси водорода.
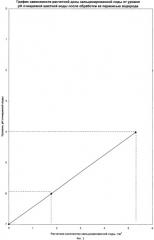
Например, при концентрации [Fe2+]=350 мг/л (6,25-10-3 моль/л) перекиси водорода нужно вводить 1/2·6,25·10-3=3,125·10-3 моль/л или 0,102 г/л концентрированной H2O2. Количество необходимого водного раствора определяется пропорционально в зависимости от концентрации H2O2 в растворе.
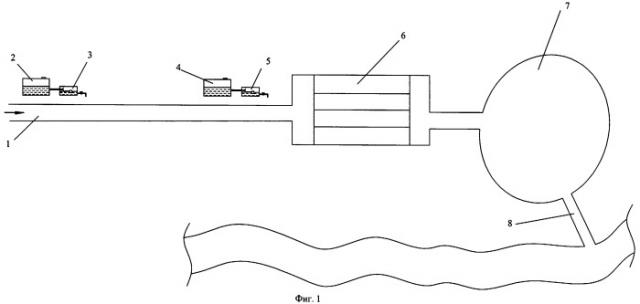
Технологическая схема предлагаемого способа приведена на фиг.1. Схема включает поток исходной воды 1, емкость с перекисью водорода или генератор перекиси водорода, 2, дозатор перекиси водорода 3, емкость с раствором кальцинированной соды 4, дозатор раствора кальцинированной соды 5, отстойник 6, пруд-осветлитель 7 и выход очищенной воды 8.
Способ осуществляется следующим образом.
В поступающий поток исходной воды на основании лабораторных анализов и согласно таблице (Фиг.2, Фиг.3) одновременно вливается расчетное количество раствора перекиси водорода и расчетное количество раствора кальцинированной соды. Смесь поступает в отстойник 6, где происходит реакция окисления железа с получением труднорастворимых соединений, которые быстро коагулируют и выпадают в осадок. В пруде-осветлителе 7 вода окончательно очищается от взвешенных частиц и может быть использована для рыборазведения.
Таким образом, способ очистки шахтных вод от железа включает обработку перекисью водорода и отличается от прототипа тем, что в воду одновременно вводят пероксид водорода и кальцинированную соду, при этом водный раствор пероксида водорода добавляют в эквимолярном количестве по отношению к концентрации железа, а кальцинированную соду добавляют в эквимолярном количестве для достижения нейтрального уровня pH среды.
Предлагаемый способ прошел опытно-промышленные испытания по очистке шахтной воды на очистных сооружениях шахты им. Кирова в г.Новошахтинске Ростовской области и на очистных сооружениях шахты «Бургустинская» в г.Гуково Ростовской области. Результаты опытно-промышленных испытаний представлены в таблице.
| Компонент | Ед. изм. | Очистные сооружения | |||||
| ш. им. Кирова | ш. «Бургустинская» | ||||||
| Вода исходная, (мг/л) | После очистки по существующей технологии (мг/л) | После очистки H2O2 и Na2CO3, (мг/л) | Вода исходная (мг/л) | После очистки по существующей технологии (мг/л) | После очистки H2O2 и Na2CO3 (мг/л) | ||
| pH | ед. | 6,35 | 6,65 | 6,61 | 7,04 | 2,6 | 6,58 |
| Железо общее | мг/л | 180,00 | 118,00 | 2,64 | 432,0 | 384,0 | 0,76 |
| Железо окисное | мг/л | 50,00 | 55,50 | 2,60 | 92,5 | 196,5 | 1,35 |
| Железо закисное | мг/л | 130,00 | 62,50 | <0,05 | 339,5 | 187,5 | 0,41 |
На очистных сооружениях шахты им. Кирова приток воды до 1000 м/час. Применяемый по проекту способ очистки воды - электролиз, аэрирование и фильтрация.
На шахте «Бургустинская» применяемый способ очистки по проекту - аэрирование, известкование с добавлением флокулянта, (полиакриламид), приток воды 230-300 м3/час.
Во время испытаний расход реагентов, перекиси водорода и кальцинированной соды определялся по графикам зависимости (фиг.2 и фиг.3), составленным на основе расчетов.
По результатам опытно-промышленных испытаний разрабатывается проектная документация на реконструкцию очистных сооружений шахтных вод с использованием перекиси водорода и кальцинированной соды.
Способ очистки шахтных вод от железа, включающий обработку перекисью водорода, отличающийся тем, что в воду одновременно вводят пероксид водорода и кальцинированную соду, причем водный раствор пероксида водорода добавляют в эквимолярном количестве по отношению к концентрации железа, а кальцинированную соду добавляют в эквимолярном количестве для достижения нейтрального уровня pH среды.