Новый вирус растений
Иллюстрации
Показать всеИзобретение относится к выделенному вирусу растений, названному вирус томата торрадо (ToTV), и его компонентам, а также к способам получения устойчивых к ToTV растений. Сначала на растение или его часть воздействуют инфекционной дозой ToTV. Затем идентифицируют растения, у которых отсутствуют или уменьшены симптомы заболевания. Растения, идентифицированные таким образом как устойчивые к вирусу, используют в качестве донорных при скрещивании с реципиентными растениями, и из растений-потомков отбирают устойчивые к ToTV. 6 н. и 2 з.п. ф-лы, 5 табл., 7 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области заболеваний растений. Более конкретно, изобретение относится к новому вирусу растений, выделенному из томата, к способам детекции указанного вируса, к способам детекции устойчивых растений и к способам получения устойчивых растений.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Томат Solanum lycopersicum (ранее Lycopersicon esculentum) является чувствительным к большому числу видов вирусов. Некоторые из наиболее известных вирусов томата включают в себя вирус бронзовости томата (TSWV; род Tospovirus), вирус мозаики пепино (PepMV; род Potexvirus) и вирус желтой курчавости листьев томата (TYLCV; род Begomovirus). Повреждения, которые эти заболевания наносят растению, находятся в диапазоне от обесцвечивания листьев и некротических очагов до серьезной потери урожайности и гибели растения.
Возможность получать устойчивые растения является крайне важной для коммерческих селекционеров, и для некоторых из вирусов, наносящих наибольший экономический ущерб, получены устойчивые варианты растений. Однако время от времени появляются новые вирусы, которые могут наносить значительный ущерб урожаю.
В 1996 г. опубликован новый вирус томата, инфицировавший растения томата в США и Италии с 1993 г, и названный вирусом инфекционного хлороза томатов (TICV; род Crinivirus; Duffus et al., 1996). Другой новый вирус томата из того же рода опубликован в 1998. Показано, что этот вирус инфицировал растения томата в США с 1989, и его назвали вирусом хлороза томатов (ToCV; Wisler et al, 1998). Доказано, что оба этих новых вируса распространяет белокрылка, насекомое, являющееся очень эффективным переносчиком заболевания.
Обычно считают, что географическое распределение известных вирусов будет увеличиваться и что будут продолжать появляться новые вирусы, частично в результате рекомбинации различных вирусов с образованием новых штаммов или новых вирусов. Разработка устойчивых культурных сортов может играть важную роль в успешном контроле этих заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Недавно на растениях томатов из Испании обнаружили новый вирус, вызывающий симптомы, которые нельзя приписать какому-либо из известных вирусов. У растений обнаруживали некротические повреждения на листьях и коричневые кольца на плодах, а также пониженный рост. Серологические тесты (ELISA) показали присутствие вируса мозаики пепино (PepMV). Исследования электронной микроскопией действительно выявили палочковидные частицы, типичные для потекс-вирусов (Potexvirus). Однако в инфицированной ткани листа обнаружены также вирусные частицы сферической формы. Авторам настоящего изобретения удалось выделить новый вирус из комплекса с PepMV. Новый вирус предварительно назвали вирус томата торрадо (ToTV).
Очень важной является возможность распознать заболевание, чтобы проследить его источник, осуществить мониторинг его эпидемиологии и предупредить его возможное распространение. Только тогда можно принимать адекватные меры для изоляции растений и начинать фитосанитарную профилактику. На настоящий момент не существует доступных диагностических средств. Следовательно, существует необходимость разработки диагностических средств для данного заболевания. Более того, в настоящее время неизвестны растения, обладающие специфической устойчивостью к этому новому вирусу, в то время как существует необходимость разработки таких устойчивых растений.
Изобретение в первом аспекте относится к вирусу растений, предварительно названному вирус томата торрадо (ToTV), депонированному в немецкой коллекции микроорганизмов и клеточных культур (DSMZ) в Брауншвейге 24 ноября 2004 г. под номером для ссылки депозитов ToTV-E01 (DSM 16999).
Вирус вызывает симптомы заболевания в растениях томата, так же как в других растениях, и может вызывать симптомы самостоятельно или в комплексе с другими вирусами или заболеваниями.
Первые системные симптомы состоят в некротических пятнах на верхушке растения, начиная с основания листочков сложного листа. Некротические пятна набухают и окружены светло-зеленой или желтой областью (см. Фиг.1). Не все системно инфицированные листья проявляют симптомы, однако в этих листьях можно обнаружить вирус, например, посредством электронной микроскопии. На плодах, инфицированных ToTV, наблюдаются некротические кольца. Рост инфицированных растений может быть сниженным по сравнению с неинфицированными растениями.
Приведенное выше описание относится к растениям, заново инфицированным выделенным вирусом, и не обязательно будет точно отражать симптомы, встречающиеся в полевых условиях. Такие факторы, как раса или вариетет растения, стадия развития, воздействие дополнительных заболеваний и абиотические факторы (например, температура и относительная влажность), будут, в конечном счете, определять проявление и характеристики симптомов.
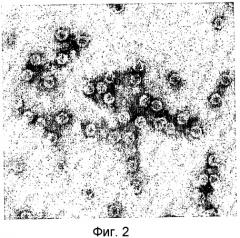
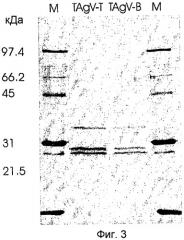
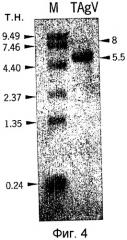
Вирусные частицы являются сферическими (икосаэдрическими) по форме с диаметром приблизительно 28 нм (см. Фиг.2). Вирусные частицы состоят по меньшей мере из трех белков капсида приблизительно по 23, 26 и 35 кДа (см. Фиг.3). После очистки вирус отображает на дисплее по меньшей мере две видимые полосы в градиенте сульфата цезия. Верхняя видимая полоса (верхняя фракция вируса) содержит молекулу РНК приблизительно 5,5 т.н. (более точно, 5,2 т.н.), а нижняя видимая полоса (нижняя фракция) содержит молекулу РНК приблизительно 8 т.н. (более точно, 7,7 т.н.) (см. Фиг.4). Инокуляция растений табака обеими объединенными полосами приводит к инфекции.
ToTV способен механически передаваться нескольким видам Nicotiana. Общепринятый буфер для инокуляции (например, 0,03 M фосфатный буфер с pH 7,7) является пригодным. Для размножения ToTV предпочтительными являются N.glutinosa, N.tabacum и N.benthamina. Виды табака N.hesperis '67A' и N.occidentalis 'Р1' являются очень чувствительными к ToTV и проявляют системные симптомы после 3-4 суток. У этих видов томата развивается сильный некроз за короткое время, и, таким образом, они являются более подходящими для использования в качестве индикаторного растения, чем в качестве хозяина для размножения. N.glutinosa реагирует местными очагами хлороза, системным хлорозом и умеренной деформацией листьев. N.benthamiana не проявляет местных симптомов и реагирует системным хлорозом и деформацией листьев.
Кроме того, изобретение относится к вирусу, содержащему по меньшей мере одну последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:1 и SEQ ID NO:2 и последовательностей, обладающих по меньшей мере 30%, предпочтительно по меньшей мере 40%, предпочтительно по меньшей мере 50%, предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 98% и наиболее предпочтительно по меньшей мере 99% гомологией с ними. Такие вирусы также охвачены термином ToTV, как используется в данном описании.
В предпочтительном варианте осуществления вируса по изобретению, обладающего вышеуказанной гомологией последовательности, указанный вирус связан с заболеваниями томата, известными под названиями «Торрадо», «Марчитец» и/или «Заболевание шоколадной пятнистости», и/или указанный вирус, на основании численного таксономического анализа таксономических признаков, в основном, как определено в таблице 1, обладает более близким родством с вирусом, как определено по п.1 формулы изобретения, чем с любым другим изолятом вируса, доступным в публичных коллекциях, и указанный вирус обладает необходимыми характеристиками, связанными с заболеванием, вызывающим некротические повреждения у томата.
В другом аспекте изобретение относится к выделенной или рекомбинантной нуклеиновой кислоте, содержащей последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, последовательностей, обладающих по меньшей мере 50%, предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 98% и наиболее предпочтительно по меньшей мере 99% гомологией нуклеотидной последовательности c SEQ ID NO:1 или SEQ ID NO:2, комплементарных им цепей и их ToTV-специфических фрагментов. Такую нуклеиновую кислоту можно получить из вируса по изобретению.
В другом аспекте изобретение относится к полинуклеотиду, способному гибридизоваться в строгих условиях с выделенной или рекомбинантной нуклеиновой кислотой по изобретению, как описано выше.
В другом аспекте изобретение относится к выделенному или рекомбинантному полипептиду, полученному из вируса по изобретению, или его ToTV-специфическому фрагменту. В предпочтительном варианте осуществления указанный полипептид выбран из группы, состоящей из белков капсида 23, 26 и 35 кДа и их ToTV-специфических фрагментов.
В другом аспекте изобретение относится к антигену, содержащему полипептид по изобретению или его ToTV-специфический фрагмент.
В другом аспекте изобретение относится к антителу, специфически направленному против антигена по изобретению.
В другом аспекте изобретение относится к способу получения антитела против ToTV, включающему стадии: a) получения вируса ToTV или его (рекомбинантного) белка, или фрагмента его пептида; b) иммунизации подходящего позвоночного-хозяина указанным вирусом, белком или фрагментом пептида и c) сбора из крови (включая сыворотку) или спленоцитов указанного позвоночного-хозяина антител против указанного вируса, белка или фрагмента пептида. В предпочтительном варианте осуществления указанный способ дополнительно включает в себя стадии: d) отбора одного продуцирующего антитело спленоцита, e) слияния указанного спленоцита с иммортализованной линией клеток гибридомы и f) обеспечения возможности указанной слитой гибридоме продуцировать моноклональные антитела.
В другом аспекте изобретение относится к антителу, которое можно получить способом получения антитела против ToTV по изобретению.
В другом аспекте изобретение относится к способу идентификации изолята вируса как вируса ToTV, включающему реакцию указанного изолята вируса или его компонента с антителом по изобретению.
В другом аспекте изобретение относится к способу идентификации изолята вируса как вируса ToTV, включающему реакцию указанного изолята вируса или его компонента с полинуклеотидом по изобретению.
В другом аспекте изобретение относится к способу детекции присутствия ToTV в образце, включающему определение в указанном образце присутствия вируса ToTV или его компонента путем реакции указанного образца с полинуклеотидом или с антителом по изобретению.
В другом аспекте изобретение относится к способу идентификации устойчивого к ToTV растения, включающему стадии: a) воздействия на растение или часть растения инфекционной дозы ToTV, и b) идентификации указанного растения как устойчивого к ToTV, когда, после указанного воздействия, или i) симптомы заболевания в указанном растении или части растения остаются отсутствующими, или их проявление задержано, или, по меньшей мере, тяжесть уменьшена, или они являются локализованными по сравнению с чувствительным контрольным растением, и/или ii) вирус ToTV или геномные последовательности ToTV не присутствуют в указанном растении или части растения или присутствие вируса ToTV является по меньшей мере уменьшенным количественно по сравнению с чувствительным контрольным растением. Стадия a) включает период инкубации достаточно долгой продолжительности, чтобы позволить установление поддающихся выявлению симптомов заболевания в чувствительных контрольных растениях, подвергавшихся воздействию сравнимой инфекционной дозы вируса. Посредством осуществления данного способа можно идентифицировать у растения все формы устойчивости, включая полную устойчивость, частичную устойчивость, гиперчувствительность и толерантность. Чтобы подтвердить толерантность, необходимо подтвердить (системное) присутствие вируса в растении (клетках). Стадия b) может включать осуществление способа детекции присутствия ToTV в образце из указанного растения или части растения по настоящему изобретению, где применяют антитело или полинуклеотид по изобретению в общепринятых способах для анализов гибридизации нуклеотидов или иммуноанализов, хорошо известных специалисту в данной области. Альтернативно, стадия b) может включать приведение в контакт части указанного подвергшегося воздействию растения с чувствительным индикаторным растением. Таким образом, можно выявлять наличие системной или местной инфекции в указанном подвергшемся воздействию растении через наблюдение возникновения заболевания в индикаторном растении или даже в дополнительном контактировавшем индикаторном растении, контактировавшем с указанным первым контактировавшим индикаторным растением.
В другом аспекте изобретение относится к способу получения устойчивого к ToTV растения, включающему стадии идентификации устойчивого к ToTV донорного растения одним из вышеуказанных способов для идентификации устойчивого к ToTV растения по изобретению, скрещивания указанного устойчивого к ToTV донорного растения с реципиентным растением (где реципиентное растение может быть либо чувствительным к ToTV, либо устойчивым к ToTV, но является, соответственно, устойчивым к ToTV растением в случае, если устойчивый фенотип обусловлен рецессивным геном), и отбора из растений-потомков (например, F1, F2 и самоопыленного растения) устойчивого растения способом идентификации устойчивости к ToTV у растения, как описано выше. В случае, если признак устойчивости является рецессивным признаком, устойчивые растения можно обнаружить среди растений-потомков самоопыления F1 или F2 или более дальних поколений. В предпочтительных вариантах осуществления по данному аспекту указанное устойчивое к ToTV донорное растение и реципиентное растение представляют собой растения семейства Solanaceae или семейства Cucurbitaceae. В других предпочтительных вариантах осуществления по данному аспекту указанное реципиентное растение представляет собой томат, баклажан, перец, дыню, арбуз или огурец, более предпочтительно растение из вида Solanum lycopersicum, наиболее предпочтительно линии S.lycopersicum, обладающей коммерчески желательными характеристиками.
В другом аспекте изобретение относится к устойчивому к ToTV растению, предпочтительно томату, баклажану, перцу, дыне, арбузу или огурцу, или его части, такой как семя, которые можно получить способом получения устойчивого к ToTV растения по изобретению.
В другом аспекте изобретение относится к диагностическому набору для детекции присутствия ToTV в образце или для идентификации устойчивости к ToTV в растении, содержащем вирус, полинуклеотид, полипептид, антиген и/или антитело по изобретению.
В другом аспекте изобретение относится к применению вируса, полинуклеотида, полипептида, антигена или антитела по изобретению для получения диагностической композиции.
В другом аспекте изобретение относится к диагностической композиции, содержащей вирус, полинуклеотид, полипептид, антиген или антитело по изобретению.
В другом аспекте изобретение относится к применению ToTV или частей вирусного генома ToTV в качестве экспрессирующего вектора.
В другом аспекте изобретение относится к применению ToTV или частей вирусного генома ToTV для получения обусловленной патогеном устойчивости у растений.
В другом аспекте изобретение относится к применению аттенуированной формы вируса ToTV, или его генома, или его частей для премуниции растения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Как используется в данном описании, термин «часть растения» обозначает часть растения, включая отдельные клетки и клеточные ткани, такие как клетки растения, являющиеся интактными в растениях, скопления клеток и культуры тканей, из которых можно регенерировать растения. Примеры частей растения включают, без ограничения, отдельные клетки и ткани из пыльцы, семяпочек, листьев, зародышей, корней, кончиков корней, пыльников, цветов, плодов, отростков стебля и семян; так же как пыльцу, семяпочки, листья, зародыши, корни, кончики корней, пыльники, цветы, плоды, стебли, побеги, черенки, корневище, семена, протопласты, каллюсы и т.п.
Термин «образец» включает в себя образец из растения, из части растения или из переносчика, или образец почвы, воды или воздуха.
Термин «переносчик», как используется в данном описании, относится к распространяющему заболевание агенту или веществу. Переносчики ToTV в полевых условиях могут включать, без ограничения, животных, таких как Arthropoda (в частности, из классов Insecta и Arachnida), Nematoda (в частности, из класса Adenophorea), а также более крупных животных, таких как, например, птицы, кролики и мыши, грибы (т.е. тип Eumycota, в частности грибы класса Phycomycota), (паразитические) растения (включая члены семейства Cuscutaceae), пыльцу, семена, воду, твердые частицы и даже руки человека, оборудование и обувь.
Термин растение-«потомок» относится к любому растению, полученному в качестве потомства благодаря вегетативному или половому размножению от одного или нескольких родительских растений или их потомков. Например, растение-потомок можно получить клонированием или самоопылением родительского растения, или скрещиванием двух родительских растений, и оно включает в себя растения, полученные самоопылением, так же как F1 или F2, или более дальние поколения. F1 представляет собой потомство первого поколения, полученное от родителей, по меньшей мере одно из которых применяли первый раз в качестве донора признака, тогда как потомство второго поколения (F2) или последующих поколений (F3, F4 и т.д.) представляет собой экземпляры, полученные от самоопылений F1, F2 и т.д. F1 может, таким образом, быть (и обычно является) гибридом, полученным от скрещивания между двумя родителями из разведения гомозигот (гомозиготы из разведения являются гомозиготными по признаку), тогда как F2 может быть (и обычно является) потомством от самоопыления указанных гибридов F1.
Термин «устойчивый», как используется в данном описании, относится к растению, способному сопротивляться размножению вируса в его клетках и/или (системному) передвижению вируса к другим клеткам и/или развитию симптомов заболевания после инфекции указанным вирусом, где вирус способен к инфицированию и размножению в соответствующих неустойчивых или чувствительных вариететов указанного растения. Термин используют для включения таких отдельно идентифицируемых форм устойчивости, как «полная устойчивость», «иммунитет», «частичная устойчивость», «гиперчувствительность» и «толерантность».
«Полная устойчивость» обозначает полную неспособность вируса развиваться после инфекции и может быть либо результатом неспособности вируса входить в клетку (отсутствие начальной инфекции), либо может быть результатом неспособности вируса размножаться в клетке и инфицировать последующие клетки (отсутствие подпороговой инфекции, отсутствие распространения). Наличие полной устойчивости можно определить установлением отсутствия вирусных частиц или вирусной РНК в клетках растения, так же как отсутствия каких-либо симптомов заболевания в указанном растении после воздействия на указанное растение инфекционной дозы вируса (т.е. после «инфекции»). Среди селекционеров данный фенотип часто обозначают как «иммунный». «Иммунитет», как используется в данном описании, таким образом, относится к форме устойчивости, характеризуемой отсутствием вирусной репликации, даже когда вирус активно переносят в клетки, например, посредством электропорации.
«Инфекционную дозу» определяют как дозу вирусных частиц или нуклеиновой кислоты вируса, способную инфицировать растение, где доза может различаться между растениями и между тестируемыми изолятами ToTV. Теоретически, количество от приблизительно 1-10 до приблизительно 500-5000 вирусных частиц указанного вируса или его нуклеиновых кислот будет являться достаточным. Инфекции, таким образом, можно достигать механической инокуляцией очищенных частиц вируса или нуклеиновой кислоты вируса в растения.
«Частичная устойчивость» обозначает уменьшенное размножение вируса в клетке, уменьшенное (системное) передвижение вируса и/или уменьшенное развитие симптомов после инфекции. Наличие частичной устойчивости можно определить установлением системного присутствия низких титров вирусных частиц или вирусной РНК в растении и присутствия уменьшенных или отсроченных симптомов заболевания в указанном растении после воздействия на указанное растение инфекционной дозы вируса. Титры вируса можно определить с использованием способа количественной детекции (например, способа ELISA или количественной полимеразной цепной реакции с обратной транскрипцией [RT-PCR]). Среди селекционеров данный фенотип часто обозначают как «промежуточно устойчивый».
Термин «гиперчувствительный» относится к форме устойчивости, при которой инфекция остается местной и не распространяется системно, например, из-за местного некроза инфицированной ткани или отсутствия системного передвижения за пределы инокулированной ткани. В гиперчувствительных растениях обнаруживают местные, но тяжелые симптомы заболевания, и в таких растениях можно установить местное присутствие вируса.
Термин «толерантный» применяют в данном описании для обозначения фенотипа растения, при котором симптомы заболевания остаются отсутствующими после воздействия на указанное растение инфекционной дозы вируса, при котором можно установить присутствие системной или местной вирусной инфекции, размножение вируса, по меньшей мере присутствие вирусных геномных последовательностей в клетках указанного растения и/или их интеграцию в геном. Таким образом, толерантные растения являются устойчивыми для проявления симптомов, однако бессимптомные растения являются носителями вируса. Иногда вирусные последовательности могут присутствовать или даже размножаться в растениях, не вызывая симптомов заболевания. Этот феномен известен также как «латентная инфекция». Некоторые ДНК- и РНК-вирусы могут становиться не подлежащими выявлению после первичной инфекции, но появляться вновь позже и приводить к острому заболеванию. При латентной инфекции вирус может существовать в истинно латентной неинфекционной скрытой форме, возможно, в виде интегрированного генома или эписомального агента (так что вирусные частицы нельзя обнаружить в цитоплазме, в то время как способами PCR можно показать присутствие последовательностей вирусной нуклеиновой кислоты) или в виде инфекционного и постоянно реплицирующегося агента. Реактивированный вирус может распространяться и вызывать эпидемию среди контактирующих чувствительных растений. Наличие «латентной инфекции» нельзя отличить от наличия «толерантного» фенотипа у растения.
Термин «чувствительный» используют в данном описании для обозначения растения, не обладающего устойчивостью к вирусу, что приводит к проникновению вируса в клетки растения, размножению и системному распространению вируса, вызывая симптомы заболевания. Термин «чувствительный», таким образом, является эквивалентным «неустойчивому». В чувствительном растении обнаруживают нормальные титры вируса в клетках после инфекции. Таким образом, чувствительность можно определить посредством установления нормальных (т.е. относительно других вирусных инфекций у растений) титров вирусных частиц или вирусной РНК в клетках растения и присутствия нормальных симптомов заболевания (т.е. относительно симптомов заболевания, как описано здесь для растения, из которого первоначально выделен ToTV) в указанном растении после воздействия на указанное растение инфекционной дозы вируса.
Термин «чувствительный» отражает симптоматическую реакцию чувствительного растения после вирусной инфекции. Реакция или симптомы могут быть более или менее тяжелыми в зависимости от уровня чувствительности растения. Если вирус повреждает или даже вызывает гибель растения, указанное растение определяют как «чувствительное».
Растения, искусственно инокулированные аттенуированными штаммами вируса, впоследствии являются защищенными от близкородственных вирулентных вирусов. В качестве защищающих вирусов можно использовать либо существующие в природе умеренные штаммы, либо аттенуированный штамм (искусственно полученный умеренный мутант). Предпочтительно, чтобы достигнуть премуниции растения против ToTV, можно использовать аттенуированный штамм ToTV, который не вызывает симптомов или для которого показано по меньшей мере уменьшенное проявление симптомов в инфицированном растении относительно вирулентного штамма ToTV. Способы получения аттенуированного вируса могут включать, например, случайный мутагенез генома ToTV и скрининг штаммов с аттенуацией симптомов. Приведена непосредственная ссылка на способы получения аттенуированных вирусов растений, как описано в статьях Takeshita et al., 2001; Lu et al., 2001; Hagiwara, et al., 2002; Hirata et al., 2003.
Как используется в данном описании, термин «томат» означает любое растение, линию или популяцию Lycopersicon или Solanum, включающие, без ограничения, представленные в списке ниже. Недавно номенклатура Lycopersicon была изменена.
Новая номенклатура Lycopersicon представлена в следующем списке (из: Peralta, Knapp & Spooner, неопубликованная монография (см.: http://www.sgn.cornell.edu "Guide to revised Solanum nomenclature")).
| Наименование в монографии о томатах (Peralta et al., в подготовке для публикации в Systematic Botany Monographs) | Эквивалент Lycopersicon |
| Solanum juglandifolium Dunal | Lycopersicon juglandifolium (Dunal) J.M.H. Shaw |
| Solanum ochranthum Dunal | Lycopersicon ochranthum (Dunal) J.M.H. Shaw |
| Solanum sitiens I.M. Johnst | Lycopersicon sitiens (I.M. Johnst.) J.M.H. Shaw |
| Solanum lycopersicoides Dunal | Lycopersicon lycopersicoides (Dunal in DC.) A. Child ex J.M.H. Shaw |
| Solanum pennellii Correll | Lycopersicon pennellii (Correll) D'Arcy |
| Solanum habrochaites S. Knapp & D.M Spooner | Lycopersicon hirsutum Dunal |
| Solanum “N peruvianum” для описания в Peralta (4 географических расы: стелющийся, лома, Марафон, Chotano-Yamaluc) | Часть Lycopersicon peruvianum (L.) Miller (вкл. вар. рас стелющийся и Марафон) |
| Solanum “Callejon de Huaylas” для описания в Peralta | Часть Lycopersicon peruvianum (L.) Miller (из Ancash, alogn Rнo Santa) |
| Solanum neorickii D.M. Spooner, G.J. Anderson & R.K. Jansen | Lycopersicon parviflorum C.M. Rick, Kesicki, Fobes & M. Holle |
| Solanum chmielewskii (C.M. Rick, Kesicki, Fobes & M. Holle) D.M. Spooner, G.J. Anderson & R.K. Jansen | Lycopersicon chmielewskii C.M. Rick, Kesicki, Fobes & M. Holle |
| Solanum corneliomuelleri J.F. Macbr. (1 географическая раса: Misti nr. Arequipa) | Часть Lycopersicon peruvianum (L.) Miller; известная также как Lycopersicon glandulosum C.F. Mull. |
| Solanum peruvianum L. | Lycopersicon peruvianum (L.) Miller |
| Solanum chilense (Dunal) Reiche | Lycopersicon chilense Dunal |
| Solanum cheesmaniae (L. Riley) Fosberg | Lycopersicon cheesmaniae L. Riley (опубликован как cheesmanii) |
| Solanum galapagense S. Darwin & Peralta | Часть Lycopersicon cheesmaniae L. Riley (ранее известная как форма или вар. minor) |
| Solanum lycopersicum L. | Lycopersicon esculentum Miller |
| Solanum pimpinellifolium L. | Lycopersicon pimpinellifolium (L.) Miller |
«Экспрессирующий вектор» определяют как молекулу нуклеиновой кислоты, содержащую ген, обычно гетерологичный ген, экспрессирующийся в клетке-хозяине. Как правило, этот ген содержит кодирующую белок последовательность. Экспрессию гена всегда помещают под контроль промотора, и такой ген, как говорят, является «функционально связанным с» промотором. Термин «гетерологичный» относится к молекуле ДНК или к популяции молекул ДНК, которая в природных условиях не существует в данной клетке-хозяине.
Термин «полинуклеотид», как используется в данном описании, является взаимозаменяемым с термином «нуклеиновая кислота» и относится к мультимеру нуклеотидов или полимерной форме нуклеотидов, обладающим любым числом нуклеотидов, например дезоксирибонуклеотидов или рибонуклеотидов, или к полученным синтетически соединениям (например, PNA, как описано в патенте США № 5948902 и процитированных там ссылках), и может быть либо двух-, либо одноцепочечным. Полинуклеотид может гибридизоваться с существующими в природе полинуклеотидами специфическим к последовательности образом, аналогичным гибридизации двух существующих в природе полинуклеотидов, например может участвовать во взаимодействиях Уотсон-Криковского спаривания оснований. Термин также включает в себя модифицированные, например, метилированием и/или кэппированием и немодифицированные формы полинуклеотида.
Термины «рибонуклеиновая кислота» и «РНК», как используется в данном описании, обозначают полимер, состоящий из рибонуклеотидов.
Термины «дезоксирибонуклеиновая кислота» и «ДНК», как используется в данном описании, обозначают полимер, состоящий из дезоксирибонуклеотидов.
Термин «олигонуклеотид» обозначает короткую последовательность мономеров нуклеотидов (обычно от 6 до 100 нуклеотидов), соединенных фосфорными связями (например, фосфодиэфирной, алкил- и арилфосфатной, фосфоротиоатной) или нефосфорными связями (например, пептидной, сульфаматной и другими). Олигонуклеотид может содержать модифицированные нуклеотиды, имеющие модифицированные основания (например, 5-метилцитозин) и модифицированные группы сахаров (например, 2'-O-метилрибозил, 2'-O-метоксиэтилрибозил, 2'-фторорибозил, 2'-аминорибозил и т.п.). Олигонуклеотиды могут представлять собой природные или синтетические молекулы двух- и одноцепочечной ДНК и двух- и одноцепочечной РНК кольцевой, разветвленной или линейной формы и, не обязательно, содержат домены, способные формировать вторичные структуры (например, стебель-петля, псевдоузлы и структуры соприкасающихся петель).
Термин «гомология нуклеотидной последовательности», как используется в данном описании, обозначает наличие гомологии между двумя полинуклеотидами. Полинуклеотиды обладают «гомологичными» последовательностями, если последовательность нуклеотидов в двух последовательностях является одинаковой при сравнении по максимальному соответствию. Сравнение последовательности между двумя или более полинуклеотидами, как правило, проводят сравнением частей двух последовательностей в окне сравнения для идентификации и сравнения локальных областей сходства последовательности. Окно сравнения обычно составляет приблизительно от 20 до 200 непрерывных нуклеотидов. «Процент гомологии последовательности» полинуклеотидов, например 50, 60, 70, 80, 90, 95, 98, 99 или 100 процентов гомологии последовательности, можно определить сравнением двух оптимально выровненных последовательностей в окне сравнения, где часть последовательности полинуклеотида в окне сравнения может содержать добавления или делеции (т.е. пропуски) по сравнению с контрольной последовательностью (которая не содержит добавлений или делеций) для оптимального выравнивания двух последовательностей. Процент вычисляют посредством (a) определения числа положений, в которых идентичные основания нуклеиновой кислоты присутствуют в обеих последовательностях, для получения числа совпадающих положений; (b) деления числа совпадающих положений на общее число положений в окне сравнения; и (c) умножения результата на 100 для получения процента гомологии последовательности. Оптимальное выравнивание последовательностей для сравнения можно проводить компьютеризированным исполнением известных алгоритмов или визуальным контролем. Легко доступными алгоритмами сравнения последовательностей и множественного выравнивания последовательностей являются, соответственно, основная программа поиска локального выравнивания (BLAST) (Altschul et al., 1990; Altschul et al., 1997) и программа ClustalW, обе доступны через интернет. Другие подходящие программы включают, без ограничения, GAP, BestFit, PlotSimilarity и FASTA в пакете программного обеспечения Wisconsin Genetics (Genetics Computer Group (GCG), Madison, WI, USA) (Devereux et al., 1984).
Как используется в данном описании, «в основном комплементарные» означает, что две последовательности нуклеиновой кислоты обладают по меньшей мере приблизительно 65%, предпочтительно приблизительно 70%, более предпочтительно приблизительно 80%, даже более предпочтительно 90% и наиболее предпочтительно приблизительно 98% комплементарностью последовательностей друг с другом. Это означает, что праймеры и зонды должны обладать достаточной комплементарностью с их матрицей и нуклеиновой кислотой-мишенью, соответственно, чтобы гибридизоваться в строгих условиях. Таким образом, последовательности праймера и зонда не должны отражать точную комплементарную последовательность связывающей области на матрице, и можно применять вырожденные праймеры. Например, некомплементарный нуклеотидный фрагмент можно присоединять к 5'-концу праймера, причем остальная последовательность праймера является комплементарной цепью. Альтернативно, в праймер можно вставлять некомплементарные основания или более длинные последовательности при условии, что праймер обладает достаточной комплементарностью с последовательностью одной из подлежащих амплификации цепей для гибридизации с ней и, таким образом, формирования структуры дуплекса, которую можно достроить способами полимеризации. Некомплементарные нуклеотидные последовательности праймеров могут включать участки для рестрикционных ферментов. Добавление участка для рестрикционного фермента на конец(концы) последовательности-мишени может быть особенно полезным для клонирования последовательности-мишени. В основном комплементарная последовательность праймера представляет собой последовательность, обладающую достаточной комплементарностью последовательности с матрицей для амплификации, чтобы приводить к связыванию праймера и синтезу второй цепи. Специалистам в данной области известно, что праймеры должны обладать достаточной комплементарностью последовательности с матрицей для амплификации.
Термин «гибрид» в контексте нуклеиновых кислот относится к двухцепочечной молекуле нуклеиновой кислоты, или дуплексу, образованной с помощью водородных связей между комплементарными нуклеотидными основаниями. Термины «гибридизоваться» или «отжигаться» относятся к процессу, при помощи которого отдельные цепи последовательности нуклеиновой кислоты образуют двуспиральные отрезки путем водородного связывания между комплементарными основаниями.
Термин «гибрид» в контексте селекции растений относится к растению, являющемуся потомком генетически разнородных родителей, полученным путем скрещивания растений из различных линий, пород или видов.
Термин «зонд» относится к одноцепочечной олигонуклеотидной последовательности, которая будет распознавать комплементарную последовательность в последовательности-мишени аналита нуклеиновой кислоты или производной от нее кДНК и формировать с ней дуплекс с водородными связями.
Термин «праймер», как используется в данном описании, относится к олигонуклеотиду, способному отжигаться с мишенью для амплификации, позволяя присоединение ДНК-полимеразы, таким образом, выполняя функцию точки инициации синтеза ДНК при помещении в условия, в которых индуцируется синтез продукта удлинения праймеров, т.е. в присутствии нуклеотидов и средства для полимеризации, такого как ДНК-полимераза, и при подходящих температуре и pH. Праймер (для амплификации) предпочтительно является одноцепочечным для максимальной эффективности амплификации. Предпочтительно, праймер представляет собой олигодезоксирибонуклеотид. Праймер должен быть достаточно длинным для праймирования синтеза продуктов удлинения в присутствии средства для полимеризации. Точные длины праймеров будут зависеть от многих факторов, включая температуру и состав (содержание A/T и G/C) праймера. Пара двусторонних праймеров состоит из одного прямого и одного обратного праймера, как общепринято в области амплификации ДНК, такой как амплификация PCR.
Понятно, что «праймер», как используется в данном описании, может относиться к более чем одному праймеру, в частности, в случае, где существует некоторая неопределенность информации относительно концевой последовательности(последовательностей) области-мишени, подлежащей амплификации. Таким образом, «праймер» включает набор олигонуклеотидов-праймеров, содержащий последовательности, представляющие возможные варианты последовательности, или включает нуклеотиды, позвол