Способ диагностики больных, пораженных опухолями головного мозга
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к нейроонкологической хирургии. Для диагностики больных, пораженных опухолями головного мозга, проводят гистологическое исследование, образца опухоли с определением ее типа. Гистологический образец опухоли растирают в среде жидкостей DMEM/F12, 10% фетальной бычьей сыворотки, 5% L-глуталина и 5% гентамицина, фильтруют и центрифугируют. После добавляют в смесь фосфатно-солевой буфер, отделяют клеточную взвесь. В лунки планшета вносят клеточную взвесь и среду без клеток. Инкубируют содержимое планшета в термостате при температуре 37°С в присутствии 5% CO2. После инкубации в лунки с клеточной взвесью и средой вносят разные цитостатики с разной их концентрацией, после последующей инкубации в каждую лунку планшета добавляют раствор МТТ в фосфатно-солевом буфере. Инкубируют содержимое планшета в термостате и добавляют в каждую лунку по 100 µM изопропанола с 0,04 М HCl. Измеряют оптическую плотность в лунках планшета при длине волны 570 нм. Оценку результатов проводят, сравнивая показатели измеренных оптических плотностей среды и клеточной взвеси с цитостатиками и оценивая % клеточной гибели в образцах опухоли с различной концентрацией цитостатиков. Способ позволяет повысить точность и эффективность диагностики посредством индивидуального подбора цитостатиков с определением их концентрации и с оценкой чувствительности цитостатической функции кортикостероидов. 2 табл.
Реферат
Способ диагностики больных, пораженных опухолями головного мозга относится к области медицины, а именно к нейроонкологической хирургии.
Статический анализ показывает, что заболеваемость злокачественными опухолями (глиомами) головного мозга составляет 5-8 случаев на 100000 населения. Несмотря на улучшение диагностики смертность больных интракраниальными опухолями остается высокой, а результаты лечения неудовлетворительными. Ведущая роль в терапии больных с интракраниальными опухолями принадлежит хирургическому методу лечения. Медиана выживаемости после хирургического лечения составляет 20 недель. Однако использование только хирургического лечения данной нозологической группы приводит к быстрому рецидивированию процесса, т.е. является паллиативным методом при отсутствии дальнейшей терапии. Наряду с хирургическим лечением важнейшим компонентом терапии больных глиомами является лучевая и лекарственная терапия. Проведение в послеоперационном периоде лучевой терапии увеличивает медиану выживаемости до 36 недель и улучшает качество жизни больных. Химиотерапия дает возможность увеличить медиану выживаемости с 40 до 50 недель. Таким образом, используемые в настоящее время подходы к терапии больных интракраниальными опухолями (глиомами) в лучшем случае увеличивает продолжительность времени здорового состояния пациента после операции по удалению опухоли до развития рецидива (продолжение роста глиомы). Так как ситуация кардинально изменяется при развитии рецидива опухоли, возможности хирургического лечения, в том числе операций, направленных на удаление опухоли (лазерной деструкции, криодеструкции), и лучевой терапии ограничены. Поэтому перспектива на увеличение продолжительности и улучшение качества жизни больных после проведения хирургических операций по удалению опухолей прежде всего связана с эффективностью лекарственной терапии. Чувствительность глиальных опухолей различных гистотипов к различным лекарственным препаратам, в частности к цитостатикам, существенно различается. Даже среди опухолей одинакового гистологического строения в связи с выраженной гетерогенностью клеточной популяции чувствительность к цитостатикам различна. Например, анапластические астроцитомы более чувствительны к лекарственным воздействиям в сравнении с глиобластомой. Медиана выживаемости у этой категории больных достигает 157 недель. Причины недостаточной эффективности химиотерапии при лечении больных с глиомами могут быть обусловлены наличием гематоэнцефалического барьера, отека мозга, гетерогенностью клеточной популяции, обуславливающей различную чувствительность клеток к цитостатикам, биохимической и фармакологической резистентностью. Причины резистентности опухолей головного мозга, в частности, глиобластом к к химиотерапии могут заключаться и в молекулярных особенностях, таких как потеря проапоптического гена (р53) или изменение продукции антиапоптических генов (BCL-2 семейства), или присутствие белка множественной лекарственной резистентности (mdr), Р - гликопротеина или mdr - связанных протеинов, а также ряда биологических характеристик, таких как плохая перфузия опухоли, гипоксия опухоли и ацидоз, что позволяет говорить о глиомах высокой степени злокачественности как о группе опухолей, имеющих разнообразную биологию развития индивидуальную для каждого больного, и предположить отсутствие единого универсального ключа для лечения глиом. Сравнительные исследования эффективности использования при лечении различных цитостатиков у больных злокачественными интракраниальными опухолями малочисленны, поскольку эталона для оценки эффективности новых цитостатиков не существует.
В нейрохирургии известны способы диагностики больных, пораженных опухолями головного мозга, например, статья Johannes E.A., Wolff, Thomas Trilling, Gabriele Molenkamp, R. Maarten Egeler, Herbert Jurgens Chemosensitivity of glioma cels in vitro: a mota analysis, J. Res. Clin Oncol // 1999 // 125 p.481-486/. В данной статье приведены данные по чувствительности клеток глиом к химиотерапевтическим препаратам in vitro: метаанализ. При использовании химиотерапии клеток гистологических образцов глиом была использована оценка воздействия лекарственных препаратов на клетки опухоли вычислением значений коэффициента LC50 летальной концентрации - клеточной гибели 50% клеток глиомы при концентрации препаратов, которые убивают 50% и более клеток опухоли - LC10. Оценка производилась по разным методикам, в том числе и по методу Моссмана по окраске живых клеток с использованием МТТ - в растворе 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиум бромид, продукт реакции которого с формазаном приобретает темно-синюю окраску. Анализ различных исследований позволял определить рамочные концентрации чувствительности клеточных линий опухолей к различным цитостатикам.
Недостатками таких исследований являются: результаты исследований носят больше теоретический характер, т.к. использованный модельный объект (клеточные линии опухолей головного мозга крысы и человека) не позволяют оценивать чувствительность к цитостатикам опухолей каждого конкретного пациента, страдающего глиомой головного мозга, кроме того, исследования проводились in vitro, не на человеке, что недостаточно для постановки конкретного диагноза по лечению опухоли с назначением определенных лекарственных средств с определенной концентрацией.
Наиболее близким решением по способу установки диагноза лечения больных, пораженных опухолями головного мозга, является материал, указанный в статье Апшкалне Д.А., Котельников В.М., Пурыньш И.Ж., Сафронов В.А. Определение индивидуальной чувствительности глиальных опухолей человека к действию химиотерапевтических препаратов // Вопросы нейрохирургии, №4, 1979 г., с.30-36. Предложенная методика включает следующие действия. После гистологического взятия образца фрагменты опухоли помещают в 12 пробирок со средой жидкостей - 10 мл среды №199 = 10% бычьей сыворотки, получали 13 пробирок. Одну пробирку со средой использовали в качестве контроля. В остальные 12 пробирок добавляли химиотерапевтические препараты: фторафур, 5-фторурацил (5-ФУ), сарколизин и метротрексат, каждый в трех концентрациях: 1 терапевтическая доза (ТД), 10ТД и 100ТД. За терапевтическую дозу принимают такую концентрацию препарата в 1 мл среды, которая равняется его концентрации, приходящейся на 1 г массы тела после однократного введения этого препарата больному в стандартной дозировке в клинических условиях. Пробирки помещают в герметический ящик с газовой смесью, содержащий 95% кислорода и 5% - углекислого газа. В течение 23 часов фрагменты опухоли инкубируют в термостате при 37°С, затем в каждую пробирку добавляли 3H-тимидин из расчета 1 мкКи на 1 мл среды и продолжали инкубировать в течение 1 часа. Суточная инкубации фрагментов опухоли в питательной среде не влияет на индекс мечения. За этот срок значительная часть клеток пролиферующей популяции в опухоли проходит фазу синтеза ДНК. Величину индекса мечения в контроле и для каждой концентрации исследовавшихся препаратов определяют в участках с наибольшим количеством меченых клеток, подсчитывая их долю среди 2000 опухолевых клеток. По полученным данным подсчитывали разницу между величиной индекса мечения в контроле и для каждой концентрации препаратов. Эту разницу нормировали по величине индекса в контроле и выражали в процентах. В случае снижения индекса мечения под воздействием препарата считали положительным, а в случае увеличения - отрицательным. По глиальным опухолям наблюдения велись по астроцитоме, глиобластоме, медуллобластоме, олигодендроглиоме и олигодендроглиобластоме. В большинстве случаев при тестировании всех химиотерапевтических препаратов отмечалось снижение величины индекса мечения по мере увеличения доз препаратов. При оценке полученных результатов было отмечено, что ни один из препаратов не оказался эффективнее остальных, каждая отдельная опухоль в различной степени реагирует на действие разных препаратов и реакция опухолевой ткани на действие препаратов in vitro не зависит от того, является данная опухоль быстро или медленнорастущей. В конце исследований было отмечено, что каждая глиальная опухоль обладает своим индивидуальным спектром чувствительности к химиотерапевтическим препаратам in vitro, отличающим ее от других опухолей.
Недостатками такого способа диагностики опухолей головного мозга являются: исследования не обнаружили преимущественной эффективности использованных препаратов; при лечении больных, пораженных злокачественными опухолями, данные in vitro по сравнению in vivo недостаточно; при данной системе тестирования слишком длительный срок обработки образцов (10 дней), выраженность реакции опухоли на действие химиотерапевтического препарата часто не зависит от его концентрации, ни один из исследованных препаратов не был достаточно эффективным для 100% подавления синтеза ДНК в опухолевой ткани.
Техническим результатом данного решения является повышение точности, качества и эффективности диагностики посредством индивидуального подбора новых современных цитостатиков и их комбинаций с определением их концентраций с оценкой максимальной чувствительности цитостатической функции кортикостероидов, обеспечивающих большую проницаемость из выбранных препаратов гематоэнцефалического барьера, т.е. обладающих увеличенной способностью к проникновению в центральную нервную систему; повышение качества диагностики для тестирования малых объемов опухолевой ткани in vivo, получаемых в результате малоинвазивных операций (при стереотаксической биопсии злокачественных глиом головного мозга) в случае локализации опухоли в областях малодоступных для открытого хирургического вмешательства, улучшение оценки цитотаксической функции определения индивидуальных химиопрепаратов в максимально эффективных концентрациях.
Этот результат достигается тем, что в способе диагностики больных, пораженных опухолями головного мозга, включающем гистологическое исследование образца опухоли после ее хирургического удаления с определением ее типа и согласно этому типу назначения лекарственных препаратов, например цитостатиков, гистологический образец удаленной опухоли растирают в среде жидкости DMEM/F12 4 мл, 10% фетальной бычьей сыворотки 0,5 мл, 5% L-глуталина 0,05 мл и 5% гентамицина 0,01 мл, фильтруют, центрифугируют смесь в течение 5' со скоростью 1200 об/мин, после окончания цитофереза добавляют в смесь фосфатно-солевой буфер, отделяют клеточную взвесь и в лунки планшета вносят последнюю в концентрации 1×10 клеток на лунку в 0,1 мл среды и среду без клеток, инкубируют содержимое планшета в термостате при температуре 37°С в присутствии 5% CO2 в течение 24 часов, после инкубации в лунки с клеточной взвесью и средой вносят разные цитостатики с разной их концентрацией, после последующей инкубации смесь планшета в течение 72 часов при температуре 37°С в присутствии 5% CO2 в каждую лунку планшета добавляют 10 µМ раствора МТТ с концентрацией 5 мг/мл в фосфатно-солевом буфере, после опять инкубируют содержимое планшета в термостате в течение 4-х часов при 37°С в присутствии 5% CO2 и добавляют в каждую лунку по 100 µМ изопропанола с 0.04М HCL, затем после размешивания образцов в лунках планшета измеряют их оптическую плотность при длине волны 570 нм, оценку результатов измерения производят, сравнивая показатели измеренных оптических плотностей среды и клеточной взвеси с цитостатиком и оценивая % клеточной гибели в цитостатиках с различной их концентрацией образцов опухоли с формированием сводной таблицы результатов исследования соответствия чувствительности образца к каждой исследуемой концентрации по всем использованным цитостатикам.
Сущность изобретения выражается в совокупности существенных признаков, достаточной для достижения обеспечиваемого изобретением технического результата.
Существенными признаками предложенного способа диагностики, совпадающими с признаками прототипа, являются: А - гистологическое исследование образца опухоли после ее хирургического удаления с определением ее типа; Б - согласно типу опухоли назначение лекарственных препаратов, например, цитостатиков.
Существенными отличительными признаками предлагаемого решения являются: В -гистологический образец удаленной опухоли растирают в среде жидкостей DMEM/F12 4 мл, 10% фетальной бычьей сыворотки 0,5 мл, 5% L-глуталина 0,05 мл и 5% гентамицина 0,01 мл; Г - фильтруют и центрифугируют смесь в течение 5' со скоростью 1200 об/мин; Д - после окончания цитофереза добавляют в смесь фосфатно-солевой буфер, отделяют клеточную взвесь и в лунки планшета вносят клеточную взвесь в концентрации 1×104 клеток на лунку в 0,1 мл среды и среду без клеток; Ж - инкубируют содержимое планшета в термостате при температуре 37°С в присутствии 5% CO2 в течение 24 часов; И - после инкубации в лунки с клеточной взвесью и средой вносят разные цитостатики с разной их концентрацией; К - после последующей инкубации смеси планшета в течение 72 часов при температуре 37°С в присутствии 5% СО2 добавляют в каждую лунку планшета 10 µМ раствора МТТ с концентрацией 5 мг/мл в фосфатно-солевом буфере; Л - после опять инкубируют содержимое планшета в термостате в течение 4 часов при 37°С в присутствии 5% CO2 и добавляют в каждую лунку по 100 µМ изопропанола с 0.04 м HCL; М - после размешивания образцов в лунках планшета измеряют их оптическую плотность при длине волны 570 нм; Н - оценку результатов измерения производят, сравнивая показатели оптических плотностей среды и клеточной взвеси с цитостатиком и оценивая % клеточной гибели в цитостатиках с различной их концентрацией образцов опухоли с формированием сводной таблицы результатов исследования соответствия чувствительности образца к каждой исследуемой концентрации по всем использованным цитостатикам.
Способ диагностики больных, пораженных опухолями головного мозга, заключается в следующем. После хирургической операции по удалению интракраниальной опухоли головного мозга часть операционного материала (2-3 см3) - биоптат помещают в чашку объемом 20 мл. Наливают в эту чашку смесь жидкостей: DMEM/F12 - 4 мл, 10% инактивированную фетальную бычью сыворотку - 0,5 мл, 5% L-глуталина 0,05 мл и 0,01 мл 5% гентамицина, механически измельчают образец опухоли, т.е. растирают его, фильтруют и центрифугируют в течение 5 минут со скоростью 1200 об/мин. После окончания цитофереза добавляют в смесь фосфатно-солевой буфер, отделяют клеточную взвесь и разносят по 72 лункам 96 луночного планшета в концентрации 1×104 клеток на лунку в 0,1 мл среды (смесь жидкостей в чашке). А в оставшиеся 24 лунки вносят только среду. Инкубируют содержимое планшета в термостате в течение 24 часов при температуре 37°С в присутствии 5% CO2. Берутся шесть цитостатиков, наиболее эффективных при лечении глиом головного мозга, а именно: цис-платин, вепезид, винкристин, производные нитрозомочевины, доксорубицин, темодал в разной концентрации: 0,1 µМ, 1,0 µМ,10 µМ и 100 µМ (µМ - микромоль). Каждый цитостатик из 6 с разными концентрациями (в данном случае 4-мя) вносят в 3 (три) лунки (в каждых 3-х лунках помещают один цитостатик и с одной какой-либо концентрацией), таким образом, занимая 72 лунки. В остальные 24 лунки из 96 луночного планшета, содержащих среду, т.е. смесь жидкостей: DMEM/F12, 10% бычью сыворотку, 5% L глуталин, 5% гентамицин, вносят по 1 лунке разный цитостатик из шести по одной его концентрации из 4-х. Затем в каждую лунку из 96 добавляют 10 µМ раствора МТТ (МТТ - это 3-(4,5 диметилтиазол-2-ил)-2,5-дифенилтетразолиум, бромид) с концентрацией 5 мг/мл в фосфатно-солевом буфере. Инкубируют содержимое планшета в течение 4-х часов в термостате при 37°С в присутствии 5% CO2. После инкубации в каждую лунку планшета добавляют по 100 µМ изопропанола с 0,04 М HCL. После тщательного размешивания образцов в лунках планшета измеряют оптическую плотность содержимого в каждой лунке при длине волны, равной 570 нм, с использованием швейцарского автоматического цитомера фирмы ПИКОН. Оценку результатов измерения производят, сравнивая показатели оптической плотности среды и клеточной взвеси с цитостатиком с различными концентрациями. Расчет % клеточной гибели производят на основе определения цитотаксического индекса С1 (по Моссману) в процентах по известной формуле.
Cl % = (1-OD1/OD2)×100, где Cl - цитотаксический индекс (% клеточной гибели),
OD1 - оптическая плотность цитостатика определенной концентрации с культурой клеток опухоли головного мозга пациента;
OD2 - оптическая плотность среды, содержащей цитостатик в определенной концентрации (контроль).
Образец опухоли, находящийся в исследуемой лунке, считается чувствительным к воздействию цитостатика в случае, если цитотаксический индекс Cl (% клеточной гибели) более 50% по сравнению с контролем. В этом случае результат исследования в данной лунке (т.е. при данной концентрации цитостатика) считается положительным и обозначается как «+», в случае, если цитотоксический индекс менее 50% по сравнению с контролем, то результат исследования считается отрицательным и обозначается как «-». На основании этих данных формируется сводная таблица соответствия чувствительности образца опухоли к каждой исследуемой концентрации цитостатика (0,1 µМ, 1,0 µМ, 10 µМ и 100 µМ) по всем исследуемым цитостатикам (шести: цис-платин, вепезид, винкристин, производные нитрозомочевины, доксорубицин, темодал). Вывод о чувствительности опухоли к исследуемому цитостатику делается на основании совокупной оценки чувствительности по всем исследуемым концентрациям и представляется в виде следующей градации: «++++» - опухоль чувствительна к данному цитостатику во всех 4-х исследуемых концентрациях (0,1. 1,0, 10, 100 µМ); «+++» - опухоль чувствительна к данному цитостатику в 3-х исследуемых концентрациях из 4-х исследуемых; «++» - опухоль чувствительна к данному цитостатику в 2-х исследуемых концентрациях; «+» -опухоль чувствительна к данному цитостатику в 1-ой исследуемой концентрации.
Индивидуальный подбор химиотерапии проведен у 20 больных с различными результатами гистологического исследования материала (образца), полученного в результате хирургических операций опухолей головного мозга. Были исследованы следующие гистологические типы опухолей: астроцитомы - 4, анапластические астроцитомы - 3, глиобластомы - 9, олигоастроцитома - 1, анапластическая олигодендроглиомы - 2, пилоцитарная астроцитома - 1. Проведена оценка эффективности цитотоксического действия стероидов в рамках подбора у 18 больных, у 14 больных получен эффект различной степени эффективности, у 4-х больных эффекта не получено.
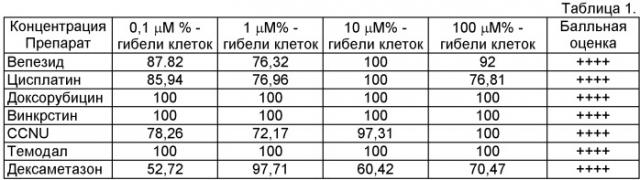
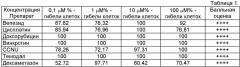
Клинический пример №1. Больная Г., 38 лет, госпитализирована 11.03.08 г., диагноз - олигодендроглиома правой лобной доли, имеются жалобы при поступлении на эпиприступы различной длительности в течение 3-х месяцев (с января 2008 г.). Неврологическая симптоматика представлена левосторонней пирамидной недостаточностью. По данным МРТ (магнитно-резонансной томографии) головного мозга и ПЭТ (позитроно-эмиссионной томографии) с С11 метионином олигодендроглиома с анаплазией правой лобной доли. 18.03.08 г. выполнена операция: костно-пластическая трепанация черепа в правой лобной области с заходом за среднюю линию, удаление внутримозговой опухоли передних отделов правой лобной доли парасагиттальной локализации. Гистологическое заключение - анапластическая олигодендроглиома. Выполнен подбор химиотерапии на материале образца глиомы пациентки по предложенному способу диагностики. Результаты исследований представлены в таблице 1.
На основании данных исследования по предложенному способу диагностики начат курс химиотерапии по схеме PCV - из цитостатиков - винкристин и CCNU, а также и другие лекарственные средства согласно схемы лечения. Проведено 4 курса полихимиотерапии. По состоянию на 01.08.09 г. у больной в результате лечения достигнута полная клиническая ремиссия, больная приступила к работе, активных жалоб не предъявляет.
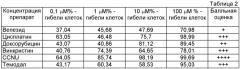
Пример 2. Больная Б., 24 года, госпитализирована 02.11.06 г. Диагноз: анапластическая астроцитома правой лобной доли. Ведущие жалобы при поступлении на появление эпиприступов виде судорог в левых конечностях без утраты сознания 1-2 раза в неделю. Неврологическая симптоматика представлена умеренной общемозговой симптоматикой. По данным МРТ головного мозга и ПЭТ с С11 метионином выявлена глиома правой лобной доли. 14.11.06 г. выполнена операция краниотомия, удаление астроцитомы верхнезадних отделов правой лобной доли. Гистологическое заключение - анапластическая астроцитома (Grade 111). Выполнен подбор лекарственных препаратов для химиотерапии на материале глиомы пациентки по предложенному способу диагностики. Результаты исследований представлены в таблице 2.
На основании данных исследования по предложенному способу с 23.11.06 проведены курсы химиотерапии с применением цитостатиков винкристин и капсул CCNU. По состоянию на 01.08.09 г. у больной достигнута полная клиническая ремиссия, активных жалоб не предъявляет. Согласно таблице оценки цитотаксической активности лекарственных средств выбирают группы препаратов, имеющих максимальную эффективность и оптимальное сочетание. Выбор винкристина и CCNN обусловлен большой проницаемостью для данных препаратов гемоатоэнцефалического барьера, т.е. большей способностью к проникновению в центральную нервную систему.
Таким образом, как показывают приведенные клинические примеры, предлагаемый «Способ диагностики больных, пораженных опухолями головного мозга» повышает эффективность лечения.
Использование изобретения «Способ диагностики больных, пораженных опухолями головного мозга» по сравнению с прототипом повышает качество и эффективность диагностики благодаря индивидуальному подбору новых современных цитостатиков и их комбинаций с определением их концентраций, оценивая и контролируя максимальную чувствительность определенного цитостатика или их совокупность по максимально эффективной их концентрации. Способ повышает также качество диагностики для тестирования малых объемов опухолевой ткани in vivo, получаемых в результате малоинвазийных операций (при стереотаксической биопсии злокачественных глиом головного мозга) в случае локализации опухоли в областях малодоступных для открытого хирургического вмешательства. По указанному способу диагностики процесс лечения был осуществлен у 20 больных, пораженных различными интракраниальными опухолями головного мозга в том числе и с злокачественными в клинике Института мозга человека ИМ. Н.П.Бехтеревой Российской Академии наук. Эффект лечения составил около 80%. Индивидуальный подход к каждому больному в зависимости от его возраста, состояния здоровья, возможности воспринимать цитостатики в определенных концентрациях показал наиболее эффективный путь лечения онкологических больных, поэтому предложенный способ диагностики может быть рекомендован для использования при лечении больных с такой патологией.
Способ диагностики больных, пораженных опухолями головного мозга, включающий гистологическое исследование образца опухоли после ее хирургического удаления с определением ее типа в жидкой среде с использованием контроля, исследование лекарственных препаратов, влияющих на клетки исследуемого образца головного мозга, при условиях инкубации в температурных режимах и газовой среде, определяя количество гибельных клеток образца и оценивая результат исследования, отличающийся тем, что гистологический образец удаленной опухоли растирают в среде жидкостей DMEM/F12 4 мл, 10% фетальной бычьей сыворотки 0,5 мл, 5% L-глуталина 0,05 мл и 5% гентамицина 0,01 мл, фильтруют и центрифугируют смесь в течение 5' со скоростью 1200 об/мин, после окончания цитофереза добавляют в смесь фосфатно-солевой буфер, отделяют клеточную взвесь и в лунки планшета вносят последнюю в концентрации 1×104 клеток на лунку в 0,1 мл среды и среду без клеток, инкубируют содержимое планшета в термостате при температуре 37°С в присутствии 5% СО2 в течение 24 ч, после инкубации в лунки с клеточной взвесью и средой вносят разные цитостатики с разной их концентрацией, после последующей инкубации смеси планшета в течение 72 ч при температуре 37°С в присутствии 5% СО2 в каждую лунку планшета добавляют 10 мкМ раствора МТТ с концентрацией 5 мг/мл в фосфатно-солевом буфере, после опять инкубируют содержимое планшета в термостате в течение 4 ч при 37°С в присутствии 5% СО2 и добавляют в каждую лунку по 100 мкМ изопропанола с 0,04М HCl, затем после размешивания образцов в лунках планшета измеряют их оптическую плотность при длине волны 570 нм, оценку результатов измерения производят, сравнивая показатели измеренных оптических плотностей среды и клеточной взвеси с цитостатиками и оценивая % клеточной гибели в цитостатиках с различной их концентрацией образца опухоли с формированием сводной таблицы результатов исследования соответствия чувствительности образца к каждой исследуемой концентрации по всем использованным цитостатикам.