Препарат на основе смеси флавоноидов со свободным в-циклом и флаванов как терапевтический агент
Иллюстрации
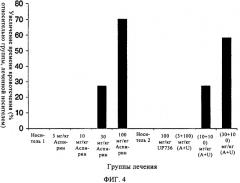
Показать всеИзобретение относится к фармацевтической промышленности, в частности к композиции для предупреждения и лечения заболеваний и состояний, связанных с агрегацией тромбоцитов и тромбозом, вызываемым тромбоцитами. Композиция для предупреждения и лечения заболеваний и состояний, связанных с агрегацией тромбоцитов и тромбозом, вызываемым тромбоцитами, включает по меньшей мере одного флавоноида со свободным В-циклом, по меньшей мере одного флавана и по меньшей мере одного агента, выбранного из группы, состоящей из инъекционного противосвертывающего агента, перорального противосвертывающего агента, антитромбоцитарного агента, лекарственного препарата против стенокардии, нестероидного противовоспалительного лекарственного препарата (NSAID) или селективного ингибитора циклооксигеназы-2 (СОХ-2) (варианты). Способ применения композиции: вышеописанные композиции эффективны для предупреждения и лечения заболеваний и состояний, связанных с агрегацией тромбоцитов и тромбозом, вызываемым тромбоцитами. 6 н. и 26 з.п. ф-лы, 4 ил.
Реферат
Область изобретения
Данное изобретение относится к предупреждению и лечению заболеваний и состояний, связанных с агрегацией тромбоцитов и тромбозом, вызываемым тромбоцитами. В частности, настоящее изобретение относится к композиции, включающей состав смеси двух специфических классов соединений - флавоноидов со свободным В-циклом и флаванов, обозначаемой в данном контексте также как UP736, предназначенной для применения с целью предупреждения и лечения заболеваний и состояний, опосредованных агрегацией тромбоцитов и тромбозом, вызываемым тромбоцитами. Данное изобретение, кроме того, относится к способу применения UP736 в качестве адъюванта, и/или синергического, и/или потенцирующего агента в сочетании с инъекционными или пероральными противосвертывающими агентами, противотромбоцитарными агентами, нестероидными противовоспалительными лекарственными препаратами (NSAID) и избирательными ингибиторами СОХ-2. Наконец, данное изобретение относится к способу применения UP736 в комбинации с противотромбоцитарными, противосвертывающими профилактическими агентами и NSAID в качестве средства снижения дозы данных агентов, уменьшения побочных эффектов, связанных с острым или постоянным применением данных агентов; противодействия или антагонистического действия в отношении риска острого или постоянного применения данных агентов и достижения дополнительных и/или многочисленных клинических преимуществ.
Уровень техники
Высвобождение и метаболизм арахидоновой кислоты (АК) из клеточной мембраны приводит в результате к генерации метаболитов несколькими различными путями. Вероятно, два из наиболее важных пути опосредуются ферментами 5-липоксигеназой (LOX) и циклооксигеназой (СОХ). Они представляют собой параллельные пути, приводящие в результате к генерации лейкотриенов и простагландинов соответственно, которые играют важные роли в инициации и развитии воспалительного ответа и агрегации тромбоцитов. Следовательно, ферменты, ответственные за генерацию данных медиаторов, стали мишенями для многих новых лекарственных препаратов, направленных на лечение воспаления и модуляцию агрегации тромбоцитов, которые участвуют в патогенезе заболеваний, таких как ревматоидный артрит, остеоартрит и атеротромбоз.
Ингибирование фермента СОХ является механизмом действия, приписываемым большинству нестероидных противовоспалительных лекарственных препаратов (NSAIDS). Существует две различные изоформы фермента СОХ (СОХ-1 и СОХ-2), которые имеют гомологию последовательностей приблизительно 60%, но различаются по профилям экспрессии и функции. СОХ-1 представляет собой конститутивную форму фермента, которая связана с продукцией физиологически важных простагландинов, которые помогают регулировать нормальные физиологические функции, такие как агрегация тромбоцитов, защита клеточной функции в желудке и поддержание нормальной функции почек (см. статью Dannhardt and Kiefer (2001) Eur. J. Med. Chem 36:109-26). Вторая изоформа, COX-2, представляет собой форму фермента, которую индуцируют провоспалительные цитокины, такие как интерлейкин-1β (ИЛ-1β) и другие факторы роста (см. статьи Herschmann (1994) Cancer Metastasis Rev. 134:241-56; Xie et al. (1992) Drugs Dev. Res. 25:249-65). Данная изоформа катализирует продукцию простагландина Е2 (PGE2) из арахидоновой кислоты (АА). Поскольку механизм действия ингибиторов СОХ перекрывает механизм действия большинства принятых NSAID, ингибиторы СОХ используют для лечения многих из тех же самых симптомов, включая атеротромбоз, боль и припухлость, ассоциированные с воспалением при временных состояниях и хронических заболеваниях.
Тромбоциты играют центральную роль в нормальном гемостазе. После сосудистого повреждения тромбоциты вытекают во внеклеточный матрикс через поврежденную эндотелиальную стенку, где они активируются различными компонентами внеклеточного матрикса, включая коллаген, протеогликаны, фибронектин и другие адгезивные гликопротеины. При контакте с внеклеточным матриксом с тромбоцитами проходят многочисленные и последовательные реакции, включая адгезию и изменение формы, секрецию двух типов гранул и агрегацию. Идентифицировано два сильных медиатора агрегации тромбоцитов: адениндифосфат (АДФ) и тромбоксан А2 (ТхА2). АДФ высвобождается из тромбоцитов после того, как они активируются компонентами внеклеточного матрикса. Кроме опосредования агрегации тромбоцитов АДФ также усиливает высвобождение АДФ из других тромбоцитов, формируя петлю положительной обратной связи для агрегации тромбоцитов. ТхА2 синтезируется и высвобождается из тромбоцитов и также представляет собой важный стимул агрегации тромбоцитов. Совместно с АДФ ТхА2 подготавливает аутокаталитическую реакцию, приводящую к построению увеличивающегося агрегата тромбоцитов. Агрегированные тромбоциты важны для последующего процесса свертывания крови. Данные активированные тромбоциты стимулируют местную активацию плазматических факторов свертывания, приводящую к генерации фибринового сгустка, который укрепляет агрегат тромбоцитов. Недавние исследования позволяют предположить, что все связанные с мембраной реакции системы свертывания могут быть локализованы на поверхности активированных тромбоцитов (см. статью Conde et al. (2005) Blood 106:1604-1611).
Хотя адгезия и активация тромбоцитов представляет собой ориентированный на восстановление ответ на внезапное сосудистое повреждение, неконтролируемое развитие данного процесса через серию самоподдерживающихся петель амплификации может привести к формированию тромба в просвете сосуда, сосудистой окклюзии и временной ишемии или инфаркту (см. статью Ruggeri (2002) Nat. Med. 8: 1227-34). Способность тромбоцитов участвовать в обоих нормальных процессах, гемостазе и атеротромбозе, зависит от их адгезионных свойств и их способности к очень быстрой активации в ответ на различные стимулы.
Природные тромбоциты экспрессируют только СОХ-1. Тромбоциты процессируют PGH2 с образованием в основном ТхА2, который синтезируется и высвобождается тромбоцитами в ответ на коллаген, тромбин и другие стимулы. ТхА2 вызывает необратимую агрегацию тромбоцитов посредством взаимодействия в G-белок-связанным рецептором, рецептором ТхА2. Таким образом, ТхА2 обеспечивает механизм усиления ответов тромбоцитов в отношении разнообразных агонистов. Кроме того, ТхА2 является сильным вазоконстриктором, индуцирует пролиферацию клеток гладкой мускулатуры сосудов и является проатерогенным. В качестве вазоконстриктора ТхА2 способствует правильной агрегации тромбоцитов. Ингибируя фермент СОХ-1, аспирин будет снижать продукцию ТхА2, которая приводит к пониженной агрегации тромбоцитов (см. статью Patrono et al. (2006) The New England Journal Medicine. 353:22: 237).
Простациклины образуются в эндотелиальной выстилке артерий и сердца. Равновесие между простациклином (PGI2), сильным вазодилататором, и представителем тромбоксанов, таким как ТхА2, важно для поддержания соответствующей сердечно-сосудистой функции (см. статью Bunting et al. (1983) Br. Med. Bull. 39:271). Оба, PGI2 и TxA2, зависят от продукции СОХ-1 и СОХ-2 в эндотелиальной выстилке артерий и в кардиоткани сердца (см. статьи Caughey et al. (2001) J Immunol, 167:2831; Ribuot et al. (2003) Cardiovascular Res 58:582). Показано, что соотношения СОХ-1 и СОХ-2 воздействуют на равновесие как PGI2, так и ТхА2. СОХ-1 метаболизирует арахидоновую кислоту, превращая жирную кислоту в основном в ТхА2, тогда как индуцированная СОХ-2 воздействует на арахидоновую кислоту, трансформируя ее в PGE2 и PGI2 (см. статьи Oh-ishi (1997) Biochem. Biophys. Res. Commun. 230:110; Brock et al. (1999) J. Biol. Chem. 274:11660). PGI2 ингибирует агрегацию тромбоцитов в ответ на все агонисты посредством взаимодействия с рецептором PGI2. ТхА2 представляет собой простаноид, в значительной степени выделенный из СОХ-1 (главным образом, из тромбоцитов), а его биосинтез высокочувствителен к ингибированию аспирином (см. статью Rocca et al. (2002) Proc. Natl. Acad. Sci. USA 99:7634-9). PGI2, с другой стороны, выделяют преимущественно из СОХ-2 (см. статью McAdam et al (1999) Proc. Natl. Acad. Sci. USA 96:272-7), и он менее чувствителен к ингибированию аспирином. Высокоизбирательное ингибирование СОХ-2 может способствовать тромбозу посредством переключения равновесия синтеза PGI2 (путь СОХ-2) относительно ТхА2 (путь СОХ-1) путем перевода арахидоновой кислоты на эйкозаноидный путь СОХ-1 (см. статью Gaetano (2003) Trends in Pharmacological Sciences. 24(5):245-252).
Агрегация тромбоцитов играет очень важную роль в индукции и развитии атротромбоза, который является главной причиной тромбоза глубоких вен, легочной эмболии, атеросклероза, инфаркта миокарда, тромбоза сосудов головного мозга и/или эмболии сосудов головного мозга, приводящих к цереброваскулярным событиям. Антитромбоцитарные лекарственные препараты, такие как аспирин, и противосвертывающие лекарственные препараты, такие как гепарин и варфарин (см. статью Verheugt (2005) Presse Med. 34:1325), специфические ингибиторы тромбина, такие как гирудин, дезирудин, бивалирудин, и неспецифические ингибиторы тромбина, такие как статины (см. статью Shen (2006) Front Biosci. 11:113), в настоящее время являются стандартными лекарственными препаратами, используемыми для лечения тромбоэмболии. Однако осложнения, возникающие вследствие серьезного кровотечения, являются основным побочным эффектом противосвертывающих лекарственных препаратов и высокодозной кратковременной антитромбоцитарной терапии. Применение меньших доз противосвертывающих лекарственных препаратов в комбинации с умеренной до низкой дозы антитромбоцитарных соединений, таких как аспирин, как показано, имеет значительную терапевтическую ценность в плане снижения угрозы кровотечения у пациентов из группы высокого риска (см. статью Harrington et al. (2004) Chest. 126.3 Suppl. 513S).
Вследствие необратимого ингибирования циклооксигеназы тромбоцитов и предупреждения формирования ТхА2 лекарственные препараты типа аспирина также используют в течение длительного времени для снижения риска сердечно-сосудистого заболевания, для предупреждения острого инфаркта миокарда и предупреждения острого окклюзионного инсульта (см. статью Hennekens (2002) Am. J. Manag. Care 8 (22 Suppl.):S691). Наиболее распространенным побочным эффектом, обусловленным длительным применением аспирина и других антитромбоцитарных салицилатов, является местная эрозия слизистой оболочки желудка вследствие ингибирования СОХ-1, которая важна для поддержания целостности выстилки слизистой оболочки. Данное повреждение слизистой оболочки желудка может привести от скрытой кровопотери до острого желудочно-кишечного кровотечения вследствие серьезного гастродуоденального повреждения. Краткосрочное высокодозное применение антитромбоцитарных лекарственных препаратов также связано со своим собственным риском, таким как существенно повышенная вероятность инсульта и кровотечения после хирургических процедур. Подбор оптимальной дозы представляет собой одну возможность снижения данных побочных эффектов (см. статью Kong (2004) Am. J. Cardiovasc. Drugs 4(3):151). Суточные дозы, лежащие в интервале 75 мг-150 мг, рекомендованы для длительного профилактического применения. Безусловно, любые соединения, которые могут улучшить антитромбоцитарный эффект аспиринов без повышения их побочных эффектов, будут обладать существенными терапевтическими преимуществами (см. статью Patrono et al. (2005) New Eng. J. Med. 353:22; 2373). К сожалению, в настоящее время отсутствует возможность, посредством которой можно путем применения антисекреторных агентов, таких как ингибитор протонного насоса, уменьшить риск кровотечения в верхнем отделе желудочно-кишечного тракта у пациентов, принимающих антитромбоцитарные лекарственные препараты.
В отношении токсичности аспирина и других классических NSAID, особенно образования язв желудочно-кишечного тракта и кровотечения, обусловленных избирательным ингибированием СОХ-1, в процессе разработки лекарственных препаратов используют две стратегии. Первая стратегия включает поиск избирательных ингибиторов СОХ-2, которые уменьшают желудочно-кишечные побочные эффекты путем создания резерва защитных функций СОХ-1 в слизистой оболочке желудка (см. статью DeWitt (1999) Mol. Pharmac. 4:625-631). Данная попытка привела к успешному внедрению ряда коммерческих лекарственных препаратов, таких как целекоксиб и рофекоксиб, которые проявляют избирательность в отношении СОХ-2. В клинических испытаниях избирательные ингибиторы СОХ-2 продемонстрировали существенную активность в отношении боли и других симптомов воспаления с пониженной вероятностью желудочно-кишечных событий. Однако постепенно появляется ряд побочных эффектов, связанных с применением избирательных ингибиторов СОХ-2. Например, обнаружено, что данные соединения стимулируют аллергические и астматические приступы, вызывают острую почечную недостаточность, застойную сердечную недостаточность, обостряют коронарные и цереброваскулярные заболевания, замедляют рост сломанных костей и заживление язв, подавляют иммунную систему, делая человека чувствительным к инфекции вирусного менингита, и способствуют развитию язв у пациентов с эрозиями желудка или инфекцией Helicobacter pylori (см. статью Rainsford (2001) J. Physiol. - Paris 95: 11-19). Недавние сообщения о том, что существенный противовоспалительный эффект некоторых высокоизбирательных ингибиторов СОХ-2 наблюдают только после того, как уровень дозы достигнет уровней, при которых происходит также ингибирование активности СОХ-1 (см. статью Wallace et al.91999) Br. J. Pharmac. 126:1200-1204.) совместно с генерацией противовоспалительных простаноидов посредством фермента СОХ-2 на более поздней фазе воспалительного процесса (см. статью Gilroy et al. (1999) Nature Med. 5:698-701), ставят, кроме того, вопрос об эффективности избирательных ингибиторов СОХ-2.
В 2004 г. лекарственный препарат Vioxx (рофекоксиб) был добровольно изъят с рынка после клинического испытания, показавшего, что с течением времени данный высокоизбирательный ингибитор СОХ-2 повышает риск сердечного приступа более чем в два раза по сравнению с другим NSAID, напроксеном. Кроме того, клиническое испытание, включающее целебрекс (целекоксиб), финансируемое Национальным институтом рака, показало, что длительное высокодозное применение данного избирательного ингибитора СОХ-2 более чем в два раза увеличивает риск сердечного приступа. Возникли также соображения относительно сердечно-сосудистого риска, связанного с другим избирательным ингибитором СОХ-2, Бекстра (валдекоксиб) (см. статью Meier В. Marketing Intensified Trouble for Pain Pills. The New York Times, 19 декабря, 2004). В действительности обзор современной научной литературы показал, что повышенный риск сердечно-сосудистого события, связанного с приемом рофекоксиба (Vioxx) и других избирательных ингибиторов СОХ-2, отмечают уже с 2000 г. (см. статьи Juni et al. (2004) Lancet. 364(9450): 2021-2029; Clark (2004) Drug Safety 27(7):427-456). Имеются дополнительные факты, которые указывают на то, что основной причиной данной кардиотоксичности является чрезвычайно высокая избирательность СОХ-2 у данного класса лекарственных препаратов (см. статью Neal et al. (2004) J. Pharm Sci. 7(3):332-336).
Недавно полученные результаты показывают, что СОХ-2 экспрессируется в здоровых органах, таких как плотное пятно почек/cTALH и медуллярные интерстициальные клетки (см. статью Harris et al. (август. 2004 г.) Acta Physiol Scand 181(4):543-7); в эндотелиальных клетках (см. статью Parente and Perretti (январь 2003 г.) Biochem Pharmacol. 65(2): 153-9) и в головном мозге (см. статью Hoffmann (ноябрь 2000 г.) Curr Med Chem. 7(11): 1113-20). В почках фермент СОХ-2 необходим для продукции PGE2 и PGI2 (простациклина) из арахидоновой кислоты. PGI2, в частности, является ключевым регулятором натриевого равновесия в организме (см. статью Harris (2000) J Am Soc Nephrol 11:2387). Ингибирование PGE2 и PGI2 посредством избирательных ингибиторов СОХ-2 в почках приводит к удерживанию натрия и воды и повышению кровяного давления, поскольку PGE2 снижает повторное всасывание натрия, тогда как PGI2 является сильным вазодилататором, который поддерживает равновесие между почечным кровотоком и скоростью клубочковой фильтрации или, проще говоря, количеством мочи, образующимся в организме. PGI2 также стимулирует высвобождение ренина, которое вызывает увеличение уровня высвобождения альдостерона, который затем повышает вторичное всасывание натрия и секрецию калия (см. статьи Carmichael and Shankel (1985) Am J Med 78:992; Whelton and Hamilton (1991) J Clin Pharmacol 31:588). Для поддержания надлежащей почечной перфузии почки повышающим образом регулируют синтез PGI2, чтобы противодействовать эффектам вазоконстрикторов для поддержания надлежащей почечной функции. У самых здоровых пациентов соответствующее кровяное давление поддерживается на основании их собственного уравновешивания поглощения жидкостей и выделения мочи без воздействия соединений, вызывающих вазоконстрикцию или вазодилатацию. Для данных пациентов не требуются эффекты вазоконстрикторов, сбалансированные PGI2. Однако обнаружено, что у пациентов с высоким кровяным давлением Vioxx еще более повышает кровяное давление (см. статьи Lamarque (2004) Bulletin du Cancer (Montrouge) 91.SI 17; Whelton et al. (2001) Am J Ther 5:85). Данное повышение кровяного давления может вносить вклад в повышенную вероятность острого инфаркта миокарда (AMI) (см. статью Deray (2004) Presse Med 33:483).
Ферменты СОХ-2 также индуцируют экспрессию PGE2 и PGI2 в сердце, что защищает от острого инфаркта миокарда (AMI) (см. статью Dai and Kloner (2004) J Cardiovascul Pharmacol Therapeutics 9:51). Недавние исследования как на кроликах, так и на мышах показали, что при вызванном AMI СОХ-2 существенно регулируется на повышение, действуя так, чтобы остановить событие, в качестве медиатора против инфаркта (см. статьи Shinmura et al. (2000) PNAS 97: 10197; Guo et al. (2000) Basic Res Cardiol 95:479). Данная активность против инфаркта препятствует дальнейшему относительно имеющегося повреждению, сохраняя тем самым сердечную функцию, (см. статью Bolli et al. (2002) Am J Physiol 282:H1943). На моделях на животных исследователи показали, что уровни PGI2 не действуют, когда крысам вводят избирательный ингибитор СОХ-2 по сравнению с плацебо. Данное отсутствие PGI2 препятствует тому, что сердца крыс противодействуют индуцированному событию AMI (см. статьи Bolli et al. (2002) Am J Physiol 282:H1943; Shinmura et al. (2002) Am. J Physiol 283:H2534). При избирательном ингибировании СОХ-2 ТхА2 образуется на значительно более высоком уровне по сравнению с PGI2. Вазоконстрикция посредством ТхА2 уравновешивается PGb-индуцируемой вазодилатацией, которая снижает кровоток в артериях в области сердца. Данное уменьшение кровотока и ограничение доставки питательных веществ и кислорода может склонить равновесие у чувствительных пациентов в сторону AMI (см. статью Bing and Lomnicka (2002) J. Am Coll. Cardiol 39:521).
В итоге недавняя оценка изоформ циклооксигеназы и их функции продемонстрировала, что отсутствие заметного ингибирования СОХ-1 является убедительным объяснением наблюдаемого повышения сердечно-сосудистых побочных эффектов, ассоциированных с Vioxx (рофекоксибом) и другими высокоизбирательными ингибиторами СОХ-2. Рекомендуют даже избегать применения высокоизбирательных в отношении СОХ-2 NSAID без применения подходящих ингибиторов СОХ-1 (например, низкодозного аспирина), (см. статью Neal et al. (2004) J. Pharm. Pharmaceut. Sci. 7(3):332-336).
Современные попытки борьбы с воспалением сосредоточены на поиске агентов, которые ингибируют как циклооксигеназу, так и липоксигеназу ( см. статьи Parente (2001) J. Rheumatol. 28:2375-2382; Bertolini et al. (2001) Pharmac. Res. 44:437-450). Ингибиторы, которые демонстрируют двойную специфичность в отношении СОХ и LOX, имели бы очевидное преимущество в плане ингибирования множества путей метаболизма арахидоновой кислоты. Данные ингибиторы блокировали бы воспалительные эффекты простагландинов (PG), а также эффекты множества лейкотриенов (LT) путем ограничения их продукции. Это включает вазодилатацию, проницаемость сосудов и хемотаксические эффекты PGE2, LTB4, LTD4 и LTE4, известных также как медленно реагирующая субстанция анафилаксии. Среди них LTB4 обладает наиболее сильными хемотаксическими и хемокинетическими эффектами (см. Moore (1985) в монографии Prostanoids: pharmacological, physiological and clinical relevance, Cambridge University Press, N.Y., стр. 229-230).
Важность блокирования воспалительных эффектов PGE2, а также эффектов множества лейкотриенов (LT) основана на том, что недавно обнаружено, что существенные недостатки избирательных ингибиторов СОХ-2 ассоциированы с переключением пути арахидоновой кислоты на путь липоксигеназы, вызывая тем самым сверхпродукцию провоспалительных, хемотаксических, повреждающих желудок и бронхоконстрикторных лейкотриенов (см. статью Celotti and Laufer (2001) Pharmac. Res. 43:429-436).
Показано, что вызываемое NSAID воспаление желудка во многом обусловлено метаболитами LOX, в частности LTC4 и LTB4 (см. статью Kirchner et al. (1997) Prostaglandins Leukot. Essent. Fatty Acids 56:417-423). Лейкотриены вносят вклад в значительное число повреждений желудочного эпителия путем стимуляции инфильтрации лейкоцитов, окклюзии микрососудов, снижения кровотока в слизистой оболочке и высвобождения медиаторов, протеаз и свободных радикалов. Избирательные ингибиторы LOX продемонстрировали значительное снижение тяжести или предупреждение образования язвы, индуцируемое индометацином (см. статью Fosslien (1998) Annals Clin. Lab. Sci. 28:67-81). Установлено, что посредством ингибирования путей СОХ аспирин и другие ингибиторы СОХ переключают метаболиты арахидоновой кислоты на путь LOX, вызывая повышенное высвобождение бронхосуживающих лейкотриенов наряду с повышением уровней цистеиниллейкотриенов, которое приводит к хроническому риноконъюнктивиту, носовым полипам и астме, сходной с затянувшейся вирусной респираторной инфекцией. Преобладание индуцированной аспирином астмы (AIA) в астматической популяции составляет приблизительно от 10 до 20%, и для лечения пациентов с AIA использовали антилейкотриеновые лекарственные препараты (см. статью Babu and Salvi (2000) Chest 118: 1470-1476).
Двойные ингибиторы также демонстрируют другие терапевтические преимущества. Показано, что они снижают коронарную вазоконстрикцию в сердце, пораженном артритом, на модели на крысах (см. статью Gok et al. (2000) Pharmac. 60:41-46) и существенно снижают вызываемые ангиотензином II сокращения во внутренней артерии молочной железы человека (см. статью Stanke-Labesque et al. (2000) Cardiovascular Res. 47:376-383). Активация опиоидного рецептора может вызвать пресинаптическое ингибирование высвобождения нейтромедиатора, опосредованное метаболитами LOX арахидоновой кислоты в нейронах среднего мозга. Эффективность опиоидов синергически повышают обработкой нейронов головного мозга двойными ингибиторами СОХ и LOX. Это может привести к созданию обезболивающих препаратов для ЦНС, включающих комбинации пониженных доз опиоидов и двойных ингибиторов COX/LOX (см. статью Christie et al. (1999) Infiamm. Res. 48:1-4). Двойные ингибиторы СОХ и LOX могут также предупреждать вызываемое белком хрусталика глазное воспаление на обеих, ранней и поздней, фазах (см. статью Chang et al. J. Ocular Pharmac. 5:353-360).
Двойные ингибиторы СОХ и LOX не только подавляют простагландины, которые делают вклад в острые воспалительные состояния, но также участвуют в накоплении фагоцитарных лейкотриенов, которые непосредственно связаны с симптомами хронического воспаления. Кроме того, двойные ингибиторы также обеспечивают защиту сердца от активности ингибирования СОХ-1. Данные свойства предполагают, что для двойных ингибиторов СОХ и LOX могут иметь явные преимущества относительно избирательных ингибиторов СОХ-2 и NSAID. Данное утверждение, как показано, обосновано на моделях in vivo с использованием потенциальных синтетических лекарственных препаратов (см. статью Fiorucci et al. (2001) Biochem. Pharmac. 62:1433-1438).
Раскрытие изобретения
Настоящее изобретение относится в основном к композиции, полученной для применения с целью предупреждения и лечения заболеваний и состояний, связанных с агрегацией тромбоцитов, и вызываемого тромбоцитами тромбоза. Данную композицию в данном контексте обозначают как UP736. Композиция состоит из смеси двух специфических классов соединений - флавоноидов со свободным В-циклом и флаванов. Композиции, состоящие из флавоноидов со свободным В-циклом, флаванов и их смесей, описаны в патентной заявке США No. 10/091362, поданной 1 марта 2002 г., под названием "Identification of Free В-ring Flavonoids as Potent COX-2 Inhibitors" (Идентификация флавоноидов со свободным В-циклом как сильных ингибиторов СОХ-2), в патентной заявке США No. 10/104477, поданной 22 марта 2002 г., под названием "Isolation of а Dual Сох-2 and 5-Lipoxygenase Inhibitor from Acacia" (Выделение двойного ингибитора Сох-2 и 5-липоксигеназы из Acacia) и в патентной заявке США No. 10/427746, поданной 22 июля 2003 г., под названием "Formulation with Dual Сох-2 and 5-Lipoxygenase Inhibitory Activity" (Препарат с активностью двойного ингибитора Сох-2 и 5-липоксигеназы). Каждая из данных ссылок включена в данном контексте в виде ссылки во всей своей полноте.
В настоящее изобретение включена новая композиция, состоящая из смеси по меньшей мере одного флавоноида со свободным В-циклом, по меньшей мере одного флавана и по меньшей мере одного агента, выбранного из группы, состоящей из инъекционного противосвертывающего агента, выбранного из группы, включающей, но без ограничения перечисленным, гепарин, дальтепарин, эноксапарин и тинцапарин, перорального противосвертывающего агента, выбранного из группы, включающей, но без ограничения перечисленным, варфарин, антагонисты витамина К и ингибиторы редуктазы витамина К; антитромбоцитарного агента, выбранного из группы, включающей, но без ограничения перечисленным, аспирин, клопидогрел и дипиридамол, лекарственного препарата против стенокардии, выбранного из группы, включающей, но без ограничения перечисленным, нитраты, β-блокаторы, блокаторы кальция, ингибиторы ангиотензин-конвертирующего фермента и активаторы калиевых каналов; нестероидного противовоспалительного лекарственного препарата (NSAID), выбранного из группы, включающей, но без ограничения перечисленным, ацетаминофен, ибупрофен, напроксен, диклофенак, салицилаты и индометацин или избирательный ингибитор СОХ-2, выбранный из группы, включающей, но без ограничения перечисленным, рофекоксиб, целекоксиб, этодолак и мелоксикам.
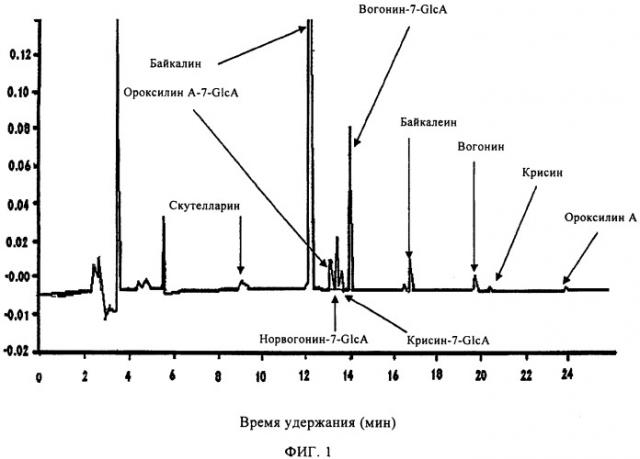
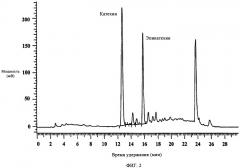
Соотношение флавоноидов со свободным В-циклом и флаванов в композиции можно подвести на основе показателей и специфических требований относительно предупреждения и лечения специфического заболевания или состояния. В основном соотношение флавоноидов со свободным В-циклом и флаванов может лежать в интервале от приблизительно 99:1 флавоноидов со свободным В-циклом:флаванов до приблизительно 1:99 флавоноидов со свободным В-циклом:флаванов. В специфических вариантах осуществления настоящего изобретения соотношение флавоноидов со свободным В-циклом к флаванам выбрано из группы, состоящей из приблизительно 90:10, 80:20, 70:30, 60:40, 50:50, 40:60, 30:70, 20:80 и 10:90. В предпочтительном варианте осуществления изобретения соотношение флавоноидов со свободным В-циклом к флаванам в предложенной композиции составляет приблизительно 85:15. Флавоноиды со свободным В-циклом и флаваны можно синтезировать и/или выделить из одного растения или множества растений. В предпочтительном варианте осуществления флавоноиды со свободным В-циклом выделены из растения или растений рода Scutellaria и флаваны выделены из растения или растений рода Acacia и Uncaria.
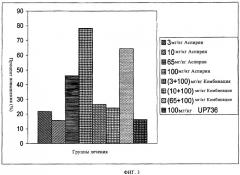
Настоящее изобретение далее включает способы лечения и предупреждения заболеваний и состояний, относящихся к агрегации тромбоцитов и вызываемому тромбоцитами тромбозу. Способ заключается во введении нуждающемуся в этом хозяину композиции, включающей смесь флавоноидов со свободным В-циклом и флаванов, синтезированных и/или выделенных из одного растения или множества растений. Эффективность данного способа демонстрируют, используя очищенные ферменты, на различных клеточных линиях и множестве моделей на животных.
Заболевания и состояния, связанные с агрегацией тромбоцитов и вызываемым тромбоцитами тромбозом, которые можно предупреждать и лечить согласно способу, представленному в изобретении, включают, но без ограничения перечисленным, тромбоз глубоких вен, легочную эмболию, атеросклероз, инфаркт миокарда, тромбоз сосудов головного мозга и/или эмболию сосудов головного мозга, приводящие к цереброваскулярным событиям, тромбозу периферической циркуляции и/или микроциркуляции, приводящей к ишемии и инфаркту, фибрилляции предсердий, которая ассоциирована со стазом крови и формированием тромбоза в левом предсердии, тромбогенными центрами, включая искусственные имплантаты, такие как механические сердечные клапаны, дефибрилляторы, хирургические имплантаты для доставки лекарственных препаратов и искусственные бедра, суставы и другие экзогенные органы.
Настоящее изобретение далее включает способы применения UP736 в качестве адъюванта, и/или синергического, и/или потенцирующего агента, которые заключаются во введении нуждающемуся в этом хозяину эффективного количества представленной композиции, включающей смесь по меньшей мере одного флавоноида со свободным В-циклом, по меньшей мере одного флавана и по меньшей мере одного агента, выбранного из группы, состоящей из инъекционного противосвертывающего агента, перорального противосвертывающего агента, антитромбоцитарного агента, агента против стенокардии, нестероидного противовоспалительного лекарственного препарата (NSAID) или избирательного ингибитора СОХ-2. Примеры инъекционных противосвертывающих агентов включают, но без ограничения перечисленным, гепарин, дальтепарин, эноксапарин и тинцапарин. Примеры пероральных противосвертывающих агентов включают, но без ограничения перечисленным, варфарин, антагонисты витамина К и ингибиторы редуктазы витамина К. Примеры антитромбоцитарных агентов включают, но без ограничения перечисленным, аспирин, клопидогрел и дипиридамол. Примеры лекарственных препаратов против стенокардии включают, но без ограничения перечисленным, нитраты, β-блокаторы, блокаторы кальция, ингибиторы ангиотензин-конвертирующего фермента и активаторы калиевых каналов. Нестероидные противовоспалительные лекарственные препараты (NSAID) включают, но без ограничения перечисленным, ацетаминофен, ибупрофен, напроксен, диклофенак, салицилаты и индометацин. Наконец, примеры избирательных ингибиторов СОХ-2 включают, но без ограничения перечисленным, рофекоксиб, целекоксиб, этодолак и мелоксикам.
Настоящее изобретение также включает способ уменьшения стандартной дозы антитромбоцитарного, противосвертывающего, профилактического агентов, NSAID и избирательных ингибиторов СОХ-2 для достижения либо равного, либо улучшенного клинического результата. Способ заключается во введении нуждающемуся в этом хозяину эффективного количества композиции, включающей смесь по меньшей мере одного флавоноида со свободным В-циклом и по меньшей мере одного флавана в комбинации с указанным антитромбоцитарным, противосвертывающим, профилактическим агентом, NSAID или избирательным ингибитором СОХ-2.
Настоящее изобретение далее включает композицию и способ применения UP736 к качестве адъюванта, и/или синергического, и/или потенцирующего агента в сочетании с по меньшей мере одним нестероидным противовоспалительным лекарственным препаратом (NSAID), выбранным из группы включающей, но без ограничения перечисленным, ацетаминофен, ибупрофен, напроксен, диклофенак, салицилаты, индометацин и по меньшей мере один избирательный ингибитор СОХ-2, выбранный из группы, включающей, но без ограничения перечисленным, рофекоксиб, целекоксиб, этодолак и мелоксикам. Указанная композиция и способ позволяют уменьшить дозу NSAID, требующихся для достижения либо равного, либо улучшенного клинического результата, приводя к уменьшению побочных эффектов, ассоциированных с острым или постоянным применением данных агентов, и противодействию или антагонистическому действию в отношении рисков острого или постоянного применения NSAID. Данный способ представляет также средства достижения дополнительного и/или множества клинических преимуществ, как подробно описано ниже. Способ заключается во введении нуждающемуся в этом хозяину эффективного количества композиции, включающей смесь флавоноидов со свободным В-циклом и флаванов в комбинации с по меньшей мере одним NSAID и по меньшей мере одним избирательным ингибитором СОХ-2 и фармацевтически приемлемым носителем.
Настоящее изобретение также включает композицию и способ снижения или устранения побочных эффектов, связанных с острым или постоянным применением антитромбоцитарного, противосвертывающего, профилактического агентов, NSAID и избирательных ингибиторов СОХ-2, посредством введения указанного агента в сочетании с UP736. Способ заключается во введении нуждающемуся в этом хозяину эффективного количества композиции, включающей смесь флавоноидов со свободным В-циклом и флаванов в комбинации с по меньшей мере антитромбоцитарным, противосвертывающим, профилактическим агентом, NSAID или избирательным ингибитором СОХ-2 и фармацевтически приемлемым носителем.
Настоящее изобретение, кроме того, включает способ противодействия или антагонистического действия в отношении рисков, связанных с острым или постоянным применением антитромбоцитарного, противосвертывающего, профилактического агентов, NSAID или избирательных ингибиторов СОХ-2, посредством совместного введения указанного агента с UP736. Способ заключается во введении нуждающемуся в этом хозяину эффективного количества композиции, включающей смесь флавоноидов со свободным В-циклом и флаванов в комбинации с указанным антитромбоцитарным, противосвертывающим, профилактическим агентом или NSAID и фармацевтически приемлемый носитель.
Наконец, настоящее изобретение включает способы достижения дополнительного и/или множества клинических преимуществ путем совместного введения антитромбоцитарного, противосвертывающего, профилактического агентов, NSAID и избирательных ингибиторов СОХ-2 в комбинации с UP736. Как обсуждают ниже, UP736 является сильным антиоксидантом, который регулирует продукцию информационной РНК NFκB и PPAR-γ, приводя к специфической понижающей регуляции TNFα, ИЛ-1β, IL-6 и других провоспалительных цитокинов на уровнях как экспрессии генов, так и продукции белков. Способ заключается во введении нуждающемуся в этом хозяину эффективного количества композиции, включающей смесь флавоноидов со свободным В-циклом и флаванов, синтезированных и/или выделенных из одного растения или множества растений, в комбинации с антитромбоцитарным, противосвертывающим, профилактическим агентом, NSAID или избирательным ингибитором СОХ-2 и фармацевтически приемлемым носителем.
Флавоноиды со свободным В-циклом, называемые также в данном контексте флавонами и флавонолами со свободным В-циклом, которые могут быть использованы в соответствии со следующим изобретением, включают соединения, иллюстрируемые следующей общей формулой:
в которой
R1, R2, R3, R4 и R5 независимо друг от друга выбраны из группы, состоящей из -Н, -ОН, -SH, OR, -SR, -NH2, -NHR, -NR2, -NR3 +X- углерода, кислорода, азота или серы, гликозида из одного или комбинации множества сахаров, включая, но без ограничения перечисленным, альдопентозы, метилальдопентозу, альдогексозы, кетогексозу и их химические производные;
в которой
R представляет собой алкильную группу, включающую от 1 до 10 атомов углерода, и
X выбрано из группы фармацевтически приемлемых противоионов, включая, но без ограничения перечисленным, гидроксил, хлорид, йодид, сульфат, фосфат, ацетат, фторид, карбонат и т.п.
Флаваны, которые могут быть использованы в соответствии со следующим изобретением, включают соединения, иллюстрируемые следующей общей формулой:
в которой
R1, R2, R3, R4 и R5 независимо друг от друга выбраны из группы, состоящей из -Н, -ОН, -SH, -ОСН3, -SCH3, -OR, -SR, -NH2, -NRH, -NR2, -NR3 +X-, сложных эфиров упомянутых замещающих групп, включая, но без ограничения перечисленным, сложные эфиры галлата, ацетата, циннамоила и гидроксициннамоила, тригидроксибензоиловые сложные эфиры и каффеоиловый сложный эфир и их химические производные; углерода, кислорода, азота или серы, гликозида из одного или комбинации множества сахаров, включая, но без ограничения перечисленным, альдопентозы, метилальдопентозу, альдогексозы, кетогексозу и их химические производные; димерные, тримерные и другие полимеризованные флаваны,
в которой
R представляет собой алкильную группу, включающую от 1 до 10 атомов углерода, и
X