Способ превращения метана в этилен и этан в процессе его окислительного превращения с использованием фталоцианиновых комплексов в качестве высокоэффективных катализаторов
Иллюстрации
Показать всеИзобретение относится к способу превращения метана в этилен и этан в процессе его окислительного превращения, характеризующемуся тем, что в качестве катализаторов данного процесса используют смесь кварца с фталоцианиновыми комплексами магния, алюминия или марганца, причем способ проводят при температуре 700-800°С. Использование указанных катализаторов позволяет повысить выход продукта. 1 з.п. ф-лы, 7 табл., 2 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к способу конверсии метана в этилен и другие гидрокарбонаты в процессе его окислительного превращения. Впервые для окислительного превращения метана в качестве высокоэффективных катализаторов этого процесса предложены фталоцианиновые комплексы как планарного, так и сэндвичевого строения.
Предпосылки создания изобретения
Окислительная конденсация метана (ОКМ) с образованием этана и этилена - относительно новая реакция, открытая в начале 1980 г. Несмотря на короткое время, прошедшее после открытия окислительной конденсации метана, появилось большое число публикаций, описывающих данный процесс. Однако уже первые попытки осуществления конверсии метана выявили основные проблемы и требования к процессу, а именно:
- в силу высокой термодинамической стабильности молекулы метана необходима высокая температура (800-1500° С) газа в аппарате для того, чтобы элементарные реакции распада метана пошли с заметной скоростью;
- воздействие высокой температуры (800-1500° С) на углеводороды, являющиеся целевыми продуктами конверсии метана (в первую очередь этан, этилен), неизбежно приводит к образованию некоторого количества твердого углерода (в виде сажи, кокса или пироуглерода);
- наличие в системе твердых продуктов конверсии метана накладывает существенные ограничения на использование в аппаратах разного рода змеевиков для контактного нагрева метана.
Реакция ОКМ оказалась настолько привлекательной, что после первой публикации произошел настоящий метановый бум. Так, в 80-е годы и первой половине 90-х годов в мире проводилось до десяти ежегодных международных конференций, посвященных процессам переработки природного газа и реакции ОКМ, в частности. В короткий срок появилось огромное число публикаций и патентов. В настоящее время исследовательская часть по процессу ОКМ, в принципе, завершена: изучены механизмы реакции, исследованы различные катализаторы и предложены наиболее эффективные из них, разработаны принципиальные технологические схемы, просчитана экономика некоторых технологических цепочек. Однако процесс все еще далек от практической реализации, так как имеются проблемы, без решения которых процесс не может быть внедрен в производство.
Необходимость совершенствовать технологии данного процесса диктуется ограниченностью сырьевых и энергетических ресурсов, экологическими проблемами.
Основные проблемы, которые препятствуют практической реализации процесса ОКМ
1. В процессе реакции образуются продукты (этан, этилен, в малой степени пропан, пропилен), более реакционноспособные, чем исходный продукт метан. Поэтому те же катализаторы, которые способствуют окислению метана, благоприятствуют окислению продуктов реакции до оксидов углерода и воды. Следовательно, необходима разработка способов, предотвращающих последующее глубокое окисление желаемых продуктов реакции.
2. По той же причине кислород газовой фазы гораздо легче реагирует с продуктами реакции, чем с метаном. Необходимы порционная подача кислорода в зону реакции или быстрое удаление продуктов из реактора.
3. Для приготовления реакционных смесей требуется чистый кислород. Это приводит к значительному повышению себестоимости продукции, так как предполагает наличие криогенных заводов по получению сжиженного кислорода.
К сожалению, надежды многих исследователей не оправдались и в последние годы наблюдается некоторый спад интереса к окислительной конденсации метана. При этом предельные выходы этана (около 25%) преодолеть подбором условий реакции не удавалось, и связано это в первую очередь с тем, что круг катализаторов, проявляющих активность и устойчивых в этих условиях, ограничен.
Все изученные катализаторы реакции ОКМ можно разделить на две большие группы: оксиды трудновосстанавливаемых металлов и оксиды восстанавливаемых металлов. Приготовление катализатора осуществляется различными способами: пропиткой носителя раствором, содержащим промотор, методом соосаждения из растворов, твердофазным синтезом и т.д. Различают также би- и многофункциональные катализаторы, у которых два или более веществ являются активными компонентами катализатора. У таких катализаторов указывают все активные фазы, например PbO/Аl2O3. К первой группе относятся оксиды щелочноземельных элементов, промотированные щелочными металлами, а также оксиды трехвалентных редкоземельных элементов (РЗЭ), как сами по себе, так и промотированные щелочными или щелочноземельными элементами. Промотирование осуществляется методом пропитки гидроксидами или солями щелочных или щелочноземельных металлов с последующей сушкой и отжигом до разложения солей и удаления воды. Первая группа катализаторов наиболее эффективно работает в непрерывном режиме, то есть при одновременной подаче реагентов - метана и кислорода. Ко второй группе катализаторов относятся оксиды восстанавливаемых металлов, и соответственно они лучше работают в режиме окисления-восстановления, то есть периодическом режиме. Эти катализаторы ведут процесс за счет кислорода решетки катализатора с последующей регенерацией последнего кислородом газовой фазы. Однако промотирование и этих катализаторов щелочными и щелочноземельными металлами способствует повышению эффективности процесса.
Ранее было показано, что эффективность катализатора определяется способностью катализатора активировать кислород, то есть создавать активные кислородные центры для разрыва С-Н-связи в молекуле метана. При введении одновалентной добавки в оксид двух- или трехвалентного металла (или двухвалентной добавки в оксид трех- или четырехвалентного металла) создаются избыточные кислородные вакансии, которые служат центрами активации кислорода. Практически во всех катализаторах, кроме оксидов трехвалентных РЗЭ, создаются дополнительные активные центры путем введения низковалентной добавки. Оксиды РЗЭ обладают структурой дефектного флюорита, в котором 25% кислородных позиций вакантны. Следовательно, они способны активировать дополнительный кислород из-за особенностей своей структуры.
Наиболее близким по своим характеристикам к предлагаемому изобретению является способ конверсии метана в этан и этилен, основанный на оксидах восстанавливаемых металлов (Mn, Sn, In, Ge, Pb, Sb, Bi, Pr, Tb, Ce, Fe), нанесенных на кремний и промотированных вольфрамом и щелочными металлами. Такие каталитические системы проявляют достаточную стабильность и приводят к высокой скорости конверсии метана в процессе его окислительного превращения до С2 продуктов. Недостатком этого способа является низкий выход целевых соединений. Кроме того, наблюдается быстрое отравление катализаторов, что значительно снижает эффективность известного способа. Поэтому в рамках данного изобретения стояла задача поиска новых катализаторов, не только более устойчивых в условиях процесса, но и позволяющих повысить выход С2 продуктов.
Сущность изобретения
Поставленная задача решается настоящим изобретением.
В способе превращения метана в этилен и этан согласно изобретению в качестве катализаторов данного процесса впервые используются фталоцианиновые комплексы.
При этом в качестве катализаторов предполагают использовать замещенные фталоцианиновые комплексы двух-, трех- и четырехвалентных металлов. В качестве фталоцианиновых комплексов предполагают использовать планарные и сэндвичеобразные фталоцианины.
Изучение термических свойств фталоцианинов, отличающихся составом и природой металла
Термогравиметрический и дифференциально-термический анализ образцов проводили на приборе "Derivatograph-C" (MOM) в алундовых тиглях при программированном повышении температуры (10°С мин-1) от 20 до 800°С в атмосфере воздуха. В качестве эталона использовали α-Аl2О3.
Заявленное изобретение иллюстрируется следующими чертежами и примерами.
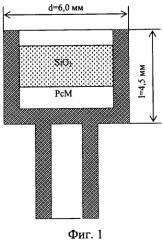
На фиг.1 представлены размеры тигля и расположение слоев фталоцианина и частиц силикагеля (размер 63-200 mesh) в типичных тестах.
Фиг.1 - расположение слоев фталоцианина и частиц силикагеля в алундовом тигле.
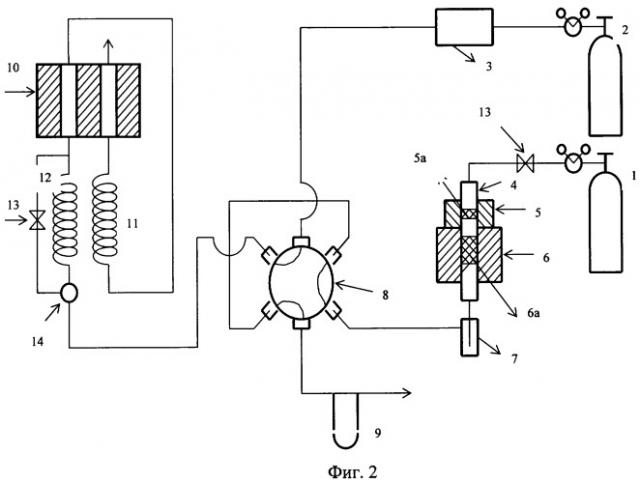
На фиг.2 представлена схема проточной установки, на которой проводились исследования фталоцианиновых катализаторов.
фиг.2 - схема установки для изучения каталитических свойств фталоцианинов в окислительной конденсации метана.
Установка содержит:
1 - баллон со смесью метана с воздухом, 2 - баллон с гелием, 3 - газовый блок хроматографа, 4 - реактор, 5 - электропечь испарителя, 5а - слой фталоцианина, 6 - электропечь реактора, 6а - слой силикагеля, 7 - сборник жидкообразных продуктов, 8 - 6-ходовой кран, 9 - реометр, 10 - катарометр, 11 - цеолитовая колонка, 12 - колонка с полисорбом, 13 - вентиль тонкой регулировки, 14 - 3-ходовой кран.
В процессе эксперимента газовая смесь (мольное отношение CH4:O2:N2=2:1:4, V=20 мл/мин) из баллона (1) поступала в реактор (4), и затем через петлю (V=1 мл) шестиходового крана (8) проба реакционной газовой смеси подавалась в хроматографическую колонку (12), заполненную полисорбом. Далее она проходила первый канал катарометра, поступала в колонку (11), заполненную цеолитом СаА, и попадала во второй канал катарометра. На колонке с полисорбом происходило разделение СО2, С2Н4 и С2Н6. Другие компоненты (O2, N2, СН4 и СО) разделялись на колонке с цеолитом СаА.
В некоторых опытах реактор (4) был разделен на две зоны. В первую зону (испаритель) помещали навеску фталоцианинового катализатора, во второй реакционной зоне находился силикагель или кварцевая крошка. В других опытах в реакционную зону загружали смесь фталоцианинового катализатора с кварцевой крошкой.
1.Строение используемых катализаторов
а) Незамещенные
М=Zn, Cu, Со, Mg, Ni, Mn
b) Октахлорзамещенные
M=Mn, Cu, Cr
с) Тетра-трет-бутилзамещенные
М=Zn, Cu, Со, Mg, Ni, Pt, Pd, Mn
2. Трехвалентные комплексы редкоземельных элементов (РЗЭ) как планарного, так и сэндвичевого строения
а) Незамещенные
М=Аl, РЗЭ
b) Октахлорзамещенные
М=Аl, РЗЭ
с) Тетра-трет-бутилзамещенные
М=Аl, РЗЭ
Результаты опытов по каталитическому окислению метана
1. Окисление метана в реакторе, заполненном SiO2
Перед началом исследования фталоцианиновых катализаторов был проведен опыт на 2 мл силикагеля (Sуд=400 м2/г, фракция частиц 0,3-0,6 мм) при различных температурах (табл.1). Видно, что метан начинает окисляться при температуре 500°С. При более высоких температурах (600-800°С) конверсия СН4 увеличивается, достигая 16,7%. Основными продуктами являются СО и СO2, причем селективность образования СО с температурой увеличивается, a S(CO2) уменьшается. Следует отметить, что при 800°С в небольшом количестве образуются также продукты окислительного сочетания метана (C2H4 и С2Н6).
2. Окислительные превращения в опыте с сублимационной подачей фталоцианина из испарителя
Этот опыт был проведен с фталоцианином ClPcMn(III). В чашку испарителя было загружено 0,0968 г фталоцианина. В реакционной зоне реактора находилось 2 мл SiO2. Температура реактора составляла 500°С, температура испарителя составляла 250 и 300°С. Продолжительность опыта - 3,5 ч, отбор проб и их анализ производился каждые 20 мин.
| Таблица 1 | ||||||||
| Окислительные превращения метана на силикагеле (V=2 мл)Скорость газовой смеси 20 мл/мин, состав исходной смеси CH4:O2:N2=2:1:4 | ||||||||
| Конверсия СН4, селективность, % | Температура, °С | |||||||
| 200 | 300 | 400 | 500 | 600 | 650 | 700 | 800 | |
| Конв. СН, | 0 | 0 | 0 | 0.2 | 2.5 | 5.1 | 17.4 | 16.7 |
| S(CO) | - | - | - | 0 | 55.1 | 69.5 | 74.8 | 75.1 |
| S(СО2) | - | - | - | 100 | 44.9 | 30.5 | 25.2 | 20.2 |
| S(C2H4) | - | - | - | 0 | 0 | 0 | 0 | 1.5 |
| S(С2Н6) | - | - | - | 0 | 0 | 0 | 0 | 3.2 |
Результаты анализа газообразных продуктов окисления представлены в табл.2. Видно, что в указанных условиях процесса наблюдалась незначительная конверсия кислорода, которая уменьшалась в ходе проведения опыта от 5-7% на 35-55 мин работы реактора до 0% на 185-й мин. Изменения концентрации метана при этом практически не происходило, поэтому можно предполагать, что наблюдаемые в качестве продуктов реакции СО и СO2 образуются в результате окислительного разложения фталоцианина.
| Таблица 2 | |||||||||
| Окислительные превращения в опыте при 500°С с подачей фталоцианина ClPCMn(3) (0.0968 г) из испарителяСкорость газовой смеси 20 мл/мин, состав исходной смеси CH4:O2:N2=2:1:4 | |||||||||
| Конверсия, Селективность, % | Температура испарителя 250°С | Температура испарителя 300°С | |||||||
| Время, мин | |||||||||
| 35 | 55 | 75 95 | 125 | 145 | 165 | 185 | 205 | ||
| Конв. O2 | 4.9 | 7.6 | 3.4 | 1.5 | 3.0 | 1.9 | 0.8 | 0 | 0 |
| Конв. СН4 | - | - | - | - | - | - | - | - | - |
| S(CO) | 0 | 12.1 | 35.7 | 0 | 0 | 0 | 0 | - | - |
| S(CO2) | 100 | 87.9 | 64.3 | 100 | 100 | 100 | 100 | - | - |
| S(C2H4) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | - | - |
| S(C2H6) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | - | - |
После опыта было проведено взвешивание чашки с фталоцианином, и обнаружено, что уменьшение веса составило 39% (в чашке осталось 0,0592 г продукта). Опыт был продолжен с остатком фталоцианина (температура реактора - 500°С, температура испарителя была повышена до 350°С). Анализ проб в течение 3-х часов (через каждые 20 мин) показал, что изменения концентрации кислорода и метана в ходе опыта не происходило и в продуктах реакции наблюдались лишь следы СO2. Взвешивание чашки с фталоцианином после этого опыта показало, что ее вес изменился лишь на 3,3%. Это может служить указанием на то, что фталоцианин ClPcMn(III) претерпел определенные превращения, которые привели к потере его летучести при 350°С.
3. Окислительные превращения в опыте с фталоцианином, расположенным на слое силикагеля в реакторе
Для того чтобы избежать трудностей, возникших при сублимационной подаче фталоцианина, проведен опыт, в котором ClPcMn(III) (0,3 г) был помещен на слое SiO2 в реакторе, т.е. в ходе опыта он находился при температуре 500°С. Как следует из полученных результатов (табл.3), конверсия кислорода вначале увеличивается с 75 до 83% и в дальнейшем постепенно уменьшается (до 8,9% к 220-й минуте работы реактора). Метан начинает окисляться с 100-й минуты работы реактора. В этот момент величина его конверсии составила 11%, и в ходе проведения опыта она постепенно понизилась до 1%.
| Таблица 3 | |||||||||||
| Окислительные превращения на катализаторе ClРсMn (III)(0,3 г), расположенном на слое SiO2 в реакторе при 500°С | |||||||||||
| Конверсия, селективность, % | Продолжительность опыта, мин | ||||||||||
| 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 | 220 | |
| Конв. O2 | 75,5 | 79,4 | 83,2 | 71,8 | 49,6 | 34,0 | 27,6 | 16,7 | 13,1 | 12,3 | 8,9 |
| Конв. СН4 | 0 | 0 | 0 | 0 | 11,4 | 3,3 | 5,2 | 1,1 | 1,0 | 4,2 | 1,3 |
| S(CO) | 18,2 | 36,5 | 33,0 | 21,2 | 24,2 | 21,3 | 16,8 | 10,0 | 3,9 | 11,7 | 11,0 |
| S(CO2) | 81,8 | 63,5 | 67,0 | 78,8 | 75,8 | 78,7 | 83,2 | 90,0 | 96,1 | 88,3 | 89,0 |
| S(C2H4) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| S(C2H6) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
В этом опыте можно выделить два этапа. На первом этапе (до 80-й мин) продукты реакции (СО и СO2) образовывались в результате окислительного разложения фталоцианина, поскольку конверсия метана на этом этапе равнялась нулю. На втором этапе (период 100-220 мин) происходило окисление метана до СО и СO2, при этом конверсия метана соответствовала конверсии кислорода, т.е. окисление фталоцианина завершилось на первом этапе.
4. Использование смесей фталоцианинов с кварцевой крошкой
Следующие опыты были проведены со смесями фталоцианинов BuMg-планарный олигомер, PcAlCl и РсCu н/з с кварцевой крошкой (фракция 0,3-0,6 мм).
4.1. Окислительные превращения метана на BuMg-планарном олигомере
В реактор была загружена смесь 0,08 г катализатора (BuMg-планарный олигомер) с 2 мл кварцевой крошки. Реакцию исследовали в интервале температур 300-800°С. Результаты опыта приведены в табл.4.
| Таблица 4 | ||||||||
| Окислительные превращения метана на смеси кварца (2 мл) с BuMg-планарным олигомером (0,08 г) | ||||||||
| Конверсия, % | Температура, °С | |||||||
| 300 | 400 | 500 | 600 | 700 | 800 | 800 | 800 | |
| Конв. O2 | 0 | 8,8 | 86,4 | 3,8 | 51,0 | 72,8 | 52,0 | 53,9 |
| Конв. СН4 | 0 | 2,0 | 4,7 | 7,2 | 14,2 | 21,9 | 14,2 | 13,1 |
| S(CO) | - | 2,1 | 8,5 | 42,1 | 32,3 | 25,9 | 29,2 | 34,4 |
| S(CO2) | - | 97,9 | 91,5 | 57,9 | 13,7 | 14,1 | 18,5 | 18,9 |
| S(C2H4) | - | 0 | 0 | 0 | 41,4 | 53,6 | 41,1 | 36,6 |
| S(С2Н6) | - | 0 | 0 | 0 | 12,6 | 6,5 | 11,1 | 10,1 |
| Суммарный выход С2-УВ | 0 | 0 | 0 | 7,7 | 13,2 | 7,4 | 6,1 |
Как видно, при 300°С реакция не происходила, а в области 400-600°С конверсия кислорода проходила через максимум, конверсия метана увеличивалась в интервале 2-7%. Максимум конверсии О2, равный 86,4% и приходящийся на температуру 500°С, по-видимому, свидетельствует о том, что при данной температуре в основном завершается окисление Mg-планарного олигомера. В области температур 600-800°С снова наблюдается увеличение конверсии кислорода с 3,8 до 72,8% и конверсии метана с 7,2 до 21,9%. Последующие две пробы, отобранные на анализ при 800°С с интервалом 20 мин, показали падение конверсии исходных веществ, что обусловлено, по-видимому, дезактивацией катализатора. Интересно отметить, что при температурах 700-800°С наблюдается образование также продуктов окислительного сочетания метана - этилена и этана, суммарный выход которых достигает 13,2% при температуре 800°С.
4.2. Окислительные превращения метана на PcAlCl
В реактор была загружена смесь 0,08 г катализатора (PcAlCl) с 2 мл кварцевой крошки. Реакцию исследовали в интервале температур 300-800°С. Результаты опыта показаны в табл.5. При 300-400°С реакция не происходила. Окисление фталоцианина до СО и СO2 наблюдалось при температурах 500-600°С. Конверсия кислорода при этом снизилась с 61,4 до 50,7%. В области 700-800°С происходило окисление метана. В этом температурном интервале конверсия кислорода повысилась до 90,2%, а метана - до 12,7%. При 800°С образовывался этан, выход которого составил 1,4%.
| Таблица 5 | ||||||
| Окислительные превращения метана на смеси кварца (2 мл) с PcAlCl (0,08 г) при температурах 300-800°С | ||||||
| Конверсия, селективность, % | Температура, °С | |||||
| 300 | 400 | 500 | 600 | 700 | 800 | |
| Конв. O2 | 0 | 0 | 61,4 | 50,7 | 54,8 | 90,2 |
| Конв. СН4 | 0 | 0 | 6,0 | 3,5 | 6,8 | 12,7 |
| S(CO) | - | - | 12,4 | 8,2 | 5,8 | 19,8 |
| S(CO2) | - | - | 87,6 | 91,8 | 94,2 | 69,6 |
| S(C2H4) | - | - | 0 | 0 | 0 | 0 |
| S(С2Н6) | - | - | 0 | 0 | 0 | 10,7 |
| Суммарный выход С2-УВ | - | - | 0 | 0 | 0 | 1,4 |
4.3. Окислительные превращения метана на PcCu н/з
В реактор загружена смесь 0,08 г катализатора (PcCu н/з) с 2 мл кварцевой крошки. Реакцию исследовали в интервале температур 300-800°С. Результаты опыта приведены в табл.6, из которой следует, что в области температур 300-500°С происходит окислительное разложение фталоцианинового катализатора. На это указывает то, что конверсия кислорода в этом температурном интервале увеличивается от 1,4 до 95,5%, а метан при этом практически не реагирует. При переходе в диапазон температур 600-800°С конверсия кислорода остается на том же уровне. Конверсия метана при этом вначале повышается до 20%, хотя образование продуктов окислительного сочетания метана на этом катализаторе не наблюдалось.
| Таблица 6 | ||||||
| Окислительное превращение метана на смеси кварца (2 мл) с РсCu н/з (0,08 г) при температурах 300-800°С | ||||||
| Конверсия, селективность, % | Температура, °С | |||||
| 300 | 400 | 500 | 600 | 700 | 800 | |
| Конв. O2 | 1,4 | 84,4 | 95,5 | 97,2 | 91,2 | 91,7 |
| Конв. СН4 | 0 | 0 | 1,7 | 20,9 | 18,6 | 19,9 |
| S(CO) | 0 | 2,5 | 7,7 | 6,0 | 0 | 8,4 |
| S(CO2) | 100 | 97,5 | 92,3 | 93,9 | 100 | 91,6 |
| S(C2H4) | 0 | 0 | 0 | 0 | 0 | 0 |
| S(C2H6) | 0 | 0 | 0 | 0 | 0 | 0 |
| Суммарный выход С2-УВ | 0 | 0 | 0 | 0 | 0 | 0 |
5. Окислительное превращение метана на каталитической системе ClPCMn+NaCl/SiO2
Система ClPCMn+NaCl/SiO2 была сформирована непосредственно в реакторе. На слой силикагеля (2 мл), в который методом пропитки было предварительно введено 20% хлорида натрия, поместили 0,6 г ClPСMn. Реактор за 2 часа нагрели до 500°С в токе реакционной смеси (CH4:O2:N2=2:1:4), после чего продолжали поддерживать эту температуру в течение 4 часов. Далее температуру реактора ступенчато повышали до 600, 700 и 800°С. Результаты анализа проб, отобранных при этих температурах, представлены в табл.7.
При 500 и 600°С продукты реакции были представлены лишь оксидами углерода. С дальнейшим повышением температуры конверсии исходных веществ увеличиваются, и в продуктах реакции появляются C2H4 и С2Н6. Обращает на себя внимание то, что образовавшаяся каталитическая система обладает очень высокой селективностью по этилену, который, очевидно, образуется в результате дегидрирования первичного продукта реакции - этана. Наибольший суммарный выход С2-углеводородов (около 30%) достигается при температуре 800°С (пробы отбирали через 20 мин).
| Таблица 7 | ||||||
| Окислительное превращение метана на каталитической системе ClPCMn+NaCl/SiO2. Скорость газовой смеси (CH4:O2:N2=2:1:4) 20 мл/мин. | ||||||
| Конверсия, селективность, % | Температура, °С | |||||
| 500 | 600 | 700 | 800 | 800 | 800 | |
| Конв. O2 | 8,9 | 81,2 | 96,5 | 96,5 | 96,5 | 96,4 |
| Конв. СН4 | 4,3 | 11,3 | 32,0 | 39,1 | 38,5 | 37,2 |
| S(CO) | 11,0 | 4,9 | 13,3 | 12,7 | 14,7 | 15,2 |
| S(CO2) | 89,0 | 95,1 | 16,1 | 4,9 | 4,8 | 5,3 |
| S(C2H4) | 0 | 0 | 62,6 | 78,5 | 75,6 | 74,1 |
| S(С2Н6) | 0 | 0 | 7,9 | 3,9 | 4,9 | 5,4 |
| Суммарный выход С2-УВ | 0 | 0 | 22,6 | 30,2 | 30,9 | 29,6 |
Выход С2-углеводородов на уровне 25-30% является предельно высоким для окислительного сочетания метана. Это определяется кинетическими факторами, связанными с реакционной способностью исходного углеводорода и продуктов реакции. При мольном соотношении СН4/С2<6, что соответствует указанному выходу С2-углеводородов, скорости окисления метана, этана и этилена выравниваются. Это делает невозможным дальнейшее накопление высших углеводородов в реакционной смеси, содержащей метан и кислород.
Данное изобретение подтверждается следующими примерами.
Пример 1
Термогравиметрический и дифференциально-термический анализ образцов проводили на приборе "Derivatograph-C" (MOM) в алундовых тиглях при программированном повышении температуры (10°С мин-1) от 20 до 800°С в атмосфере воздуха. В качестве эталона использовали α-Аl2О3. Перед началом исследования фталоцианиновых катализаторов был проведен опыт на 2 мл силикагеля (Sуд=400 м2/г, фракция частиц 0,3-0,6 мм) при различных температурах (табл.1). Видно, что метан начинает окисляться при температуре 500°С. При более высоких температурах (600-800°С) конверсия СH4 увеличиваются, достигая 16,7%. Основными продуктами являются СО и СO2, причем селективность образования СО с температурой увеличивается, a S(CO2) уменьшается. Следует отметить, что при 800°С в небольшом количестве образуются также продукты окислительного сочетания метана (С2Н4 и С2Н6).
Пример 2
Схема проточной установки, на которой проводились исследования фталоцианиновых катализаторов, представлена на фиг.2. Этот опыт был проведен с фталоцианином ClРсMn(III). В чашку испарителя было загружено 0,0968 г фталоцианина. В реакционной зоне реактора находилось 2 мл SiO2. Температура реактора составляла 500°С, температура испарителя составляла 250 и 300°С. Продолжительность опыта - 3,5 ч, отбор проб и их анализ производился каждые 20 мин.
Результаты анализа газообразных продуктов окисления представлены в табл.2. Видно, что в указанных условиях процесса наблюдалась незначительная конверсия кислорода, которая уменьшалась в ходе проведения опыта от 5-7% на 35-55 мин работы реактора до 0% на 185-й мин. Изменения концентрации метана при этом практически не происходило, поэтому можно предполагать, что наблюдаемые в качестве продуктов реакции СО и CO2 образуются в результате окислительного разложения фталоцианина.
Пример 3
Для того чтобы избежать трудностей, возникших при сублимационной подаче фталоцианина, проведен опыт, в котором ClРсMn(III) (0,3 г) был помещен на слое SiO2 в реакторе, т.е. в ходе опыта он находился при температуре 500°С. Как следует из полученных результатов (табл.3), конверсия кислорода вначале увеличивается с 75 до 83% и в дальнейшем постепенно уменьшается (до 8,9% к 220-й минуте работы реактора). Метан начинает окисляться с 100-й минуты работы реактора. В этот момент величина его конверсии составила 11%, и в ходе проведения опыта она постепенно понизилась до 1%.
Пример 4
В реактор была загружена смесь 0,08 г катализатора (BuMg-планарный олигомер) с 2 мл кварцевой крошки. Реакцию исследовали в интервале температур 300-800°С. Результаты опыта приведены в табл.4.
Как видно, при 300°С реакция не происходила, а в области 400-600°С конверсия кислорода проходила через максимум, конверсия метана увеличивалась в интервале 2-7%. Максимум конверсии О2, равный 86,4% и приходящийся на температуру 500°С, по-видимому, свидетельствует о том, что при данной температуре в основном завершается окисление Mg-планарного олигомера. В области температур 600-800°С снова наблюдается увеличение конверсии кислорода с 3,8 до 72,8% и конверсии метана с 7,2 до 21,9%. Последующие две пробы, отобранные на анализ при 800°С с интервалом 20 мин, показали падение конверсии исходных веществ, что обусловлено, по-видимому, дезактивацией катализатора. Интересно отметить, что при температурах 700-800°С наблюдается образование также продуктов окислительного сочетания метана - этилена и этана, суммарный выход которых достигает 13,2% при температуре 800°С.
Пример 5
В реактор была загружена смесь 0,08 г катализатора (PcAlCl) с 2 мл кварцевой крошки. Реакцию исследовали в интервале температур 300-800°С. Результаты опыта показаны в табл.5. При 300-400°С реакция не происходила. Окисление фталоцианина до СО и СО2 наблюдалось при температурах 500-600°С. Конверсия кислорода при этом снизилась с 61,4 до 50,7%. В области 700-800°С происходило окисление метана. В этом температурном интервале конверсия кислорода повысилась до 90,2%, а метана - до 12,7%. При 800°С образовывался этан, выход которого составил 1,4%.
Пример 6
В реактор загружена смесь 0,08 г катализатора (РсCu н/з) с 2 мл кварцевой крошки. Реакцию исследовали в интервале температур 300-800°С. Результаты опыта приведены в табл.6, из которой следует, что в области температур 300-500°С происходит окислительное разложение фталоцианинового катализатора. На это указывает то, что конверсия кислорода в этом температурном интервале увеличивается от 1,4 до 95,5%, а метан при этом практически не реагирует. При переходе в диапазон температур 600-800°С конверсия кислорода остается на том же уровне. Конверсия метана при этом вначале повышается до 20%, хотя образование продуктов окислительного сочетания метана на этом катализаторе не наблюдалось.
Пример 7
Система ClPCMn+NaCl/SiO2 была сформирована непосредственно в реакторе. На слой силикагеля (2 мл), в который методом пропитки было предварительно введено 20% хлорида натрия, поместили 0,6 г ClРСMn. Реактор за 2 часа нагрели до 500°С в токе реакционной смеси (СН4:О2:N2=2:1:4), после чего продолжали поддерживать эту температуру в течение 4 часов. Далее температуру реактора ступенчато повышали до 600, 700 и 800°С. Результаты анализа проб, отобранных при этих температурах, представлены в табл.7.
При 500 и 600°С продукты реакции были представлены лишь оксидами углерода. С дальнейшим повышением температуры конверсии исходных веществ увеличиваются, и в продуктах реакции появляются С2Н4 и С2Н6. Обращает на себя внимание то, что образовавшаяся каталитическая система обладает очень высокой селективностью по этилену, который, очевидно, образуется в результате дегидрирования первичного продукта реакции - этана. Наибольший суммарный выход С2-углеводородов (около 30%) достигается при температуре 800°С (пробы отбирали через 20 мин).
Таким образом, было установлено, что:
- в условиях высокотемпературного процесса окислительного сочетания метана фталоцианины подвергаются разложению с образованием оксидов углерода;
- при использовании в качестве катализатора смеси PcMg с кварцевой крошкой при 800°С образуются продукты окислительного сочетания метана - этан и этилен, суммарный выход которых составляет 13%;
- на катализаторе, полученном из смеси ClPСMn+NaCl/SiO2, достигнут предельно возможный выход С2-углеводородов в условиях окислительного сочетания метана - 30,9%.
Литература
1. J. Catalysis, 2000, 189 (2), 349-359.
2. J. Catalysis, 2000, 192 (1), 252-255.
3. J. Catalysis, 2001, 204 (2), 324-332.
4. Zarrinpashne, Saeed; Ahmadi, Reza; Zekordi, Seyyed Madjid (Research Institute of Petroleum Industry, Iran). Eur. Pat. Appl. EP 1632467 - прототип.
5. Huang, Kai; Xiao, Guomin; Fu, Shuxia (Southeast University, Peop. Rep. China). Faming Zhuanli Shenqing Gongkai Shuomingshu, CN 1597109 A, 23 Mar 2005, 11 pp. (Chinese).
1. Способ превращения метана в этилен и этан в процессе его окислительного превращения, отличающийся тем, что в качестве катализаторов данного процесса используют смесь кварца с фталоцианиновыми комплексами магния, алюминия или марганца, причем способ проводят при температуре 700-800°С.
2. Способ по п.1, отличающийся тем, что в качестве фталоцианиновых комплексов использовали планарные и сэндвичеобразные фталоцианины.