Цитотоксические линейные гетероциклические производные антрацендиона, содержащие в боковой цепи циклические диамины, активные в отношении опухолевых клеток с множественной лекарственной устойчивостью
Иллюстрации
Показать всеНастоящее изобретение относится к производным антрацендиона, пригодным для терапии онкологических заболеваний, формулы:
где W - фрагмент пятичленного гетероцикла, содержащего от одного до двух гетероатомов, выбранных из N, О или S, необязательно замещенный алкилом, галогеном; Y - остаток моноциклического диамина, содержащего экзоциклическую аминогруппу, или полициклического диамина с мостиковыми аминогруппами, который представляет собой соединение, в котором две аминогруппы вовлечены в образование 4- и 6-членных кольцевых систем, содержащих от 2 до 6 атомов углерода и связанных между собой одним, двумя или тремя мостиковыми атомами, причем Y необязательно замещен одним или несколькими заместителями, выбранными из алкила, галогеноалкила, галогена, гидроксила, гидроксиалкила, карбамоила и CO2R, где R представляет собой алкил; X - алкилен, СО или SO2; n и m независимо равны от 0 до 2; Z1 выбраны из гидрокси, алкокси, -NH2, -NHR1, -NR1R2, где R1 и R2 означают алкил, аминоалкиламино, галогено; Z2 выбраны из гидрокси, алкокси, фтора. Технический результат - получение новых противоопухолевых соединений. 3 табл.
Реферат
Изобретение относится к фармацевтической промышленности и касается линейных тетрациклических гетероциклических производных антрахинона (гетероциклические аналоги 5,12-нафтаценхинона), их структуры, методов получения и медицинского использования в качестве цитотоксических агентов.
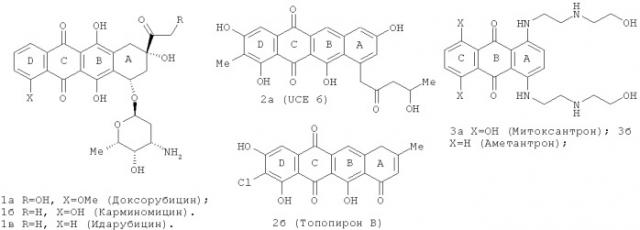
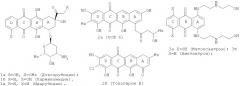
Известно, что выделенные из некоторых штаммов микроорганизмов производные 5,12-нафтаценхинона и ряд их синтетических аналогов обладают высокой биологической активностью. Антрациклиновые антибиотики, являющиеся гликозидами тетрагидронафтаценхинона, например доксорубицин, карминомицин, идарубицин (формулы 1а-в), используется в химиотерапии для лечения широкого спектра онкологических заболеваний [Гаузе Г.Ф. Противоопухолевые антибиотики. - М.: Медицина, 1987, 18-48]. Также известны тетрациклические линейные производные антрахинона с аннелированным бензольным или гетероциклическим ядром А, обладающие высокой цитотоксичностью. Так, антибиотики UCE6 и топопирон В (формулы 2а, б) превосходят по активности препарат сравнения камптотецин [Fujii N., et. al. Molecular Pharmacology, 1997, 57, 269; Khan Q.A., et. al. J. Amer. Chem. Soc., 2008, 130, 12888].
Наряду с ценными свойствами клинически значимые антрациклины имеют некоторые недостатки, основными из которых являются высокая кардиотоксичность и развитие множественной лекарственной устойчивости (МЛУ) в опухолевых клетках. В связи с этим ведутся исследования по химической модификации природных антибиотиков и синтезу новых препаратов с улучшенными химиотерапевтическими свойствами. Поиски более доступных и эффективных противоопухолевых препаратов с пониженной кардиотоксичностью привели к появлению антрациклинов и их аналогов нового поколения. Однако для всех соединений этого класса, разрешенных к клиническому использованию, характерна низкая активность в отношении опухолевых клеток с МЛУ, что зачастую значительно ограничивает их терапевтический потенциал. [Hill В.Т., et al. Cancer Chemolher. Pharmacol. 1989, 23, 140]. Известно, что экспрессия трансмембранного транспортера Р-гликопротеина (Pgp) и инактивация р53-опосредованного пути программируемой гибели клеток (апоптоза) являются наиболее распространенными механизмами развития МЛУ опухолевых клеток при химиотерапии [Sarkadi В., et al. FEBS Lett. 2004, 567 (1), 116]. Поэтому для создания противоопухолевых средств нового поколения особенно интересны препараты, активные в отношении клеточных линий с генетически детерминированными механизмами МЛУ. Несмотря на обширные поиски противоопухолевых агентов в ряду антрациклиновых антибиотиков и производных антрахинонов, приведшие к открытию синтетических аналогов антрациклинов (например, препаратов митоксантрона и аметантрона (3а-б) [Zee-Cheng, R.К.Y.; Cheng С.С. Drugs Future. 1983, 8, 228]), биологическая активность линейных гетероциклических производных антрацендиона осталась малоизученной.
Настоящее изобретение призвано получить новые линейные тетрациклические производные антрацендиона с гетероциклическим кольцом А, обладающие цитотоксическими свойствами и активные в отношении опухолевых клеток с активированными механизмами резистентности. Настоящее изобретение включает соединения, соответствующие формуле 4, и их фармакологически приемлемые соли, пригодные для терапии онкологических заболеваний:
где W - означает фрагмент пятичленного гетероциклического ядра (кольцо А), конденсированного с антрацендионовым ядром по связи 2-3 (кольца B-D) и являющегося гетероциклом, содержащим от одного до трех гетероатомов, выбранных из N, О, S, и не менее трех атомов углерода, два из которых общие с антрацендионовым ядром, а третий связан с функциональной группой X. Примеры гетероциклического ядра (кольцо А) включая фрагмент пиррола, фурана, тиофена, пиразола, изоксазола, изотиазола, не обязательно замещенный заместителем, выбранным из алкила, алкокси, амино, аминоалкила, ациламино, ацилокси, галогена, галогеналкила, гидрокси, гидроксиалкила, имино, оксо. Подразумевается, что кратные связи в гетероциклическом фрагменте могут принимать различные резонансные формы;
Y - означает остаток диамина, являющегося моноциклическим диамином, содержащим экзоциклическую аминогруппу, или полициклическим диамином, содержащим мостиковые аминогруппы. Примеры моноциклических диаминов с экзоциклическими аминогруппами, используемыми в настоящем изобретении в фрагменте Y формулы 4, включают аминопроизводные азетидина, пирролидина, пиперидина, гомопиперидина и т.п. Бициклические диамины, которые могут быть использованы в настоящем изобретении в фрагменте Y формулы 4, представляют собой соединения, в которых две аминогруппы вовлечены в образование 4- и 6-членных кольцевых систем, содержащих от 2 до 6 атомов углерода и связанных между собой одним, двумя или тремя мостиковыми атомами. Предпочтительные примеры диаминов Y включают соединения формул 5-8 (моноциклические диамины с экзоциклическими аминогруппами) и 9-11 (полициклические диамины с мостиковыми аминогруппами).
Диамин Y может быть необязательно замещенный одним или несколькими заместителями, связанными с остатком диамина через атом азота или углерода, выбранными из алкила, алкенила, алкокси, арила, ацила, галогена, галогеналкила, гетероарила, гидрокси, гидроксиалкила, карбамоила, карбоксиалкила, циклоалкила. Очевидно, что некоторые циклические диамины могут существовать в виде стереоизомеров. Настоящее изобретение включает все возможные стереоизомеры и геометрические изомеры в виде оптически чистых соединений или смесей с различным содержанием оптических изомеров, включая их рацемические смеси.
X означает спейсерную группу, связывающую остаток указанного диамина Y с указанным гетероциклическим ядром А тетрациклического производного антрацендиона, выбранную из алкилена, СО, SO, SO2.
n и m означает число заместителей Z1 и Z2 в антрацендионовом фрагменте, независимо равное от 0 до 2.
Заместители Z1 в кольце В соединений формулы 4 означают заместители, независимо выбранные из алкила, алкокси, амино, аминоалкиламино, ациламино, галогена, галогеналкила, гидрокси, нитро, алкилсульфониламино.
Кольцо D соединений формулы 4 необязательно содержит заместители Z, независимо выбранные из группы: гидрокси, алкокси, фтор. Известно, что наличие таких групп в пери-положениях хинонового фрагмента (например, в кольце D антрациклинов la-в или в кольце С их синтетических аналогов 3а-б), не вызывающих существенных стерических затруднений при связывании с ДНК, в ряде случаев приводит к росту или к изменению спектра противоопухолевой активности антрахинонсодержащих препаратов [Lown J.W. (Ed.) Anthracycline and Anthracendione based Anticancer Agents (Bioactive molecules), Elsevier, Science Publishers B.V.: Amsterdam, 1988, 6, 738 pp; Krohn K. (Ed.) Anthracycline chemistry and biology II. Mode of action, clinical aspects and new drugs. In Topics Current Chemistry; Springer: Heidelberg, 2008, 283, 224 pp; Swenton J.S. et. al. US pat. №4663445].
Очевидно, что соединения формулы 4 могут существовать в форме таутомеров, отличающихся положением кратных связей и атомов водорода, и подразумевается, что настоящее изобретение включает все таутомерные формы соединений.
Кроме того, настоящее изобретение относится к применению таких соединений в качестве терапевтически активных для лечения заболеваний человека, связанных с повышенной скоростью роста клеток (т.е. гиперпролиферацией), прежде всего онкологических заболеваний различного генеза. В дополнение к настоящему изобретению относится способ лечения, заключающийся во введении указанной выше фармацевтической композиции субъекту с заболеванием.
Соединения по настоящему изобретению могут быть получены различными способами, некоторые из них, описанные ниже, лишь иллюстрируют методы их синтеза и модификации функциональных групп. Исходные материалы и реагенты, которые используются при получении соединений формулы 4, являются коммерческими химическими препаратами, поставляемыми фирмами, такими как Aldrich Chemical Co., или их можно получить методами, известными специалисту в данной области, по методикам, описанным в литературе, при необходимости используя защитные группы.
Если не указано иное, реакции, приведенные в описании заявки, проводят при атмосферном давлении от приблизительно -78°С до 180°С в инертном растворителе или без него.
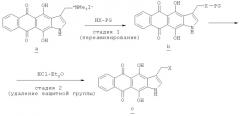
Типичные схемы получения соединений по настоящему изобретению основаны на взаимодействии тетрациклических линейных гетероциклических производных антрахинона, содержащих в боковой цепи группу -X-LG, с циклическими диаминами, содержащими остаток Y (схема А). При этом подразумевается, что LG означает уходящую группу, например, алкилсульфонилокси, амино, арилсульфонилокси, ацилокси, галоген, триалкиламонийную группы и т.п. Кроме того, подразумевается, что диамин Y, так же как и гетероциклическое производное антрахинона, может необязательно содержать защитные или активирующие группы для повышения эффективности синтеза, удаляемые или модифицируемые на последующих стадиях синтеза.
Схема А
В других, менее предпочтительных вариантах схемы синтеза соединений формулы 4, возможно образование гетероциклического фрагмента (кольца А) циклизацией производных антрацендиона с соединениями, содержащими фрагмент диамина Y, или образование колец B-D, циклизацией ациклических или циклических полупродуктов, содержащих остаток диамина Y и один, два или три цикла конечной конденсированной тетрадиклической системы соединений формулы 4.
Если не указано иное, формы единственного числа, используемые в описании и пунктах формулы, включают также формы множественного числа.
Термины, используемые в описании заявки и пунктах формулы изобретения, имеют значения, указанные ниже.
"Алкил" означает одновалентный насыщенный углеводородный радикал с прямой или разветвленной цепью, включающий только атомы углерода и водорода и содержащий от 1 до 6 атомов углерода включительно. Примеры алкильных радикалов включают метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-буил, пентил, неопентил, гексил и т.п.
"Алкенил" означает одновалентный углеводородный радикал, содержащий от 2 до 6 атомов углерода, включающий, по меньшей мере, одну двойную связь, например, этенил, пропенил, аллил и т.п.
"Алкилен" означает насыщенный двухвалентный углеводородный радикал с прямой цепью, содержащий от 1 до 6 атомов углерода, или насыщенный двухвалентный углеводородный радикал с разветвленной цепью, содержащий от 3 до 6 атомов углерода. Например, С2-С3 алкилен включает метилен, этилен, 2,2-диметилэтилен, пропилен, 2-метилпропилен.
"Алкокси" означает радикал -OR, где R - указанный выше алкильный радикал. Примеры алкоксирадикалов включают метокси, этокси, изопропокси и т.п.
"Алкилсульфонилокси" означает радикал -OSO2R, где R означает алкильную группу, указанную выше.
"Алкилтио" означает радикал -SR, где R - указанный выше алкил. Примеры алкилтиорадикала включают метилтио, этилтио и т.п.
"Амино" означает группы -NH2, -NHR1, -NR1R2, где R1 и R2 каждый независимо означает алкильные радикалы. Примеры аминорадикалов включают, метиламино, этиламино, диметиламино, метилэтиламино, диэтиламино и т.п.
"Аминоалкил" означает алкильный радикал, указанный выше, замещенный аминогруппой, указанной выше. Примеры аминоалкильных радикалов включают аминометил, метиламинометил, диметиламинометил и т.п.
"Аминоалкиламино" означает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от одного до шести атомов углерода, связанный с двумя аминогруппами, указанными выше, при условии, что к одному углеродному атому присоединено не более одной аминогруппы. Примеры аминоалкиламино радикалов включают 2-аминоэтиламино, 2-(метиламино)этиламино, 2-(этиламино)этиламино, 2-[(2-гидроксиэтил)амино]этиламино, 2-(диметиламино)этиламино, 2-аминопропиламино, 3-аминопропиламино.
"Арил" означает одновалентный циклический ароматический углеводородный радикал, содержащий один или более конденсированных циклов, из которых, по меньшей мере, один цикл является ароматическим, который необязательно замещен заместителем, выбранным из группы, включающей алкил, амино, аминосульфонил, алкокси, алкилтио, галоген, галогеналкил, гидрокси, гидроксиалкил, гетероарил, нитро, карбоксиалкил, карбамоил, сульфониламино и/или циано. Примеры арильных радикалов включают, фенил, нафтил, бифенил и т.п.
"Арилсульфонилокси" означает радикал -OSO2R, где R означает арильную группу, указанную выше.
"Ацил" обозначается группу, соответствующую формуле: -COR, -CSR, где R означает, водород или алкил, алкенил, арил, гетероарил.
"Ациламино" означает -N(R1)COR2, -N(R1)CSR2, где R1 и R2 каждый независимо означает водород, алкил, алкенил или гидроксиалкил, аминоалкил.
"Ацилокси" обозначается группу, соответствующую формуле: -OCOR, -OCSR, где R означает водород или алкил, алкенил, арил, указанный выше.
"Галоген" означает радикал фтор, бром, хлор, иод.
"Галогеноалкил" означает алкильный радикал, имеющий значения, указанные выше, замещенный в любом положении одним или более атомами галогена. Примеры галогеналкильного радикала включают 1-фторметил, 1,2-дифторметил, трифторметил, 2,2,2-трифторэтил, хлорметил.
"Гетероарил" означает одновалентный ароматический карбоциклический радикал, содержащий один или более циклов, включающих в цикле от 1 до 4 гетероатомов (выбранных из N, О или S), и необязательно замещенный заместителем, выбранным из группы, включающей алкил, алкокси, амино, аминосульфонил, галоген, галогеналкил, гидрокси, гидроксиалкил, карбоксиалкил, карбамоил, нитро, сульфониламино, тиоалкил и/или циано. Примеры гетероарильных радикалов включают имидазолил, оксазолил, оксадиазолил, тиазолил, изотиазолил, изоксазолил, изотиазолил, пиразинил, тиофенил, фурил, пиранил, пиридинил, хинолинил, изохинолинил, бензофурил, бензотиофенил, бензимидазолил, бензоксазолил, бензотиазолил, бензопиранил, индазолил, индолил, индолинил, изоиндолил, хинолинил, изохинолинил.
"Гидроксиалкил" означает алкильный радикал, указанный выше, замещенный одной, двумя или тремя гидроксигруппами при условии, что к одному углеродному атому присоединено не более одной гидроксигруппы. Примеры гидроксиалкильных радикалов включают гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 2,3-дигидроксипропил и т.п.
"Гидроксиалкиламино" означает радикал -NR1R2, где R1 означает водород, алкил или гидроксиалкил, a R2 означает указанный выше гидроксиалкил.
"Иминоалкил" обозначает группу, соответствующую формуле: -C(=NH)R, где R означает алкил или галогеноалкил.
"Карбамоил" обозначает группу, соответствующую формуле: -CONR1R2, где R1 и R2 каждый независимо означает водород, алкил, арил, гидроксиалкил, аминоалкил.
"Карбоксиалкил" обозначает группу, соответствующую формуле: -CO2R, где R означает алкил или гидроксиалкил.
"Сульфониламино" означает радикал -N(R1)SO2R2, где R1 означает водород или алкильный радикал, указанный выше, a R2 означает алкил, галогеноалкил, арил, гетероарил. Примеры алкилсульфониламино радикалов включают метилсульфониламино, трифторметилсульфониламино, фенилсульфониламино и т.п.
"Триалкиламмоний" означает положительно заряженную четвертичную аммонийную группу [-NR1R2R3]+, где R1-R3 каждый независимо означает алкильные или алкиленовые радикалы, например триметиламмоний, триэтиламоний.
"Циклоалкил" означает насыщенный одновалентный циклический углеводородный радикал, содержащий в цикле от 3 до 7 атомов углерода и необязательно замещенный заместителями, выбранными из группы, включающей алкил, галогенил, амино, алкиламино, арил, гетероарил и т.п. Термин циклоалкил включает, например, циклопропил, циклобутил, циклопентил, циклогексил и т.п.
Термин "биоизостер" используется в значении, обычно применяемом в области медицинской химии [Lipinski C.A. Bioisosterism in Drug Design. Annual Reports in Medicinal Chemistry. 1986, 21, pp.283-291]. В соответствии с этим общепринятым значением биоизостерами называют заместители или группы атомов с близким физическими или химическими свойствами, способные придавать подобные биологические свойства химическим соединениям. Биоизостерическое замещение позволяет модулировать биологические или физические свойства соединений, не делая существенных изменений в химической структуре биологически активных препаратов. В соответствии с общепринятой терминологией "классическими биоизостерами" называют атомы или группы атомов, имеющие близкие размер, форму, количество атомов и электронную плотность. "Неклассическими биоизостерами" принято считать атомы или группы атомов, не обладающие структурным подобием, характерным для классических биоизостеров, однако имеющие сходную биологическую активность. Примеры классических биоизостеров включают замещение аминогруппы на гидроксильную, замену связи -СН= в аренах или гетероаренах на фрагмент -N= и т.п. Примеры неклассических биоизостеров включают замену гидроксигруппы на ациламино или сульфониламино группы; замещение атома галогена на трифторметильную или цианогруппы; замену карбоксильной группы на сульфамидную группу или на ядро тетразола; замену -СН=СН- группировки ароматических ядер на гетероатом -S- и т.п. Указанные примеры и ряд других биоизостеров хорошо известен для различных классов биологически активных веществ и описан в соответствующей литературе [например, в Silverman R.B. The Organic Chemistry of Drug Deign and Drug Action. 2-nd Edition. Elsevier, Academic Press: Amsterdam, 2004, 29-34; Lima L.M., Barreiro E.J. Bioisosterism: A Useful Strategy for Molecular Modification and Drug Design. Current Medicinal Chemistry, 2005,12, 23-49].
Термин "изомеры" означает соединения с одинаковой молекулярной формулой, но отличающиеся природой или последовательностью химических связей или пространственным расположением атомов. Изомеры, которые различаются пространственным расположением атомов, называются "стереоизомерами". Атом углерода, связанный с четырьмя разными заместителями, называется "хиральным центром".
"Хиральное соединение" означает соединение с одним или более хиральными центрами. Это соединение имеет две энантиомерные формы с противоположной хиральностью и может существовать как в виде отдельных энантиомеров, так и в виде смеси энантиомеров. Смесь, содержащая равные количества отдельных энантиомеров, называется "рацемической смесью". Соединения, содержащие более одного хирального центра, могут существовать в виде индивидуального диастереомера или в виде смеси диастереомеров, которая называется "диастереомерной смесью". При наличии хирального центра стереизомеры можно охарактеризовать абсолютной конфигурацией (R или S), означающей пространственное расположение заместителей у хирального центра. Указанные заместители, связанные с хиральным центром, классифицируются по правилу Кана, Ингольда и Прелога [Cahn et al., Angew. Chem., 1966, 75, 413].
"Таутомеры" означает соединения, структуры которых отличаются пространственным расположением атомов, но находятся в равновесном состоянии. Соединения формулы 4 могут содержать группы, которые могут находиться в таутомерном равновесии. Подразумевается, что, если соединения формулы 4 могут существовать в таутомерных формах, то настоящее изобретение включает все таутомерные формы, а названия соединений не исключают любую таутомерную форму.
"Необязательный" или "необязательно" означает, что последующее событие или обстоятельство может произойти, но необязательно произойдет и что описание включает случаи, когда это событие или обстоятельство произойдет, и случаи, когда оно не произойдет. Например, термин "необязательно замещенный" при использовании в связи с термином "арил", "гетероарил" означает арил или гетероарил, который необязательно и независимо содержит от одного до четырех заместителей, выбранных из группы, включающей алкил, алкокси, амино, ацилокси гидрокси, галоген, галогеналкил, гидроксиалкил, карбоксиалкил, карбамоил, нитро, циано.
"Уходящая группа" означает группу, название которой обычно ассоциируется с ее использованием в синтетической органической химии, т.е. означает атом или группу, которая замещается в условиях реакции. Примеры уходящей группы включают алкилсульфонилокси или арилсульфонилокси (такие, как метансульфонилокси, трифторметансульфонилокси, этансульфонилокси, бензолсульфонилокси, тозилокси), ацилокси, галоген, амино, триалкиламонийная группы и т.п.
Термином "защитная группа" обозначается группа, подходящая для блокирования функциональной группы в условиях проведения реакций, как описано литературе [Green T.W., Wuts P.G.M. Protective Groups in Organic Synthesis. J.Wiley & Sons, N.-Y., 1991, 351 pp]. Пример таких групп для блокирования аминогруппы включает трет-бутоксикарбонильную (Boc), адамантилоксикарбонильную (Adoc), флуоренилметилоксикарбонильную (Fmoc) и карбонибензилокси (Cbz), этоксикарбонильную, ацетильную группы и т.п. Пример таких групп для блокирования карбоксигруппы включает трет-бутильную, метальную, этильную, бензильную группы и т.п. Пример таких групп для блокирования гидроксигруппы включает метильную, этильную, бензильную, метоксиметильную, бензилоксиметильную, триметилсилильную, ацетильную и т.п.
"Инертный органический растворитель" означает растворитель, инертный в условиях реакции описываемой в тексте, включающий, например, бензол, толуол, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, диметилсульфоксид, сульфолан, хлороформ, дихлорметан, дихлорэтан, этилацетат, ацетон, метилэтилкетон, метанол, этанол, пропанол, изопропанол, трет-бутанол, диоксан, пиридин и т.п. Если не указано иное, растворители, использованные в реакциях по настоящему изобретению, являются инертными растворителями.
"Фармацевтически приемлемый" означает материал, который используют при получении фармацевтической композиции и который обычно является нетоксичным, безопасным в биологическом или ином отношении и включает материал, приемлемый как в ветеринарии, так и в фармацевтике.
"Фармацевтически приемлемые соли" соединения означают соли, которые являются фармацевтически приемлемыми и которые обладают необходимой фармакологической активностью исходного соединения. Такие соли включают: (1) кислотно-аддитивные соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и т.п., или органических кислот, таких как уксусная кислота, бензойная кислота, лимонная кислота, фумаровая кислота, глутаминовая кислота, гликолевая кислота, молочная кислота, малеиновая кислота, яблочная кислота, метансульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, винная кислота, толуолсульфоновая кислота и т.п. или (2) соли, образующиеся при замене кислотного протона (в О-Н, N-H или S-H-группах), присутствующего в исходном соединении, на ион металла, например, ион щелочного металла, ион щелочно-земельного металла или ион алюминия, или при образовании протоном координационного соединения с органическим или неорганическим основанием. Приемлемые органические основания включают диэтаноламин, этаноламин, триэтаноламин и т.п. Приемлемые неорганические основания включают гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия и гидроксид натрия и т.п. Подразумевается, что фармацевтически приемлемые соли включают сольваты или кристаллические формы (полиморфные образования) указанной кислотно-аддитивной соли. Предпочтительными фармацевтически приемлемыми солями являются соли уксусной кислоты, соляной кислоты, серной кислоты, метансульфоновой кислоты, малеиновой кислоты, фосфорной кислоты, винной кислоты, лимонной кислоты, соли натрия, калия, кальция, цинка и магния.
Термин "сольваты" означает сольватированные формы, содержащие стехиометрическое или нестехиометрическое количество растворителя. Некоторые соединения способны удерживать в кристаллической решетке фиксированное количество молекул растворителя, образуя сольват. Гидраты образуются в том случае, если в качестве растворителя используется вода, а алкоголяты образуются в том случае, если растворителем является спирт.
"Субъект" означает млекопитающих, т.е. означает любого члена класса млекопитающих, включая человека, приматов, сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы и свиньи, домашних животных, таких как кролики, собаки и кошки, лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки и т.п. Термин субъект не означает конкретный возраст или пол.
"Терапевтически эффективное количество" означает количество соединения, которое при введении субъекту для лечения патологического состояния является достаточным для оказания фармакологического действия при лечении патологического состояния субъекта. Терапевтически эффективное количество варьирует в зависимости от типа соединения, патологического состояния, подлежащего лечению, тяжести болезни, возраста и относительного состояния здоровья субъекта, от способа и формы введения, от мнения лечащего врача или практикующего ветеринара и других факторов.
Термин "фармакологическое действие", используемый в описании заявки, включает результаты воздействия на субъект, при которых достигается предполагаемая цель терапии. Например, фармакологическое действие означает такие результаты воздействия, которые приводят к излечению или замедлению развития, предупреждению рецидива заболевания.
Типичные соединения по изобретению и некоторые схемы их синтеза приводятся в ряде примеров, описанных ниже.
Схема Б
Пример 1
(S)-4,11-Дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто(2,3-f]индол-5,10-дион дигидрохлорид
Раствор 50 мг (0.1 ммоль) иодометилата 4,11-дигидрокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема Б), полученного по ранее описанному методу [Shchekotikhin A.E. et. al., Bioorg. Med. Chem., 2005, 13, 2285] и 0.1 г (2.5 ммоль) (S)-трет-бутил 3-амино-1-пирролидинкарбоксилата в хлороформе (10 мл) кипятят 1 ч. Смесь разбавляют хлороформом, промывают водой, раствором NaHCO3, сушат и упаривают. Остаток очищают колоночной хроматографией (хлороформ - метанол, 10:1→2:1). Получают 33 мг (70%) Вос-производного b, которое растворяют в метаноле (0.5 мл) и прибавляют 0.5 мл раствора (1H) HCl в эфире. Смесь перемешивают 6 ч и отфильтровывают красный осадок дигидрохлорида с. Выход 26 мг (56%). Т.пл. 254-255°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д.: 7.72 (1Н, д, J=7.5, Н9), 7.59 (1Н, д, J=7.5, Н6), 7.45 (2Н, м, Н7,8), 7.18 (1Н, с, Н2), 4.17 (3Н, м, CH2NCH2CH), 3.83 (1Н, м, NCH2CH), 3.62 (1Н, м, NCH2CH2), 3.50 (2Н, м, NCH2CH2, СН), 2.62 (1Н, м, J=7.5, СН2СН2СН), 2.29 (1Н, м, J=7.0, СН2СН2СН). Масс-спектр, m/z (Ioтн., %): 377 (12) [М]+, 358 (12), 308 (20), 293 (100), 279 (90), 263 (14). Найдено, %: С 53.30, Н 5.17, N 8.81. C21H19N3O4·2HCl·H2O. Вычислено, %: С 53.86, Н 4.95, N 8.97, М 377.12.
Пример 2
(R)-4,11-Дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто[2,3-f]индол-5,10-дион дигидрохлорид
Получают по методике, аналогичной приведенной в примере 1, из иодометилата 4,11-дигидрокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема Б) и (R)-трет-6утил 3-амино-1-пирролидинкарбоксилата. Выход 55%. Т. пл. 255-256°С (разл.). ВЭЖХ (колонка GraseSmart RP-18, 6×250 мм, LW=260 нм; элюент: А - H3PO4 (0.01 м), Б - MeCN; градиент Б 10→40% (30 мин)): время выхода 19.3 мин, чистота 99.8%. Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д.: 7.76 (1Н, д, J=7.5, Н9), 7.64 (1Н, д, J=7.5, Н6), 7.45 (2Н, м, Н7,8), 7.13 (1Н, с, Н2), 4.40 (3Н, м, СН2СН2СН), 3.88 (1Н, м, NCH2CH), 3.60 (2Н, м, NCH2CH2, СН), 3.50 (1Н, м, NCH2CH2), 2.64 (1Н, м, J=7.5, СН2СН2СН), 2.32 (1Н, м, J=7.0, СН2СН2СН). Масс-спектр, m/z (Ioтн., %): 377 (12) [М]+, 358 (14), 308 (23), 293 (100), 279 (92), 263 (15). Найдено, %: С 53.75, Н 5.31, N 9.18. C21H19N3O4·2HCl·H2O. Вычислено, %: С 53.86, Н 4.95 N 8.97. М 377.12.
Пример 3
(S)-3-[(3-Аминопирролидин-1-ил)метил]-4,11-дигидрокси-1H-нафто[2,3-f]индол-5,10-дион дигидрохлорид
Получают по методике, аналогичной приведенной в примере 1, из иодометилата 4,11-дигидрокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема Б) и (S)-3-(трет-бутоксикарбониламино)пирролидина. Выход 64%. Т. пл. 255-258°С (разл.). ВЭЖХ (колонка Gemini 100A С-18, 6×250 мм, LW=260 нм; элюент: А - HCO2NH4 (0.2%), Б - MeCN; градиент Б 10→50% (30 мин)): время выхода 22.6 мин, чистота 99.4%. Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д.: 7.61 (1Н, д, J=7.5, Н9), 7.52 (1Н, д, J=7.5, Н6), 7.40 (1Н, т, J=7.5, Н5), 7.35 (1Н, т, J=7.5, Н7), 7.13 (1Н, с, Н2), 4.37 (2Н, с, CH2N), 4.16 (1Н, дд, J=7.4, NCH2CH), 3.85 (1Н, м, NCH2CH), 3.60 (1Н, м, NCH2CH2), 3.49 (2Н, м, NCH2CH2, СН), 2.59 (1Н, м, J=7.4, СН2СН2СН), 2.28 (1Н, м, J=7.0, СН2СН2СН). Масс-спектр, m/z (Ioтн., %): 377 (12) [М]+, 358 (14), 293 (100), 279 (80), 263 (15). Найдено, %: С 54.08, Н 4.78, N 9.25. C21H19N3O4·2HCl·H2O. Вычислено, %: С 53.86, Н 4.95, N 8.97. М 377.12.
Пример 4
(R)-3-[(3-Аминопирролидин-1-ил)метил]-4,11-дигидрокси-1H-нафто[2,3-f]индол-5,10-дион дигидрохлорид
Получают по методике, аналогичной приведенной в примере 1, из иодометилата 4,11-дигидрокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема Б) и (R)-3-(трет-бутоксикарбониламино)пирролидина. Выход 65%. Т.пл. 255-256°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д.: 7.62 (1Н, д, J=7.5, Н9), 7.52 (1Н, д, J=7.5, Н6), 7.42 (1Н, т, J=7.5, Н5), 7.38 (1Н, т, J=7.5, Н7), 7.13 (1Н, с, Н2), 4.35 (2Н, с, CH2N), 4.18 (1Н, дд, J=7.4, NCH2CH), 3.82 (1Н, м, NCH2CH), 3.60 (1Н, м, NCH2CH2), 3.44 (2Н, м, NCH2CH2, СН), 2.63 (1Н, м, J=7.4, СН2СН2СН), 2.22 (1Н, м, J=7.0, CH2CH2CH). Масс-спектр, m/z (Ioтн., %): 377 (11) [М]+, 358 (16), 293 (100), 279 (89), 263 (19). Найдено, %: С 53.72, Н 5.14, N 8.82. C21H19N3O4·2HCl·H2O. Вычислено, %: С 53.86, Н 4.95, N 8.97. М 377.12.
Пример 5
3-({(1S,4S)-2,5-Диазабицикло[2.2.1]гептан-2-ил}метил)-4,11-дигидрокси-1H-нафто-[2,3-f]индол-5,10-дион дигидрохлорид
Получают по методике, аналогичной приведенной в примере 1, из иодометилата 4,11-дигидрокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема Б) и (1S,4S)-N-(трет-бутоксикарбонил)-2,5-диаза-бицикло[2.2.1]гептана. Выход 61%. Т.пл. 246-247°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д., J=(Гц): 7.48 (1Н, уш. с, Н9), 7.38-7.24 (3Н, уш. м, Н6,7,8), 7.12 (1Н, с, Н2), 4.68 (1Н, с, СН), 4.57 (1Н, с, СН), 4.39 (1Н, д, J=15.2, CH2N), 4.30 (1Н, д, J=14.1, CH2N), 3.75 (2Н, т, J=12.6, NCH2CH), 3.61 (2Н, д, J=12.6, NCH2CH), 2.63 (1Н, д, J=12.3, СНСН2СН), 2.32 (1Н, д, J=12.3, СНСН2СН). Масс-спектр, m/z (Ioтн, %): 389 (8) [М]+, 370 (13), 293 (100), 279 (83), 263 (16). Найдено, %: С 55.22, Н 5.09, N 9.01. C22H19N3O4·2HCl·H2O. Вычислено, %: С 55.01, Н 4.83, N 8.75. М 389.12.
Схема В
Пример 6
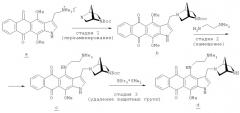
3-{(1S,4S)-2,5-Диазабицикло[2.2.1]гептан-2-ил}метил-11-гидрокси-4-[2-(диметиламино)этил]амино-1H-нафто[2,3-f]индол-5,10-дион
Стадия 1
3-({(1S,4S)-5-(трет-Бутоксикарбонил)-2,5-диазабицикло[2.2.1]гептан-2-ил}метил)-4,11-диметокси-1H-нафто[2,3-f]индол-5,10-дион
Раствор 100 мг (0.2 ммоль) иодометилата 4,11-диметокси-3-[(диметиламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (а, схема В), полученного по ранее описанному методу (Shchekotikhin A.E. et. al., Bioorg. Med. Chem., 2007, 15, 2651) и 0.2 г (5 ммоль) (1S,4S)-N-(трет-бутоксикарбонил)-2,5-диаза-бицикло[2.2.1]гептана в хлороформе (10 мл) кипятят 30-40 мин. Смесь разбавляют хлороформом, промывают водой, раствором NaHCO3, сушат и упаривают. Остаток очищают колоночной хроматографией (хлороформ - метанол - конц. NH4OH, 10:2:0→10:3:1). Выход 76 мг (74%). Спектр ЯМР 1Н (400 МГц, CDCl3), 8, м.д., J=(Гц): 9.58 (1Н, уш. 1, NH), 8.21 (2Н, м, Н6'9), 7.69 (2Н, м, Н7,8), 7.36 (1Н, уш. д. Н2), 4.39 (0.5Н, с, СН), 4.28 (0.5Н, с, СН), 4.10 (2Н, м, СН2Н), 4.06 (3Н, с, ОМе), 4.02 (3Н, с, ОМе), 3.58 (1Н, м, NCH2CH), 3.27 (1Н, м, NCH2CH), 2.89 (1Н, м, NCH2CH), 2.80 (1Н, м, NCH2CH), 1.86 (1Н, м, CHCH2CH), 1.70 (1Н, м, CHCH2CH), 1.45 (9Н, с, трет-Bu). Найдено, %: С 67.10, Н 6.23, N 8.27. C29H31N3O6. Вычислено, %: С 67.30, Н 6.04, N 8.12.
Стадия 2
3-({(1S,4S)-5-(трет-Бутоксикарбонил)-2,5-диазабицикло[2.2.1]гептан-2-ил}метил)-4-[2-(диметиламино)этил]амино-11-метокси-1H-нафто[2,3-f]индол-5,10-дион
Раствор 65 мг (0.125 ммоль) 3-({(1S,4S)-5-(трет-бутоксикарбонил)-2,5-диаза-бицикло[2.2.1]гептан-2-ил}метил)-4,11-диметокси-1H-нафто[2,3-f]индол-5,10-диона (b, схема В)в 50 мл ТГФ и 0.3 мл N,N-диметилэтилендиамина нагревают при 30°С 4-5 ч. В течение этого времени цвет реакционной смеси меняется от темно-желтого до малинового. Смесь охлаждают и разбавляют водой и прибавляют уксусную кислоту до рН 8.0. Основной продукт экстрагируют хлороформом (4×20 мл), экстракт промывают водой, сушат и упаривают. Остаток очищают колоночной хроматографией (хлороформ - метанол, 10:0→2:1) и кристаллизуют продукт из смеси бензол - н-гептан (1:4). Выход 38 мг (53%) в виде малиновых кристаллов. Т.пл. 145-149°С.Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м. д., J=(Гц): 9.42 (1Н, уш. с, NH), 9.20 (1Н, уш. с, NH), 8.24 (2Н, м, Н6,9), 7.67 (2Н, м, Н7,8), 7.22 (1Н, уш. с, Н2), 4.43 (0.5Н, с, СН), 4.28 (0.5Н, с, СН), 4.03 (3Н, с, ОМе), 3.93 (2Н, м, CH2N), 3.60 (2Н, м, СН), 3.20-2.80 (5Н, м, СН), 2.59 (2Н, м, CH2NMe2), 2.28 (3Н, с, NMe2), 2.27 (3Н, с, NMe2), 1.92 (1Н, м, СНСН2СН), 1.73 (1Н, м, СНСН2СН), 1.48 (9Н, с, t-Bu). Масс-спектр, m/z (Ioтн., %): 573 (12) [М]+, 473 (100). C32H39N5O5. Вычислено М: 573.22.
Стадия 3
3-{(1S,4S)-2,5-Диазабицикло[2.2.1]гептан-2-ил}метил-11-гидрокси-4-[2-(диметил-амино)этил]амино-1H-нафто[2,3-f]индол-5,10-дион дигидрохлорид
К перемешиваемому раствору 30 мг (0.05 ммоль) 3-({(1S,4S)-5-(трет-бутоксикарбонил)-2,5-диазабицикло[2.2.1]гептан-2-ил}метил)-4-[2-(диметиламино)этил]-амино-11-метокси-1H-нафто[2,3-f]индол-5,10-диона (c, схема В) в 20.0 мл сухого дихлорэтана прибавляют 1.5 мл (1.5 ммоль) 1M-ного раствора BBr3×SMe2 в дихлометане, кипятят 30 мин, охлаждают, прибавляют по каплям метанол (2.0 мл) и упаривают. Остаток распределяют в теплой смеси н-бутанола (50 мл) и 2%-ного водного раствора Na2CO3 (30 мл). Экстракт промывают водой, сушат и упаривают. Малиновое масло, полученное после упаривания раствора, растворяют в метаноле (3.0 мл) и прибавляют 5.0 мл раствора (1н) HCl в эфире. Смесь выдерживают в течение ночи в морозильнике и отфильтровывают темно-малиновый кристаллический осадок. Выход 15 мг (51%) тригидрохлорида d (схема В) с т.пл. 229-231°С (разл.). Спектр ЯМР 1Н (400 МГц, D2O), δ, м. д., J=(Гц): 7.76 (1Н, уш. с, Н9), 7.46 (1Н, с, Н2), 7.39-7.25 (3Н, уш. м, Н6,7,8), 4.50 (2Н, с, СН), 4.40 (2Н, м, СН), 3.64 (1Н, м, СН), 3.50 (5Н, м, СН), 3.24 (2Н, м, СН), 2.78 (6Н, с, NMe2), 2.45 (1Н, д, J=12.3, СНСН2СН), 2.34 (1Н, д, J=12.3, СНСН2СН). Найдено, %: С 53.46, Н 5.99, N 12.11. C26H29N5O3·3HCl·H2O. Вычислено, %: С 53.20, Н 5.84, N 11.93.
Схема Г
Пример 7
4,11-Дигидрокси-2-метил-N-(3-пирролидинил)антра[2,3-b]фуран-5,10-дион-3-карбоксамид гидрохлорид
Суспензию 100 мг (0.3 ммоль) 4,11-дигидрокси-2-метилантра[2,3-b]фуран-5,10-дион-3-карбоновой кислоты (а, схема Г), полученной по ранее описанному методу [Горелик М.В., Мишина Е.В., ЖОрХ, 1983,19, 2185] в 10 мл толуола и 0.2 мл (2.8 ммоль) SOCl2 кипятят при интенсивном перемешивании 40 мин, после чего реакционную массу упаривают. Остаток растворяют в горячем хлороформе и прибавляют 0.18 г (1 ммоль) трет-бутил 3-амино-1-пирролидинкарбоксилата. Реакционную массу кипятят 10 мин промывают раствором (1%-ным) NaHCO3, водой, разбавленным раствором HCl, водой, сушат и упаривают. Остаток очищают колоночной хроматографией (хлороформ - метанол, 10:1→5:1), полученный красный порошок растворяют в горячем хлороформе и прибавляют 3.0 мл раствора (1н) HCl в метаноле. Смесь перемешивают 6 ч и отфильтровывают красный осадок. Выход 73 мг (55%) гидрохлорида 4,11-дигидрокси-2-метил-N-(3-пирролидинил