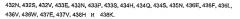Fc-варианты с измененным связыванием с fcrn
Иллюстрации
Показать всеИзобретение относится к иммунологии и биотехнологии. Предложены варианты полипептидов с Fc-участком из IgG, которые обладают увеличенным связыванием FcRn за счет введения мутации 308С, 308F, 308W, 308Y или измененным связыванием при введении мутации 252Y/308F, 257L/308F, 257L/308Y, 257N/308Y, 279Q/308F, 279Y/308F, ^281S/308F, ^281S/308Y, 284E/308F, 298A/308F/333A/334A, 308F/332E, 308F/311V, 308F/G385H, 308F/428L, и 308F/434Y. Описано антитело с указанными мутациями в Fc-области, а также использование таких Fc-областей для получения слитого белка. Использование изобретения обеспечивает новые Fc-варианты с измененным связыванием FcRn, что может найти применение в медицине для получения различных конструкций, с пролонгированным временем удержания в сыворотке крови in vivo или, наоборот, в случае терапии с использованием радиоактивных лекарственных средств, с пониженным временем удержания в сыворотке крови in vivo. 4 н. и 10 з.п. ф-лы, 44 ил.
Реферат
Эта заявка заявляет права в соответствии с 35 U.S.С. §119(е) на все преимущества заявок US 60/627,763, зарегистрированной 12 ноября 2004 года; US 60/642,886, зарегистрированной 11 января 2006 года; US 60/649,508, зарегистрированной 2 февраля 2005 года; US 60/662,468, зарегистрированной 15 марта 2005 года; US 60/669,311, зарегистрированной 6 апреля 2005 года; US 60/681,607, зарегистрированной 16 мая 2005 года, US 60/690,200, зарегистрированной 13 июня 2005 года; US 60/696,609, зарегистрированной 5 июля 2005 года; US 60/703,018, зарегистрированной 27 июля 2005 года и US 60/726,453, зарегистрированной 12 августа 2005 года, которые включены путем отсылки во всей своей полноте.
Область техники, к которой относится изобретение
Это изобретение имеет отношение к оптимизированным вариантам иммуноглобулинов IgG, к конструкторским способам их получения и к их применению, в особенности в терапевтических целях.
Уровень техники
Антитела представляют собой иммунологические белки, которые связывают специфический антиген. У большинства млекопитающих, включая людей и мышей, антитела построены из спаренных тяжелых и легких полипептидных цепей. Каждая цепь собирается из индивидуальных доменов иммуноглобулина (Ig), и, таким образом, для таких белков используют общий термин иммуноглобулин. Каждая цепь собирается из двух различных участков, относящихся к вариабельной и константной области. Вариабельные области легкой и тяжелой цепей демонстрируют значительное различие в последовательности между антителами и отвечают за связывание с антигеном-мишенью. Константные области демонстрируют меньшие различия в последовательности и отвечают за связывание с большим количеством природных белков для достижения значимых биохимических эффектов. У человека существуют пять различных классов антител, включающих IgA (которые включают подклассы IgA1 и IgA2), IgD, IgE, IgG (которые включают подклассы IgG1, IgG2, IgG3 и IgG4) и IgM. Характерной особенностью этих классов антител являются их константные области, хотя более тонкие различия могут существовать и в V-области. Фигура 1 демонстрирует антитело IgG1, используемое здесь в качестве примера, чтобы описать основные структурные черты иммуноглобулинов. Антитела IgG представляют собой тетрамерные белки, состоящие из двух тяжелых цепей и двух легких цепей. Тяжелая цепь IgG состоит из четырех иммуноглобулиновых доменов, присоединенных от N-конца к С-концу в порядке VH-СН1-СН2-СН3, относящихся к вариабельному домену тяжелой цепи, константному домену 1 тяжелой цепи, константному домену 2 тяжелой цепи и константному домену 3 тяжелой цепи соответственно (также называемых VH-Cγ1-Cγ2-Cγ3, относящихся к вариабельному домену тяжелой цепи, константному домену гамма-1, константному домену гамма-2 и константному домену гамма-3 соответственно). Легкая цепь IgG состоит из двух иммуноглобулиновых доменов, присоединенных от N-конца к С-концу в порядке VL-CL, относящихся к вариабельному домену легкой цепи и константному домену легкой цепи соответственно.
Вариабельная область антитела содержит антиген-связывающие детерминанты молекулы и, таким образом, определяет специфичность антитела в отношении антигена-мишени. Вариабельная область называется так потому, что она наиболее сильно различается по последовательности от других антител внутри одного и того же класса. Наибольшие различия в последовательности обнаруживаются в гипервариабельных участках (CDR). Всего существует 6 участков CDR, по три на каждую тяжелую и легкую цепи, обозначаемые как VH CDR1, VH CDR2, VH CDR3, VL CDR1, VL CDR2 и VL CDR3. Вариабельный участок, находящийся вне участков CDR, относится к каркасному участку (FR). Среди различных антител наблюдают различия последовательности в участках FR, хотя и не такие существенные, как в участках CDR. В целом, это характерное строение антител обеспечивает стабильную основу (участок FR), на которой значительное разнообразие связывания антигенов (CDR) может использоваться иммунной системой для достижения специфичности для широкого множества антигенов. Для множества фрагментов вариабельных областей различных организмов доступно некоторое количество структур, определенных с высоким разрешением, некоторые из них находятся в свободном виде, а некоторые находятся в комплексе с антигенами. Последовательность и структурные особенности вариабельных областей антител хорошо охарактеризованы (Morea et al., 1997, Biophys Chem 68:9-16; Morea et al., 2000, Methods 20:267-279, работы включены путем отсылки во всей своей полноте), консервативные свойства антител позволили развить множество инженерных технологий для производства антител (Maynard et al., 2000, Annu Rev Biomed Eng 2:339-376, работа включена путем отсылки во всей своей полноте). Например, возможно пересадить CDR от одного антитела, например мышиного антитела, на каркасный участок другого антитела, например человеческого антитела. Этот процесс, называемый в этой области техники «гуманизацией», позволяет получить менее иммуногенные терапевтические антитела из антител, не имеющих отношения к человеческим. Фрагменты, включающие вариабельную область, могут существовать в отсутствие других областей антитела, такие фрагменты включают, например, фрагмент, связывающий антиген (Fab), включающий VH-Cγ1 и VH-CL; вариабельный фрагмент (Fv), включающий VH и VL; одноцепочечный вариабельный фрагмент (scFv), включающий VH и VL, связанные между собой в одну и ту же цепь; а также множество других фрагментов вариабельной области (Little et al., 2000, Immunol Today 21:364-370, работа включена путем отсылки во всей своей полноте).
Участок антитела Fc взаимодействует с различными рецепторами Fc и лигандами, которые сообщают ему множество важных функциональных возможностей, так называемые эффекторные функции. В иммуноглобулинах IgG Fc-участок, как показано на фигурах 1 и 2, включает иммуноглобулиновый домен Сγ2 и Сγ3 и N-концевой шарнир, ведущий в Сγ2. Важное семейство рецепторов Fc класса IgG включает гамма-рецепторы Fc (FcγRs). Эти рецепторы осуществляют связь между антителами и клеточными механизмами иммунной системы (Raghavan et al., 1996, Annu Rev Cell Dev Biol 12:181-220; Ravetch et al., 2001, Annu Rev Immunol 19:275-290, все работы включены путем отсылки во всей своей полноте). У людей это семейство белков включает FcγRI (CD64), включающий изоформы FcγRIa, FcγRIb и FcγRIc; FcγRII (CD32), включающий изоформы FcγRIIa (включающий аллотипы Н131 и R131), FcγRIIb (включающий FcγRIIb-1 и FcγRIIb-2) и FcγRIIc; и FcγRIII (CD16), включающий изоформы FcγRIIIa (включающий аллотипы V158 и F158) и FcγRIIIb (включающий аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2) (Jefferis et al., 2002, Immunol Lett 82:57-65, работа включена путем отсылки во всей своей полноте). Эти рецепторы обычно имеют внеклеточный домен, который опосредует связывание с Fc, мембранно-связанный участок и внутриклеточный домен, который может опосредовать некоторые сигнальные события внутри клетки. Эти рецепторы экспрессируются в различных иммунных клетках, включающих моноциты, макрофаги, нейтрофилы, дендритные клетки, эозинофилы, тучные клетки, тромбоциты, В-клетки, большие зернистые лимфоциты, клетки Лангерганса, натуральные киллеры (NK) и γγ Т-клетки. Образование комплекса Fc/FcγR направляет эти эффекторные клетки к местам связывания антигенов, что обычно приводит к проведению сигнала в клетках и важным последующим иммунным ответам, таким как высвобождение воспалительных медиаторов, активация В-клеток, эндоцитоз, фагоцитоз и цитотоксическая атака. Способность опосредовать цитотоксическую и фаготоксическую эффекторную функцию является потенциальным механизмом, с помощью которого антитела разрушают клетки-мишени. Опосредованная клетками реакция, в которой неспецифические цитотоксические клетки, экспрессирующие FcγRs, узнают антитело, связанное на поверхности клетки-мишени, и затем вызывают лизис клетки-мишени, называется антитело-зависимой клеточно-опосредованной цитотоксичностью (ADCC) (Raghavan et al., 1996, Annu Rev Cell Dev Biol 12:181-220; Gheitie et al., 2000, Annu Rev Immunol 18:739-766; Ravetch et al., 2001, Annu Rev Immunol 19:275-290, все работы включены путем отсылки во всей своей полноте). Опосредованную клетками реакцию, в которой неспецифические цитотоксические клетки, экспрессирущие FcγRs, узнают антитело, связанное на поверхности клетки-мишени, и затем вызывают фагоцитоз клетки-мишени, называют антитело-зависимым клеточно-опосредованным фагоцитозом клеток-мишеней (ADCP). Было определено некоторое количество структур внеклеточных доменов FcγRs человека, включающих FcγRsIIa (код доступа в базе данных pdb 1H9V, включен путем отсылки во всей своей полноте) (Sonderman et al., 2001, J Mol Biol 309:737-749, работа включена путем отсылки во всей своей полноте) (код доступа в базе данных pdb 1FCG, включен путем отсылки во всей своей полноте) (Maxwell et al., 1999, Nat Struc Biol 6:437-442, работа включена путем отсылки во всей своей полноте), FcγRsIIb (код доступа в базе данных pdb 2FCB, включен путем отсылки во всей своей полноте) (Sondermann et al., 1999, Embo J 18:1095-1103, работа включена путем отсылки во всей своей полноте); и FcγRsIIIb (код доступа в базу данных pdb 1E4J, включен путем отсылки во всей своей полноте) (Sondermann et al., 2000, Nature 406:267-273, работа включена путем отсылки во всей своей полноте). Все FcγRs связывают один и тот же Fc-участок в N-концевом участке домена Сγ2 и предшествующего шарнирного участка, показанных на фигуре 1. Это взаимодействие хорошо охарактеризовано структурно (Sondermann et al., 2001, J Mol Biol 309:737-749, работа включена путем отсылки во всей своей полноте), и было определено несколько структур Fc человека, связывающихся с внеклеточным доменом FcγRsIIIb человека (код доступа в базе данных pdb 1E4K, включен путем отсылки во всей своей полноте) (Sondermann et al., 2000, Nature 406:267-273, работа включена путем отсылки во всей своей полноте) (код доступа в базе данных pdb 1IIS и 1IIX, включен путем отсылки во всей своей полноте) (Radaev et al., 2001, J Biol Chem 276:16469-16477, работа включена путем отсылки во всей своей полноте), а также структура комплекса Fc/FcєRIα человеческого IgE (код доступа в базе данных pdb 1F6A, включен путем отсылки во всей своей полноте) (Garman et al., 2000, Nature 406:259-266, работа включена путем отсылки во всей своей полноте).
Различные подклассы IgG обладают различным сродством к FcγRs, обычно IgG1 и IgG3 связываются с рецепторами значительно лучше, чем IgG2 и IgG4 (Jefferis et al., 2002, Immunol Lett. 82:57-65, работа включена путем отсылки во всей своей полноте). Все FcγRs связываются с одним и тем же Fc-участком IgG, но с различным сродством: FcγRI, связывающий с самым высоким сродством, имеет Kd для IgG1, равную 10-8М, тогда как рецепторы с низким сродством, FcγRII и FcγRIII, связываются при 10-6М и 10-5М соответственно. Внеклеточные домены FcγRIIIa и FcγRIIIb идентичны на 96%, однако FcγRIIIb не имеет внутриклеточного сигнального домена. Кроме того, поскольку FcγRI, FcγRIIa/с и FcγRIIIa являются положительными регуляторами активации, запускаемой иммунным комплексом, они характеризуются наличием внутриклеточного домена, в состав которого входит иммунорецепторный тирозин-зависимый активационный мотив (ITAM), FcγRIIb имеет в своем составе иммунорецепторный тирозин-зависимый ингибиторный мотив (ITIM) и поэтому является ингибитором. Таким образом, первые рецепторы относятся к активирующим рецепторам, a FcγRIIb относится к ингибирующим рецепторам. Рецепторы также различаются по характеру и уровням экспрессии на различных иммунных клетках. Еще один уровень сложности состоит в существовании полиморфизма FcγR в протеоме человека. Особенно важным полиморфизмом с клиническим значением являются формы V158/F158 FcγRIIIa. IgG1 человека связывается с более высоким сродством с аллотипом V158 по сравнению с аллотипом F158. Показано, что различие в сродстве и предположительно влияние этого различия на ADCC и/или ADCP являются существенным показателем эффективности антитела к CD20 ритуксимаба (Rituxan®, BiogenIdec). Пациенты с аллотипом V158 благоприятно реагируют на лечение ритуксимабом, однако пациенты с аллотипом F158, обладающим более низкой аффиностью, слабо отвечают на такое лечение (Cartron et al., 2002, Blood 99:754-758, работа включена путем отсылки во всей своей полноте). Приблизительно 10-20% людей являются гомозиготами V158/V158, 45% являются гетерозиготами V158/F158 и 35-45% людей являются гомозиготами F158/F158 (Lehmbecher et al., 1999, Blood 94:4220-4232; Cartron et al., 2002, Blood 99:754-758, работы включены путем отсылки во всей своей полноте). Таким образом, 80-90% людей являются слабо реагирующими, так как у них есть, по меньшей мере, одна аллель F158 FcγRIIIa.
Перекрывающийся, но индивидуальный участок на Fc, показанный на фигуре 1, служит контактной поверхностью для белка комплемента C1q. Тем же самым способом, при котором связывание Fc/FcγR опосредует ADCC, связывание Fc/C1q опосредует зависимую от комплемента цитотоксичность (CDC). Чтобы сформировать комплекс С1, C1q образует комплекс с сериновыми протеазами С1r и C1s. C1q способен к связыванию с шестью антителами, хотя для активации комплементного каскада достаточно связывания с двумя IgG. Подобно взаимодействию Fc с FcγRs, различные подклассы IgG обладают различным сродством к C1q, обычно IgG1 и IgG3 лучше связываются с FcγRs, чем IgG2 и IgG4 (Jefferis et al., 2002, Immunol Lett. 82:57-65, работа включена путем отсылки во всей своей полноте.
В IgG участок на Fc между доменами Сγ2 и Сγ3 (фигура 1) опосредует взаимодействие с неонатальным рецептором FcRn, связывание которого приводит к рециркуляции эндоцитозного антитела от эндосомы обратно в кровяное русло (Raghavan et al., 1996, Annu Rev Cell Dev Biol 12:181-220; Ghetie et al., 2000, Annu Rev Immunol 18:739-766, обе работы включены путем отсылки во всей своей полноте). Этот процесс, сопряженный с устранением почечной фильтрации из-за большого габарита полноразмерной молекулы, приводит к тому, что время полужизни подходящих антител в сыворотке крови составляет диапазон от одной до трех недель. Связывание Fc с FcRn также играет ключевую роль в транспорте антител. Участок связывания для FcRn на Fc также является участком, в котором связываются бактериальные протеины А и G. Прочное связывание с этими белками обычно используют в качестве способа очистки антител при применении протеин А- или протеин G- аффинной хроматографии во время очистки белков. Таким образом, точное воспроизведение этого участка на Fc очень существенно как для клинических свойств антител, так и для их очистки. Имеющиеся в распоряжении структуры крысиного комплекса Fc/FcRn (Burmeister et al., 1994, Nature, 372:379-383; Martin et al., 2001, Mol Cell 7:867-877, обе работы включены путем отсылки во всей своей полноте) и комплексов с протеинами А и G (Deisenhofer et al., 1981, Biochemistry 20:2361-2370; Sauer-Eriksson et al., 1995, Structure 3:265-278; Tashiro et al., 1995, Curr Opin Struct Biol 5:471-481, все работы включены путем отсылки во всей своей полноте) обеспечивают понимание того, как происходит взаимодействие Fc с этими белками. Рецептор FcRn также отвечает за перенос IgG в желудочно-кишечный тракт новорожденных и в просвет эпителия кишечника у взрослых (Ghetie and Ward, Annu. Rev. Immunol., 2000, 18:739-766; Yoshida et al., Immunity, 2004, 20(6):769-783, обе работы включены путем отсылки во всей своей полноте).
Исследования, проведенные на доменах Fcγ крысы и человека, продемонстрировали важность некоторых остатков Fc в связывании FcRn. Последовательности в Fc-участках у крыс и человека идентичны приблизительно на 65% (остатки 237-443 в нумерации по Kabat et al.). См. фигуры 3, 4 и 5, показывающие результаты выравнивания Fc, тяжелой цепи FcRn и легкой цепи FcRn (бета-2-микроглобулин) крысы/человека. На основе существующей структуры комплекса Fc/FcRn крысы была построена модель комплекса Fc/FcRn человека (Martin et al., 2001, Mol. Cell 7:867-877, работа включена путем отсылки во всей своей полноте). Последовательности у крысы и человека содержат некоторые общие для них остатки, которые критичны для связывания FcRn, например Н310 и Н435 (Medesan et al., 1997, J. Immunol. 158(5):221-7; Shields et al., 2001, J. Biol. Chem. 276(9):6591-6604, обе работы включены путем отсылки во всей своей полноте). Во многих положениях, однако, белки у крысы и человека имеют разные аминокислоты, обеспечивая для остатков в последовательности у человека другое окружение и возможно другие особенности по сравнению с последовательностью у крысы. Эта вариабельность ограничивает способность переносить характеристики одного гомолога на другой гомолог.
В мышином Fcγ случайная мутация и селекция с использованием фагового дисплея в участках Т252, Т254 и Т256 приводят к тройному мутанту T252L/T254S/T256F, у которого сродство к FcRn повышается в 3,5 раза и в 1,5 раза увеличивается время полужизни (Ghetie et al., 1997, Nat. Biotech. 15(7):637-640, работа включена путем отсылки во всей своей полноте).
Кристаллические структуры комплекса Fc/FcRn крысы идентифицировали остатки Fc, важные для связывания FcRn (Burmeister et al., Nature, 372:379-383 (1994); Martin et al. Molecular Cell. 7:867-877 (2001), обе работы включены путем отсылки во всей своей полноте). Первоначальная структура комплекса Fc/FcRn была получена в 1994 году с разрешением 6 Е (таблица 2а, Burmeister et al., Nature, 372:379-383 (1994), работа включена путем отсылки во всей своей полноте). Структура с более высоким разрешением, выполненная в 2001 году Martin et al., показала более детальный вид расположения боковых цепей (Martin et al. Molecular Cell. 7:867-877 (2001), работа включена путем отсылки во всей своей полноте). Эта кристаллическая структура Fc крысы, связанного с FcRn крысы, была разрешена с использованием димера Fc с одним мономером, содержащим мутации Т252G/I253G/Т254G/Н310Е/Н433Е/Н435Е, у которого нарушено связывание с FcRn, и одним мономером, содержащим мономер Fc дикого типа.
Мутационные исследования Fcγ человека были выполнены на некоторых остатках, которые важны для связывания с FcRn и которые, как было показано, имеют увеличенное время полужизни в сыворотке крови. Hinton et al. в Fcγ человека мутировали три остатка по отдельности от 19 общих аминокислот. Hinton et al. обнаружили, что некоторые точечные мутации двойного мутанта повышали сродство при связывании FcRn (Hinton et al., 2004, J. Biol. Chem. 279(8):6213-6216, работа включена путем отсылки во всей своей полноте). Две мутации повышали время полужизни у обезьян. Shields et al. мутировали остатки, почти что исключительно на Ala и изучали их связывание с FcRn и FcγR's (Shields et al., 2001, J Biol Chem 276:6591-6604, работа включена путем отсылки во всей своей полноте).
Чтобы отобрать Fc-мутанты, которые связывают FcRn с повышенным сродством, Dall'Acqua et al. использовали фаговый дисплей (Dall'Acqua et al., 2002, J. Immunol. 169:5171-5180, работа включена путем отсылки во всей своей полноте). Отобранные последовательности ДНК были двойными и тройными мутантами. В ссылке представлены белки, кодируемые многими отобранными последовательностями, и обнаружены некоторые белки, которые связываются с FcRn более прочно, чем Fc дикого типа.
Для введения антител и белков, слитых с Fc, в качестве терапевтических средств необходимы инъекции с предписанной частотой, зависящей от характеристик выведения и времени полужизни белков. Более длительное время полужизни in vivo делает возможным более редкие инъекции или сниженные дозировки, что, несомненно, выгодно. Хотя мутации, сделанные ранее в Fc-домене, привели к получению некоторых белков с повышенным сродством при связывании с FcRn и увеличенными временами полужизни in vivo, эти мутации не выяснили оптимальные мутации и увеличенное время полужизни in vivo.
Ключевой чертой Fc-участка является консервативное N-гликозилирование, показанное на фигуре 1, которое обнаруживают на остатке N297. Этот углевод или олигосахарид, как его иногда называют, играет особую структурную и функциональную роль в антителе, что является одной из принципиальных причин, по которой антитела должны продуцироваться с применением экспрессионных систем млекопитающих (Umana et al., 1999, Nat Biotechnol 17:176-180; Davies et al., 2001, Biotechnol Bioeng 74:288-294; Mimura et al., 2001, J Biol Chem 276:45539-45547; Radaev et al., 2001, J Biol Chem 276:16478-16483; Shields et al., 2001, J Biol Chem 276:6591-6604; Shields et al., 2002, J Biol Chem 277:26773-26740; Simmons et al., 2002, J Immunol Methods 263:133-147). Однако влияние углевода незначительно, если имеется любой специфический контакт с FcγR (Radaev et al., 2001, J Biol Chem 276:16469-16477; Radaev et al., 2001, J Biol Chem 276:16469-16477 и Krapp et al., 2003, J. Mol. Biol. 325:979-989, работы включены путем отсылки во всей своей полноте).
Антитела были разработаны для терапевтического применения. Наиболее типичные публикации, имеющие отношение к такому лечению включают Chamow et al., 1996, Trends Biotechnol 14:52-60; Ashkenazi et al., 1997, Curr Opin Immunol 9:195-200; Cragg et al., 1999, Curr. Opin. Immunol. 11:541-547; Glennie et al., 2000, Immunol. Today 21:403-410; McLaughlin et al., 1998, J. Clin. Oncol. 16:2855-2833 и Cobleigh et. al., 1999, J. Clin. Oncol. 17:2639-2648, все работы включены путем отсылки во всей своей полноте. В настоящее время для противораковой терапии любое небольшое улучшение в коэффициенте смертности определяется как успех. Определенные IgG-варианты, раскрытые здесь, по меньшей мере, частично, увеличивают эффективность антител в ограничении дальнейшего роста или разрушения раковых клеток-мишеней.
Противоопухолевая эффективность антител реализуется через повышение их способности опосредовать цитотоксические эффекторные функции, такие как ADCC, ADCP и CDC. Примеры включают работы Clynes et al., 1998, Proc Natl Acad Sci USA 95:652-656; Clynes et al., 2000, Nat Med 6:443-446 и Cartron et al., 2002, Blood 99:754-758, все работы включены путем отсылки во всей своей полноте.
IgG1 человека - антитело, наиболее часто применяемое в терапевтических целях, и большая часть конструкторских исследований была выполнена в этом контексте. Различные изотипы класса IgG, включающие IgG1, IgG2, IgG3 и IgG4, однако, имеют уникальные физические, биологические и клинические свойства. В этой области техники существует необходимость разрабатывать такие варианты, чтобы улучшить связывание с FcRn и/или увеличить время полужизни in vivo по сравнению с природными полипептидами IgG. Настоящая заявка отвечает всем этим и другим требованиям.
Раскрытие изобретения
Настоящее изобретение раскрывает создание новых вариантов Fc-доменов, включая те, которые обнаружены в антителах, слитых Fc и иммуноадгезинах, которые обладают повышенным связыванием с рецептором FcRn и повышенным удержанием в сыворотке крови in vivo. Дополнительный аспект изобретения - повышение связывания с FcRn по сравнению с диким типом, в особенности при низких значениях рН, около 6,0 для того, чтобы обеспечить связывание Fc/FcRn в эндосомах. Дополнительный аспект настоящего изобретения - предпочтительное связывание сконструированных вариантов при рН около 6 по сравнению с их связыванием при рН около 7,4 для того, чтобы облегчить высвобождение Fc в кровь после клеточного рециклирования.
Еще один аспект настоящего изобретения имеет отношение к конструированию вариантов Fc со сниженным связыванием с FcRn и сниженным временем полужизни in vivo. Такие белки, включающие мутации для снижения сродства к FcRn и/или времени полужизни in vivo, полезны для многих вариантов терапии и диагностики, включая доставку и мониторинг радиоактивных лекарственных средств, где в идеальном случае время полужизни радиоактивной метки приблизительно равно времени полужизни in vivo ее белкового конъюгата.
Еще один аспект настоящего изобретения имеет отношение к изменению связывания Fc-домена с FcR's, например с FcgRI, FcgRIIa, FcgRIIb, FcgRIIIa у людей. Эти рецепторы отвечают за индукцию различных эффекторных функций антител. Поэтому еще один аспект изобретения имеет отношение к изменению эффекторных функций Fc-домена, таких как зависимая антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC), зависимая от комплемента цитотоксичность (CDC) и антитело-зависимый клеточно-опосредованный фагоцитоз (ADCP).
Еще один аспект настоящего изобретения имеет отношение к Fc-вариантам, которые обладают и измененным связыванием с FcRn, и измененным связыванием с Fcg, чтобы повлиять и на время полужизни in vivo, и на эффекторные функции белка, включающего Fc. Например, эти варианты могут иметь увеличенное время полужизни in vivo, а также улучшенную ADCC. Варианты, например, могут иметь увеличенное время полужизни in vivo и сниженную CDC.
Еще в одном аспекте изобретение обеспечивает рекомбинантные нуклеиновые кислоты, кодирующие вариантные Fc-белки, экспрессионные векторы и клетки хозяина.
В дополнительном аспекте изобретение обеспечивает способы продуцирования белка, включающего Fc, включающие культивирование клеток-хозяев изобретения в условиях, подходящих для экспрессии белка.
В еще одном аспекте изобретение обеспечивает фармацевтические композиции, включающие вариантный Fc-белок изобретения и фармацевтический носитель.
Еще в одном аспекте изобретение обеспечивает способы лечения нарушений, включающие введение пациенту белка, включающего вариантный Fc изобретения.
В дополнительном аспекте изобретение предоставляет Fc-участок варианта в исходном Fc-полипептиде, включающий, по меньшей мере, одну модификацию в Fc-участке указанного исходного полипептида, где указанный вариантный белок демонстрирует измененное связывание с FcRn по сравнению с исходным полипептидом, и где указанный Fc-вариант включает, по меньшей мере, одну модификацию, выбираемую из группы, состоящей из:
где нумерация соответствует индексу EU и символ «^» означает вставку после указанного положения, а символ «#» означает делецию в этом указанном положении.
Еще в одном аспекте изобретение обеспечивает Fc-варианты, включающие, по меньшей мере, одну модификацию, выбираемую из группы, состоящей из:
В дополнительном аспекте изобретение обеспечивает Fc-варианты, включающие, по меньшей мере, одну модификацию, выбираемую из группы, состоящей из:
Краткое описание чертежей
Фигура 1: Структура и функция антител. Показана модель полноразмерного человеческого антитела IgG1, смоделированного с использованием структуры гуманизированного фрагмента Fab с кодом доступа 1СЕ1 в базе данных pdb (James et al., 1999, J Mol Biol 289:293-301, работа включена путем отсылки во всей своей полноте) и структуры Fc-фрагмента человеческого IgG1 с кодом доступа 1DN2 в базе данных pdb (DeLano et al., 2000, Science 287:1279-1283, работа включена путем отсылки во всей своей полноте). Подвижный шарнир, который связывает участки Fab и Fc, не показан. IgG1 представляет собой гомодимер, состоящий из гетеродимеров, составленных из двух легких цепей и двух тяжелых цепей. Домены Ig, которые составляют антитело, отмечены и включают VL и CL в легкой цепи и VH, С-гамма-1 (Cγ1), С-гамма-2 (Сγ2) и С-гамма-3 (Сγ3) для тяжелой цепи. Fc-участок отмечен. Места связывания важных белков отмечены и включают место связывания антигена в вариабельной области и места связывания FcγRs, FcRn, C1q и протеинов А и G в участке Fc.
Фигура 2: Последовательности IgG человека, применяемые в настоящем изобретении, с нумерацией в соответствии с индексом EU базы данных Kabat et al.
Фигура 3: Пример последовательностей IgG человека и грызунов, применяемых в настоящем изобретении, с нумерацией в соответствии с индексом EU базы данных Kabat et al.
Фигура 4: Пример последовательностей тяжелых цепей FcRn человека и грызунов, применяемых в настоящем изобретении.
Фигура 5: Пример последовательностей бета-2-микроглобулина человека и грызунов, применяемых в настоящем изобретении.
Фигура 6: Модель комплекса Fc/FcRn человека, созданная на основании структур крысы (Burmeister et al., 1994, Nature, 372:379-383; Martin et al., 2001, Mol Cell 7:867-877, обе работы включены путем отсылки во всей своей полноте). Некоторые остатки гистидина показаны в виде заполняющих пространство атомов в цепях FcRn (светлосерые) и в Fc-полипептиде (темно-серые).
Фигура 7: Иллюстрация некоторых концепций, применяемых при конструировании вариантов, включающих вставки и делеции.
Фигура 8: Варианты настоящего изобретения.
Фигура 9: Варианты настоящего изобретения.
Фигура 10: Варианты настоящего изобретения.
Фигура 11: Схема вектора pcDNA3.1 Zeo+, который можно применять в конструкциях Fc-вариантов.
Фигура 12: Данные по конкуренции связывания Fc дикого типа и Fc-вариантов настоящего изобретения с FcRn. Ha каждой панели Fc-варианты настоящего изобретения показаны в виде левой кривой (красной или темно-серой), а трастузумаб дикого типа показан в виде правой кривой (синей или светло-серой).
Фигура 13: Обобщенные результаты FcRn-связывающих свойств Fc-вариантов. Колонки справа налево показывают модификации связывания FcRn, используемый иммуноглобулин, другие модификации, относительное сродство к FcRn, измеренное с помощью конкурентного анализа AlphaScreen™, по сравнению с диким типом (значение медианы), число проведенных анализов и идентификационный номер белка. Относительное сродство FcRn, которое выше, чем 1,0, показывает улучшение связывания по сравнению с диким типом.
Фигура 14: Данные по связыванию FcRn Fc-вариантами настоящего изобретения. Fc-варианты настоящего изобретения представляют собой алемтузумаб и трастузумаб. Показано кратное усиление связывания по сравнению с диким типом.
Фигура 15: Обобщенные эксперименты, проведенные методом поверхностного плазменного резонанса с Fc-вариантами, имеющими улучшенное связывание с FcRn. Гистограмма показывает кратность увеличения сродства при связывании с FcRn каждого варианта по отношению к Fc-домену дикого типа.
Фигура 16: Эксперименты, проведенные методом поверхностного плазменного резонанса с антителами дикого типа и вариантами настоящего изобретения. Показанные кривые представляют собой ассоциацию и диссоциацию Fc-вариантного антитела с FcRn при рН 6,0.
Фигура 17: Анализы связывания Fc-вариантов настоящего изобретения с FcRn. Показаны результаты анализа прямого связывания методом AlphaScreen™ при рН 6,0 (а и b) и при рН 7,0 (с).
Фигура 18: Анализы связывания Fc-вариантов настоящего изобретения с FcRn. Приведены единицы поверхностного плазмонного резонанса, полученные при связывании Fc-варианта с прикрепленным на поверхности FcRn.
Осуществление изобретения
Настоящее изобретение раскрывает создание новых вариантов Fc-доменов, включая те, которые обнаружены в антителах, слитых Fc и иммуноадгезинах, которые обладают усиленным связыванием с FcRn-рецептором. Как указано здесь, связывание с FcRn приводит к их более длительному удержанию в сыворотке крови in vivo.
Чтобы увеличить удержание Fc-белков in vivo, увеличение сродства при связывании должно быть приблизительно при рН 6,0 без сопутствующего увеличения сродства приблизительно при рН 7,4. Хотя это еще выясняется, полагают, что Fc-участки имеют более длительное время полужизни in vivo, так как связывание с FcRn при рН 6 в эндосоме приводит к захвату Fc (Ghetie and Ward, 1997, Immunol. Today, 18(12):592-598, работа включена путем отсылки во всей своей полноте). Эндосомальный компартмент затем вновь возвращает Fc на клеточную поверхность. После того, как компартмент открывается во внеклеточное пространство, более высокие значения рН около 7,4 индуцируют высвобождение Fc назад в кровяное русло. Dall' Acqua et al. показали, что Fc-мутанты с усиленным связыванием FcRn при рН 6 и 7,4 в действительности имеют сниженные концентрации в сыворотке крови и то же самое время полужизни, что и Fc дикого типа (Dall' Acqua et al., 2002, J. Immunol., 169:5171-5180, работа включена путем отсылки во всей своей полноте). Считают, что повышенное сродство Fc к FcRn при рН 7,4 не позволяет Fc высвобождаться обратно в кровь. Таким образом, мутации Fc, которые будут повышать время полужизни Fc in vivo, будут в идеальном случае увеличивать связывание FcRn при низких значениях рН, и в то же время все еще обеспечивать высвобождение Fc при более высоких значениях рН. Аминокислота гистидин изменяет свой заряд в диапазоне рН от 6,0 до 7,4. Следовательно, не удивительно обнаружить остатки His в важных положениях в комплексе Fc/FcRn (фигура 6).
На Фигурах 8-10 и 17-19 представлены дополнительные данные по вариантам, раскрытым в первоначально поданном описании. На Фигурах 20, 27 и 30 приведены данные, полученные in vivo.
На Фигуре 20 представлено обобщение по результатам измерения аффинности связывания Fc-вариантов настоящего изобретения с FcRn человека, макаки и мыши, полученные методом поверхностного плазменного резонанса (SPR). Значения, превышающие единицу, указывают на увеличение связывания Fc-варианта настоящего изобретения с FcRn. Измерения проводились с использованием аппроксимации кривых, полученных методом SPR, в соответствии с моделью связывания по Лэнгмюру при стехиометрии связывания 1:1.
На Фигуре 27 представлены результаты, полученные in vivo. Показаны значения концентрации антител дикого типа (WT) и вариантов в сыворотке мышей с нокином человеческого FcRn. Использовались следующие антитела против VEGF: антитела дикого типа (WT) - открытые квадратики, V308F - закрытые квадратики, P257L - закрытые треугольники, и P257N - крестики.
На Фигуре 30 представлены данные по связыванию антител дикого типа и вариантов с FcRn на поверхности клеток 293Т.
Дополнительный аспект изобретения - повышение связывания с FcRn по сравнению с диким типом, в особенности при низких значениях рН, около 6,0, чтобы облегчить связывание Fc/FcRn в эндосоме. Также в заявке раскрыты Fc-варианты с измененным связыванием с FcRn и измененным связыванием с другим классом Fc-рецепторов, FcγR's, так как было показано, что различное связывание с FcγRs, в особенности повышенное связывание с FcγRIIIb и пониженное связывание с FcγRIIb, приводит к увеличению эффективности.
Определения
Чтобы заявку можно было бы более полно понять, ниже приведены некоторые определения. Разумеется, что такие определения включают грамматические эквиваленты.
Термин «ADCC» или «антитело-зависимая клеточно-опосредованная цитотоксичность», который используют здесь, означает опосредованную клетками реакцию, в которой неспецифические цитотоксические клетки, экспрессирующие FcγRs, распознают антитела, связанные на клетке-мишени, и, впоследствии, вызывают лизис клетки-мишени.
Термин «ADCP» или «антитело-зависимый клеточно-опосредованный фагоцитоз», который используют здесь, означает опосредованную клетками реакцию, в которой неспецифические цитотоксические клетки, экспрессирующие FcγRs, распознают антитела, связанные на клетке-мишени, и впоследствии вызывают фагоцитоз клетки-мишени.
Термин «модификация аминокислот» означает здесь замену, вставку и/или делецию в полипептидной последовательности.
Термины «замена аминокислот» или «замена» означают здесь замещение аминокислоты в определенном положении в исходной полипептидной последовательности на другую аминокислоту. Например, замена E272Y относится к вариантному полипептиду, в данном случае к Fc-варианту, в котором глутаминовую кислоту в положении 272 замещают на тирозин.
Термин «вставка аминокислоты» или «вставка» означает здесь добавление аминокислоты в определенное положение в исходной полипептидной цепи. Например, -233Е или ^233Е обозначает вставку глутаминовой кислоты после положения 233 и до положения 234. Кроме того, -233ADE или ^233ADE обозначает вставку AlaAspGlu после положения 233 и перед положением 234.
Термин «делеция аминокислоты» или «делеция», который используют здесь, означает удаление аминокислоты, в частности, в определенном положении исходной полипептидной последовательности. Например, Е233- или Е233# обозначают делецию глутаминовой кислоты в положении 233. Кроме того, EDA233- или EDA233# делецию удаление последовательности GluAspAla, которая начинается от положения 233.
Термин «вариантный белок», или «вариант белка», или «вариант», который здесь используют, означает белок, которая отличается от исходного белка, по меньшей мере, одной аминокислотной модификацией. Вариант белка может относиться к белку самому по себе, к композиции, которая включает белок, или к последовательности аминокислот, которая его кодирует. Предпочтительно, когда вариант белка имеет, по меньшей мере, одну аминокислотную модификацию по сравнению с исходным белком, например приблизительно от одной до приблизительно десяти аминокислотных модификаций и предпочтительно приблизительно от одной до приблизительно пяти аминокислотных модификаций по сравнению с исходным белком. Последовательность варианта белка здесь предпочтительно будет иметь, по меньшей мере, 80%-ную гомологию с последовательностью исходного белка, наиболее предпочтительно, по меньшей мере, примерно 90%-ную гомологию, более предпочтительно, по меньшей мере, примерно 95%-ную гомологию. Вариантный белок может относиться к вариантному белку самому по себе, к композиции, которая включает вариант белка, или к последовательности аминокислот, которая его кодирует. Соответственно термин «вариант антитела» или «вариантное антитело», который здесь используют, обозначает антитело, которое отличается от исходного антитела, по меньшей мере, одной аминокислотной модификацией, термин «IgG-вариант» или вариантный «IgG», используемый здесь, обозначает антитело, которое отличается от исходного IgG, по меньшей мере, одной аминокислотной модификацией, и термин «вариант иммуноглобулина» или «вариантный иммуноглобулин», который используют здесь, обозначает иммуноглобулиновую последовательность, которая отличается от исходной иммуноглобулиновой последовательности, по меньшей мере, одной аминокислотной модификацией. Варианты могут включать неприродные аминокислоты. Примеры включают US 6586207; WO 98/48032; WO 03/073238; US 2004-021988 A1; WO 05/35727A2; WO 05/74524A2; J.W.Chin et al., (2002) Journal of the Americ