Способ определения функциональной гибели клеток
Иллюстрации
Показать всеИзобретение относится к области биомедицинских технологий. Сущность способа определения функциональной гибели клетки заключается в том, что измеряют спектр комбинационного рассеяния света от одной исследуемой клетки с помощью оптического конфокального когерентного томографа, используя зондирующее излучение с длиной волны, не попадающей в полосу поглощения хромофоров клетки, облучают клетку резонансным лазерным излучением, попадающим в полосу поглощения хромофоров клетки и вызывающим гипертермию. Увеличивают интенсивность лазерного излучения до величины, вызывающей изменение спектральных компонент комбинационного рассеяния. Функциональную гибель клеток определяют по пороговому уровню лазерного воздействия, при котором возникают необратимые изменения спектральных компонент комбинационного воздействия. Использование способа позволяет осуществить неинвазивный контроль функциональной гибели клетки при гипертермии и определить порог функционального повреждения клеток независимо от вида излучения по необратимому изменению молекулярных спектров комбинационного рассеяния клетки. 4 з.п. ф-лы, 6 ил.
Реферат
Изобретение относится к области биомедицинских технологий, в частности к созданию контролируемого лазерного фототермического разрушения раковых клеток, патологических клеток крови или порогового воздействия электромагнитного излучения других спектральных диапазонов, включая ультрафиолетовое, рентгеновское, гамма, СВЧ и КВЧ излучение на основе анализа изменения спектров комбинационного рассеяния биомолекул отдельной живой клетки, измеренных с помощью конфокального лазерного томографа.
Известен гистологический способ определения некроза плазматической мембраны клеток в биоткани при использовании определенных красителей (пропидиум-йодид), которые проникают через плазматическую мембрану клетки, что вызывает красную флюоресценцию ядра (Хэм А., Кормак Д. Гистология. 5 том. - М.: Мир. 1983).
Однако данный способ применим для клеток, имеющих ядро, и не позволяет оценить функциональное состояние, например, эритроцитов крови. Кроме того, способ может определить некроз только для поврежденной мембраны клетки, т.е. когда клетка уже разрушилась и не исследовать динамику гибели клетки.
Известен флюоресцентный способ определения повреждения плазматической мембраны клетки, включающий введение определенного типа фотосенсибилизатора во внешнюю среду клеток, который не проникает через мембрану нормальной клетки, облучение красителя и длиной волны, соответствующей полосе поглощения красителя и наблюдение флюоресценции красителя внутри клетки, что соответствует повреждению внешней плазматической мембраны диагностируемой клетки (Любимов Ю.В., Потапенко А.Я. Фотобиология, 2007, с.290).
Однако данный способ позволяет исследовать только целостность плазматической мембраны, т.е. функционирование молекулярных мембранных каналов, через которые происходит внутриклеточная диффузия.
Известен электрофизиологический способ определения функционального состояния плазматической мембраны нервных клеток, включающий определения порога возбуждения нервного импульса при подаче электрического импульса определенной амплитуды и миллисекундной длительности с генератора тока с помощью внеклеточного внешнего возбуждающего электрода (Блонси Р., Барр Р. Биоэлектричество. - М.: Мир, 1992, с.366.). Метод позволяет контролировать увеличение порога возбуждения нервных клеток с помощью фармакологических лекарств (типа лидокаина, новокаина, морфина и т.д.), что используется как обратимое обезболивающее средство (Хуго Ф. Нейрохимия. - М. Мир. 1990).
Однако данный способ позволяет оценивать функциональное состояние только нервных клеток.
Для диагностики функционального состояния нервных (ганглиозных) клеток глаза человека во всех современных офтальмологических клиниках мира применяется способ электроретинографии при воздействии вспышки света на сетчатку глаза и измерении формы и амплитуды интегрального электрического импульса ганглиозных клеток сетчатки, обусловленного изменения мембранного потенциала колбочек при поглощении импульса света, что вызывает пропорциональное изменение кожного потенциала на поверхности века глаза человека (A.M.Шамшинова, В.В.Волков. Функциональные методы исследования в офтальмологии. - М.: Медицина. 1999, с.133-196).
Однако данный метод является интегральным и несет информацию о функциональном состоянии ансамбля клеток сетчатки (в среднем в сетчатке глаза человека около миллиона ганзлиозных клеток, а фоторецепторных в среднем 7 млн. колбочек и 150 млн. палочек).
Известен способ определения функционального состояния самовозбуждающихся (пейсмекерных) сердечных кардиомиоцитов. Способ включает введение потенциал-зависимого красителя на поверхность кардиомиоцитов, при этом потенциал-зависимый краситель изменяет спектральный коэффициент отражения во времени в соответствии с изменением мембранного потенциала диагностируемых кардиомиоцитов (Лекции по фундаментальной физиологии. М: 2008.).
Однако данный способ применим для оценки функционального состояния только пейсмекерных клеток или кардиомиоцитов, по которым распространяется мембранный потенциал действия в тканях сердца.
Наиболее близким к предлагаемому техническому решению является фотодинамический способ оценки повреждения клеток, включающий введение раствора фотосенсибилизатора вне клеточного пространства, облучение клетки резонансным лазерным излучением, совпадающим с полосой поглощения фотосенсибилизатора, при этом устанавливают определенный уровень плотности лазерной мощности с определенной длительностью, вызывающий некроз облучаемой клетки, контролируемый в оптический микроскоп по изменению формы клетки, вызывающий ее лизис, который проявляется при вытекании внутриклеточной жидкости через поврежденную плазматическую мембрану (Wilson B.C. The physics of photodynamic therapy // Phys. Med. Biol. 1986. V.31. P.327-360).
Однако данный способ позволяет определить гибель клетки только за счет повреждения плазматической мембраны клетки (лизис), но не функциональную гибель. Известен процесс гибели практически всех нормальных клеток, обусловленный апоптозом (Начала физиологии. Под ред. Ноздрачева А.Д. СПб.: "Лань", 2001), т.е. запрограммированной гибелью клеток, при котором не происходит повреждение плазматической мембраны.
Задачей изобретения является неинвазивный контроль функциональной гибели клетки при гипертермии, а также установление порога допустимого (обратимого) внешнего воздействия различных видов электромагнитного облучения, включая рентгеновское, гамма, ультрафиолетовое, СВЧ или КВЧ на функционирование клетки.
Способ определения функциональной гибели клеток характеризуется тем, что измеряют спектр комбинационного рассеяния света от одной исследуемой клетки с помощью оптического конфокального когерентного томографа, используя зондирующее лазерное излучение с длиной волны, не попадающей в полосу поглощения хромофоров клетки, облучают клетку резонансным лазерным излучением, попадающим в полосу поглощения хромофоров клетки и вызывающим гипертермию, увеличивают интенсивность лазерного излучения до величины, вызывающей изменение спектральных компонент комбинационного рассеяния, определяют функциональную гибель клетки по пороговому уровню лазерного воздействия, при котором возникают необратимые изменения спектральных компонент комбинационного рассеяния.
Резонансное облучение клетки производят с помощью воздействия УФ-излучения
Резонансное облучение производят с помощью воздействия рентгеновского излучения.
Резонансное облучение производят с помощью воздействия гамма-излучения.
Резонансное облучение производят с помощью воздействия СВЧ или КВЧ-радиоизлучения.
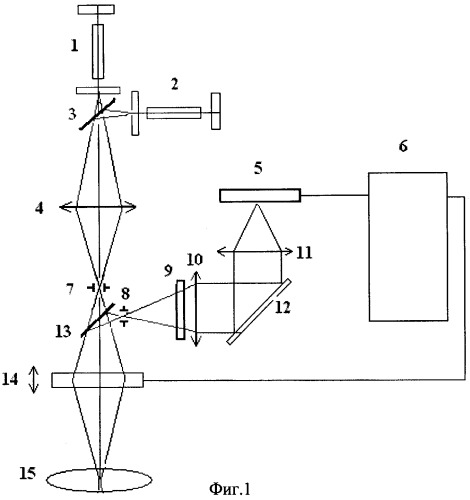
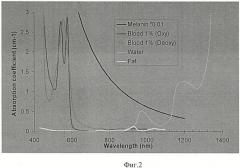
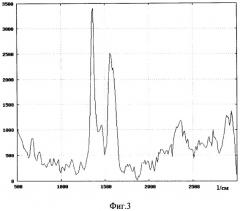
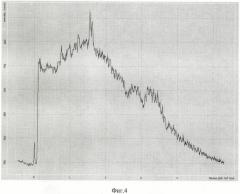
Изобретение поясняется чертежами, где на фиг.1 представлена блок-схема установки для управляемого лазерного фототермического разрушения клеток на основе анализа субклеточного комбинационного рассеяния, измеренного лазерным конфокальным томографом; на фиг.2 - оптический спектр поглощения основных компонент биоткани кожи человека, включая кровь - blood, насыщенную кислородом-оху и ненасыщенную кислородом - deoxy, меланин, жировые клетки - fat и воду - water; на фиг.3 - спектр комбинационного рассеяния гемоглобина при концентрации 150 г/л, измеренный в диапазоне волновых чисел 500-3000 см-1 (по оси ординат - интенсивность спектральных компонент комбинационного рассеяния света, по оси абсцисс - волновое число в см-1, характеризующее частотный сдвиг резонансных колебаний зондируемых молекул относительно лазерной частоты; на фиг.4 представлен измеренный спектр комбинационного рассеяния одного выбранного эритроцита в диапазоне волновых чисел 100-5000 см-1 до облучения лазерным излучением с длиной волны, попадающей в полосу поглощения хромофора клетки (гемоглобина); на фиг.5 представлен спектр комбинационного рассеяния эритроцита, предварительно облученного сфокусированным лазерным пучком с длиной волны λ=473 нм, попадающей в полосу поглощения гемоглобина эритроцита, с оптической мощностью 20 мВт при воздействии в течение 10 секунд. Спектр комбинационного рассеяния (диапазон волновых чисел 100-5000 см-1), измеренный с помощью лазерного (зондирующая длина волны λ=633 нм) конфокального томографа из субклеточного объема эритроцита, в котором под действием сфокусированного лазерного пучка (с длиной волны λ=473 нм) произошла гипертермия, приводящая к локальной карбонизация клетки (локальная температура достигла 180°С); на фиг.6 - представлен спектр комбинационного рассеяния того же эритроцита, измеренный из субклеточного объема из области эритроцита, не подверженного непосредственно облучению лазерным пучком (с края эритроцита), но в котором вследствие гипертермии произошло необратимое повреждение, которое отразилось на возникновении дополнительных спектральных компонент комбинационного рассеяния.
Для реализации способа представлено устройство на фиг.1, которое состоит из:
1 - зондирующего лазера конфокального томографа, длина волны которого не попадает в полосу поглощения зондируемой клетки (He-Ne лазер с λ=633 нм или полупроводниковый лазер с λ=780 нм);
2 - лазера, длина волны которого попадает в полосу поглощения клетки и вызывает гипертермию (YAG: Nd твердотельный лазер с диодной накачкой и внутрирезонаторным генератором второй гармоники с λ=473 нм);
3 - смесительного зеркала;
4, 10, 11 - фокусирующих линз;
5 - ПЗС фотодиодной видеолинейки;
6 - персонального компьютера;
7, 8 - сопряженных микродиафрагм;
9 - узкополосных лазерных фильтров;
12 - дифракционной решеткой спектрометра;
13 - делительного зеркала;
14 - пространственного 3-мерного сканера;
15 - исследуемой клетки.
Способ определения функциональной гибели клеток при фототермолизе работает следующим образом: оптический пучок зондирующего лазера 1, длина волны которого не попадает в полосу поглощения зондируемой клетки, пройдя смесительное зеркало 3 с помощью фокусирующей линзы 4, сопряженной микродиафрагмы 7 и пространственного 3-мерного сканера 14, фокусируется в определенную клетку. Лазерное и рассеянное (комбинационное) оптическое излучение, отраженное назад от клетки 15 с помощью делительного зеркала 13 и сопряженной микродиафрагмы 8, пройдя соответствующий узкополосный лазерный фильтр 9, не пропускающий зондирующее лазерное излучение, а только оптическое излучение, обусловленное комбинационным рассеянием молекул клетки с помощью линзы 10, формирующий параллельный пучок, поступающий в спектрометор, представляющий собой дифракционную решетку 12, сферическую фокусирующую линзу 11 и детектирующую ПЗС фотодиодную видеолинейку 5, электрический сигнал с пикселей которой, пропорциональный интенсивности комбинационного излучения поступает в персональный компьютер 6, где формируется спектр комбинационного рассеяния из конфокального объема клетки, поперечное сечение которого определяется дифракционным пятном фокусирующей системы 3-мерного сканера 14, а продольный размер определяется диаметром сопряженных диафрагм и может быть соизмерим с длиной волны. С помощью компьютера 6 и управляемого пространственного 3-мерного сканера 14 возможно измерять сигнал комбинационного рассеяния из субклеточного объема зондируемой клетки. Таким образом, сопряженные микродиафрагмы 7, 8 и 3-мерный сканер 14 позволяют измерять отраженное назад оптическое излучение из объема на два порядка меньше объема клетки, при этом в отличие от обычного лазерного конфокального томографа из зондируемого объема измеряется молекулярное комбинационное рассеяние. Излучение лазера 2, длина волны которого попадает в полосу поглощения клетки, вызывает регулируемую оптическую гипертермию при изменении мощности этого лазера. Способ позволяет исследовать изменение спектра комбинационного рассеяния одной клетки при воздействии на нее электромагнитного излучения, когда вместо оптического лазерного излучения можно использовать низкочастотное излучение радиодиапазона (СВЧ, КВЧ), так и высокочастотное ультрафиолетовое, рентгеновское и гамма-излучение, что крайне важно для анализа уровня воздействия на раковые клетки и минимального воздействия на нормальные.
Как видно из сравнения спектров комбинационного рассеяния, представленных на фиг.4-5, гипертермия с температурой более 180°С, вызывающая локальную субклеточную карбонизацию части эритроцита, вызывает принципиальное изменение спектра комбинационного рассеяния - исчезают характерные пика гемоглобина в области 1500 см-1. Сравнение спектров комбинационного рассеяния на фиг.4 и 6 показывает, что локальная гипертермия с температурой более 50°С приводит к появлению дополнительных спектральных пиков в области 500-1500 см-1. Порог необратимого воздействия при гипертермии определяется по необратимому возникновению или исчезновению дополнительных спектральных компонент в спектре комбинационного рассеяния по сравнению со спектром без воздействия. Аналогично определяется порог по необратимому изменению спектральных компонент при воздействии на клетку электромагнитного излучения других диапазонов (радио, ультрафиолетового рентгена, гамма-излучения). Таким образом, функциональная гибель клетки определяется по необратимому изменению спектральных компонент комбинационного рассеяния по сравнению со спектром комбинационного рассеяния клетки, не подверженной воздействию электромагнитного излучения.
Известно, что колебательная спектроскопия ИК-диапазона и спектроскопия комбинационного рассеяния использует возбуждаемые светом колебательно-вращательные энергетические состояния молекул для получения информации о составе, структуре и взаимодействии молекул и их комплексов. (Д.Лукассен, П.Касперс, Х.Паппелс. Спектроскопия инфракрасного поглощения и комбинационного рассеяния кожи человека in vivo. В кн. Оптическая медицинская диагностика, ред. В.В.Тучин. - М.: Физматлит. 2007. в 2 т.). Однако ИК-спектроскопия биотканей встречает существенные ограничения, связанные с очень сильным поглощением воды, содержащейся в большинстве клеток и биотканей.
Следует отметить, что кроме процессов поглощения зондирующего излучения, оптически неоднородные биоткани сильно рассеивают оптическое излучение. Метод комбинационного рассеяния света позволяет получать соизмеримую информацию о молекулярных взаимодействиях, а использование технологии лазерного конфокальной томографии позволяет измерять оптический сигнал из регулируемого зондируемого объема, с минимальным объемом, ограниченным длиной волны, т.е. субклеточного объема.
1. Способ определения функциональной гибели клеток, характеризующийся тем, что измеряют спектр комбинационного рассеяния света от одной исследуемой клетки с помощью оптического конфокального когерентного томографа, используя зондирующее лазерное излучение с длиной волны, не попадающей в полосу поглощения хромофоров клетки, облучают клетку резонансным лазерным излучением, попадающим в полосу поглощения хромофоров клетки и вызывающим гипертермию, увеличивают интенсивность лазерного излучения до величины, вызывающей изменение спектральных компонент комбинационного рассеяния, определяют функциональную гибель клетки по пороговому уровню лазерного воздействия, при котором возникают необратимые изменения спектральных компонент комбинационного рассеяния.
2. Способ по п.1, характеризующийся тем, что резонансное облучение клетки производят с помощью воздействия УФ-излучения.
3. Способ по п.1, характеризующийся тем, что резонансное облучение производят с помощью воздействия рентгеновского излучения.
4. Способ по п.1, характеризующийся тем, что резонансное облучение производят с помощью воздействия гамма-излучения.
5. Способ по п.1, характеризующийся тем, что резонансное облучение производят с помощью воздействия СВЧ- или КВЧ-радиоизлучения.