Популяция свиней с низкими уровнями свиного эндогенного ретровируса и ее применения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, животноводства и медицины. Изобретение раскрывает способ отбора и поддержания популяции свиней, имеющих низкое число копий свиного эндогенного ретровируса, и применение таких свиней в качестве источника клеток, тканей и/или органов, пригодных для ксенотрансплантации. Изобретение позволяет получать свиней, особенно подходящих для применения в качестве доноров для ксенотрансплантации. Изобретение может быть использовано в животноводстве и медицине. 3 н. и 25 з.п. ф-лы, 1 ил., 8 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам отбора и поддержания популяции свиней с низким числом копий свиного эндогенного ретровируса и применению таких свиней в качестве источника клеток, тканей и/или органов, пригодных для ксенотрансплантации. Также изобретение относится к способам отбора клеток, тканей и/или органов от таких свиней на их пригодность для применения в ксенотрансплантации.
Уровень техники
Трансплантация органов является эффективным способом лечения конечной стадии органной недостаточности, но она существенно ограничивается недостатком донорских органов. Ежегодно большое количество людей погибает, ожидая орган. Кроме того, трудности, существующие при получении донорских органов, высокая стоимость трансплантации органов также ограничивают количество выполняемых операций по поводу трансплантации органов.
Возможность того, что животные могут быть альтернативным источником донорских органов и тканей, вызывает большие дебаты. Совершенно очевидно, что ксенотрансплантация может привести к снижению страданий и смертности, связанных с недостатком донорских органов, однако существуют вопросы безопасности, связанные с данным вмешательством. Они включают риск инфицирования реципиента ксенотрансплантата и для тех, кто имеет контакт с реципиентом и, следовательно, для больших групп населения.
Наиболее серьезным вопросом является возможность передачи возбудителей инфекции, включая микроорганизмы, от ксенотрансплантата реципиенту и последующая возможность появления новой инфекции человека и возможно заболевания. Основной причиной того, что свиньи рассматриваются в качестве животных-доноров выбора в предпочтении приматам, не относящимся к человеку, является низкая микробиологическая нагрузка, которую они несут. Следует отметить, что риск передачи микроорганизмов не является уникальным для ксенотрансплантации. Имеются сообщения о передаче микроорганизмов, вызывающих заболевания, во время аллотрансплантации.
Однако межвидовая инфекция (зооноз) имеет особое значение по сравнению с передачей инфекции внутри вида, поскольку невозможно прогнозировать поведение возбудителя инфекции у ксеногенного хозяина по его патогенности в природном хозяине. Микроорганизмы, рассматриваемые в качестве «доброкачественных» в их природном хозяине, могут привести к высокой смертности при сценарии развития зооноза. Примеры включают потенциально смертельные инфекции для людей при заражении вирусом Nipah свиней, герпесвирусом В приматов и гантавирусом грызунов (1).
Риск возникновения межвидовой инфекции также усиливается за счет того, что, как правило, у реципиента ксенотрансплантата имеется состояние иммуносупрессии.
Микроорганизмы, которые могут передаваться вместе с органом, тканью или клеточной популяцией, варьируют по их способности к инфицированию реципиента. Такие вирусы, как лимфотропный герпесвирус (PLHV), свиной цитомегаловирус (PCMV) и свиной цирковирус (PCV), которые все могут иметь очень широкое распространение в популяции свиней (см., например, пример 2), способны вызывать устойчивые инфекции, и они рассматриваются в качестве потенциально онкогенных вирусов. На основании данных по активации цитомегаловируса при трансплантации органа от свиньи примату можно предположить, что PCMV может представлять собой важный патоген у реципиентов ксенотрансплантата с иммуносупрессией (3). Также сообщалось, что PCV типа 2 может передаваться в человеческие клетки в условиях in vitro (4).
Однако наибольший риск инфицирования может возникнуть от таких микроорганизмов, которые обладают способностью передаваться в виде бессимптомных латентных микроорганизмов в органе. Такие микроорганизмы включают эндогенные ретровирусы (ERV) и герпесвирусы. Свиные эндогенные ретровирусы (PERV) являются основным источником беспокойства и представляют, возможно, наиболее важную проблему с точки зрения безопасности при ксенотрансплантации, так как сообщалось, что два из трех семейств PERV приводят к инфицированию человеческих клеток в условиях in vitro (5).
В отличие от других возбудителей инфекций, которые могут иметь место у свиней, вирусы PERV не передаются от животного животному в качестве возбудителя инфекции, а в большей степени наследуются всеми животными в качестве части их зародышевой ДНК. Таким образом, данные вирусы составляют часть генома и, следовательно, находятся в каждой клетке. Количество присутствующего вируса варьирует между видами свиней, но было установлено, что в среднем в каждой клетке находится примерно 50 копий вируса и в обычных условиях разведения невозможно удалить данные вирусы из популяций свиней (6). Таким образом, наличие инфекционных микроорганизмов и, в частности, PERV в свиных клетках представляет потенциальный барьер для будущего ксенотрансплантации.
Следовательно, было бы желательным иметь способ получения свиных клеток, тканей и/или органов, пригодных для ксенотрансплантации, которые имеют существенно более низкое число микроорганизмов, которые способны передаваться человеку-реципиенту, и тем самым существенно снизить риск развития ксенозоонозной инфекции. Конкретнее, было бы желательным получить свиные клетки, ткани и/или органы для ксенотрансплантации, которые имеют низкое число копий PERV, тем самым, сведя до минимума его передачу реципиенту ксенотрансплантата. Целью изобретения является изыскание пути достижения этой цели и/или обеспечения населения пригодным выбором.
Сущность изобретения
С удивлением было обнаружено, что стадо свиней Оклендских островов обладает уникальным преимуществом по сравнению с другими породами свиней в отношении эндогенных микроорганизмов. В частности, данное стадо включает новую подгруппу животных, которые имеют необычно низкое число копий PERV. Следовательно, полагается, что избирательное разведение таких животных будет давать потомство с дополнительно низким содержанием микроорганизмов, включая число копий PERV. Таким образом, такие свиньи будут особенно пригодными для ксенотрансплантации.
Следовательно, в первом аспекте настоящее изобретение относится к способу разведения стада свиней, которые свободны от инфекционных микроорганизмов и имеют число копий PERV в пределах от 0 до 30, где указанный способ включает стадии:
(а) отбора хряка и свиноматки из свиней Оклендских островов с благоприятным профилем микроорганизмов,
(b) спаривания хряка и свиноматки, отобранных на стадии (а),
(с) отбора потомства, полученного на стадии (b), с благоприятным профилем микроорганизмов и числом копий PERV в пределах от 0 до 30;
посредством чего потомство, отобранное на стадии (с), является пригодным для применения в ксенотрансплантации.
Хряки и/или свиноматки со стадии (b) и/или потомство со стадии (с) может иметь число копий PERV предпочтительно в пределах от 0 до 25; в пределах от 0 до 20; в пределах от 0 до 18; в пределах от 0 до 16; в пределах от 0 до 14; в пределах от 0 до 12; в пределах от 0 до 10; в пределах от 0 до 8; в пределах от 0 до 7; в пределах от 0 до 6; наиболее предпочтительно в пределах от 0 до 5.
Благоприятный профиль микроорганизмов на стадии (а) и стадии (с) включает отсутствие детектируемых количеств герпесвируса, лимфотропного герпесвируса (PLHV), свиного цитомегаловируса (PCMV), вируса энцефаломиокардита (EMCV), свиного цирковируса (PCV), вируса гепатита Е (HEV), токсоплазм, эперитрозоонов, бактерий рода Brucella, бактерий рода Listeria, микобактерий ТВ, бактерий рода Leptospira, Haemophilus suis, любого вируса, вызывающего респираторно-репродуктивный синдром, любого вируса бешенства, любого вируса ложного бешенства, парвовируса, вируса энцефаломиокардита, любого вируса, вызывающего везикулярную болезнь свиней, свиного полиовируса (тешен), любого вируса, вызывающего гемагглютинирующий энцефаломиокардит, вируса свиного гриппа типа А, аденовируса, вируса трансмиссивного гастроэнтерита и вируса везикулярного стоматита.
Хряков и свиноматок потомства, отобранного на стадии (с), можно спарить на стадии (b) с получением дополнительного потомства для применения в ксенотрансплантации для поддержания стада.
Способ может необязательно включать дополнительный скрининг в отношении определенных групп крови для совместимости с потенциальным реципиентом ксенотрансплантата или совместимости с антигенным профилем сыворотки, используемой для культивирования в условиях in vitro, в целях снижения отторжения ткани и/или повреждения клеток в результате иммунных реакций.
Предпочтительно свиньи, отобранные на стадии (а), и более предпочтительно потомство, отобранное на стадии (с), имеют группу крови О.
Предпочтительно у свиней, отобранных на стадии (а), и более предпочтительно у потомства, отобранного на стадии (с), отсутствует PERV-C.
Более предпочтительно свиньи, отобранные на стадии (а), и еще более предпочтительно потомство, отобранное на стадии (с), имеют группу крови О и у них отсутствует PERV-C.
Способ может необязательно включать дополнительный скрининг в отношении иммуногенных антигенов, присутствующих на поверхности клеток, таких как антиген МНС группы I, вновь в целях снижения отторжения органов, тканей или клеток или повреждения в условиях in vivo или in vitro.
Изобретение дополнительно относится к одной или более свиньям, полученным способом по изобретению.
Во втором аспекте настоящее изобретение относится к одной или более свиньям, свободным от инфекционных микроорганизмов и имеющим число копий PERV в пределах от 0 до 30, где указанная одна или более свиней получены способом, включающим стадии:
(а) отбора хряка и свиноматки из свиней Оклендских островов с благоприятным профилем микроорганизмов,
(b) спаривания хряка и свиноматки, отобранных на стадии (а),
(с) отбора потомства, полученного на стадии (b), с благоприятным профилем микроорганизмов и числом копий PERV в пределах от 0 до 30.
В третьем аспекте настоящее изобретение относится к одной или более свиньям, свободным от инфекционных микроорганизмов и имеющим число копий PERV в пределах от 0 до 30 и группу крови О и/или у которых отсутствует PERV-С, где указанная одна или более свиней получены способом, включающим стадии:
(а) отбора хряка и свиноматки из свиней Оклендских островов с благоприятным профилем микроорганизмов,
(b) спаривания хряка и свиноматки, отобранных на стадии (а),
(с) отбора потомства, полученного на стадии (b), с благоприятным профилем микроорганизмов и числом копий PERV в пределах от 0 до 30.
В другом аспекте настоящее изобретение обеспечивает органы, ткани или клетки, выделенные от одной или более свиней, полученных способом по изобретению, где указанные органы, ткани или клетки свободны от инфекционных микроорганизмов, имеют число копий PERV в пределах от 0 до 30 и являются особенно пригодными для трансплантации ксеногенному субъекту, включая человека.
Предпочтительно один или более органов, тканей или клеток выделяют от одной или более свиней, где указанные одна или более свиней представляют новорожденных поросят в возрасте от 7 до 21 суток.
Органы, ткани и клетки можно отобрать или выделить из группы, состоящей из печени, легких, сердца, мозга, поджелудочной железы, мышц, крови, кости, семенников и яичников.
Предпочтительно органы для ксенотрансплантации целого органа выбраны из печени, легких и сердца.
Предпочтительно ткани и клетки для ксенотрансплантации выбраны из островков Лангерганса поджелудочной железы, гепатоцитов, непаренхиматозных клеток печени, эпителиальных клеток желчного пузыря, эндотелиальных клеток желчного пузыря, эпителиальных клеток желчных протоков, эндотелиальных клеток желчных протоков, эпителиальных клеток сосудов печени, эндотелиальных клеток сосудов печени, синусоидных клеток, клеток сосудистого сплетения, клеток Сертоли, хромаффинных клеток надпочечников и мышечных клеток.
Настоящее изобретение также относится к имплантируемой композиции, содержащей, по меньшей мере, один выделенный орган, ткань или клетку свиньи по настоящему изобретению вместе с фармацевтически приемлемым носителем.
Композиция может дополнительно включать питающие клетки, такие как фибробласты или клетки Сертоли, выделенные от свиней, полученных способом по изобретению.
Изобретение дополнительно относится к применению, по меньшей мере, одного выделенного органа, ткани или клетки, выделенных от одной или более свиней, полученных способом по изобретению, где указанный орган, ткань или клетка свободны от инфекционных микроорганизмов и имеют число копий PERV в пределах от 0 до 30, в получении имплантируемой композиции или средства для лечения пациента, страдающего или предрасположенного к развитию заболевания, нарушения или состояния, ассоциированного с недостаточностью или отсутствием функции органа.
Предпочтительно, по меньшей мере, один выделенный орган, ткань или клетка выделены от новорожденного поросенка в возрасте от 7 до 21 суток.
По дополнительному аспекту изобретения обеспечивается способ лечения пациента, страдающего или предрасположенного к развитию заболевания, нарушения или состояния, ассоциированного с недостаточностью или отсутствием функции органа, ткани или клетки, включающий имплантацию пациенту, нуждающемуся в этом, органа, ткани или клетки, выделенных от одной или более свиней, полученных способом по изобретению.
По дополнительному аспекту изобретения обеспечивается способ лечения пациента, страдающего или предрасположенного к развитию заболевания, нарушения или состояния, ассоциированного с недостаточностью или отсутствием функции органа, включающий введение эффективного количества одной или более имплантируемых композиций по изобретению пациенту, нуждающемуся в этом.
В одном варианте осуществления недостаточность или отсутствие относится к функции печени, и имплантируемая композиция содержит гепатоциты, непаренхиматозные клетки печени, клетки желчного пузыря, клетки желчных протоков, клетки сосудов печени или синусоидные клетки. В альтернативном варианте осуществления указанная недостаточность или отсутствие относится к функции поджелудочной железы, и имплантируемая композиция содержит клетки островков Лангерганса поджелудочной железы. В альтернативном варианте осуществления указанная недостаточность или отсутствие относится к неврологической функции, и имплантируемая композиция содержит клетки сосудистого сплетения.
В широком смысле можно сказать, что данное изобретение состоит из частей, элементов и признаков, относящихся или указанных в описании заявки, индивидуально или в совокупности, и любой или всех комбинаций любых двух или более указанных частей, элементов или признаков, где указанные целые числа, которые упомянуты здесь, имеют эквиваленты, известные в данной области, к которой относится данное изобретение, такие известные эквиваленты предполагаются для включения здесь, как это представлено ниже.
Краткое описание фигур
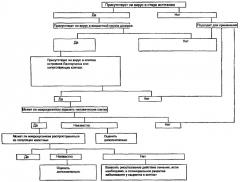
На чертеже представлен в виде схемы способ идентификации вируса в популяции свиней и, таким образом, средство отбора подходящих хряка и свиноматки для разведения и поддержания стада свиней по настоящему изобретению.
Подробное описание изобретения
Настоящее изобретение относится к отбору донорного стада свиней, которые свободны от инфекционных микроорганизмов и, в частности, имеют число копий PERV в пределах от 0 до 30 (и предпочтительно в пределах от 0 до 30). Такие свиньи будут представлять особенно подходящий источник органов, тканей и клеток для ксенотрансплантации.
Ранее предпринимались попытки получить свиней, подходящих для ксенотрансплантации. Например, в патенте США № 6867347 (6) раскрывается стадо инбредных свиней с дефектом в отношении передачи свиного эндогенного ретровируса (PERV). Однако среднее число копий PERV в данном стаде является высоким, составляющим примерно 50 копий вируса в каждой клетке. Кроме того, не раскрывается статус данного стада в отношении инфекционных микроорганизмов, и остается неизвестным, насколько данные свиньи свободны от распространенных свиных вирусов PCMV, PLHV, EMCV, HEV И PCV типа 1 и типа 2.
Аналогично, в патенте США № 6469229 (7) раскрываются инбредные минисвиньи, которые являются гомозиготными в отношении гаплотипа главного комплекса гистосовместимости. Однако вновь среднее число копий PERV в данном стаде является высоким, и не раскрывается статус данного стада в отношении инфекционных микроорганизмов, не указывается, что данные свиньи свободны от всех распространенных свиных вирусов, описанных выше.
С удивлением в настоящее время заявители установили, что новозеландская инбредная линия свиней имеет очень низкое число копий широко распространенного ретровируса, свиного эндогенного ретровируса (PERV). Данная линия свиней также свободна от вирусов, возбудителей распространенных инфекций свиней, включая PCMV, PLHV, EMCV, HEV И PCV.
Данная линия постоянно обитает на отдаленных Оклендских островах, субантарктической группе островов, принадлежащих Новой Зеландии, которые в течение примерно 200 лет являются очень изолированными, и она относится здесь к свиньям AI.
Сообщалось, что эндогенные ретровирусы (ERV) являются составляющим компонентом нормальной ДНК у каждого вида позвоночных, включая свиней и людей. Нормальный цикл развития ретровирусов включает стабильную интеграцию генетического материала ретровирусов в хромосомную ДНК клетки-хозяина. В тех случаях, когда клетка представляет собой клетку зародышевой линии, то нуклеиновокислотный материал вируса (или провирус) будет затем наследоваться всем потомством обычным образом, как в случае любого другого гена согласно менделевским законам. Было высказано предположение, что если конкретный провирус присутствует в ДНК клетки зародышевой линии, то потомство при избирательном неблагоприятном положении не будет выживать в течение эволюционных периодов времени и не ожидается присутствие данного ERV в последующем пуле генов. Присутствие ERV в настоящее время в зародышевой линии животных не является патогенным для их собственных видов. Отдельные локусы ERV также имеют тенденцию к дефектной репликации за счет мутаций, имеющихся в их геноме. Однако также было высказано предположение, что существует вероятность того, что отдельные дефектные локусы будут взаимодействовать посредством комплементации и рекомбинации с образованием инфекционного вируса. Несмотря на то что ERV могут быть не патогенными для их обычных видов хозяев, те же самые вирусы могут изменять их патогенность при межвидовой передаче.
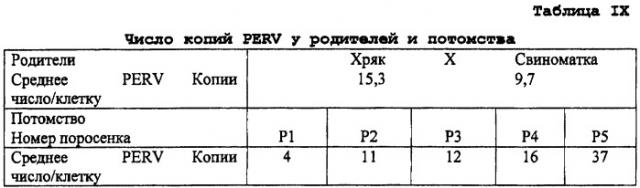
Утверждалось, что все свиные клетки, включая выделенные от минисвиней NIH, Yucatan, свиней многих пастбищных пород и животных, используемых в настоящее время в клинических испытаниях, за единственным исключением в отношении клеточной линии ST-IOWA, продуцируют PERV, способный к инфицированию и репликации в человеческих клетках (6). Позднее клетки от различных пород свиней оценивали на присутствие инфекционных частиц PERV, и было идентифицировано несколько из них, которые не содержали инфекционные частицы PERV, например, см. представленные в таблице I ниже.
| Таблица I Присутствие инфекционных частиц PERV у различных пород свиней | ||
| Порода свиней | Клетки | Инфекционный PERV |
| Ландрас | Эндотелиальные клетки | + |
| Ландрас | Клетки островков Лангерганса | + |
| Крупная белая/ландрас | Клетки островков Лангерганса | + |
| Минисвиньи | PBMC | + |
| Крупная белая | Клетки островков Лангерганса | - |
| Йоркширская | PBMCНейроны плодов | - |
| Минисвиньи D/D | PBMC | - |
| Камбруг | РВМС, клетки Сертоли, клетки островков Лангерганса | - |
| РВМС=мононуклеарные клетки периферической крови |
Кроме того, утверждалось, что несмотря на то, что применение программы по разведению животных, свободных от специфических патогенов (SPF), будет приводить к элиминации большей части патогенов, которые могут передаваться во время ксенотрансплантации, такие патогены, как PERV, которые передаются через зародышевую линию, не будут подвергаться элиминации, и в результате одним из потенциальных рисков при применении органов свиней будет передача таких патогенов (6).
Является принципиально важным, что в настоящее время заявители установили, что свиньи AI, описанные здесь, имеют необычно низкое число копий свиного эндогенного ретровируса (PERV), значение которого ниже по сравнению с ранее имеющимися сообщениями. Кроме того, в результате проведенных экспериментов не было показано ни продукции инфекционных частиц PERV, ни передачи PERV в условиях in vitro с использованием совместного культивирования или не наблюдали передачу в условиях in vivo реципиентам ксенотрансплантатов при использовании клеток от свиней AI, отобранных способами по настоящему изобретению.
Следовательно, в первом аспекте настоящее изобретение относится к способу разведения стада свиней, которые свободны от инфекционных микроорганизмов и имеют число копий PERV в пределах от 0 до 30, где указанный способ включает стадии:
(а) отбора хряка и свиноматки из свиней Оклендских островов с благоприятным профилем микроорганизмов,
(b) спаривания хряка и свиноматки, отобранных на стадии (а),
(с) отбора потомства, полученного на стадии (b), с благоприятным профилем микроорганизмов и числом копий PERV в пределах от 0 до 30;
посредством чего потомство, отобранное на стадии (с), является пригодным для применения в ксенотрансплантации.
Существует три различные группы PERV: PERV-А, PERV-В и PERV-С. Три группы различаются по области оболочки PERV. Вирусная оболочка представляет основную детерминанту ряда хозяев и имеет значение для инфицирования. Два основных типа свиного ретровируса, PERV-А и PERV-В, широко распространены среди различных пород свиней (8). Вирусы PERV-А и PERV-В имеют более широкий ряд хозяев, включая несколько человеческих клеточных линий, по сравнению с вирусами PERV-С, которые приводят к заражению только двух свиных клеточных линий (9). Недавно было показано, что PERV-А и PERV-C могут подвергаться рекомбинации и образовывать вариант с новыми инфекционными характеристиками (10).
Было бы желательным, чтобы у свиньи-донора отсутствовал PERV-С для предупреждения любой возможной рекомбинации с существующим PERV-А. Предпочтительно, чтобы процесс отбора включал разведение свиней, у которых отсутствует вариант PERV-С, и/или отбор донорного потомства, у которого отсутствует вариант PERV-С.
Свиней, свободных от инфекционных микроорганизмов, и их поддержание проводят способами, хорошо известными в животноводстве для сведения до минимума проникновения потенциальных патогенов. Такие способы включают барьерное содержание и изоляцию в дополнение к специализированным методам разведения, таким как гистеротомия в подходящих единицах содержания. Предпочтительно поддержание свободного от инфекционных микроорганизмов статуса стада включает регулярное обследование поголовья на наличие инфекционных микроорганизмов. Методы определения присутствия или отсутствия инфекционных микроорганизмов являются хорошо известными в данной области, и они включают иммунологические тесты и тесты анализа нуклеиновых кислот, такие как методы на основе ПЦР.
Методы определения присутствия или отсутствия инфекционных микроорганизмов можно использовать для оценки профиля микроорганизмов у животного, например для установления его пригодности для включения в способ разведения по изобретению или его использования в качестве донора ксенотрансплантата. Благоприятный профиль в отношении микроорганизмов на стадии (а) и стадии (с) включает отсутствие детектируемых количеств герпесвируса, PLHV, PCMV, EMCV, PCV, HEV, токсоплазм, эперитрозоонов, бактерий рода Brucella, бактерий рода Listeria, микобактерий ТВ, бактерий рода Leptospira, Haemophilus suis, любого вируса, вызывающего респираторно-репродуктивный синдром, любого вируса бешенства, любого вируса ложного бешенства, парвовируса, вируса энцефаломиокардита, любого вируса, вызывающего везикулярную болезнь свиней, свиного полиовируса (тешен), любого вируса, вызывающего гемагглютинирующий энцефаломиокардит, вируса свиного гриппа типа А, аденовируса, вируса трансмиссивного гастроэнтерита и вируса везикулярного стоматита.
Примерный способ определения пригодности потенциального донорного стада для ксенотрансплантации представлен на чертеже. Данный примерный способ включает определение того, присутствует ли патоген в стране источника, и если да, то в стаде источника. Если он находится в стаде источника, то следует установить, присутствует ли патоген в донорной группе и, в частности, в органах, тканях или клетках, предназначенных для трансплантации. Также является важным установить, насколько патоген может передаваться в клетку-реципиент, например человеческую клетку, и, таким образом, реципиенту, например человеку.
Применение отобранных животных и, в частности, потомства в результате такого разведения в качестве источника донорного стада для ксенотрансплантации является предпочтительным, поскольку низкое число копий PERV с сочетании с отсутствием передаваемого PERV безопаснее по сравнению с использованием доноров с более высоким числом копий PERV.
Заявители полагают, без желания связываться с какой-либо теорией, что при применении способа разведения по изобретению, например, многократным образом будет возможно разводить и отбирать потомство от каждого последующего поколения с еще более низким числом копий PERV. Кроме того, заявители полагают, вновь без желания связываться с какой-либо теорией, что таким образом будет возможно разводить и отбирать потомство без наличия копий PERV в их геноме.
Свиньи AI, описанные здесь, также свободны от ряда свиных вирусов с эндемичным или широким распространением среди популяций свиней во всем мире.
Например, свиной цитомегаловирус (PCMV) представляет собой бета-герпесвирус (семейства Herpesviridae), и он считается повсеместно распространенным вирусом, которым заражено, по меньшей мере, 98% всех обследованных свиней в Великобритании (11). PCMV выделили из дыхательных путей свиней, и он может быть ассоциирован с атрофическим ринитом или ринитом с включениями, распространенным синдромом, поражающим в последнее время поросят-отъемышей. Синдром чихания после отъема и признаки легкого ринита являются очень частыми явлениями у поросят в Новой Зеландии. Важное значение инфекции, вызванной человеческим CMV, у реципиентов аллогенных трансплантатов поднимает вопрос о том, что свиной цитомегаловирус может вести себя аналогично у реципиентов ксенотрансплантатов (12).
Важно, что заявители установили, что стадо AI, описанное здесь, свободно от PCMV. Следовательно, не может происходить передачи PCMV с органами, тканями или клетками, полученными от донорного стада AI, реципиенту ксенотрансплантата.
В другом примере сообщалось, что инфекция, вызываемая свиным лимфотропным герпесвирусом (PLHV), является эндемичной при наличии вируса в товарных стадах (13). PLHV относится к подсемейству гамма-герпесвирусов (Herpesviridae). Основные свойства данных герпесвирусов, включая инфекционность для других видов, еще не установлены. В филогенетическом отношении они очень близки к овечьему и бычьему лимфотропным герпесвирусам, которые вызывают лимфопролиферативное заболевание у их хозяев (14).
Важно, что заявители установили, что стадо AI, описанное здесь, свободно от PLHV. Следовательно, не может происходить передачи PLHV с органами, тканями или клетками, полученными от донорного стада AI, реципиенту ксенотрансплантата.
Вирус энцефаломиокардита (EMCV) (Picornaviridae) является широко распространенным вирусом, относящимся к роду Cardiovirus. Полагают, что имеет место межвидовое инфицирование EMCV и свиной EMCV может приводить к заражению человеческих клеток миокарда (15). Сообщалось, что EMCV имеет место в Новой Зеландии (16).
Заявители установили, что стадо AI, описанное здесь, свободно от EMCV. Следовательно, не может происходить передачи EMCV с органами, тканями или клетками, полученными от донорного стада AI, реципиенту ксенотрансплантата.
Недавно вирус гепатита Е (HEV) удалили из семейства Caliciviridae, и в настоящее время он не классифицирован. Появляется все больше доказательств того, что свиной HEV может быть зоонозным. Следовательно, данный вирус должен быть исключен перед использованием ткани для ксенотрансплантации.
Заявители установили, что стадо AI, описанное здесь, свободно от HEV. Следовательно, не может происходить передачи HEV с органами, тканями или клетками, полученными от донорного стада AI, реципиенту ксенотрансплантата.
Свиной цирковирус (PCV) принадлежит к семейству Circiviridae. Впервые свиной цирковирус был открыт в 1974 в качестве загрязнителя стабильной клеточной линии свиных почечных клеток, РК15 (17), и сообщались результаты последующих серологических исследований сыворотки крови свиней из Германии, Канады, Новой Зеландии, Великобритании, Северной Ирландии и США, свидетельствующие о том, что в 25-98% из них были обнаружены антитела против PCV1 у откормочных и взрослых свиней (18). Было высказано предположение, что инфицирование PCV является широко распространенным во всем мире. Не было установлено ассоциированного с ним заболевания. Однако имеется несколько противоречивых сообщений о зоонозных свойствах свиного цирковируса. Сообщалось об антителах против PCV типа 1 у человека, мышей и крупного рогатого скота (18). Сообщалось, что примерно 20% здоровых взрослых людей и 30% госпитализированных пациентов в Германии и 24% госпитализированных пациентов в Канаде являются серопозитивными на PCV-подобный антиген. Однако ни у одного вида млекопитающих, иного, чем свиньи, ни вирус, ни вирусный геном не были детектированы. Было высказано предположение, что антитела против PCV1, обнаруженные у людей или других видов, могут быть неспецифическими.
У свиней с мультисистемным синдромом истощения, возникающим после отъема (PMWS), был обнаружен новый штамм свиного цирковируса, названный свиным цирковирусом типа 2 (19). Чаще всего PMWS поражает 5-12-недельных поросят, и он характеризуется прогрессирующей потерей массы тела, желтухой и симптомами со стороны дыхательной системы. Позднее PCV2 был ассоциирован с миокардитом у мертворожденных поросят (20). Совершенно ясно, что необходимо проведение дополнительных исследований для выяснения патогенеза ассоциированных с PCV2 заболеваний у свиней. Сообщалось, что PCV2 может инфицировать человеческие клетки в условиях in vitro (21) и мышей Balb/c в эксперименте (22). Данный установленный факт имеет особое значение для ксенотрансплантации и связан с риском инфицирования.
Заявители установили, что стадо AI, описанное здесь, свободно от PCV1 и PCV2. Следовательно, не может происходить передачи PCV1 и PCV2 с органами, тканями или клетками, полученными от донорного стада AI, реципиенту ксенотрансплантата.
Заявители также установили, что стадо AI, описанное здесь, свободно от возбудителей инфекционных везикулярных заболеваний, которые поражают свиней (ящура, везикулярного стоматита, везикулярной экзантемы и везикулярной болезни свиней), бешенства, Brucella suis, свиной лихорадки, ложного бешенства и губчатых энцефалопатий, в дополнение к 45 другим патогенам, многие из которых создают актуальные проблемы в ветеринарной практике. Очевидно, понятно, что стадо AI, описанное здесь, имеет характеристики, способные обеспечить отдельных животных, выбранных из них как пригодных для использования, в качестве источника донорного стада для ксенотрансплантации.
Способы установления или определения числа копий PERV включают различный скрининг генома и другие методы, известные в данной области, в качестве подходящих для установления или определения числа копий определенной нуклеиновокислотной последовательности в геноме организма. Примеры таких методов представлены здесь в примерах.
Настоящее изобретение дополнительно относится к органам, тканям или клеткам, выделенным от одной или более свиней, полученных способом по изобретению, где указанные органы, ткани или клетки свободны от инфекционных микроорганизмов и имеют число копий PERV в пределах от 0 до 30, и они особенно пригодны для трансплантации ксеногенному субъекту, включая человека.
Указанные одна или более свиней свободны от инфекционных микроорганизмов, в том числе патогенов, которые поражают людей, и они включают, но не ограничиваются ими, один или более патогенов из следующих групп патогенов: паразиты, бактерии, микоплазмы и вирусы. Свинья может быть свободна, например, от таких паразитов, как токсоплазмы и эперитерозооны или микоплазмы, такие как M. hyopneumonia. Примеры бактерий, от которых могут быть свободны свиньи, включают бактерии рода Brucella, бактерии рода Listeria, микобактерии ТВ, бактерии рода Leptospira и Haemophilus suis. Кроме того, свиньи могут быть свободны от вирусов, таких как зоонозные вирусы, вирусы, которые могут проникать через плаценту у супоросных свиноматок, и нейротропных вирусов. Зоонозные вирусы, например, включают вирус, относящийся к группе вирусов бешенства, герпесподобный вирус, который вызывает ложное бешенство, вирус энцефаломиокардита, вирус гриппа типа А, вирус трансмиссивного гастроэнтерита, вирус парагриппа 3 и вирус везикулярного стоматита. Вирусы, которые могут проникать через плаценту, включают, например, вирусы, которые вызывают респираторно-репродуктивный синдром у свиней, вирус, относящийся к группе вирусов бешенства, герпесподобный вирус, который вызывает ложное бешенство, парвовирус, вирус, который вызывает везикулярную болезнь у свиней, тешен (свиной полиовирус), вирус гемагглютинирующего энцефаломиокардита, цитомегаловирус, вирус оспы свиней и вирус гриппа типа А. Нейротропные вирусы включают, например, вирус, относящийся к группе вирусов бешенства, герпесподобный вирус, который вызывает ложное бешенство, парвовирус, вирус энцефаломиокардита, вирус, который вызывает везикулярную болезнь у свиней, свиной полиовирус (тешен), вирус, вызывающий гемагглютинирующий энцефаломиокардит, аденовирус, вирус парагриппа 3. Конкретные примеры вирусов, от которых свиньи свободны, включают: вирус, который вызывает (или приводит к развитию) респираторно-репродуктивный синдром, вирус, относящийся к группе вирусов бешенства, герпесподобный вирус, который вызывает ложное бешенство, парвовирус, вирус энцефаломиокардита, вирус, который вызывает везикулярную болезнь у свиней, свиной полиовирус (тешен), вирус, вызывающий гемагглютинирующий энцефаломиокардит, цитомегаловирус, вирус гриппа А у свиней, аденовирус, вирус трансмиссивного гастроэнтерита, вирус, вызывающий вирусную диарею крупного рогатого скота, и вирус везикулярного стоматита.
В одном варианте осуществления указанная одна или более свиней свободны от следующих микроорганизмов: герпесвируса, токсоплазм, эперитрозоон, бактерий рода Brucella, бактерий рода Listeria, микобактерий ТВ, бактерий рода Leptospira, Haemophilus suis, любого вируса, вызывающего респираторно-репродуктивный синдром у свиней, любого вируса, вызывающего бешенство, любого вируса, вызывающего ложное бешенство, парвовируса, вируса энцефаломиокардита, любого вируса, вызывающего везикулярную болезнь свиней, свиного полиовируса (тешен), любого вируса, вызывающего гемагглютинирующий энцефаломиокардит, вируса оспы свиней, вируса гриппа типа А, аденовируса, вируса трансмиссивного гастроэнтерита и вируса везикулярного стоматита.
Органы, ткани или клетки, выделенные от указанной одной или более свиней, можно получить от эмбрионов (т.е. плодов), новорожденных (в неонатальном периоде) или взрослых свиней. В большинстве случаев, когда орган свиньи предназначен для ксенотрансплантации, то предпочтительно можно использовать орган взрослой свиньи, поскольку его большие размеры делают его более подходящим для извлечения, обращения и имплантации.
Ткани и клетки новорожденных, как правило, будут особенно предпочтительными для ксенотрансплантации, поскольку их извлечение, как правило, является менее проблематичным по сравнению с таковыми у плодов, кроме того, выживаемость после выделения, например в культуре ткани или после ксенотрансплантации, обычно выше по срав