Применение ремиелинизирующего средства для стимуляции нервных клеток при демиелинизирующем заболевании
Иллюстрации
Показать всеИзобретение относится к области медицины. Изобретение раскрывает применение ремиелинизирующего средства для получения лекарственного средства в количестве, стимулирующем ремиелинизацию нервных клеток млекопитающего, для лечения демиелинизирующего заболевания и способ стимуляции ремиелинизации нервных клеток у млекопитающего, где лекарственное средство вводят постоянно нуждающемуся в этом млекопитающему; постоянное введение ремиелинизирующего средства представляет собой еженедельное или ежемесячное введение в течение периода, по меньшей мере, равного шести месяцам; и ремиелинизирующее средство представляет собой антитело или его иммунологически активный фрагмент, связывающийся с альфа-4-интегрином, и, в частности, антитело представляет собой моноклональное антитело натализумаб или его иммунологически активный фрагмент. 2 н. и 24 з.п. ф-лы, 20 табл., 18 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение, в общем, относится к композициям, соединениям, которые могут использоваться для лечения демиелинизирующих заболеваний и состояний и/или снижения паралича у пациента.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Воспаление является ответом васкуляризованных тканей на инфекцию или повреждение и вызвано адгезией лейкоцитов к эндотелиальным клеткам и их инфильтрацией в окружающие ткани. При нормальном воспалении инфильтрирующие лейкоциты высвобождают токсические медиаторы для уничтожения вторгшихся организмов, фагоцитируют дебрис и погибшие клетки, и играют роль в восстановлении тканей и иммунном ответе. Однако при патологическом воспалении инфильтрирующие лейкоциты реагируют избыточно и могут вызывать серьезное или фатальное повреждение. См., например, Hickey, Psychoneuroimmunology II (Academic Press 1990).
Интегрины представляют собой семейство гликопротеинов клеточной поверхности, участвующих в клеточной адгезии, миграции и активации иммунных клеток. Альфа-4-интегрин экспрессируется всеми циркулирующими лейкоцитами кроме нейтрофилов и образует гетеродимерные рецепторы в связи с бета-1 (β1) или бета-7 (β7) интегриновыми субъединицами; альфа-4-бета-1(α4β1) и альфа-4-бета-7 (α4β7) играют роль в миграции лейкоцитов по сосудистому эндотелию (Springer et al., Cell 1994, 76: 301-14; Butcher et al., Science 1996, 272: 60-6) и вносят вклад в активацию и выживание клеток в паренхиме (Damle et al., J Immunol. 1993; 151: 2368-79; Koopman et al., J. Immunol. 1994, 152: 3760-7; Leussink et al., Acta Neuropathol, 2002, 103:131-136). α4β1 конститутивно экспрессируется на лимфоцитах, моноцитах, макрофагах, тучных клетках, базофилах и эозинофилах.
Альфа-4-бета-1 (также известный как очень поздний антиген-4, VLA-4) связывается молекулой адгезии сосудистых клеток-1 (Lobb et al., J. Clin. Invest. 1994, 94: 1722-8), которая экспрессируется сосудистым эндотелием во многих участках хронического воспаления (Bevilacqua et al., 1993 Annu. Rev. Immunol. 11: 767-804; Postigo et al. 1993 Res. Immunol. 144: 723-35). α4β1 имеет другие лиганды, включая фибронектин и другие компоненты внеклеточного матрикса (ECM).
Димер альфа-4-бета-7 взаимодействует с адрессином - молекулой клеточной адгезии слизистой (MAdCAM-1), и опосредует хоуминг лимфоцитов в кишечник (Farstad et al., 1997 Am. J. Pathol. 150: 187-99; Issekutz, 1991 J.Immunol. 147: 4178-84). Экспрессия MAdCAM-1 на сосудистом эндотелии также повышена в участках воспаления в кишечном тракте пациентов с воспалительным заболеванием кишечника (IBD) (Briskin et al., 1997 Am. J.Pathol. 151: 97-110).
Молекулы адгезии, такие как альфа-4-интегрины, являются потенциальными мишенями для терапевтических средств. Например, рецептор VLA-4, субъединицей которого является альфа-4-интегрин, является важной мишенью из-за его взаимодействия с лигандом, находящимся на эндотелиальных клетках головного мозга. Заболевания и состояния, являющиеся результатом воспаления головного мозга, имеют особо тяжелые последствия. В другом примере димер интегрина альфа-4-бета-7 является важной мишенью вследствие его вовлечения в хоуминг лимфоцитов и патологическое воспаление желудочно-кишечного тракта.
Альфа-4-бета-1 интегрин экспрессирован на внеклеточной поверхности активированных лимфоцитов и моноцитов, которые были задействованы в патогенез острых воспалительных повреждений головного мозга и нарушение гемато-энцефалического барьера (ГЭБ), связанное с рассеянным склерозом (РС) (Coles et al., 1999 Ann. Neurol. 46 (3): 296-304). Средства, направленные против интегрина альфа-4, тестировали на их противовоспалительный потенциал in vitro и in vivo. См. Yednock et al., Nature 1992, 356: 63-66; патент США № 5840299, выданный Bendig et al. 24 ноября 1998 г., и патент США № 6001809, выданный Thorsett et al. 14 декабря 1999 года. Эксперименты in vitro демонстрируют, что антитела против интегрина альфа-4 блокируют присоединение лимфоцитов к эндотелиальным клеткам головного мозга. Эксперименты, в которых тестируется действие антител против альфа-4 интегрина на животных, имеющих искусственно индуцированное состояние, имитирующее рассеянный склероз, экспериментальный аутоиммунный энцефаломиелит (EAE), продемонстрировали, что введение антител против альфа-4 интегрина предотвращает воспаление головного мозга и последующий паралич у животных. Во всех данных экспериментах антитела против альфа-4 интегрина выявляются как терапевтические средства, которые потенциально могут использоваться для лечения рассеянного склероза и других воспалительных заболеваний и нарушений.
К настоящему времени не было открыто каких-либо способов лечения, которые бы ингибировали или предотвращали демиелинизацию, не говоря о средствах, которые способствовали ремиелинизации. Например, влияние рассеянного склероза на здравоохранение и затраты на него превышают таковые для других демиелинизирующих заболеваний. Для РС не существует эффективного способа лечения. Это заболевание, которое поражает преимущественно молодых взрослых людей (т.е. в среднем возрасте 30 лет) с частотой 1 случай на 1000 субъектов. Экспериментальный аутоиммунный энцефаломиелит является основной моделью, используемой для изучения РС на животных. Однако, в отличие от EAE, РС представляет собой аутоиммунное заболевание, причина которого неизвестна. Прогрессирование заболевания характеризуется вбросом иммунных клеток в центральную нервную систему, которое время от времени приводит к отеку, демиелинизации, повреждению и утрате аксонов.
Необходимы новые соединения, композиции и способы применения данных соединений и композиций для ингибирования демиелинизации, для стимуляции ремиелинизации и/или для лечения паралича, ассоциированного с демиелинизацией, и их продолжают искать для лечения таких заболеваний, как РС, а также других демиелинизирующих заболеваний, связанных с воспалением.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Основываясь на указанном выше, необходимы новые композиции и способы лечения данных заболеваний, которые будут эффективно лечить или ингибировать данные заболевания, так что пациенты смогут достигать большей продолжительности жизни и более высокого ее качества.
Изобретение относится к способам стимуляции ремиелинизации нервных клеток млекопитающего, охватывающим введение млекопитающему ремиелинизирующего средства в эффективном для ремиелинизации количестве. Предпочтительно, млекопитающее по способам настоящего изобретения является человеком, и данный человек страдает от состояния, которое демиелинизирует клетки.
Состояния, которые демиелинизируют клетки, по настоящему изобретению включают в себя рассеянный склероз, врожденное метаболическое заболевание, невропатию с аномальной миелинизацией, демиелинизацию, индуцированную лекарственными средствами, демиелинизацию, индуцированную облучением, наследственное демиелинизирующее состояние, индуцированное прионами демиелинизирующее состояние, демиелинизацию, индуцированную энцефалитом, или повреждение спинного мозга. Предпочтительно, состояние представляет собой рассеянный склероз.
Изобретение далее относится к композиции, содержащей терапевтически эффективное количество ремиелинизирующего средства, которое предотвращает демиелинизацию и/или стимулирует ремиелинизацию при введении нуждающемуся в этом субъекту.
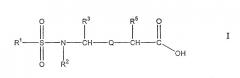
В способах и композициях по изобретению ремиелинизирующее средство может представлять собой антитело, иммунологически активный фрагмент антитела, соединение или их комбинации. Антитело или его иммунологически активный фрагмент предпочтительно представляет собой натализумаб (Antegren®) или его иммунологически активный фрагмент.
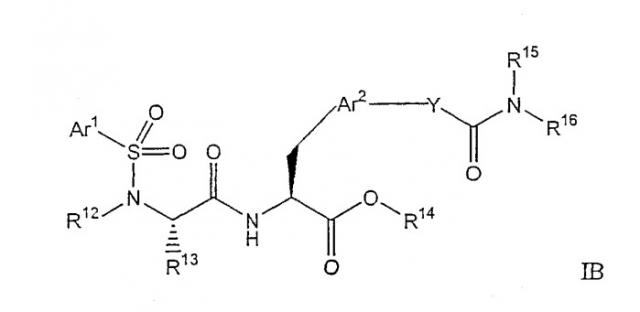
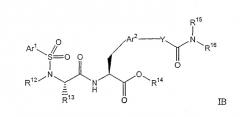
В способах и композициях по изобретению ремиелинизирующее средство может представлять собой низкомолекулярное соединение формулы I, IA, IB, IC, II, IIA или IIB. Предпочтительно, соединения представляют собой соединения следующей формулы IB
в которой:
Ar1 выбран из группы, состоящей из арила, замещенного арила, гетероарила и замещенного гетероарила;
Ar2 выбран из группы, состоящей из арила, замещенного арила, гетероарила и замещенного гетероарила; R12 выбран из группы, состоящей из алкила, замещенного алкила, циклоалкила и замещенного циклоалкила, или R12 и R13 вместе с атомом азота, связанным с R12, и атомом углерода, связанным с R13, образуют гетероциклическую или замещенную гетероциклическую группу;
R13 выбран из группы, состоящей из водорода, алкила и замещенного алкила, или R12 и R13 вместе с атомом азота, связанным с R12, и атомом углерода, связанным с R13, образуют гетероциклическую или замещенную гетероциклическую группу;
R14 выбран из группы, состоящей из водорода, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, арила и замещенного арила;
R15 выбран из группы, состоящей из алкила и замещенного алкила, или R15 и R16 вместе с атомом азота, с которым они связаны, образуют гетероциклическую или замещенную гетероциклическую группу;
R16 выбран из группы, состоящей из алкила и замещенного алкила, или R15 и R16 вместе с атомом азота, с которым они связаны, образуют гетероциклическую или замещенную гетероциклическую группу; и
Y выбран из группы, состоящей из -O-, -NR100-, и -CH2-, в котором R100 представляет водород или алкил;
и их фармацевтически приемлемые соли.
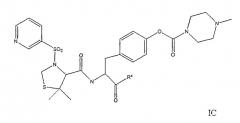
В дальнейшем осуществлении соединения предпочтительно представляют собой соединения следующей формулы IC
в которой Rx представляет собой гидрокси или C1-5-алкокси, и их фармацевтически приемлемые соли. Предпочтительно, соединение представляет собой изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина.
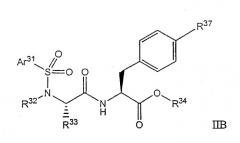
В другом осуществлении соединения предпочтительно представляют собой соединения следующей формулы IIB
в котором:
Ar31 выбран из группы, состоящей из арила, замещенного арила, гетероарила и замещенного гетероарила;
R32 выбран из группы, состоящей из алкила, замещенного алкила, циклоалкила и замещенного циклоалкила, или R32 и R33 вместе с атомом азота, связанным с R32, и атомом углерода, связанным с R33, образуют гетероциклическую или замещенную гетероциклическую группу;
R33 выбран из группы, состоящей из водорода, алкила и замещенного алкила, или R32 и R33 вместе с атомом азота, связанным с R32, и атомом углерода, связанным с R33, образуют гетероциклическую или замещенную гетероциклическую группу;
R34 выбран из группы, состоящей из водорода, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, арила и замещенного арила; и
R37 представляет собой арил, гетероарил, замещенный арил, замещенный гетероарил, гетероцикл, замещенный гетероцикл, арилокси, замещенный арилокси, аралкокси, замещенный аралкокси, гетероарилокси, замещенный гетероарилокси;
и их фармацевтически приемлемые соли.
Еще в одном осуществлении соединение представляет собой изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-О-[1-метилпиперазин-4-илкарбонил]-L-тирозина.
Изобретение также относится к фармацевтической композиции, включающей в себя терапевтически эффективное количество соединения формулы I, IA, IB, IC, II, IIA или IIB и их фармацевтически приемлемые соли. Предпочтительно, соединение представляет собой соединение формулы IB, IC или IIB. В предпочтительном осуществлении соединение представляет собой изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина.
Ремиелинизирующее средство по изобретению может вводиться отдельно или в комбинации с другими ремиелинизирующими средствами, средствами против альфа-4, или противовоспалительными средствами. Изобретение, кроме того, относится к фармацевтическим композициям, включающим в себя фармацевтически приемлемый носитель и терапевтически эффективное количество описанного здесь ремиелинизирующего средства. Фармацевтическая композиция по настоящему изобретению может дополнительно включать в себя один или несколько дополнительных средств, включая другие ремиелинизирующие средства, средства против альфа-4 или противовоспалительные средства.
Композиции по изобретению могут вводиться различными способами введения, включая пероральный, парентеральный (например, подкожный, субдуральный, внутривенный, внутримышечный, интратекальный, внутрибрюшинный, интрацеребральный, внутриартериальный пути введения или путь введения в очаг повреждения), местный, локализованный (например, хирургический компресс или хирургический суппозиторий), ректальный и легочный (например, аэрозоли, ингаляция или порошок).
Другой аспект изобретения относится к комбинированной терапии, включающей в себя терапевтически эффективное количество ремиелинизирующего средства и терапевтически эффективное количество противовоспалительного средства. Противовоспалительные средства включают в себя в качестве неограничивающих примеров адренокортикотропный гормон (ACTH), кортикостероид (например, преднизон, метилпреднизолон, дексаметазон кортизол, кортизон, флудрокортизон, преднизолон, 6α-метилпреднизолон, триамцинолон и бетаметазон), интерферон (например, интерферон бета-1b и интерферон бета-1a), Copaxone® или нестероидное противовоспалительное лекарственное средство (например, аспирин, салицилат натрия, трисалицилат холина-магния, сальсалат, дифлунизал, сульфасалазин, олсалазин, производные парааминофенола, индол, инденуксусная кислота, гетероарилуксусная кислота, антраниловая кислота, еноловая кислота, алканоны, диарилзамещенный фуранон, диарилзамещенные пиразолы, индолуксусные кислоты и сульфонанилид). Ремиелинизирующее средство может быть выбрано из любых соединений формулы I, IA, IB, IC, II, IIA или IIB. Альтернативно, ремиелинизирующее средство может представлять собой антитело против VLA-4 или его иммунологически эффективный фрагмент или полипептид, который связывается с VLA-4, предотвращая таким образом его связывание с собственным лигандом.
Комбинированная терапия может использоваться для лечения субъекта, страдающего от рассеянного склероза, врожденного метаболического заболевания, невропатии с аномальной миелинизацией, демиелинизации, индуцированной лекарственными средствами, демиелинизации, индуцированной облучением, наследственного демиелинизирующего состояния, индуцированного прионами демиелинизирующего состояния, демиелинизации, индуцированной энцефалитом или повреждения спинного мозга.
Еще один аспект изобретения относится к применению соединения формулы I, IA, IB, IC, II, IIA или IIB для получения лекарственного средства для лечения демиелинизирующего заболевания у нуждающегося в этом субъекта. Предпочтительно, соединение представляет собой соединение формулы IB, IC или IIB. В предпочтительном осуществлении соединение представляет собой изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина.
В другом аспекте предоставляется способ инверсии паралича у субъекта с демиелинизирующим заболеванием, включающий в себя введение субъекту ремиелинизирующего средства в количестве, достаточном для ингибирования лимфоцитарной инфильтрации иммунными клетками спинного мозга для стимуляции ремиелинизации нервных клеток в спинном мозге и лечения, таким образом, паралича в указанном субъекте при такой необходимости.
Другой аспект изобретения относится к применению ремиелинизирующего средства для получения лекарственного средства для лечения демиелинизирующего заболевания у нуждающегося в этом субъекта или для лечения паралича у субъекта с демиелинизирующим заболеванием.
Эти и другие объекты, преимущества и характеристики изобретения станут понятны специалистам в данной области после чтения подробностей способов и препаратов, более полно описанных ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ.1A. Продолжительная инверсия хронического экспериментального аутоиммунного энцефаломиелита в течение лечения изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина. EAE индуцировали у самок морских свинок Hartley посредством затылочной внутрикожной инъекции 0,6 мл смеси 1:1 гомогенизированной изологичной ткани ЦНС и полного адъюванта Фрейнда (CFA), с 10 мг/мл инактивированной M. tuberculosis. Начиная с 40 суток после иммунизации, животные получали солевой раствор (n=20, 0,5 мл/сутки) или изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина (n=25, 30 мг/кг, 2×/сутки) в течение 10, 20, 30 или 40 суток. После курса лечения средний клинический балл животных, обработанных изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, был значимо ниже, чем таковой в контрольной группе солевого раствора (p < 0,001, тест суммы рангов Манна-Уитни). Более того, во время продолжительного введения изопропилового эфира N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина не наблюдалось неблагоприятных побочных эффектов, и не было смертей от лечения, как ранее наблюдалось с антителами.
ФИГ.1B. Возвращение клинически активного заболевания после отмены изопропилового эфира N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина. Через 30 суток лечения изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина пять животных поддерживали в течение дополнительных 10 суток без введения малой молекулы. Как только изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина отменяли, животные возвращались к клиническому прогрессированию заболевания. Между 70 и 80 сутками средний клинический балл животных после введения изопропилового эфира N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина был значимо выше, чем у животных, получавших изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина во время периода лечения (p < 0,05, тест суммы рангов Манна-Уитни).
ФИГ.2. Восстановление по данным патологии во время длительного лечения изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина. Панели A, C, E, G, I и K представляли собой срезы спинного мозга, окрашенные солохром-R-цианином (SCR) (увеличение 40×). На панелях B, D, F, H, J и L показано большое увеличение (250×) окрашенных гематоксилином-эозином (H-E) срезов, взятых из дорсальной медиальной области соответствующего окрашенного SCR фото. Данный срез (2A), взятый от нормальной морской свинки, не характеризуется ни воспалением, ни демиелинизацией, в отличие от панели (2B), соответствующих срезов H-E. На 40 сутки после иммунизиации животное, которое не получало лечение, характеризовалось интенсивным менингеальным воспалением и большой дорсо-медиальной бляшкой демиелинизации (2C). Плотность инфильтрации клетками данной области (2D) была намного выше, чем на ФИГ.2. Даже позже при заболевании, на 60 сутки после иммунизации обработанное солевым раствором животное характеризовалось обширной зоной демиелинизации под мягкой мозговой оболочкой (2E), с очень большой плотностью клеточных инфильтратов (2F). Животное, которое в течение 20 суток получало лечение изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, наоборот, характеризовалось намного меньшей областью демиелинизации (2G), и намного меньшей плотностью клеточной инфильтрации в области повреждения (2H). Животное, представленное на 2I, получало 40 суток обработки солевым раствором. Фактически весь срез был инфильтрирован и демиелинизирован, включая вторжение в некоторые области серого вещества. В то время как клеточная инфильтрация на 2J была снижена по сравнению с 60 сутками после иммунизации (см. 2F), она все же была намного выше, чем нормальные уровни, наблюдаемые на 2B. Однако через 40 суток лечения изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина почти не было менингеального и периваскулярного воспаления, и миелин был очевидно незатронутым (2K). Клеточное воспаление (2L) было практически таким же, как и у нормального животного (2B).
ФИГ.3. Снижение патологической аномалии при хроническом EAE во время лечения изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина. Животные получали солевой раствор или изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина (n=25) в течение 10, 20, 30 или 40 суток. Кроме того, подгруппа животных получала изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина в течение 30 суток, и затем лечение отменяли в течение оставшихся 10 суток эксперимента (группа после введения изопропилового эфира N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина). После умерщвления головной и спинной мозг фиксировали в формалине и заливали парафином. Срезы толщиной пять мкм окрашивали гематоксилином-эозином (H-E) или солохром-R-цианином, и вслепую назначали 4-числовой патологический балл, основываясь на оценке каждой из четырех категорий: (3A) менингеальное воспаление, (3B) периваскулярная инфильтрация, (3C) энцефалит и (3D) демиелинизация. Заметьте, что животные, не имеющие EAE, имеют балл, равный нулю во всех категориях. После курса лечения животные, получавшие изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, характеризовались значимым снижением среднего патологического балла в каждой из четырех категорий, в отношении обработанных солевым раствором животных (p<0,001, 2-сторонний ANOVA). При отмене изопропилового эфира N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, и поддержании животных в течение дополнительных 10 суток без лечения, средний комбинированный патологический балл во всех четырех категориях возвращался к значимо более высокому по сравнению с таковым у животных, получавших малую молекулу (p<0,05, ANOVA по Крускалу-Уоллису на рангах с тестом SNK).
ФИГ.4. Сниженная инфильтрация спинного мозга при лечении изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина. Среднее число инфильтрирующих клеток подсчитывали в репрезентативных областях из двенадцати областей, покрывающих весь спинной мозг в форме пирога (см. способы). Значимое снижение клеточной инфильтрации происходило при индукции EAE по сравнению с животными без EAE (*, p<0,05; ANOVA по Крускалу-Уоллису на рангах с тестом SNK). Животные, обработанные изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, имели меньше клеток в спинном мозге, чем обработанные солевым раствором животные во время 10, 20, 30 или 40 суток лечения (*, p<0,001, двухсторонний ANOVA). Более того, животные, которых лечили изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина 20, 30 или 40 суток, имели значимо более низкое количество клеток, чем контрольные (d4O) животные с EAE (#, р<0,05, ANOVA по Крускалу-Уоллису на рангах с тестом SNK). После изопропилового эфира N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина среднее количество клеток у животных, поддерживаемых в течение дополнительных 10 суток без введения малых молекул, было значимо повышено по сравнению с животными, которые получали лечение изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина (p<0,05, ANOVA по Крускалу-Уоллису на рангах с тестом SNK).
ФИГ.5. Сниженная экспрессия воспалительных цитокинов при лечении изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина. Кусок поясничного отдела спинного мозга моментально замораживали в жидком азоте и рутинно обрабатывали для экстракции РНК для количественного ПЦР-анализа. Тогда как незаметные уровни РНК цитокинов выявляли у животных без EAE, экспрессия IL-2 (B), IL-10 (C) и MCP-1 (A) повышалась у контрольных животных d40 с воспалением ЦНС. В то время как обработанные солевым раствором животные имели повышенные уровни воспалительных цитокинов в течение эксперимента, животные, получавшие изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, характеризовались заметным снижением их экспрессии, соответственно с клиническим и патологическим восстановлением. После отмены изопропилового эфира N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина и повторной инфильтрации ЦНС, экспрессия IL-2, IL-10 и MCP-1 снова возрастала до уровня, сравнимого с таковым в обработанных солевым раствором животных.
ФИГ.6. Экспрессия α4 интегрина на лимфоцитах. На 80 сутки после иммунизации гепаринизированные образцы крови собирали от животных без EAE, животных, обработанных солевым раствором, животных, которых лечили изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, и животных через 10 суток после отмены изопропилового эфира N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина. Образцы подвергали воздействию антител против интегрина α4, затем оценивали на проточном цитометре, разделяющем разные клеточные популяции по светорассеянию. Лечение животных изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина вызывало сильное повышение в циркуляции количества лимфоцитов, несущих β4 интегрин, по сравнению с животными, обработанными солевым раствором. Данные результаты указывают на число клеток, экспрессирующих альфа-4. В присутствии соединения имеется больше альфа-4-экспрессирующих клеток, чем у животных, обработанных солевым контролем. Ось x представляет экспрессию альфа-4; ось y представляет число клеток, оцениваемых путем FACS.
ФИГ.7. Экспрессия интегрина α4 на лимфоцитах и моноцитах в циркуляции на 80 сутки после иммунизации. Гепаринизированные образцы крови собирали от всех групп животных на 80 сутки после иммунизации, подвергали воздействию антитела против интегрина α4, и сортировали посредством проточной цитометрии. На панели А показано, что лечение изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина вызывало большое повышение процента несущих интегрин α4 лимфоцитов в циркуляции по сравнению с животными без EAE и обработанными солевым раствором животными, и это указывает на то, что активированные периферические лимфоциты не способны входить в ЦНС в присутствии ингибитора. В соответствии с данной идеей процент данных клеток в циркуляции возвращался к уровню обработки солевым раствором, когда изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина был отменен, и воспаление ЦНС возобновлялось, как показано на панели B. Общая экспрессия интегрина β4 на циркулирующих моноцитах была повышена во всех животных с EAE, хотя не имелось различимых субпопуляций. Данное повышение в моноцитах α4 интегрина не подвергалось влиянию изопропилового эфира N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, и это указывало на то, что ингибитор не влияет на периферическую иммунную реакцию.
ФИГ.8. У животных, которых лечили изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, наблюдали теневые бляшки. Изображения 8A-F представляют окрашенные солохром-R-цианином срезы спинного мозга отдельных животных в группах обработки. (8A) Изображение малого увеличения (40×) показывает степень демиелинизации спинного мозга. (8B) Изображение большого увеличения (100×) демиелинизированного очага повреждения на «сутки 0» (сутки 0 отмеряют, по меньшей мере, через 40 суток после индукции заболевания, причем животное достигает клинического балла, равного 2 или выше) у контрольного животного показывает плотную клеточную инфильтрацию и пенистые макрофаги, содержащие фагоцитированный миелиновый дебрис (стрелки). (8C) Повреждение от животного, которое получало 20 дней обработки солевым раствором, остается полностью лишенным миелина (250×). (8D) Животные, которые получали 20 суток лечения изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, наоборот, представляли очаги с диффузной голубой окраской, покрывающие бляшку (250×). (8E) Сильная демиелинизация была видна в спинном мозге через 40 суток обработки носителем (100×). (8F) Однако через 40 суток терапии изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина большинство повреждений характеризовались ясной миелиновой бледностью (100×).
ФИГ.9. Полутонкие и EM срезы подтверждают ремиелинизацию за счет лечения изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина. Полутонкие срезы, окрашенные толуидиновым голубым, показаны на панелях 9A, 9B и 9C (все 400×). Репрезентативные EM срезы из тех же животных показаны на панелях 9D, 9E и 9F (9D и 9E, 1100×; 9F, 1300×). (ФИГ. 9A и 9D) Нормальный миелин. (9B и 9E) 30 сутки обработки солевым раствором. Некоторые мелкоразмерные аксоны характеризовались тонкими миелиновыми оболочками (t), соседствующими с полной демиелинизацией (d) и нормальным миелином (n). Некоторые аксоны претерпевали уоллеровское перерождение (стрелки). В данном случае дегенерирующие аксоны наблюдали внутри нормально присутствующего миелина (стрелки, 9B). Электронная микроскопия подтверждала отсутствие миелиновой обертки вокруг крупноразмерных аксонов (9E). (9C и 9F) 30 сутки обработки изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина. У животных, которые получали изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, область нормально присутствующего миелина в левой части изображения (n) находится вблизи большой области аксонов сходного размера с тонким слоем миелина (t). Область аксонов с тонким слоем миелина была более протяженной и состояла из аксонов большого размера (9C). Путем EM подтверждали наличие множественных тонких миелиновых обверток вокруг аксонов большого диаметра, что указывало на ремиелинизацию (9F).
ФИГ.10. Изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина повышал частоту и площадь ремиелинизации в спинном мозге (10A). Число очагов, характеризующихся миелиновой бледностью, выражали в процентах от общего числа очагов в среднем из двенадцати поперечных срезов спинного мозга для каждого животного. Изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина (черные полосы) повышал частоту ремиелинизации по отношению к обработанным солевым раствором животным (белые полосы), и имелось зависимое от времени повышение теневых бляшек при обработке изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина. (10B) Представление методологии определения степени ремиелинизации. Обводили контуры всех очагов повреждения внутри среза спинного мозга и подсчитывали площадь внутри обведения. Очаги повреждения, на которых показана миелиновая бледность, также обводили для получения общей области ремиелинизации для каждого животного, и степень ремиелинизации выражали в процентах общей области повреждения. (10C-F) Каждый график рассеяния показывает общую площадь повреждения по оси х, и процентную долю очагов повреждения, характеризующихся миелиновой бледностью, по оси y. Очаги повреждения у животных, обработанных солевым раствором (белые символы) характеризуются малой степенью ремиелинизации. После 20, 30 или 40 суток лечения изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, наоборот, большинство очагов повреждения у животных, которых лечили изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина (черные символы), характеризовались изменчивостью по степени ремиелинизации (0-100%). Средняя площадь в процентах показана на гистограмме справа от каждого графика рассеяния (солевой раствор, белый столбик; изопропиловый эфир N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, черный столбик). Через 20, 30 или 40 суток лечения животные, обработанные изопропиловым эфиром N-[N-(3-пиридинсульфонил)-L-3,3-диметил-4-тиапролил]-O-[1-метилпиперазин-4-илкарбонил]-L-тирозина, характеризовались значимо более высокими процентными долями ремиелинизации (50%), чем таковые после 10 суток лечения или все контроли солевого раствора (< 10%).
ФИГ.11A и 11B. Последовательности ДНК и аминокислотные последовательности вариабельной области легкой цепи мышиного 21.6 соотвественно.
ФИГ.12A и 12B. Последовательности ДНК и аминокислотные последовательности вариабельной области тяжелой цепи мышиного 21.6 соотвественно.
ФИГ.13. Сравнение аминокислотных последовательностей мышиной и измененной человеческой вариабельных областей легкой цепи 21.6. Аминокислотные последовательности, которые представляют собой часть канонических для петлевых структур CDR последовательностей, помечены звездочкой. RE1 обозначает FR и CDR из VL-области легкой цепи человеческого RE1. La и Lb представляют собой две версии измененной человеческой VL-области 21.6. Остатки в FR La, которые отличаются от таковых в последовательности RE1, подчеркнуты. В Lb показаны только остатки в каркасных областях, которые отличаются от таковых в RE1.
ФИГ.14. Сравнение аминокислотных последовательностей мышиной и измененной человеческой вариабельных областей тяжелой цепи 21.6. Аминокислотные последовательности, которые представляют собой часть канонических для петлевых структур CDR последовательностей, помечены звездочкой. 2*CL обозначает FR и CDR из VH-области человеческого антитела 21/28'CL. Ha, Hb и Hc представляют собой три варианта измененной человеческой VH-области 21.6. Остатки в FR Ha, которые отличаются от таковых в последовательности 21/28'CL, подчеркнуты. В Hb и Hc показаны только остатки в каркасных областях, которые отличаются от таковых в 21/28'CL.
ФИГ.15A и 15B. Последовательность кДНК и аминокислотная последовательность первого варианта («a») измененной человеческой вариабельной области легкой цепи 21.6.
ФИГ.16A и 16B. Последовательность кДНК и аминокислотная последовательность первого версии («a») измененной человеческой вариабельной области тяжелой цепи 21.6.
ФИГ.17A и 17B. ФИГ.17A представляет собой последовательность длиной 109 аминокислот мышиных областей каппа VL из подгруппы 5, использованных для конструирования измененных человеческих вариабельных областей легкой цепи 21.6. ФИГ.17B представляет собой последовательность длиной 114 аминокислот человеческих областей VL из подгруппы 1, использованных для конструирования измененных человеческих вариабельных областей легкой цепи 21.6. Последовательности далее описаны ниже в таблице 10.
ФИГ.18A и 18B. ФИГ.18A представляет собой консенсусную последовательность длиной 125 аминокислот мышиных областей VH из подгруппы 2c, использованных для конструирования измененных человеческих вариабельных областей тяжелой цепи 21.6. ФИГ.18B представляет собой консенсусную последовательность длиной 129 аминокислот человеческих областей VH из подгруппы 1, использованных для конструирования измененных человеческих вариабельных областей тяжелой цепи 21.6. Последовательности далее описаны ниже в таблице 11.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед описанием настоящих способов и терапевтиче