Способ индивидуального выявления антагонистической активности пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии, в отношении условно-патогенных микроорганизмов, выделенных при диагностике дисбактериоза кишечника
Иллюстрации
Показать всеВыделяют штаммы условно-патогенных микроорганизмов (УПМ) из фекалий обследуемого, затем выделяют лактобактерии и/или бифидобактерии, входящие в состав пробиотического препарата в чистой культуре. Определяют антагонистическую активность лактобактерии и/или бифидобактерии одновременно методом двухслойного агара и методом перевернутого агара, при этом посев осуществляют по Gold. Оценивают мощность антагонистического воздействия пробиотических штаммов по степени интенсивности подавления штаммов УПМ по сравнению с контролем. Выявляют антагонистическую активность пробиотиков одним из этих методов или двумя. При индивидуальном выявлении антагонистической активности пробиотических препаратов, содержащих лактобактерии, при отсутствии антагонистической активности или выявлении низкой или средней степени интенсивности подавления УПМ антагонистическую активность дополнительно определяют капельной методикой. Изобретение обеспечивает повышение точности способа и расширение спектра оптимально подобранных пробиотических препаратов для конкретного пациента, а также упрощение посева и учета полученного результата. 1 з.п. ф-лы, 3 ил., 10 табл.
Реферат
Изобретение относится к области медицины, а именно к микробиологии и может использоваться в бактериологических лабораториях для выявления антагонистической активности пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии в отношении условно-патогенных микроорганизмов (УПМ), выделенных при диагностике дисбактериоза кишечника у конкретного пациента.
Существуют 2 основные методики для выявления антагонистической активности пробиотических штаммов: 1) метод штрихов [1]; 2) метод двухслойного агара [2]. Кроме этого, описан метод перевернутого агара [3] и метод прямого совместного культивирования - капельная методика [4], которые широко не применяются.
При использовании метода штрихов по диаметру чашки Петри с питательной средой петлей наносят культуру штамма пробиотического препарата, инкубируют в течение двух суток при 37°С в анаэробных условиях, затем штрихом перпендикулярно выросшим культурам штаммов пробиотических препаратов подсевают тест-штаммы УПМ, инкубируют в аэробных условиях при 37°С, учет результатов проводят через 24 ч по величине зоны задержки роста тест-культур в мм. Контролем роста тест-культур служит параллельный посев на чашки с той же средой, но без пробиотических препаратов, в соответствии с требованиями к штаммам пробиотических препаратов зоны угнетения роста тест-культур должны составлять не менее 20 мм [1].
При использовании классического метода изучения антагонистической активности - метода двухслойного агара - в питательную среду вносят штамм пробиотического препарата в определенной концентрации, разливают в чашки Петри, а после застывания на поверхность нижнего слоя наливают второй слой питательной среды. Далее на поверхность верхнего слоя засевают тест-культуры условно-патогенных микроорганизмов в концентрации 106 КОЕ/мл [2]. Снижение концентрации тест-штаммов в присутствии пробиотического препарата по сравнению с контролем без пробиотического препарата свидетельствует об антагонистической активности пробиотического препарата.
Для оценки взаимного влияния пробиотических препаратов и УПМ можно использовать метод прямого совместного культивирования на поверхности плотной питательной среды (капельная методика) [4]. Суточную культуру штамма пробиотического препарата наносят на поверхность питательной среды бактериологической петлей диаметром 3 мм. Посев оставляют при комнатной температуре до полного впитывания капли. После этого, отступив 1-2 мм от края первого пятна, наносят каплю культуры тестируемого микроорганизма. Растекаясь, вторая капля затекает на пятно культуры штамма пробиотического препарата до половины диаметра. В той части, где произошло наложение капель, возникают конкурирующие отношения культур. Свободные части пятен каждой культуры служат контролем жизнеспособности каждой из культур и всхожести питательной среды. После подсыхания капель чашки инкубируют в анаэростате в микроаэрофильных условиях при 37°С. Наличие антагонизма выявляют визуально по наличию признаков подавления одной культуры другой.
Метод перевернутого агара описан для выявления антагонистической активности пробиотических препаратов, содержащих Bacillus subtilis и Escherichia coli, в отношении оппортунистических дрожжей [3]. Для этого штаммы Bacillus subtilis и Escherichia coli засевают газоном на плотную питательную среду, через 2 суток агар переворачивают и на его обратную сторону засевают предварительно оттитрованную посевную дозу дрожжей. Инкубируют 24 ч в аэробных условиях при 37°С. Наличие антагонизма выявляют по подавлению роста дрожжей по сравнению с аналогичным посевом без штаммов пробиотического препарата не менее чем на 1 порядок.
Одним из основных показателей качества пробиотических штаммов при выборе кандидатов для создания новых пробиотических препаратов является их антагонистическая активность, определяемая in vitro. Однако их антагонистическая активность в организме человека может быть обусловлена многими факторами: конкуренцией за рецепторы, выработкой биологически активных веществ, бактериоцинов и бактериоциноподобных веществ, лизоцима, молочной, уксусной и других кислот, перекиси водорода. Однако эти механизмы не универсальны для различных штаммов, входящих в состав пробиотических препаратов. Также неизвестно, какой из этих факторов оказывает решающее значение в подавлении тех или иных микроорганизмов. Поэтому выбор методики выявления антагонизма пробиотических культур обычно осуществляется разными авторами произвольно. Вероятно, каждая из предложенных методик не позволяет оценить всю совокупность факторов, влияющих на выраженность антагонизма, а выявляет какую-либо ее составляющую, при этом какую именно, определить не представляется возможным. Анализируя потенциальную эффективность методов определения антагонистической активности пробиотических препаратов, следует отметить ограниченные возможности каждого отдельно взятого способа.
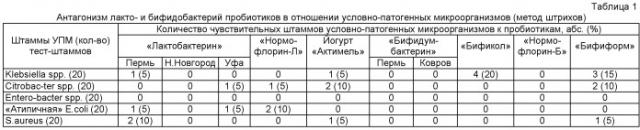
Так, например, достоинством метода штрихов является его очевидная простота. Однако такой подход не позволяет определить мощность антагонистической активности, так как посев проводится не количественно. Кроме этого, эта методика эффективна при выявлении антагонистической активности в отношении патогенных микроорганизмов, по данным литературы [1]. Но при использовании тест-культур условно-патогенных микроорганизмов, выделенных при дисбактериозе кишечника, выявляемость антагонистической активности, по собственным данным, крайне низкая (табл.1 - Антагонизм лакто- и бифидобактерий пробиотических препаратов в отношении условно-патогенных микроорганизмов (метод штрихов)). Возможно, это связано с тем, что условно-патогенные микроорганизмы приспособлены к сосуществованию с лакто- и бифидобактериями, и такие факторы антагонизма, как закисление среды в процессе культивирования, на них не действуют. Также, возможно, при перпендикулярном подсеве УПМ играет роль феномен «quorum sensing», не дающий реализовать пробиотическим штаммам свои антагонистические возможности.
Недостатком метода двухслойного агара, по мнению авторов заявляемого способа, является неудобство посева и учета полученного результата. Метод двухслойного агара требует подтитровки, так как посев тест-культур должен производиться с таким расчетом, чтобы после инкубации количество микроорганизмов было считабельным, т.е. не превышало бы 300 КОЕ на питательной среде. При проведении посева суспензии шпателем в количестве от 10 до 100 мкл с концентрацией микроорганизмов 106 КОЕ/мл, если в процессе инкубации количество микроорганизмов не уменьшится, это приведет к сложности (сплошной рост) и даже невозможности (зарост) учета результата. Это, безусловно, требует подтитровки и дополнительных исследований при тестировании каждого штамма. Подтитровка подразумевает приготовление дополнительных разведений и высев из каждого разведения на отдельную чашку с питательной средой, что влечет за собой дополнительный расход питательных сред и лабораторной посуды.
Кроме этого, по собственным данным, интенсивность антагонистического воздействия на условно-патогенные микроорганизмы при использовании метода двухслойного агара в большинстве случаев недостаточно интенсивна - происходит снижением УПМ на 1 порядок по сравнению с контролем - посевом тех же культур УПМ без пробиотического препарата (табл.2 - Различия в степени антагонистической активности пробиотических препаратов в отношении условно-патогенных микроорганизмов. Метод двухслойного агара). Данная степень подавления ничтожно мала для успешного применения пробиотического препарата. Следовательно, при использовании только метода двухслойного агара может потребоваться дополнительное тестирование с другими пробиотическими препаратами, поскольку единовременно охватить весь спектр имеющихся на рынке препаратов невозможно.
Метод перевернутого агара описан и протестирован для оценки антифунгального действия пробиотических препаратов, содержащих Bacillus subtilis и Escherichia coli [3]. Но оценка антагонистического действия лакто- и/или бифидосодержащих пробиотических препаратов на другие условно-патогенные микроорганизмы (неоппортунистические дрожжи) не производилась. Кроме этого, оригинальная методика подразумевает подбор посевной дозы дрожжей, при которой на агаре вырастало бы не более 70 колоний. Это, безусловно, требует подтитровки и дополнительных исследований при тестировании каждого пробиотического препарата, как и при методе двухслойного агара. При использовании метода перевернутого агара также нередки случаи низкой антагонистической активности, поэтому, применяя только метод перевернутого агара, невозможно дифференцированно подходить к выбору пробиотического препарата или возникает необходимость в дополнительном тестировании с другими пробиотическими препаратами, как и при использовании метода двухслойного агара.
Недостатком метода совместного культивирования, по мнению авторов заявляемого способа, является невозможность соблюдения обязательного условия для применения этого метода - способность обоих тестируемых микроорганизмов - штамма пробиотического препарата и условно-патогенного микроорганизма к росту на используемой питательной среде и в используемой атмосфере инкубации. Так, бифидобактерии не растут в микроаэрофильных условиях, а УПМ при культивировании в анаэробных условиях вырастают в значительно меньшем количестве, чем при культивировании в присутствии кислорода. Поэтому эта методика наиболее подходит для тестирования пробиотических лактобактерий, которые менее требовательны по сравнению с бифидобактериями. Кроме этого, невозможность количественной оценки антагонистической активности в данной методике существенно ограничивает ее применение, т.к. не позволяет дать прогноз успешности применения пробиотического препарата.
Все разработанные на сегодняшний день методики оценки антагонистической активности направлены на определение таковой при выборе производственных штаммов для массового производства пробиотических препаратов. Поэтому пробиотические препараты могут оказаться неэффективны в отношении штаммов условно-патогенных микроорганизмов, выделенных от конкретного пациента.
В качестве прототипа по наиболее близкой технической сущности нами выбран метод двухслойного агара.
Техническим результатом изобретения является повышение точности выявления антагонистической активности пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии, в отношении условно-патогенных микроорганизмов, выделенных при диагностике дисбактериоза кишечника у конкретного пациента и расширение спектра оптимально подобранных пробиотических препаратов для конкретного пациента, а также упрощение посева и учета полученного результата.
Технический результат достигается тем, что выделяют штаммы условно-патогенных микроорганизмов из фекалий обследуемого, затем выделяют лактобактерии и/или бифидобактерии, входящие в состав пробиотических препаратов в чистой культуре, после чего определяют антагонистическую активность лактобактерий и/или бифидобактерий одновременно методом двухслойного агара и методом перевернутого агара, при этом посев осуществляют по Gold и оценивают мощность антагонистического воздействия штаммов пробиотических препаратов по степени интенсивности подавления штаммов условно-патогенных микроорганизмов по сравнению с контролем: низкая степень - подавление на 1-2 lg КОЕ/мл, средняя степень - на 3-4 lg КОЕ/мл, высокая степень - на 5-9 lg КОЕ/мл, вплоть до полного подавления роста УПМ, и при регистрации антагонистической активности пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии, двумя способами или хотя бы одним из способов, то есть или методом двухслойного агара, или методом перевернутого агара, антагонистическую активность пробиотического препарата, содержащего лактобактерии и/или бифидобактерии в отношении условно-патогенного микроорганизма, выделенного от данного больного, считают выявленной. При индивидуальном выявлении антагонистической активности пробиотических препаратов, содержащих лактобактерии в отношении условно-патогенных микроорганизмов, выделенных при диагностике дисбактериоза кишечника, при отсутствии антагонистической активности или выявлении низкой или средней степени интенсивности подавления условно-патогенных микроорганизмов антагонистическую активность дополнительно определяют капельной методикой.
Способ осуществляется следующим образом.
Стандартными способами выделяют чистую культуру условно-патогенных микроорганизмов из фекалий обследуемого и чистую культуру пробиотических лактобактерий и/или бифидобактерий.
Оценку антагонистического влияния пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии, на условно-патогенные микроорганизмы, выделенные от данного пациента, осуществляют одновременно методом двуслойного агара и методом перевернутого агара, а при необходимости оценку антагонистического влияния пробиотических препаратов, содержащих лактобактерии, дополнительно осуществляют капельной методикой.
Метод двухслойного агара для тестирования штаммов пробиотических препаратов и условно-патогенных микроорганизмов используют в варианте, модифицированном авторами заявляемого способа, то есть используя посев по Gold. Нижний слой среды готовят из колумбийского агара. В расплавленную остывающую среду вносят 1 мл штамма тестируемого пробиотического препарата в конечной концентрации 109 клеток по стандарту мутности ГИСК им. Л.А.Тарасевича на 1 мл среды, разливают по 10 мл в чашки Петри и оставляют на 1 час в термостате при 37°С. Затем на поверхность нижнего слоя наливают 10 мл колумбийского агара. Приготовленный таким образом двухслойный агар оставляют на 1 час при 37°С. Засеянные лактобактерии и бифидобактерии инкубируют в аэробных условиях. При посеве бифидобактерии в толщу агара и наслаивании сверху дополнительного слоя плотной среды создаются условия культивирования, близкие к анаэробным, поэтому анаэробная техника не используется.
Далее на поверхность верхнего слоя засевают мерно по Gold тест-культуры условно-патогенных микроорганизмов, выделенные от обследуемого. Для этого готовят суспензию культуры условно-патогенного микроорганизма в конечной концентрации 109 клеток по стандарту мутности ГИСК им. Л.А.Тарасевича. Методика проведения посева градуированной петлей штриховым методом по Gold заключается в следующем: бактериологической петлей диаметром 3 мм и емкостью 2 мкл производят посев исследуемого материала на сектор А чашки Петри с питательной средой (30-40 штрихов). После этого петлю прожигают и делают 4 штриховых посева из сектора А в сектор 1, аналогично из первого во второй, из второго в третий, каждый раз прожигая петлю. После инкубации подсчитывают число колоний, выросших на разных секторах питательной среды. Количество бактерий в 1 мл суспензии определяют по расчетной таблице 3 (Расчетная таблица для определения количества бактерий в мл жидкости) [5].
Контролем служат чашки с такой же питательной средой без пробиотических препаратов, на которые засевают УПМ в таком же количестве, как и в опыте. Засев тест-культур может осуществляться уже через 2 часа после начала инкубации. Кроме этого, появляется возможность культивировать тест-культуры с различными потребностями, варьируя состав второго слоя.
Антагонистическими активными считают пробиотические препараты, при тестировании которых с использованием метода двухслойного агара происходит снижение роста условно-патогенных микроорганизмов по сравнению с контролем. Авторами заявляемого способа предлагается оценивать мощность антагонистического воздействия пробиотических препаратов по степени интенсивности подавления штаммов УПМ по сравнению с контролем: 1 степень (низкая) - подавление на 1-2 lg КОЕ/мл, 2 степень (средняя) - на 3-4 lg КОЕ/мл, 3 степень (высокая) - на 5-9 lg КОЕ/мл, вплоть до полного подавления роста УПМ (Таблица 2).
Метод перевернутого агара для тестирования штаммов и условно-патогенных микроорганизмов используют в варианте, модифицированном авторами заявляемого способа, то есть используя посев по Gold. Пробиотические препараты лактобактерий и/или бифидобактерий в концентрации 1×109 по стандарту мутности ГИСК им. Л.А.Тарасевича в количестве 50 мкл засевают газоном на колумбийский агар. Предполагаемые антагонистические метаболиты штаммов пробиотических препаратов диффундируют в толщу агара и в дальнейшем влияют на рост тест-культур. Инкубируют в анаэробных условиях при 37°С 48 ч. Затем агар переворачивают с помощью стерильного деревянного шпателя и засевают тест-культуры условно-патогенных микроорганизмов с обратной стороны в концентрации 109 клеток/мл, используя количественный посев УПМ мерной петлей по Gold для простоты дальнейшего подсчета (табл.3 - Расчетная таблица для определения количества бактерий в мл жидкости).
Инкубируют 24 ч в аэробных условиях при 37°С. Для контроля штаммы условно-патогенных микроорганизмов высевают на колумбийский агар без пробиотических препаратов по Gold.
Антагонистическую активность данного пробиотического препарата считают выявленной с использованием метода перевернутого агара, если происходит снижение количества условно-патогенных микроорганизмов на питательной среде по сравнению с контролем. Оценивают мощность антагонистического воздействия пробиотических препаратов по степени интенсивности подавления штаммов УПМ по сравнению с контролем: низкая степень - подавление на 1-2 lg КОЕ/мл, средняя степень - на 3-4 lg КОЕ/мл, высокая степень - на 5-9 lg КОЕ/мл, вплоть до полного подавления роста УПМ (табл. 4 - Различия в степени антагонистической активности пробиотических препаратов в отношении условно-патогенных микроорганизмов. Метод перевернутого агара).
В случае выявления низкой или средней степени интенсивности подавления условно-патогенных микроорганизмов или полного отсутствия антагонистической активности изучаемого лактосодержащего пробиотического препарата используют капельную методику, дающую качественную оценку наличия антагонизма. Суточную культуру пробиотических лактобактерий, выращенных в жидкой среде Шедлера, наносят на поверхность колумбийского агара бактериологической петлей диаметром 3 мм. Посев оставляют при комнатной температуре до полного впитывания капли. После этого, отступив 1-2 мм от края первого пятна, наносят каплю культуры тестируемого условно-патогенного микроорганизма, предварительно выращенного в мясо-пептонном бульоне (МПБ). Растекаясь, вторая капля затекает на пятно культуры штамма пробиотического препарата до половины диаметра. В той части, где произошло наложение капель, возникают конкурирующие отношения культур. Свободные части пятен каждой культуры служат контролем жизнеспособности каждой из культур и всхожести питательной среды. После подсыхания капель чашки инкубируют в анаэростате в микроаэрофильных условиях при 37°С. Чтобы исключить возможность влияния последовательности наслоения капель тест-штаммов условно-патогенных микроорганизмов и культур лактобактерий, каждый опыт ставят в двух вариантах, меняя очередность посева культур. Наличие антагонизма выявляют визуально по наличию признаков подавления одной культуры другой. При задержке или отсутствии роста одной из культур (при росте контрольных) взаимоотношения между ними рассматривают как антагонистические.
При регистрации антагонистической активности хотя бы одним способом, антагонистическую активность пробиотического препарата, содержащего лактобактерии и/или бифидобактерии, в отношении условно-патогенного микроорганизма, выделенного от данного больного, считают выявленной. При этом наиболее эффективными в отношении штамма УПМ, выделенного от конкретного пациента, считают пробиотические препараты с третьей (высокой, сильной) степенью интенсивности антагонистического воздействия.
Существенными отличительными признаками заявляемого способа являются:
- выделяют штаммы условно-патогенных микроорганизмов из фекалий обследуемого, выделяют лактобактерии и/или бифидобактерии, входящие в состав пробиотических препаратов в чистой культуре и определяют антагонистическую активность лактобактерий и/или бифидобактерий в отношении условно-патогенных микроорганизмов одновременно методом двухслойного агара и методом перевернутого агара;
- посев осуществляют по Gold и оценивают мощность антагонистического воздействия штаммов пробиотических препаратов по степени интенсивности подавления штаммов условно-патогенных микроорганизмов по сравнению с контролем: низкая степень - подавление на 1-2 lg КОЕ/мл, средняя степень - на 3-4 lg КОЕ/мл, высокая степень - на 5-9 lg КОЕ/мл, вплоть до полного подавления роста УПМ;
- при выявлении низкой или средней степени интенсивности подавления условно-патогенных микроорганизмов или при ее отсутствии антагонистическую активность лактобактерий дополнительно определяют капельной методикой;
- при регистрации антагонистической активности пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии, двумя способами или хотя бы одним из способов, то есть или методом двухслойного агара, или методом перевернутого агара, антагонистическую активность пробиотического препарата, содержащего лактобактерии и/или бифидобактерии в отношении условно-патогенного микроорганизма, выделенного от данного больного, считают выявленной.
Причинно-следственная связь между существенными отличительными признаками и достигаемым результатом.
- Каждый пробиотический штамм действует за счет разного набора факторов и обладает индивидуальным спектром антагонистического действия. Антагонистическая активность изучаемого препарата в зависимости от используемого метода может варьировать, что не характеризует метод как низко- или высокоэффективный. Такие вариации объясняются разной природой антагонизма: накоплением в среде культивирования органических кислот (молочной, муравьиной, уксусной) и изменением рН, разной скоростью размножения микробных популяций, конкуренцией за пищевой субстрат, выработкой лизоцима, бактериоцинов и других биологически активных веществ [6, 7, 8, 9, 10, 2, 1, 11]. Поэтому методы для выявления антагонизма также могут быть разнообразны.
Так, например, при использовании метода прямого антагонизма (метод штрихов), когда осуществляется одновременный посев пробиотического препарата и тестируемых культур, бактериоцины не успевают выработаться и диффундировать в среду и, очевидно, действуют другие механизмы, например изменение физико-химической среды. Но этот механизм не универсален, так как в кишечнике человека могут и не произойти подобные изменения.
При прямом совместном культивировании (капельная методика) происходит непосредственное взаимодействие штамма пробиотического препарата и испытуемой культуры.
При использовании метода перевернутого агара метаболиты штамма пробиотического препарата в течение 2 суток инкубации насыщают питательную среду и влияют на рост тест-штамма.
В методе двухслойного агара штаммы пробиотических препаратов растут в условиях, близких к анаэробным, и могут максимально проявлять свои свойства, однако при этом нет прямого взаимодействия с индикаторными культурами.
Антагонистическая активность одного и того же пробиотического штамма может быть обусловлена несколькими одновременно действующими механизмами. Поэтому, применяя один метод определения антагонизма пробиотического препарата, затруднительно судить о достоверности получаемых результатов, а отрицательный результат не означает отсутствие активности. Таким образом, применяя только один метод выявления антагонистической активности пробиотических лактобактерий и/или бифидобактерий, можно добиться искусственного ограничения успешного применения конкретного препарата в отношении штамма, выявленного у данного пациента. Одновременное использование нескольких методов определения антагонистической активности повышает эффективность выбора препарата для коррекции дисбиоза. При этом в случае даже одного положительного результата можно говорить о наличии антагонистической активности пробиотического препарата к изучаемому штамму микроорганизма.
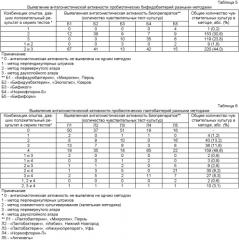
Для выбора оптимального метода, комбинаций или последовательности методов авторами исследована антагонистическая активность пяти лактосодержащих и пяти бифидосодержащих пробиотических препаратов в отношении штаммов УПМ, выделенных при диагностике дисбактериоза кишечника. При этом активность лактосодержащих пробиотических препаратов изучалась четырьмя методами: штрихов, перевернутого агара, двухслойного агара, капельной методикой. Активность бифидосодержащих пробиотических препаратов изучалась тремя методами: штрихов, перевернутого агара, двухслойного агара. Было проведено 500 серий тестов в отношении пробиотических бифидобактерий со ста культурами УПМ и использованием пяти штаммов пробиотических препаратов в трех методах. Таким образом, общее количество опытов с пробиотическими бифидобактериями составило 1500 (Таблица 5 - Выявление антагонистической активности бифидосодержащих пробиотических препаратов разными методами). В отношении пробиотических лактобактерий было проведено 500 серий тестов со ста культурами УПМ и использованием пяти штаммов пробиотических препаратов в четырех методах. Таким образом, общее количество опытов с пробиотическими лактобактериями составило 2000 (Таблица 6 - Выявление антагонистической активности лактосодержащих пробиотических препаратов разными методами).
Тестировали антагонистическую активность десяти пробиотических культур, входящих в препараты: 1) «Бифидумбактерин сухой» «Микроген» г.Пермь; 2) «Бифидумбактерин» ЗАО «Экополис», Ковров; 3) «Бификол» ОАО «Биомед» имени Мечникова, Московская область; 4) «Нормофлорин-Б» ООО «Бифилюкс», Москва; 5) «Бифиформ» «Ferrosan», Дания; 6) «Лактобактерин» НПО «Микроген», Пермь; 7) «Лактобактерин» НПО «Имбио», Нижний Новгород; 8) «Лактобактерин» НПО «Иммунопрепарат»; 9) «Нормофлорин-Л» ООО «Бифилюкс», Москва; 10) йогурт «Актимель». Все коммерческие лиофилизированные культуры пробиотических препаратов предварительно оживляли путем трехкратного пассажа на жидкой среде Шедлера так, чтобы их концентрация составляла 109 КОЕ/мл.
В качестве тест-культур изучали 100 штаммов УПМ, изолированных от больных с дисбактериозом толстого кишечника - по 20 штаммов Enterobacter spp., Klebsiella spp., Citrobacter spp., S.aureus, «атипичной» E.coli. Культуры предварительно выращивали на ГМФ-бульоне при 37°С в течение 16-18 часов.
Число положительных результатов при тестировании пробиотических бифидобактерий с использованием комбинации из трех методов составило 413 из 500 проведенных тестов (Таблица 5 - Выявление антагонистической активности бифидосодержащих пробиотических препаратов разными методами). Не выявлено антагонистической активности ни одним методом лишь в 87 сериях тестов. При тестировании пробиотических лактобактерий с использованием комбинации из четырех методов число положительных результатов составило 327 из 500 проведенных тестов (Таблица 6 - Выявление антагонистической активности лактосодержащих пробиотических препаратов разными методами). Не выявлено антагонистической активности ни одним методом лишь в 173 сериях тестов. Полученные результаты свидетельствуют то, что зачастую антагонизм, не выявленный одним методом, выявлялся другим методом. Т.е. в разных методиках выявления антагонистической активности выявляются разные чувствительные штаммы условно-патогенных микроорганизмов, не обязательно повторяющиеся в каждой из них (Таблицы 7, 8, 9 - Антагонистическая активность пробиотических препаратов, выявленная различными методиками в отношении штаммов УПМ, выделенных при исследовании на дисбактериоз). Таким образом, не существует универсальной стандартизированной методики определения антагонистической активности. Используя несколько вариантов определения антагонистической активности, можно охватить большее количество восприимчивых тест-штаммов. Применяя только один метод выявления антагонистической активности пробиотических бифидобактерий и лактобактерий, можно добиться искусственного ограничения успешного применения конкретного препарата в отношении штамма, выявленного у данного пациента (Таблицы 7, 8, 9, 10, 11). Как видно из таблицы 10 (Сравнительная характеристика двух подходов выявления антагонистической активности пробиотических препаратов в отношении условно-патогенных микроорганизмов, выявленных при диагностике дисбактериоза кишечника), доля случаев невыявленной антагонистической активности при использовании какого-либо одного метода составляет 60,6% при тестировании бифидобактерий и 78,65% при тестировании лактобактерий. В то же время при одновременном использовании нескольких методик процент невыявленных случаев резко снижается и составляет 17,4% для бифидобактерий и 34,6% для лактобактерий. Во избежание неоправданного сужения выбора пробиотических препаратов рекомендуется использовать несколько методик определения антагонизма, и в случае выявления даже одного положительного результата в одном из методов можно говорить о наличии антагонистической активности данного пробиотического препарата к данному штамму микроорганизма.
Авторами проанализирована значимость каждой из методик и предложена последовательность их применения при тестировании пробиотических бифидобактерий и лактобактерий. При сравнении эффективности каждого метода в отдельности показано, что наименьшей эффективностью обладает метод штрихов. Выявляемость антагонизма методом штрихов составила 1,2±2,6% (9 положительных результатов из 500 опытов) для бифидобактерий и для 4,6±2,6% (23 положительных результата из 500 опытов) - для лактобактерий. Статистически достоверна неэффективность этого метода (Фиг.1, Фиг.2).
При этом в 5 случаях антагонистическая активность бифидобактерий была выявлена и другими методами. Таким образом, только 4 результата (0,9% от общего числа положительных результатов) могут быть «упущены», если отказаться от метода штрихов. Очевидно, что его использование не оправдывает затрат. Наибольшая эффективность при тестировании пробиотических бифидобактерий в отношении УПМ зафиксирована в отношении метода перевернутого агара - 42,4±1,5%. При этом статистически достоверно различие с другими применяемыми методами (Фиг.2). Использование метода перевернутого агара как основного метода при оценке антагонистической активности пробиотических бифидобактерий в отношении УПМ оправдано. Однако это не позволяет отказаться от применения дополнительного метода, так как при использовании нескольких методик статистически достоверно повышается выявляемость антагонизма - до 65,4±3,4% (Фиг.2). Поэтому показано одновременное применение методов перевернутого и двухслойного агара.
При анализе значимости каждой из методик при выборе препаратов, содержащих лактобактерии, также показана низкая эффективность метода штрихов - 4,6±2,6% (23 положительных результата из 500 опытов). При этом антагонистическая активность пробиотических лактобактерий в 12 случаях была выявлена и другими методами. Таким образом, только 11 результатов (3,4% от общего числа положительных результатов) могут быть не зарегистрированы в случае отказа от метода штрихов. Наибольшая эффективность при тестировании пробиотических лактобактерий в отношении УПМ зафиксирована в отношении метода двухслойного агара - 46,6±1,5%. Статистически достоверно различие с другими применяемыми методами (Фиг.1). Использование метода двухслойного агара как основного метода при оценке антагонистической активности пробиотических лактобактерий в отношении УПМ оправдано. Однако это не позволяет отказаться от применения других методов, так как при использовании нескольких методик статистически достоверно повышается выявляемость антагонизма - до 65,4±3,4%, что иллюстрируют диаграммы выявлямости антагонизма пробиотических лактобактерий с использованием двух подходов (одним методом и комплексной методикой из 4-х методов) на Фиг.1.
- Выбор дополнительного метода при тестировании лактобактерий не очевиден, так как количество выявленных случаев антагонизма методом перевернутого агара и капельной методикой практически совпадает - 19,4±1,1% и 18,2±1,2% соответственно. Различия статистически недостоверны (Фиг.1). Для выбора приоритетного метода из двух вышеозначенных были проанализированы совпадения при изучении антагонизма этими методиками (Таблица 11 - Совпадения при выявлении антагонистической активности лактосодержащих пробиотических препаратов в отношении УПМ методом перевернутого агара и капельной методикой). Лишь в 5,8% от общего числа положительных результатов (в 3,8% протестированных случаях) получены совпадения в капельной методике и методе перевернутого агара (Таблица 11). А в 38,6% (20,4%+18,2%) от всех положительных результатов (28,4% протестированных случаев) требуется использование двух методик одновременно для выявления антагонистической активности лактобактерий. Однако, учитывая тот факт, что капельная методика носит качественный характер, ее применение должно носить дополнительный характер, в случае отсутствия антагонизма в других методах или при слабой и средней степеней антагонистической активности пробиотических препаратов.
Метод прямого совместного культивирования на поверхности плотной питательной среды (капельная методика) проводят только для лактобактерий. В отличие от метода перевернутого агара, где культивирование пробиотических культур и УПМ разобщено во времени и используются сначала анаэробные, а затем аэробные условия, при методе совместного культивирования оба микроорганизма (пробиотический штамм и штамм УПМ) должны культивироваться одновременно в одинаковых условиях. Бифидобактерии не растут в микроаэрофильных условиях, а УПМ при культивировании в анаэробных условиях вырастают в значительно меньшем количестве, чем при культивировании в присутствии кислорода, поэтому эта методика наиболее подходит для тестирования пробиотических лактобактерий, которые менее требовательны по сравнению с бифидобактериями.
- Методика посева по Gold позволяет отказаться от предварительной подтитровки посевной дозы и легко рассчитать подавляемое количество микроорганизмов с использованием расчетной таблицы, тогда как при посеве шпателем, особенно в случае интенсивного роста, подсчет всех колоний на питательной среде занимает несоизмеримо большее время. Например, при использовании способа-прототипа, то есть метода двухслойного агара, для посева используется сразу несколько чашек, и в итоге можно потратить 30-60 минут на учет полученного результата. Используя методику посева по Gold, затрачивается 2-3 минуты.
- Мощность антагонистического воздействия штаммов пробиотических препаратов оценивают по степени интенсивности подавления штаммов условно-патогенных микроорганизмов по сравнению с контролем: низкая степень - подавление на 1-2 lg КОЕ/мл, средняя степень - на 3-4 lg КОЕ/мл, высокая степень - на 5-9 lg КОЕ/мл, вплоть до полного подавления роста УПМ.
Таким образом, наиболее целесообразно пошаговое определение антагонистической активности пробиотических лактобактерий в отношении УПМ, выделенных при диагностике дисбактериоза. Сначала определяют антагонистическую активность лактобактерий в отношении УПМ одновременно методом двухслойного агара и методом перевернутого агара. Оценивают мощность антагонистического воздействия пробиотических препаратов степени интенсивности подавления штаммов условно-патогенных микроорганизмов по сравнению с контролем. При отсутствии антагонистической активности, а также при низкой или средней степени интенсивности подавления условно-патогенных микроорганизмов антагонистическую активность дополнительно определяют одновременно капельной методикой и выявляют наличие антагонистической активности в отношении условно-патогенного микроорганизма, выделенного