Способ изготовления матрикса для культивирования и размножения клеточной массы
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано в различных разделах медицины при внедрении современных биоматериалов в качестве трехмерных матриксов для клеточных и тканевых культур. Микропорошок, полученный дроблением и рассеиванием упорядоченных упаковок микросфер SiO2, подвергают предварительной термообработке при температурах 750-850°С в течение 40-60 мин, при скорости изменения температуры в интервале 150-200°С/час и последующей термообработке в вакууме при температуре 300-350°С и давлении 0,1-0,5 Па в течение 80-100 мин, при этом в качестве упорядоченных упаковок микросфер SiO2 используют синтетические опаловые матрицы с размерами микросфер 0,25-0,4 мкм и микропор 0,15-0,3 мкм или природный минерал из кремнезема с опалоподобной структурой с размерами микросфер 0,3-4 мкм и микропор 0,5-4 мкм. Изобретение позволяет увеличить объем клеточной массы без замены культуральной среды. 6 ил., 4 табл.
Реферат
Изобретение относится к области биотехнологии и может быть использовано в различных разделах медицины при внедрении современных нанобиоматериалов в качестве трехмерных матриксов для клеточных и тканевых культур. Наращивание клеточной массы в культуре in vitro является необходимым этапом многих исследований. В частности, для доклинических испытаний новых лекарственных препаратов, ряда физических воздействий на клетки, биотехнологических целей и других. Ряд клеточных культур являются адгезивными, а именно формируют тонкие слои на подложках (полистирол, стекло и другие) толщиной несколько десятков микрон. Кинетика роста таких клеточных культур зависит от многих составляющих, в том числе от состава питательной среды, температуры, адгезивных свойств полимера, плотности посева и других. Традиционно в последние 10-летия для культивирования указанных клеток используют культуральные флаконы, многолуночные культуральные планшеты, роллерные бутыли и др. Лимит культивирования в этих условиях 5-7 дней обусловлен несколькими причинами. Во-первых, ограниченной площадью поверхности культивирования, что ведет к быстрому заселению ее клетками и снижению их пролиферативной активности вследствие контактного торможения. Во-вторых, истощением питательной среды, что также приводит к торможению деления клеток. Приведенные причины (контактное торможение и истощение питательной среды) обуславливают необходимость периодического рассеивания клеток с использованием новой культуральной посуды и новой питательной среды. Таким образом, наращивание адгезивной клеточной культуры традиционным способом in vitro - длительная, дорогостоящая многоэтапная манипуляция. Размножение клеток в роллерных бутылях (с постоянной ротацией) вряд ли можно отнести к физиологическим способам, поскольку в таком случае могут нарушаться все пространственно-организованные процессы в клетках, в норме протекающие при постоянном воздействии на клетки земной гравитации. Одновременно такой способ позволяет за один пассаж нарастить значительную клеточную массу вследствие исходно бóльшей площади культуральной поверхности в сравнении с флаконами и сократить расход питательной среды. Кроме того, клеточные культуры, полученные в приповерхностных слоях, нельзя считать полными аналогами роста подобных клеток в организме, где клетки растут, существуют и делятся в объеме, формируя ткани, что генетически обусловлено.
Многие исследователи для культивирования клеточной массы используют микропорошки различных веществ, в частности кремнезема (SiO2). Известны различные способы приготовления микропорошков кремнезема для культивирования и размножения клеточной массы и устройства для их реализации [1-5]. Авторы работы [1] предлагают наносить на традиционно используемую культуральную поверхность пленку из коллоидного аморфного кремнезема толщиной <100 нм, которая обеспечивает хорошую смачиваемость и адгезивность для клеточных культур и, как следствие, высокую скорость их роста, более длительный рост культур (до контактного торможения) благодаря развитой поверхности. Однако такую пленку нельзя отнести к полностью биоинертным (так как она содержит биоактивные группы Si-OH). Кроме того, сами авторы отмечают, что пленка частично растворима в культуральной среде (неконтролируемый процесс), что ведет к обогащению микроокружения клеток кремнием. Следует отметить, что, несмотря на развитую поверхность пленки, культивирование клеток происходит в тонком слое и, таким образом, его продолжительность ограничивается контактным торможением, что требует замены культуральной посуды и среды культивирования.
Авторами работ [2, 3] патентуется материал для покрытия культуральной поверхности (полимерного носителя) в виде тонкого слоя оксида кремния, оксида алюминия, оксида магния или оксида железа путем вакуумного испарения или распыления, что улучшает условия культивирования и пролиферацию клеток. Хотя продолжительность культивирования (равно, как и количество наращиваемых за 1 пассаж клеток) увеличивается, но время культивирования (продолжительность пассажа до рассева клеток, замены посуды и среды) будет ограничено контактным торможением при заселении тонкого слоя на поверхности.
Авторами работы [4] патентуется технология получения макропористых гранул (бусин) из хитозана (диаметр пор - 30-150 мкм) как матриксов для культивирования клеток. Гранулы обладают развитой адгезивной поверхностью, к которой легко прикрепляются клетки. Большой размер пор позволяет клеткам заселяться в них и обеспечивает диффузию питательных веществ. Через поры может идти ангиогенез, хитозан не является биоинертным материалом. Биоактивность хитозана обусловлена тем, что в его основе лежит N-ацетил глюкозамин - углеводная составляющая внеклеточной основы костной и хрящевой тканей. Поэтому гранулы хитозана, как матриксы, ограниченно пригодны для наращивания в объеме адгезивных клеточных культур. Так, сами авторы предлагают использовать пористые хитазановые гранулы в качестве матриксов для стволовых клеток, в частности для исследования их дифференцировки в хондро- и остеогенном направлениях.
Аналогом заявляемого изобретения является изобретение [5] «Носитель для клеток», состоящий из микрочастиц кремнезема (SiO2) или алюмосиликата величиной 8 мкм (5-15 мкм), спеченных друг с другом при температуре 900°С в более крупные микрочастицы (агрегаты), размером 190 мкм (125-250 мкм), которые таким образом содержат от 30 до 110 более мелких микрочастиц. Такие микрочастицы (агрегаты) авторы предлагают использовать в качестве поверхности для роста клеток в объеме питательной среды. Таким образом, в изобретении [7] представлены особенности формирования клеточной массы и устройство, включающее культуральный объем, содержащий питательный раствор, клеточную культуру и микрочастицы кремнезема. В зависимости от целей исследования спеченные микрочастицы предлагается покрывать разными полимерами: агаром, альгинатом, декстраном, желатином, гликогеном, пектином, хитозаном, деацетилированным хитозаном. Предполагается, что толщина слоя полимера на поверхности микрочастиц должна быть в пределах 1-30 молекул. Предпочтительно использовать нерастворимые полимеры с 1 ОН- и 1 NH3 + группами. В данном изобретении (в сравнении с заявляемыми способом и устройством) есть ряд особенностей (недостатков). Прежде всего - нерегулярность структуры и формы мелких микрочастиц (5-15 мкм), из которых спечены более крупные микрочастицы (агрегаты), а именно нестандартизируемость их структуры и формы (что отмечают и сами авторы). Последнее относится и к спеченным из микрочастиц агрегатам. Кроме того, процесс спекания частиц при 900°С ведет к частичному остеклению их поверхности, следствием чего является формирование плотной иррегулярной упаковки микрочастиц с относительно гладкой (неразвитой) поверхностью. Высокая плотность агрегатов подтверждается и самими авторами: 1,1-1, 6, а именно варьирует в широких пределах и своем верхнем пределе (1, 6) существенно выше, чем у H2O. В результате агрегаты образуют плотный слой на дне культуральной посуды, что препятствует эффективному всестороннему заселению этих микрочастиц клетками, хотя авторы отмечают, что на агрегатах микрочастиц встречаются щели и выемки.
Наиболее близким аналогом (прототипом) заявляемого изобретения является способ изготовления матрикса с использованием микропорошков кремнезема (опаловых матриц и гейзерита- композита на основе кремнезема, являющегося природным аналогом опаловых матриц) для культивирования клеток [6, 7], включающий использование для этого образцов нанокомпозитов в виде упорядоченных упаковок наносфер SiO2, их дробление и рассеивание для выделения размеров 5-40 мкм, а также термообработку на воздухе и в вакууме. Однако микропорошки кремнезема, подготовленные по указанному в этих работах способу не меняют своих форм и размеров в процессе формирования двухфазной клеточной структуры, что приводит к замедлению и полному прекращению процесса клеточного роста из-за прекращения доступа питательного раствора к растущей клеточной массе. Используемое устройство не позволяет компенсировать дефицит микрочастиц опаловых матриц и гейзерита по формам и размерам, требуемым для поддержания процесса формирования двухфазной клеточной системы.
Патентуется способ изготовления матрикса для культивирования и размножения клеточной массы с использованием микропорошков кремнезема. Способ разработан с целью реализации в питательном растворе (культуральной среде) длительного по продолжительности процесса культивирования клеточной массы и получения ее больших объемов в виде пространственно разделенных двухфазных конгломератов размерами 0,05-1 мм, состоящих из упорядоченно расположенных клеток и микрочастиц кремнезема.
Предлагаемый способ основан на использовании микропорошков кремнезема для культивирования и размножения в культуральной среде клеточной массы, для чего включает применение нанокомпозитов в виде упорядоченных упаковок наносфер SiO2, их дробление и рассеивание для выделения размеров 5-40 мкм, предварительную термообработку микропорошка кремнезема на воздухе при температурах 750-850°С в течение 40-60 минут, при скорости изменения температуры в интервале 150-200 градусов/ч; термообработку в вакууме при температуре 300-350°С, давлении 0,1-0,5 Па, в течение 80-120 минут. В качестве упорядоченных упаковок наносфер SiO2 используют синтетические опаловые матрицы с размером наносфер 250-400 нм и нанопор 150-300 нм. В качестве упорядоченных упаковок наносфер SiO2 используют природные минералы из кремнезема с опалоподобной структурой, например гейзерит с размером наносфер 0,3-4 мкм и нанопор 0,5-4 мкм.
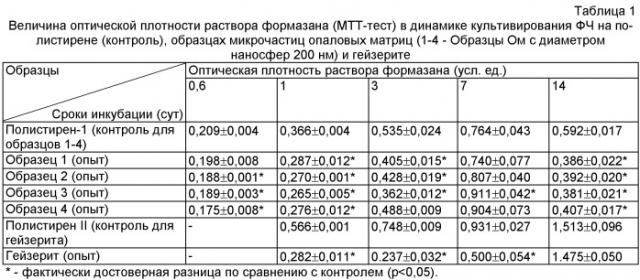
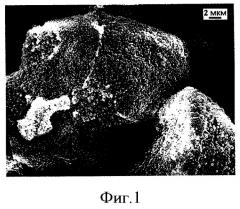
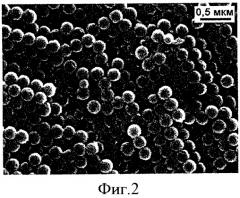
На фиг.1-6 представлены данные, иллюстрирующие особенности микропорошков из микрочастиц кремнезема (SiO2) и их взаимодействия с клеточной средой, в частности фиг.1. Частицы нанокомпозита - опаловой матрицы из упорядоченных упаковок наносфер SiO2 (растровая электронная микроскопия), составляющие микропорошок кремнезема; фиг.2. Строение поверхности нанокомпозита - опаловой матрицы - упорядоченных упаковок наносфер SiO2 (растровая электронная микроскопия); фиг.3. Культивирование фибробластов человека на микрочастицах опаловых матриц разных размеров (7 сутки). Увеличение: левый снимок х8, правый снимок х32; фиг.4. Разрыхление упорядоченных упаковок наносфер SiO2 в микрочастицах при их культивировании in vitro с фибробластами человека, 14 день культивирования (растровая электронная микроскопия); фиг.5. Структура сфероида из фибробластов человека и микрочастиц опаловых матриц (14 день культивирования; гематоксилин-эозин); фиг.6. Общий вид (растровая электронная микроскопия) отдельных объемных структур двухфазной системы клеточная биологическая масса + гейзерит: 28 дней и 60 дней культивирования.
В основе лежит разработанная ранее авторами технология получения объемных нанокомпозитов с регулируемыми размерами наносфер SiO2 в упорядоченных упаковках, в которых сферические наночастицы SiO2 имеют соприкосновение, близкое к точечному, что обеспечивает при определенных условиях увеличение скорости их дезинтеграции.
Преимущества предлагаемого изобретения. Предлагаемое изобретение - способ изготовления матрикса с использованием микропорошков кремнезема для культивирования и размножения клеточной массы:
- позволяет получить длительный по продолжительности процесс культивирования клеточной массы и поучения ее в большом объеме в виде пространственно разделенных двухфазных конгломератов размерами 0,05-1 мм, состоящих из упорядоченно расположенных клеток и микрочастиц кремнезема в культуральном объеме;
- использует для адгезии биоинертный материал - микрочастицы из упакованных наносфер SiO2, который не модифицирует и не трансформирует клетки;
- позволяет по мере формирования объемных (клеточно-опаловых конгломератов) добавлять дополнительные микрочастицы кремнезема и питательную среду без замены культуральной посуды, а следовательно, увеличивать объем, в котором культивируются и формируют сфероиды клетки, продолжать процесс наращивания клеточной массы без их перепассирования;
- позволяет легко заменять использованную питательную среду в культуральной посуде на свежую и в малом культуральном объеме за 1 месяц наращивать в 2-3 раза больше клеточной массы;
- позволяет технологически просто получать из двухфазных конгломератов одноклеточную суспензию традиционным способом (трипсинизацией).
Технический результат предлагаемого способа заключается не только в значительном повышении эффективности процесса выращивания клеток, но и в расширении областей применения подобных материалов в медицине: имплантаты жизненно важных органов; трансплантация клеток; трансдермальные или имплантируемые системы с контролируемым и регулируемым выходом биологически активных веществ; изделия с «памятью формы» для ортопедии и сердечно-сосудистой хирургии; биосенсоры; различные биотехнологические способы сепарации, очистки и идентификации биологических объектов на молекулярном и клеточном уровнях.
Примеры реализации предлагаемого способа
Микропорошки кремнезема для культивирования и размножения клеточной массы подготавливают дроблением массивных объемных образцов нанокомпозитов опаловых матриц (в качестве упорядоченных упаковок наносфер SiO2 используют синтетические опаловые матрицы с размером наносфер 250-400 нм и нанопор 150-300 нм, а также природные минералы из кремнезема с опалоподобной структурой, например гейзерит с размером наносфер 0,3-4 мкм и нанопор 0,5-4 мкм), рассеиванием полученного после дробления порошка для выделения размеров 5-40 мкм, предварительной термообработкой микропорошка кремнезема на воздухе при температурах 750-850°С в течение 40-60 минут при скорости изменения температуры в интервале 150-200 градусов/ч; термообработкой в вакууме при температуре 300-350°С, давлении 0,1-0,5 Па в течение 80-120 минут. Перед началом исследований образцы частиц микропорошка кремнезема тщательно (до 6 раз) отмывали в дистиллированной воде в объеме 50 мл: 1 г с последующим их спонтанным осаждением и высушиванием (150°С). Данную операцию повторяли дважды, далее образцы стерилизовали в сухожаровом шкафу (160°С, 120 мин).
Рост клеток с использованием частиц микропорошка кремнезема исследовали в 24-х луночных культуральных планшетах (Costar, США). При проведении экспериментов в планшеты помещали заранее подготовленные стерильные материалы (200 мг на лунку) и вносили по 1 мл ростовой среды для (и до) полного их насыщения культуральной жидкостью (не менее 4-х часов инкубации при 37°С в стерильных условиях). Особенности строения структуры «частицы микропорошка кремнезема - адгезивная культура клеток» in vitro, а также оценка адгезивных свойств, острой цитотоксичности опаловых матриксов и динамики нарастания на них клеток изучали на модели иммортализованных фибробластов человека (ФЧ, клон №1608, Медико-генетический научный центр РАМН). Клеточную линию поддерживали в полной ростовой среде следующего состава: среда ДМЕМ, 10% эмбриональная телячья сыворотка, глютамин (600 мг/л). В экспериментах использовали клетки в логарифмической фазе роста (предконфлюэнтный монослой). Для получения суспензии одиночных клеток монослой ФЧ обрабатывали 0,25% раствором трипсина, а полученную взвесь клеток дважды отмывали центрифугированием в большом объеме полной ростовой среды, производили их подсчет и оценку жизнеспособности, окрашивая клеточную суспензию 0,04% раствором трипанового синего. В платы с исследуемыми образцами (опыт) и без них (контроль) помещали ФЧ (190 тыс.клеток/см3, 380 тыс.клеток в лунке) в объеме 1500 мкл полной ростовой среды и инкубировали: для определения острой цитотоксичности в течение 4-24 ч, для оценки матриксных свойств микрочастиц опаловых микрочастиц - 3,7, 14 суток с регулярной (дважды в неделю) заменой полной ростовой среды. Культивирование проводили в атмосфере влажного воздуха (37°С), содержащего 5,0 об.% CO2. Жизнеспособность ФЧ в динамике экспериментов оценивали с использованием метода, основанного на способности дегидрогеназ живых клеток восстанавливать 3-(-4,5-диметилтиазолил-2)-2,5-дифенилтетразолий бромистый (МТТ) в голубые кристаллы формазана, нерастворимые в воде (МТТ-метод). Как было показано ранее, количество образовавшегося формазана характеризует пролиферативную активность различных клеток человека и животных (жизнеспособность/ количество).
Для проведения МТТ-теста в опытах in vitro по окончании культивирования ФЧ на культуральном пластике - полистерене (контроль) и ФЧ на образцах частиц опаловых матриксов (опыт) из каждой лунки отбирали по 100 мкл среды и вносили по 125 мкл раствора МТТ в концентрации 5 мг/мл. Через 3 ч инкубации (5,0% CO2, 37°С) из каждой лунки декантировали по 250 мкл среды. Образовавшийся формазан растворяли в изопропиловом спирте (750 мкл на лунку). От осадка, образующегося в результате преципитации белков в изопропаноле, освобождались центрифугированием плат в течение 10 мин при 3000 об/мин. Далее из каждой лунки переносили по 100 мкл супернатанта в 96 луночный плоскодонный планшет (Costar, США) и оценивали оптическую плотность (D усл.ед.) раствора формазана с использованием спектрофотометра МСС-340 (Швеция) при длине волны 540 нм (табл.1-2).
При оценке матриксных свойств образцов опаловых матриц определяли изменение пула ФЧ (Δ) для фиксированного периода по формуле:
Δ=([Dнаст-Dпред]/Dпред)×100%,
где D наст- величина оптической плотности раствора формазана для фиксированного периода, D пред - величина оптической плотности раствора формазана для предыдущего периода. Положительная величина пула ФЧ свидетельствовала о приросте популяции ФЧ, отрицательная - о гибели части популяции. Статистическую обработку результатов проводили по методу Стьюдента (достоверным считали разницу при р<0,05).
Гистологические исследования объемных опалово-клеточных конгломератов проводили традиционным способом, изготавливая парафиновые блоки и гистологические срезы, которые окрашивали гематоксилинэозином. В дальнейшем препараты изучали с использованием стереомикроскопа. Для определения цитотоксичности материала рассчитывали фракцию выживших клеток (ФВК) после 4-24 ч инкубации с ними по формуле:
ФВК=(D*опыт/Dконтр)×100%,
где D* опыт - оптическая плотность раствора формазана, усл. ед. (табл.3).
В качестве спектрофотометрического контроля (бланк) использовали пробы с чистой ростовой средой и пробы, содержащие тестируемые образцы в ростовой среде (без клеток).
В качестве спектрофотометрического контроля (бланк) использовали пробы с чистой ростовой средой и пробы, содержащие тестируемые образцы в ростовой среде (без клеток).
В экспериментах были использованы микрочастицы из упорядоченно упакованных наносфер SiO2 разных размеров, полученные путем термообработки при разных температурах на воздухе и в вакууме. Исследована сравнительная цитотоксичность образцов in vitro в сроки 4 и 24 часа культивирования ФЧ. Установлено, что наилучшими для культивирования клеток являются микрочастицы из упорядоченных упаковок SiO2 размером 0,25-0,4 мкм, содержащие нанопоры размером 150-300 нм. Последнее подтверждается макроскопическим исследованием роста ФЧ на опаловых частицах разных размеров (фиг.3): ФЧ образуют скопления вокруг более мелких частиц и в меньшей мере заселяют более крупные. Исследование динамики роста ФЧ (до 14 суток) показало, что прирост ФЧ на микрочастицах выбранного размера превышает таковой в контроле (на полистерене) на всех сроках культивирования на 50-70%, что и обеспечивает возможность более быстрого и интенсивного наращивания клеточной массы (табл.4).
| Таблица 2 | |||||
| Величина прироста пула ФЧ при культивировании на полистирене (контроль), образцах опаловых матриц (ОМ) и гейзерите в разные сроки наблюдения (относительно предыдущего срока) | |||||
| Образцы материалов | Величина прироста пула ФЧ (в %) | ||||
| 4 часа | 1 сутки | 3 суток | 7 суток | 14 суток | |
| Полистирен-I (контроль для образцов 1-4) | 0 | 79 | 46 | 43 | -23 |
| Образец 1 (опыт) | 0 | 45 | 41 | 83 | -48 |
| Полистирен-II (контроль для гейзерита) | - | 0 | 32 | 25 | 63 |
| Гейзерит (опыт) | - | 0 | -16 | 111 | 195 |
Микроскопическое исследование роста ФЧ с использованием микрочастиц размером 0,25-0,4 мкм, состоящих из упорядоченных упаковок SiO2, показало, что в динамике культивирования происходит формирование опалово-клеточных конгломератов, которые со временем увеличиваются в размерах, достигая на 14-21 сутки нескольких миллиметров в диаметре (фиг.3). Замена среды в культуральной посуде и добавление новых микрочастиц SiO2 позволяют продолжать наращивать клеточную массу до тех пор, пока весь объем культуральной посуды не будет занят опалово-клеточными конгломератами. «Культивирование» опаловых микрочастиц (сформированных из упакованных наносфер SiO2) без клеток не приводит к изменению их структуры и структуры их поверхности. В то же время при их культивировании с ФЧ при образовании опалово-клеточных конгломератов происходит разрыхление поверхности опаловых микрочастиц (клетками) - фиг.4.
| Таблица 3 | ||||||
| Оценка острой цитотоксичности образцов микрочастиц кремнезема (на основе ОМ) в отношении культуры ФЧ (время культивирования 4 и 24 ч, МТТ-тест) | ||||||
| Измеряемые параметры | Образцы Ом с диаметром наносфер 200 нм | |||||
| Контроль | 1 | 2 | 3 | 4 | ||
| 4 часа | Оптическая плотность раствора формазана (усл. ед.) | 0,205 | 0,198 | 0,188* | 0,189* | 0,175* |
| Фракция выживших клеток | 100 | 97 | 92 | 92 | 85 | |
| 24 часа | Оптическая плотность раствора формазана (усл. ед.) | 0,366 | 0,287* | 0,270* | 0,255* | 0,276* |
| Фракция выживших клеток, % | 100 | 78 | 74 | 70 | 75 |
Гистологические исследования конгломератов типа сфероидов показали, что они представляют собой не просто клеточные конгломераты, инкрустированные микрочастицами SiO2. Конгломераты клетки располагаются концентрически, а опаловые частицы формируют геликоидально-подобные структуры (фиг.5-6), причем нарастание величины сфероида происходит за счет привлечения в его структуру все новых опаловых частиц. Важно, что даже в центре сфероида не наблюдается некроза и гибели клеток, вероятно, благодаря эффективной диффузии питательных веществ через нанопоры между упорядоченно упакованными наносферами SiO2. Разобщение клеток конгломератов производится традиционными методами, в частности трипсинизацией.
В таблице 4 приведены результаты культивирования и увеличения клеточной массы при использовании микропорошков кремнезема по предлагаемому изобретению. В экспериментах использованы синтетические опаловые матрицы, представляющие плотнейшую упорядоченную упаковку наносфер кремнезема с диаметром наносфер 250-400 нм и имеющие нанопоры размером 150-300 нм, образующиеся в результате плотнейшей упаковки наносфер в процессе изготовления объемных образцов, подвергаемых в последующем операциям дробления и рассеивания. Использовались образцы порошка кремнезема (опаловые матрицы и минерал из кремнезема с опалоподобной структурой), прошедшие предварительную термообработку при температурах T1=750-850°С в течение П1=40-60 минут, при скорости изменения температуры в интервале V=150-200 град/ч, и последующую термообработку в вакууме при температуре Т2=300-350°С, при давлении Р=0,1-0,5 Па, в течение П2=80-120 минут, что обеспечивало наличие в питательном растворе (культуральной среде) длительного по продолжительности процесса культивирования клеточной массы и получения ее большого объема в виде пространственно разделенных двухфазных конгломератов размерами 0,05-1 мм, состоящих из упорядоченно расположенных клеток и микрочастиц кремнезема (примеры 3, 14-16 в табл.4, примеры 1-2 иллюстрируют снижение эффективности процессов культивирования и размножения клеточной массы по сравнению с результатами, когда используются параметры по предлагаемому изобретению).
Одновременно в таблице 4 приведены аналогичные данные при использовании микропорошков по прототипу, следует отметить, что в таком случае развитие клеточной массы имеет место только на поверхности частиц, так что даже использование различных покрытий не приводит к ее объемному формированию (пример 18). Отметим, что двухфазные конгломераты в объеме культуральной среды не образуются при использовании параметров по прототипу. При использовании оптимальных параметров, приведенных в аналогах [5, 6], эффективность (под которой понимается увеличение прироста клеточной массы за единицу продолжительности по времени) процессов культивирования и размножения клеточной массы также ниже по сравнению с результатами по предлагаемому изобретению (пример 17). При использовании микропорошков кремнезема на основе опаловых матриц с диаметром наносфер 250-400 нм и имеющих нанопоры размером 150-300 нм, максимальная длительность эффективного процесса составляла не более 18 суток, тогда как при использовании природного минерала из кремнезема с опалоподобной структурой, а именно гейзерита с размером наносфер 0,3-4 мкм и нанопор 0,5-4 мкм, доходила до 60 суток (пример 3а, б).
| Таблица 4 | ||||||||||
| Примеры влияния способа приготовления микропорошков кремнезема на процессы культивирования и размножения клеточной массы по величине прироста пула ФЧ с использованием образцов опаловых матриц (Ом) с диаметром наносфер 250-400 нм и размером нанопор 150-300 нм и гейзерита (природного минерала на основе кремнезема с опалоподобной структурой) с размером наносфер 0,2-4 мкм и нанопор 0,5-4 мкм. | ||||||||||
| № пп | Измеряемые параметры | Величина прироста пула ФЧ в течение суток | Примечание | |||||||
| Предварительная термообработка | Термообработка в вакууме | 7 | 14 | 24 | ||||||
| Т1, °С | П1, мин | V, град/ч | Т2, °С | Р, Па | П2, мин | |||||
| 1 | 730 | 40 | 150 | 300 | 0,5 | 100 | 80 | 100 | - | Ом с диаметром наносфер 250 нм |
| 2 | 870 | 60 | 200 | 350 | 0,1 | 80 | 120 | 80 | - | |
| 3 | 800 | 50 | 175 | 325 | 0,3 | 100 | 240 | 200 | - | Ом с диаметром наносфер 250 нм |
| 3а | 800 | 50 | 175 | 325 | 0,3 | 100 | 140 | 450 | 850 | гейзерит с диаметром наносфер 0,5 мкм |
| 3б | 750 | 400 | 175 | 300 | 0,5 | 120 | 140 | 400 | 800 | гейзерит с диаметром наносфер 2,5 мкм |
| 4 | 800 | 40 | 175 | 325 | 0,3 | 100 | 200 | 180 | - | |
| 5 | 800 | 50 | 150 | 325 | 0,3 | 100 | 190 | 170 | - | Ом с диаметром |
| наносфер 300 нм | ||||||||||
| 6 | 800 | 50 | 175 | 300 | 0,3 | 100 | 210 | 190 | - | |
| 7 | 800 | 50 | 175 | 325 | 0,3 | 80 | 195 | 185 | - | Ом с диаметром наносфер 400 нм |
| 8 | 800 | 50 | 175 | 325 | 0,3 | 100 | 220 | 190 | - | |
| 9 | 800 | 60 | 175 | 325 | 0,3 | 100 | 230 | 185 | ||
| 10 | 800 | 50 | 200 | 325 | 0,3 | 100 | 200 | 175 | - | |
| 11 | 800 | 50 | 175 | 325 | 0,1 | 100 | 210 | 180 | - | Ом с диаметром наносфер 300 нм |
| 12 | 800 | 50 | 175 | 325 | 0,5 | 100 | 230 | 195 | - | |
| 13 | 800 | 50 | 175 | 325 | 0,3 | 120 | 215 | 190 | ||
| 14 | 750 | 55 | 170 | 300 | 0,4 | 140 | 180 | 120 | - | |
| 15 | 850 | 45 | 170 | 380 | 0,1 | 90 | 170 | 140 | - | |
| 16 | 810 | 40 | 175 | 310 | 0,5 | 110 | 200 | 170 | - | |
| 17 | 300 | 180 | 150 | 600 | 0,8 | 80 | 160 | 145 | - | Ом с диаметром наносфер 320 нм |
| 20 | 800 | 50 | 175 | 325 | 0,3 | 100 | 150 | 475 | 920 | гейзерит с диаметром наносфер 1,5 мкм |
Приведенная в табл.4 продолжительность процесса культивирования клеточной массы, оценивалась по величине фракции выживших клеток (ФВК) и величине прироста пула ФЧ (Δ, в %), рассчитанных по результатам измерений оптической плотности раствора фор-мазана (в усл. ед.) в соответствии с приведенными выше формулами.
Образцы порошка кремнезема (опаловые матрицы и минералы из кремнезема с опалоподобной структурой), не прошедшие предварительную термообработку при температурах T1=750-850°С в течение П1=40-60 минут, при скорости изменения температуры в интервале V=150-200 град/ч и последующей термообработке в вакууме при температуре T2=300-350°С, при давлении P=0,1-0,5 Па в течение П2=80-120 минут не обеспечивают в питательном растворе (культуральной среде) длительного по продолжительности процесса культивирования клеточной массы и получения ее большого объема в виде пространственно разделенных двухфазных конгломератов размерами 0,05-1 мм, состоящих из упорядоченно расположенных клеток и микрочастиц кремнезема (примеры 1, 2, 4-13 в табл.4).
Источники информации
1. ЕР № 0853664 А1, кл. С12N 11/44 от 1997 г.
2. Япония № 08110963, кл. С12N 5/00 от 1996 г.
3. Япония № 0767618, кл. С12N 5/00 от 1995 г.
4. РФ № 02234514 С2, кл. кл. С12N 5/00 от 2000 г.
5. ЕР № 0245338 А1, кл. С12N 11/04 от 1987 г.
6. Самойлович М.И., Белянин А.Ф., Клещева С.М., Сергеева Н.С., Свиридова И.К., Кирсанова В.А., Ахмедова С.А., Урусов B.C., Шванская Л.В. Использование упорядоченных упаковок наносфер SiO2 для создания биосовместимых наноматериалов. // Нано- и микросистемная техника. 2008. № 8. С.38-49.
7. Урусов B.C., Самойлович М.И., Сергеева Н.С., Белянин А.Ф., Шванская Л.В., Свиридова И.К., Кирсанова В.А., Бычков А.Ю., Ахмедова С.А., Клещева С.М. Образование биокомпозитов на основе природных гейзеритов и синтетических опалов. // Доклады Академии наук. 2008. Т. 423. № 6. С.841-845.
Способ изготовления матрикса для культивирования и размножения в культуральной среде фибробластов человека, включающий использование микропорошка, полученного дроблением и рассеиванием упорядоченных упаковок микросфер SiO2, а также термообработки на воздухе и в вакууме, отличающийся тем, что микропорошок подвергают предварительной термообработке на воздухе при температуре 750-850°С в течение 40-60 мин при скорости изменения температуры в интервале 150-200°С/ч и последующей термообработке в вакууме при температуре 300-350°С и давлении 0,1-0,5 Па в течение 80-100 мин, при этом в качестве упорядоченных упаковок микросфер SiO2 используют синтетические опаловые матрицы с размерами микросфер 0,25-0,4 мкм и микропор 0,15-0,3 мкм или природный минерал из кремнезема с опалоподобной структурой с размерами микросфер 0,3-4 мкм и микропор 0,5-4 мкм.