Субстрат и способ его изготовления
Иллюстрации
Показать всеИзобретение относится к области медицины и представляет собой способ изготовления субстрата, в котором соединение, обладающее активностью против свертывания крови, выбранное из группы, состоящей из гепарина, тромбомодулина, 4-метоксибензолсульфонил-Asn (PEG2000-Ome)-Pro-4-амидинобензиламидо, ATIII и гирудина, и гидрофильное соединение, выбранное из группы, состоящей из PVA, PVP, PEG, PPG, материала, состоящего из полиэфира и полисилоксана, полиэтиленамина, полиаллиламина, поливиниламина, поливинилацетата, полиакриловой кислоты и полиакриламида, а также сополимера или привитого полимера из мономера указанных полимеров и другого мономера, приводят в контакт с субстратом, который содержит раствор органического растворителя, в котором содержание влаги составляет 25 об.% или более и 90 об.% или менее, и содержится по меньшей мере одна вторичная или третичная гидроксильная группа; затем облучают соединение, обладающее активностью против свертывания крови, и гидрофильное соединение, приведенные в контакт с субстратом, с использованием излучения, выбранного из группы, состоящей из β-лучей, γ-лучей, рентгеновских лучей, пучка электронов и пучка нейтронов, и отмывают непрореагировавшие компоненты при помощи неионогенного поверхностно-активного агента. Изобретение обеспечивает сокращение вымывания соединения, обладающего противосвертывающей активностью, и гидрофильного полимерного соединения. 1 з.п. ф-лы, 4 табл., 3 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к субстрату и технологии модификации его поверхности, пригодных для применения в области медицины.
УРОВЕНЬ ТЕХНИКИ
Кровь обладает свойствами активироваться и образовывать тромб, когда она контактирует с инородным материалом. В случае, если тромб образуется в контуре циркуляции или установке для диализа при экстракорпоральной циркуляции крови, как в случае искусственной почки, давление циркуляции возрастает и, помимо того, что становится невозможной быстрая циркуляция крови, появляется риск обструкции кровеносного сосуда, если часть образовавшегося тромба проникнет в организм. Таким образом, необходимо добавлять в кровь вещество, обладающее противосвертывающей активностью (антикоагулянт), и указанный способ широко применяется. В качестве антикоагулянта обычно используют недорогой гепарин. Однако гепарин нельзя использовать у пациентов с гепарин-индуцированной тромбоцитопенией (далее в настоящем документе называемой HIT) и у пациентов с кровотечением, таких как пациенты немедленно после оперативного вмешательства, и вместо гепарина необходимо использовать дорогой антикоагулянт, такой как нафомостата мезилат и габексата мезилат, в результате чего возникает проблема повышения стоимости медицинских услуг (см. непатентные документы 1, 2 и 3).
Были проведены исследования, касающиеся противосвертывающих материалов, которые могут сократить использование антикоагулянтов посредством сообщения противосвертывающих свойств поверхности материала или которые можно использовать в условиях, при которых антикоагулянт не добавляется. Иными словами, указанные материалы получаются иммобилизацией препятствующих коагуляции веществ на поверхности материала и включают в себя гепаринизированный материал как наиболее изученный материал. Основной способ иммобилизации гепарина на материале основан на ионной связи, использующей катионы соли аммония и т.п., введенные в материал, и анионы гепарина (см. непатентный документ 4). Однако в данном случае существует вероятность вымывания гепарина, и, таким образом, указанный способ нельзя использовать у пациентов с HIT, а также он порождает проблему понижения противосвертывающей активности. По указанной причине сообщалось о нескольких способах иммобилизации гепарина на основе ковалентной связи для разрешения проблемы вымывания. Во-первых, сообщалось о способе иммобилизации, основанном на ковалентной связи, образованной органическими химическими агентами, но он также порождает проблему понижения противосвертывающей активности во время химической реакции (см. патентный документ 1). Во-вторых, сообщалось о способе иммобилизации на материале гепарина, основанном на ковалентной связи, предотвращающем понижение противосвертывающей активности, в котором используется пучок ионов и лазерный свет, но поскольку используется пучок ионов и лазерный свет, то трудно иммобилизовать гепарин на внутренней поверхности, такой как поверхность внутри полого волокна, где пучок ионов отбрасывает тень (см. патентный документ 2).
Сам по себе гепарин обладает очень низкими антикоагулянтными свойствами и демонстрирует высокую противосвертывающую активность после связывания с антитромбином III (далее в настоящем документе называемым ATIII). Иными словами, существует также проблема, которая заключается в том, что противосвертывающие свойства являются недостаточными в крови с дефицитом ATIII (см. непатентный документ 2).
Что касается перечисленных выше проблем с материалом, иммобилизующим гепарин, были проведены исследования, касающиеся материалов, на которых иммобилизовали соединения, обладающие противосвертывающей активностью, не являющиеся гепарином (см. патентный документ 3). Однако существует проблема, которая заключается в том, что трудно подавлять прикрепление тромбоцитов с использованием одного лишь соединения, обладающего противосвертывающей активностью, что приводит к возникновению тромбоцитарного тромбоза. Кроме того, не было предложений, касающихся проблемы вымывания соединения, обладающего противосвертывающей активностью, из субстрата.
В последние годы изучалась иммобилизация соединения, обладающего противосвертывающей активностью, не являющегося гепарином, посредством излучения (см. патентный документ 4). С помощью указанного способа можно сдерживать понижение противосвертывающей активности посредством облучения с использованием излучения и, кроме того, можно утверждать, что вымывание из субстрата соединения, обладающего противосвертывающей активностью, в некоторой степени уменьшается. Однако, согласно способу иммобилизации одного лишь соединения, обладающего противосвертывающей активностью, может подавляться естественная реакция свертывания крови, но трудно подавить прикрепление тромбоцитов; таким образом, достаточный уровень противосвертывающей активности до сих пор не достигнут. Более того, вещества, не вступающие в реакции при облучении с использованием излучения, в указанном случае не принимаются во внимание, и уменьшение вымывания из субстрата соединения, обладающего противосвертывающей активностью, не может быть восстановлено.
Патентный источник 1: JP-A-H2003-507082
Патентный источник 2: JP-A-H2001-213984
Патентный источник 3: JP-A-H2004-525888
Патентный источник 4: JP-A-H2006-291193
Непатентный источник 1: Kazuo Ota, “Jinkoujinzounojissai (в исправленной форме 4)”, Nankodo, 1993, стр. 158-164
Непатентный источник 2: Tetsuzo Agishi et al. “Tousekinyumon”, Syujunsha, 1994, стр. 170-182
Непатентный источник 3: American journal of gematology. 2006 81(1), стр. 36-44
Непатентный источник 4: Journal Biomedical Materials Research. 1998 39, стр. 86-91
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Проблема, для решения которой предназначено настоящее изобретение
Принимая во внимание описанные выше проблемы, задачей настоящего изобретения является разработка субстрата, которому приданы противосвертывающие свойства, предпочтительно антитромбиновая активность и способность подавлять прикрепление тромбоцитов, и который обладает отличной совместимостью с кровью, а также разработка способа изготовления указанного субстрата, которые, кроме того, способны сокращать вымывание соединения, обладающего противосвертывающей активностью, и гидрофильного полимерного соединения.
1. Субстрат, включающий в себя соединение, обладающее активностью против свертывания крови, и гидрофильное полимерное соединение, в котором вымывание соединения, обладающего активностью против свертывания крови, в количественном отношении составляет менее 0,6 мкг/мл.
2. Субстрат согласно абзацу 1, в котором 1 нг/см2 или более соединения, обладающего активностью против свертывания крови, содержится на поверхности субстрата.
3. Субстрат согласно абзацу 1 или 2, в котором соединение, обладающее активностью против свертывания крови, обладает антитромбиновой активностью, а адсорбция тромбина составляет 1,0 нг/см2 или более.
4. Субстрат по любому из абзацев 1-3, в котором количество прикрепившихся тромбоцитов составляет 10/(4,3×103 мкм2) или менее, а время свертывания крови продлевается на 10 секунд или более по результатам теста на свертываемость крови.
5. Субстрат по любому из абзацев 1-4, в котором относительное содержание гидрофильного полимерного соединения составляет 20% мас. или более.
6. Субстрат по любому из абзацев 1-5, в котором соединение, обладающее активностью против свертывания крови, содержит часть, обладающую активностью против свертывания крови, и часть, состоящую из полимерной цепи.
7. Субстрат согласно абзацу 6, в котором часть, состоящая из полимерной цепи, обладает гидрофильностью.
8. Субстрат согласно абзацу 7, в котором часть, состоящая из полимерной цепи, содержит по меньшей мере один из остатка пропиленгликоля, остатка поливинипирролидона, остатка полипропиленгликоля, остатка поливинилового спирта и остатка сополимера одного из указанных остатков.
9. Субстрат согласно абзацу 8, включающий в себя поливиниловый спирт, степень омыления которого составляет 50 мольных % или более и 99,9 мольных % или менее.
10. Субстрат по любому из абзацев 7-9, в котором соединение, обладающее активностью против свертывания крови, представляет собой 4-метоксибензолсульфонил-Asn (PEG2000-Ome)-Pro-4-амидинобензиламидо.
11. Субстрат по любому из абзацев 1-10, в котором гидрофильное полимерное соединение содержит по меньшей мере один агент, выбранный из группы, состоящей из поливинилового спирта, полиэфира, поливинилпирролидона и материала, состоящего из полиэфира и полисилоксана.
12. Субстрат согласно абзацу 11, в котором материал, состоящий из полиэфира и полисилоксана, представляет собой сополимер полиэфир/полисилоксан.
13. Субстрат согласно абзацу 11 или 12, в котором полиэфир включает в себя полиэтиленгликоль и полипропиленгликоль.
14. Субстрат согласно абзацу 12 или 13, в котором содержание полипропиленгликоля в сополимере полиэфир/полисилоксан составляет 5 мольных % или более и 90 мольных % или менее.
15. Способ изготовления субстрата, в котором после того, как соединение, обладающее активностью против свертывания крови, и гидрофильное соединение, приведенные в контакт с субстратом, облучены с использованием излучения, отмывают непрореагировавшие компоненты.
16. Способ изготовления субстрата согласно абзацу 15, в котором после того, как соединение, обладающее активностью против свертывания крови, и гидрофильное соединение, приведенные в контакт с субстратом, облучены с использованием излучения, субстрат промывают с использованием поверхностно-активного агента.
17. Способ изготовления субстрата согласно абзацу 15 или 16, в котором, когда соединение, обладающее активностью против свертывания крови, и гидрофильное соединение, приведенные в контакт с субстратом, облучены с использованием излучения, субстрат облучают с использованием излучения, в то время как он содержит раствор органического растворителя, удовлетворяющий следующим условиям А и В:
А: Содержание влаги составляет 25 об.% или более или 90 об.% или менее;
В: Содержится по меньшей мере одна вторичная или третичная гидроксильная группа.
18. Способ изготовления субстрата по любому из абзацев 15-17, в котором, когда соединение, обладающее активностью против свертывания крови, и гидрофильное соединение, приведенные в контакт с субстратом, облучены с использованием излучения, субстрат облучают с использованием излучения, в то время как он содержит буферный раствор с рН 3 или более и 10 или менее.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению, крайне высокие противосвертывающие свойства можно придать поверхности субстрата внедрением соединения, обладающего противосвертывающей активностью, и гидрофильного полимерного соединения, на поверхность субстрата. В результате использование антикоагулянтов, добавленных в кровь во время экстракорпоральной циркуляции, можно сократить, как и при вариантах использования, при которых кровь и материал контактируют между собой, а также нет необходимости использовать указанные антикоагулянты в некоторых случаях и, таким образом, можно уменьшить риск, такой как риск неблагоприятных реакций на антикоагулянты, и, в конечном итоге, можно ожидать уменьшения затрат на медицинские цели.
Помимо этого, согласно способу изготовления по настоящему изобретению, радиационную привитую полимеризацию осуществляют на поверхности субстрата облучением соединения, обладающего противосвертывающей активностью, и гидрофильного полимерного соединения в контакте с субстратом в присутствии органического растворителя с использованием излучения и далее отмыванием непрореагировавших компонентов, в то же время сохраняя активность соединения, обладающего противосвертывающей активностью, таким образом, что риск вымывания соединения, обладающего противосвертывающей активностью, внедренного на поверхность субстрата, также может быть уменьшен.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
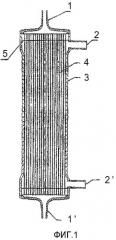
Фиг.1 представляет собой схематичный вид сбоку, изображающий пример модуля полых волокон примеров 1 и 2 и сравнительных примеров 1 и 2 настоящего изобретения.
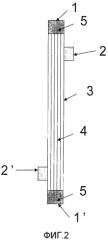
Фиг.2 представляет собой схематичный вид сбоку, изображающий пример мини-модуля полых волокон примеров 12-14 и сравнительных примеров 10-12 настоящего изобретения.
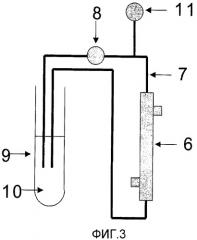
Фиг.3 представляет собой схематичную принципиальную диаграмму, изображающую контур, используемый для проверки циркуляции примеров 12-14 и сравнительных примеров 10-12 настоящего изобретения.
ОБЪЯСНЕНИЕ ОБОЗНАЧЕНИЙ
1 и 1' - порт для крови
2 и 2' - диализный порт
3 - корпус модуля
4 - полое волокно
5 - герметизирующий агент
6 - мини-модуль
7 - силиконовая трубка
8 - перистальтический насос
9 - полистироловая круглая пробирка или пробирка EIKEN № 1
10 - плазма или белковый раствор
11 - манометр
ОПТИМАЛЬНЫЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Субстрат по настоящему изобретению содержит соединение, обладающее противосвертывающей активностью, и гидрофильное полимерное соединение. Если на поверхность субстрата внедрено только лишь соединение, обладающее противосвертывающей активностью, активация реакции свертывания крови факторами свертывания может быть подавлена, но образование тромба и прикрепление тромбоцитов к субстрату полностью подавить невозможно, в случаях, когда кровь с ним контактирует, поскольку агрегацию тромбоцитов подавить нельзя. С другой стороны, если на поверхность субстрата внедрено только лишь гидрофильное полимерное соединение, агрегация тромбоцитов может быть подавлена, но активация факторами свертывания не может быть подавлена, и, таким образом, как в описанном выше случае, образование тромба полностью подавить невозможно. Иными словами, вопрос настоящего изобретения не может быть разрешен простым увеличением количества одного соединения. В настоящем изобретении, однако, только после того как субстрат стал содержать как соединение, обладающее противосвертывающей активностью, так и гидрофильное полимерное соединение, стало возможным подавление множества реакций свертывания и создание эффективного материала, обладающего противосвертывающими свойствами. Кроме того, в настоящем изобретении принимается во внимание вымывание соединения, обладающего противосвертывающей активностью, поскольку соединение, обладающее активностью против свертывания крови, обладает эффектом замедления времени свертывания и может вызывать неблагоприятные реакции. Посредством уменьшения вымывания до уровня менее 1 мкг/мл, предпочтительно менее 0,8 мкг/мл, более предпочтительно менее 0,6 мкг/мл, становится возможным сокращение неблагоприятных реакций, обусловленных соединением, обладающим противосвертывающей активностью, и количества внедренного в субстрат соединения, и также становится возможным достижение безопасности и снижение расходов, в результате чего решается проблема, являющаяся предметом настоящего изобретения.
В настоящем изобретении субстрат, содержащий соединение, обладающее противосвертывающей активностью, и гидрофильное полимерное соединение на своей поверхности, представляет собой субстрат, на поверхности которого присутствуют соединение, обладающее противосвертывающей активностью, и гидрофильное полимерное соединение. Соединение, обладающее противосвертывающей активностью, и гидрофильное полимерное соединение могут быть напрямую связаны между собой или могут быть не связаны. Однако предпочтительно, чтобы указанные соединения были напрямую связаны между собой, поскольку, соответственно, вероятность того, что указанные соединения будут вымываться и не будут способны оказывать свое действие, становится меньше, и можно ожидать уменьшения вымывания указанных соединений. Связь в данном случае включает в себя химическую связь, такую как ковалентная связь, ионная связь, водородная связь, координационная связь, и гидрофобное взаимодействие, а ковалентная связь является предпочтительной, поскольку ковалентная связь представляет собой относительно прочную связь. Альтернативно связь может представлять собой комбинацию множества указанных связей. Способ формирования ковалентной связи, т.е. осуществление прививки соединения, обладающего противосвертывающей активностью, и гидрофильного полимерного соединения на поверхность субстрата, включает в себя органический химический способ посредством реакции нуклеофильного замещения и т.п. и радиационный химический способ посредством облучения с использованием ионизирующего излучения. Среди указанных способов радиационный химический способ является предпочтительным, поскольку количество побочных продуктов реакции меньше, и также субстрат может быть стерилизован правильным выбором типа и дозы излучения. Соединение, обладающее противосвертывающей активностью, и гидрофильное полимерное соединение можно обрабатывать одновременно или по отдельности. Гидрофильное полимерное соединение может служить компонентом, составляющим субстрат, посредством смешивания до однородной массы с сырым материалом во время изготовления субстрата, но в зависимости от типа субстрата, механических или химических свойств (например, прочность, хрупкость, поверхностный заряд и смачиваемость поверхности) субстрата может повреждаться. Следовательно, в указанном случае гидрофильное полимерное соединение может быть внедрено и иммобилизовано на поверхности субстрата, например, непосредственным контактированием водного раствора, содержащего гидрофильное полимерное соединение, с поверхностью субстрата. Если принять указанный способ внедрения/иммобилизации, область применимости может быть расширена, без необходимости подбора типа субстрата. Следовательно, становится возможным не только использование эффекта настоящего изобретения во множестве областей, но также легкое изменение типа гидрофильного полимерного соединения, чтобы оптимизировать субстрат для конкретного применения, что является более удобным с точки зрения функциональности и затрат на производство.
Способ подтверждения вымывания веществ особо не ограничивается, но способ измерения, описанный ниже, приводится в качестве примера. Например, набор ECA-T от компании HaemoSys используется в качестве реагента, а COATRON M1 (код 80 800 000) производства TECO Medical Instruments Production - в качестве аппарата. Область (для полого волокна - область поверхности внутри волокна, которая контактирует с кровью) (далее в настоящем документе называется областью А), которая контактирует с кровью, биогенным веществом или тканью организма, промывают с использованием 160 мкл человеческой плазмы на 1 см2 в течение четырех часов. 80 мкл человеческой плазмы после промывки собирают и добавляют к ней 20 мкл дистиллированной воды. Указанный раствор определяют как пробный раствор. Немедленно после изготовления пробного раствора смешивают 100 мкл ECA протромбинового буфера, 30 мкл пробного раствора и 25 мкл субстрата ECA-T и помещают после инкубации при 37°С в течение 60 с в аппарат. Затем для измерения добавляют 50 мкл реагента ЕСА экарин. Заранее проводят измерение смешанного раствора 20 мкл водного раствора соединения, обладающего противосвертывающей активностью, или контрольной дистиллированной воды и 80 мкл человеческой плазмы с использованием той же методики, результаты которого используют в качестве калибровочной кривой, и количество соединения, обладающего противосвертывающей активностью, рассчитанное с использованием калибровочной кривой, определяют как количество вымывания.
Количество соединения, обладающего противосвертывающей активностью, на поверхности субстрата изменяется в зависимости от силы противосвертывающих свойств, но, если количество соединения слишком мало, возникает проблема, которая заключается в том, что противосвертывающий эффект является низким. Таким образом, что касается области А, количество соединения предпочтительно составляет 0,1 нг/см2 или более, более предпочтительно 0,5 нг/см2 или более, еще более предпочтительно 1 нг/см2 или более и наиболее предпочтительно 50 нг/см2 или более. Если, с другой стороны, количество соединения, обладающего противосвертывающей активностью, слишком велико, возникает проблема, которая заключается в том, что увеличиваются затраты и вымывание. Таким образом, количество соединения предпочтительно составляет 100 мкг/см2 или менее, более предпочтительно 10 мкг/см2 или менее и наиболее предпочтительно 1 мкг/см2 или менее. Количество соединения, обладающего противосвертывающей активностью, на поверхности субстрата измеряют следующим образом: на основании содержания соединения, обладающего противосвертывающей активностью, относительно субстрата, количество соединения определяют в ходе последующего процесса, например, который представляет собой, главным образом, процесс промывки, вычитанием количества, удаленного с помощью процесса удаления непрореагировавших компонентов, которые не закрепились на субстрате, но способ этим не ограничивается. Также количество соединения можно рассчитать с использованием калибровочной кривой соединения, обладающего противосвертывающей активностью, полученной заранее, и с использованием количества адсорбции тромбина, путем измерения величины адсорбции тромбина, как описано ниже.
Соединение, обладающее противосвертывающей активностью, предпочтительно обладает антитромбиновой активностью. Соединение, обладающее антитромбиновой активностью, в настоящем изобретении представляет собой соединение, которое подавляет активность тромбина, который представляет собой вещество, связанное со свертываемостью крови. Величину адсорбции тромбина измеряют с использованием твердофазного иммуноферментного анализа (метода ELISA), но способ этим не ограничивается. Подробно экспериментальный метод будет описан ниже, и количество тромбина, абсорбированного субстратом, в настоящем изобретении составляет, в отношении области А, предпочтительно 0,5 нг/см2 или более и более предпочтительно 1,0 нг/см2 или более.
Также, если количество гидрофильного полимерного соединения слишком мало, возникает проблема, которая заключается в том, что эффект подавления прикрепления тромбоцитов является низким. Субстрат в настоящем изобретении предпочтительно имеет 20% мас. или более поверхностной гидрофильной высокомолекулярной массы. В данном случае определяется поверхностная гидрофильная высокомолекулярная масса, если масса мономерной единицы гидрофильных полимеров (количество молей мономерной единицы х молекулярная масса мономерной единицы) на поверхности субстрата составляет (А), а масса мономерной единицы полимеров (количество молей мономерной единицы х молекулярная масса мономерной единицы), составляющих субстрат, на поверхности субстрата составляет (В), как соотношение, представленное А/(А+В). Поверхностная гидрофильная высокомолекулярная масса является параметром, представляющим степень гидрофильности на поверхности субстрата.
Поверхностную гидрофильную высокомолекулярную массу определяют измерением только поверхности субстрата, т.е. на глубину приблизительно до 10 нм от поверхности, с использованием рентгеновской фотоэлектронной спектроскопии (ESCA) (угол детектора с учетом угла падения рентгеновских лучей составляет 90 градусов). Иными словами, поверхностную гидрофильную высокомолекулярную массу определяют по изменениям величины площади спектров C1s и O1s до и после обработки субстрата. Поверхностная гидрофильная высокомолекулярная масса предпочтительно составляет 20% мас. или более и более предпочтительно 32% мас. Если поверхностная гидрофильная высокомолекулярная масса составляет менее 20% мас., эффект подавления прикрепления органических веществ, таких как белки и биогенные вещества, понижается.
Субстрат по настоящему изобретению имеет 10/(4,3×103 мкм2) или менее прикрепленных человеческих тромбоцитов. Количество прикрепленных тромбоцитов представляет собой величину, определяемую как количество тромбоцитов, прикрепленных к поверхности субстрата на 4,3×103 мкм2 поверхности субстрата, когда субстрат и кровь находятся в контакте друг с другом в течение одного часа. Способ измерения количества прикрепленных тромбоцитов, который следует использовать, заключается в следующем: после того как образец встряхивают в гепаринизированной человеческой крови при 37°С в течение одного часа, образец промывают физиологическим раствором, компоненты крови иммобилизуют раствором глутарового альдегида и после медленного промывания и сушки (используется сушка при пониженном давлении до тех пор, пока скорость изменения веса не будет в пределах 2% до и после сушки в течение одного часа) поверхность образца изучают при увеличении 1500х под сканирующим электронном микроскопом, подсчитывают количество тромбоцитов в одном поле зрения (4,3×103 мкм2) и среднюю величину от количеств тромбоцитов в 10 различных полях зрения вблизи от центра образца принимают за количество прикрепленных тромбоцитов (количества/4,3×103 мкм2). Если количество прикрепленных человеческих тромбоцитов превышает 10/4,3×103 мкм2), совместимость с кровью будет недостаточной, а также эффект подавления прикрепления органических веществ, таких как белки и биогенные вещества, будет недостаточным.
Далее, субстрат по настоящему изобретению предпочтительно продлевает время свертывания крови на 10 секунд или более, когда осуществляют эксперимент со свертыванием крови. В данном случае время свертывания крови измеряют с использованием Sonoclot (анализатор свертывания и функции тромбоцитов, производства US Sienco Inc.), но использование данного аппарат не является ограничением. В данном случае добавляют физиологический раствор таким образом, чтобы концентрация субстрата достигла 100 мкг/мл, 342 мкл человеческой крови и 14,8 мкл раствора глюконата кальция для инъекций (от компании Dainippon Sumitomo Pharma Co., Ltd.), и определяют продление времени с использованием набора SonACT и программы АСТ, которая представляет собой внутреннюю программу Sonoclot. Продление времени свертывания крови предпочтительно составляет 10 секунд или более и более предпочтительно 15 секунд или более.
Соединение, содержащее аминокислоту в качестве компонента, можно привести в качестве примера соединения, обладающего противосвертывающей активностью, используемого в настоящем изобретении. Аминокислота имеет различные функциональные группы в качестве боковых цепей и способна демонстрировать активность как благодаря самой аминокислоте, так и связыванию с активными группами. Соединение, содержащее аминокислоту в качестве компонента, представляет собой соединение, содержащее белки, составленные из α-аминокислот, и включает в себя, например, соединение, составленное только из аминокислот, такое как белок и пептид, и соединение, составленное из аминокислот и других компонентов, которые не являются аминокислотами, такое как гликопротеин, аминокислотный комплекс и аминоациладенилат.
Когда кровь приходит в контакт с инородным материалом, компоненты свертывания активируются для быстрого образования тромба. Если тромб образуется в контуре циркуляции или установке для диализа при экстракорпоральной циркуляции крови, как в случае искусственной почки, давление циркуляции возрастает, и, помимо того, что становится невозможной быстрая циркуляция крови, появляется риск обструкции кровеносного сосуда, если часть образовавшегося тромба проникнет в организм. Таким образом, в случае экстракорпоральной циркуляции крови необходимо добавлять в циркулирующую экстракорпорально кровь соединение, обладающее противосвертывающей активностью. Однако, если соединение, обладающее противосвертывающей активностью, добавляют в кровь пациентам немедленно после оперативного вмешательства или пациентам с кровотечением из пищеварительного тракта, у таких пациентов может появиться кровотечение. Таким образом, путем иммобилизации соединения, обладающего противосвертывающей активностью, на поверхности субстрата, используемого для экстракорпоральной циркуляции, становится возможным подавление свертывания крови без добавления в циркулирующую экстракорпорально кровь соединения, обладающего активностью против свертывания крови.
Соединение, обладающее противосвертывающей активностью, представляет собой соединение, которое продлевает протромбиновое время на 30% или более, когда соединение добавляют в кровь таким образом, что его концентрация достигает 10 мкг/мл, по сравнению со случаем, когда его не добавляют. Протромбиновое время можно измерить способом, описанным в следующем литературном источнике:
M. Kanai et al. “Rinsho Kensaho Teiyo (Clinical Examination Method Handbook), 30-е изд.” Kanehara & Co., Ltd., 1993, стр. 416-418.
Конкретно: 10% по объему 3,2% цитрата натрия и 90% по объему крови смешивают, 0,1 мл предварительно выделенной цитратной плазмы помещают в маленькую пробирку (внутренний диаметр 8 мм; длина 7,5 см) и пробирку помещают в баню с постоянной температурой 37°С для нагревания пробирки в течение приблизительно трех минут. В нее добавляют 0,2 мл реагента тканевый тромбопластин/кальций, который поддерживали при той же температуре, и в это же время запускают секундомер и после легкого встряхивания маленькой пробирки измеряют время до отложения фибрина, в то время как маленькая пробирка отстаивается в наклонном положении.
Соединение, обладающее противосвертывающей активностью, использующееся в настоящем изобретении, включает, например, гепарин, нафомостата мезилат, цитрат натрия, оксалат натрия, антитрипсин-α1, макроглобулин-α2, ингибитор С1, тромбомодулин и С-белок. Среди соединений, обладающих противосвертывающей активностью, существует соединение, демонстрирующее сильную активность против свертывания крови посредством подавления активности тромбина, т.е. соединение, обладающее антитромбиновой активностью.
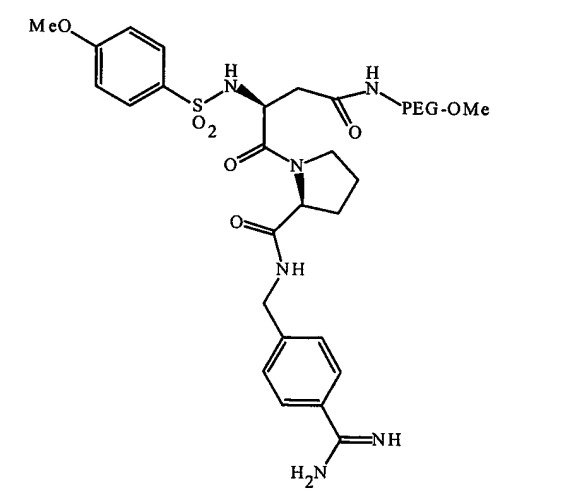
В качестве соединений, обладающих антитромбиновой активностью по отношению к ультрачистой воде, можно назвать 4-метоксибензолсульфонил-Asn (PEG2000-Ome)-Pro-4-амидинбензиламидо (далее в настоящем документе иногда называемое соединением А), представленный следующей общей формулой
Химический агент 1
(где PEG представляет собой остаток полиэтиленгликоля (далее в настоящем документе называемого PEG) со среднечисленной молекулярной массой 2000, а Ме представляет собой метильную группу), ATIII и гирудин.
Если соединение, обладающее противосвертывающей активностью, содержит часть, состоящую из полимерной цепи, подобную соединению А, соединение может связываться с субстратом частью, состоящей из полимерной цепи, таким образом, что часть, обладающая активностью против свертывания крови, может предпочтительно связываться с субстратом, чтобы подавлять снижение активности. Часть, состоящая из полимерной цепи, по настоящему изобретению относится к молекулярной цепи, в которой повторяющиеся единицы, имеющие особую химическую структуру, связаны между собой ковалентной связью и молекулярная масса которой составляет 1000 или более. Указанная часть, состоящая из полимерной цепи, включает гидрофильную полимерную цепь, такую как остаток PEG, остаток поливинилпирролидона (далее в настоящем документе называемого PVP), остаток пропиленгликоля (далее в настоящем документе называемого PPG), остаток поливинилового спирта (далее в настоящем документе называемого PVA) и остаток сополимера одного из указанных остатков. Соединение, имеющее указанную гидрофильную полимерную цепь, может быть использовано особенно предпочтительно, поскольку растворимость в воде соединения, обладающего противосвертывающей активностью, уменьшается с меньшей вероятностью, производные, имеющие аминогруппу или карбоксильную группу, имеются в продаже, а способ изготовления соединения, обладающего противосвертывающей активностью, введением указанных производных в часть, состоящую из полимерной цепи, является относительно легким.
Гидрофильное полимерное соединение в настоящем изобретении относится к полимерному соединению, которое является растворимым в воде или не растворимым в воде, но может вступать в слабое взаимодействие с молекулами воды посредством электростатического взаимодействия или водородной связи. Полимерное соединение относится к соединению, среднечисленная молекулярная масса которого составляет 1000 или более. Примеры гидрофильного полимерного соединения включают в себя, например, PVA, PVP, PEG, PPG, материал, состоящий из полиэфира и полисилоксана, полиэтиленамин, полиаллиламин, поливиниламин, поливинилацетат, полиакриловую кислоту и полиакриламид, а также сополимер или привитой полимер из мономера указанных полимеров и другого мономера, но названными агентами не ограничивается. Среди них гидрофильное полимерное соединение, содержащее по меньшей мере один агент из материала, состоящего из полиэфира и полисилоксана, PVA, полиэфира и PVP, является подходящим для использования, и особенно материал, состоящий из полиэфира и полисилоксана, и PVA достигают высокого гидрофильного эффекта и являются предпочтительными. Материал, состоящий из полиэфира и полисилоксана, используемый в настоящем изобретении, включает в себя сополимер полиэфира и полисилоксана, полимерный комплекс и полимерный смешанный материал. Среди них сополимер является предпочтительным, поскольку сополимер имеет высокую растворимость в воде, и, таким образом, обработка с целью прививки с использованием водного раствора является возможной, так что риски воспламенения растворителя и возгорания в оборудовании для облучения с использованием излучения могут быть снижены. Сополимер полиэфир/полисилоксан состоит из полиэфирной единицы и полисилоксановой единицы, и образованный ими сополимер может представлять собой неупорядоченный сополимер, блок-сополимер или привитой полимер или смесь указанных сополимеров.
PPG и PEG являются подходящими для использования в качестве полиэфира, но по сравнению с PEG PPG является предпочтительным благодаря его более высокой гидрофобности, и, таким образом, он может иметь более сильное гидрофобное взаимодействие с субстратом, и, если, например, осуществляется прививка с использованием излучения, материал, состоящий из полиэфира и полисилоксана, можно эффективно привить на субстрат. В настоящем документе, если содержание PPG в полиэфире слишком сильно увеличивается, растворимость сополимера в воде понижается, и, таким образом, содержание PPG в полиэфире предпочтительно составляет 5 мольных % или более, более предпочтительно 10 мольных % или более и еще более предпочтительно 20 мольных % или более. С другой стороны, содержание PPG в полиэфире предпочтительно составляет 90 мольных % или менее, более предпочтительно 80 мольных % или менее и еще более предпочтительно 60 мольных % или менее. Содержание (в мольных %) PPG в настоящем изобретении рассчитывают по формуле (1):
| Р = 100×(а)/(b). | (1) |
В данной формуле Р представляет собой содержание (в мольных %) PPG, (а) представляет собой количество PPG единиц в полиэфире, а (b) представляет собой количество эфирных PPG единиц в полиэфире. PPG единица в полиэфире относится к структуре, представленной следующей химической формулой:
Химический агент 2
Эфирная единица в полиэфире относится к структуре, представленной следующей химической формулой:
Химический агент 3
В представленной выше формуле R1 представляет собой алкильную группу, имеющую шесть атомов углерода или менее. Содержание PPG можно измерить с использованием ядерной магнитно-резонансной спектроскопии (далее в настоящем документе называемой 1Н-ЯМР) или подобного метода.
Помимо этого, полиэфир может быть сополимеризован, и PEG предпочтительно используется в качестве другого компонента сополимеризации, не являющегося PPG, в полиэфире, с учетом его легкой доступности. В материале, состоящем из указанного PEG и PPG, могут содержаться другие сополимеризационные компоненты в количествах, которые не ухудшают его эффект.
Что ка