Применение цитокина из семейства интерлейкина-6 для получения композиции для комбинированного введения с интерфероном-альфа
Иллюстрации
Показать всеИзобретение относится к медицине и фармакологии и представляет собой применение по меньшей мере одного цитокина семейства ИЛ-6, для получения фармацевтической композиции, предназначенной для комбинированного введения по меньшей мере с одним ИФН-α для лечения вирусных заболеваний, при этом указанный цитокин выбран из онкостатина М, кардиотрофина-1 и их комбинаций. Изобретение обеспечивает преодоление ингибирующего действия ВГС на фосфорилирование STAT3, которое происходит, когда клетки инкубируют только с одним ИНФ-α или с одним цитокином семейства ИЛ-6 (например, КТ-1 или ОСМ), повышение индукции интерферон чувствительных генов (ИЧГ), например, 2'-5'-олигоаденилатсинтазы (2'-5'ОАС), и повышение уровней STAT1 и STAT3, по сравнению с клетками, которые инкубируются с одним цитокином, и более эффективное ингибирование репликации вируса, чем при использовании одного цитокина, а так же проявление сильного синергетического взаимодействия ИФН-α и КТ-1, или ИФН-α и ОСМ. 4 н. и 34 з.п. ф-лы, 3 табл., 5 ил.
Реферат
Настоящее изобретение относится к применению цитокина в комбинации с интерфероном для получения композиций, предназначенных для лечения вирусных заболеваний.
Уровень техники
Система интерферона (ИФН) является первой линией защиты против вирусных заболеваний у млекопитающих. Интерфероны I типа (которые включают несколько подтипов ИФН-α и ИФН-β) являются молекулами, обладающими противовирусной активностью, которые индуцируются в клетках млекопитающих в ответ на вирусные инфекции. Действие ИФН-α опосредовано взаимодействием с рецепторной мультисубъединицей на поверхности клетки, которая состоит из двух рецепторных субъединиц, рецептора 1 (IFNAR1) и рецептора 2 (IFNAR2) к ИФН-α. Идентифицирована только одна цепочечная форма IFNAR1 и обнаружены три варианта субъединицы IFNAR2: одна полноразмерная форма, IFNAR2c, и две усеченные изоформы, IFNAR2b и IFNAR2a. Вариант IFNAR2c участвует в связывании с лигандами и трансдукции сигналов, а две усеченные формы, IFNAR2b и IFNAR2a, у которых отсутствуют внутриклеточные домены, подавляют сигнал ИФН-α, вследствие конкуренции с IFNAR2c за связывание с ИФН-α.
Сигнальный каскад ИФН-α инициируется при связывании ИФН-α с рецептором. Связывание ИФН-α с рецептором приводит к активации связанных с IFNAR тирозинкиназ (Янус-киназа 1 (Jak1) и тирозинкиназа 2 (Tyk2)), которые фосфорилируют обе субъединицы, IFNAR1 и IFNAR2. После фосфорилирования посредством Tyk2 или Jak1, фосфорилированный IFNAR1 предоставляет место связывания для сигнального трансдуктора и активатора транскрипции 2 (STAT2), который содержит домен Src гомолог 2. В результате другие STAT, включая STAT1, STAT3 и STAT5, рекрутируются к рецептору для фосфорилирования и активации. Затем активированные мономеры STAT1 и STAT2 вновь высвобождаются в цитозоль, где они образуют гетеродимеры и связываются с интерферон-регулирующим фактором 9/белком р48 с образованием активного комплекса транскрипционных факторов, известного в качестве интерферон-стимулируемого генного фактора 3 (ISGF3). Этот комплекс перемещается к ядру и связывается с ИФН-стимулируемым отвечающим элементом (ISRE) с тем, чтобы инициировать транскрипцию целевых генов, включая некоторые противовирусные и иммунорегуляторные белки. ИФН-α также индуцирует образование других комплексов STAT, включая STAT1/STAT1, STAT1/STAT3 и STAT3/STAT3, которые связываются с активированной γ-последовательностью в промоторных участках чувствительных генов. В первичных гепатоцитах человека ИФН-α активирует STAT1, STAT2, STAT3 и STAT5 с последующей индукцией широкого ряда противовирусных и проапоптических генов, которые могут вносить вклад в противоопухолевую и противовирусную активность ИФН-α в печени человека.
В противоположность ИФН-α, который активирует STAT1, STAT2 и STAT3, в случае ИФН II типа (ИФН-γ) связывание с рецептором приводит к исключительному фосфорилированию STAT1 посредством Jak1 и Jak2, сопровождаемому гомодимеризацией STAT1 и ядерной транслокацией гомодимера.
Вирусные инфекции представляют большую опасность для здоровья по всему миру. Среди вирусов, которые вызывают хронические инфекции, вирусы, вызывающие гепатит В (ВГВ) и гепатит С (ВГС), важны в качестве основных этиологических факторов хронического вирусного гепатита и цирроза печени. Этими нарушениями поражены свыше 500 миллионов человек по всему миру (примерно 300 миллионов поражены ВГВ и 200 миллионов - ВГС). ВГВ вызывает хроническую инфекцию главным образом в случае наследственной передачи и у лиц с подавленным иммунитетом. С другой стороны, инфекция ВГС примечательна тенденцией перехода в большинстве случаев в хроническую форму, которая означает, что у этого вируса развиты очень эффективные механизмы, позволяющие ему избегать систему интерферона. Пациенты с хронической инфекцией ВГС и пациенты с хроническим гепатитом В не отвечают на терапию интерфероном. При хроническом гепатите В устойчивый противовирусный ответ наблюдается менее чем в 40% случаев [1]. В случае хронического гепатита С, хотя большинство пациентов, инфицированных генотипами вируса ВГС 2 или 3, проявляют устойчивый вирусологический ответ (УВО) после 24 или 28 недель комбинированной терапии с использованием пэгилированного ИФН-α и рибавирина [2], только 50% пациентов, инфицированных вирусом с генотипом 1, достигали УВО при этом терапевтическом режиме [2]. Поскольку на Западе и в Азии свыше 80% больных, инфицированных ВГС, инфицировано генотипом 1, крайне необходимы более действенные средства повышения противовирусной эффективности ИФН-α. Механизмы, обусловливающие устойчивость к ИФН-α, наблюдаемые в случае ВГС и других хронических вирусных заболеваний, еще не полностью установлены, и существует огромная потребность в разработке стратегий лечения для преодоления устойчивости к терапии с применением ИФН-α при этих заболеваниях.
Ответ на интерферон-α клеток, инфицированных вирусом, зависит от нескольких решающих факторов, включая факторы, относящиеся к вирусу, и специфические факторы, относящиеся к хозяину. Показано, что различные генные продукты ВГС модулируют ответ хозяина на терапию ИФН и оказывают влияние на тяжесть вирусного заболевания, особенно в случае гепатита. Установлено, что неструктурные (NS5A) и структурные (Е2) белки ВГС взаимодействуют с PKR, одной из ключевых молекул, вовлеченных в развитие противовирусного состояния в ответ на ИФН [3, 4]. Это может блокировать PKR, приводя к ингибированию активности ИФН в ВГС-инфицированных клетках. С другой стороны, некоторые исследования показали, что и у трансгенных мышей с ВГС и в биоптатах печени пациентов с хронической инфекцией ВГС, затрагивается сигнал STAT1, индуцируемый ИФН-α [5, 6].
Установлено, что в образцах печени, инфицированной ВГС, и в клетках печени, несущих геномный репликон ВГС (полноразмерный), наблюдается заметное снижение количества и РНК IFNAR2 и STAT3. Существенно, что активация STAT1, STAT2 и STAT3 посредством ИФН-α блокируется в клетках печени, содержащих полноразмерный репликон ВГС, что подтверждает тот факт, что репликация ВГС может блокировать сигнализацию ИФН-α в инфицированных клетках. Также интересно отметить, что активация STAT1 в этих клетках не затрагивается при их инкубировании с провоспалительной молекулой ИФН-γ, что означает, что блокирование активации STAT1, индуцируемое ВГС, специфично для сигнального каскада ИФН 1 типа и не влияет на сигнальный путь ИФН II типа.
Существуют другие цитокины, которые активируют Jak-STAT сигнальный путь, особенно члены семейства ИЛ-6, которое включает ИЛ-6, ИЛ-11, фактор, ингибирующий лейкоз (ФИЛ), онкостатин (OSM), кардиотрофин-1 (КТ-1), цилиарный нейротрофический фактор (ЦНТФ) и кардиотрофин-подобный цитокин (КТПЦ) [7]. Эти цитокины связываются с рецепторными комплексами плазматической мембраны, которые включают общую рецепторную цепь трансдукции сигнала gp130 [7]. Трансдукция сигналов вызывает активацию членов семейства тирозинкиназ Jak, приводящую к активации факторов транскрипции STAT1 и STAT3. Эти цитокины интенсивно активируют STAT3 и, в меньшей степени, STAT1 через общую рецепторную субъединицу gp130. Однако хоть и показано, что ИЛ-6 индуцирует некоторые противовирусные эффекты [8], это противовирусное действие цитокина является гораздо слабее действия интерферона-α.
Настоящее изобретение относится к применению интерлейкина семейства ИЛ-6, предпочтительно кардиотрофина-1 (КТ-1) или онкостатина М (ОСМ):
(1) для повышения противовирусной активности интерферона-альфа (ИФН-α),
(2) для преодоления устойчивости к интерферону, наблюдаемой у пациентов с хронической вирусной инфекцией, которые не отвечают на терапию с применением ИФН-α (самого по себе или в комбинации с другими противовирусными компонентами),
(3) для проведения комбинированного лечения с применением интерлейкина семейства ИЛ-6, предпочтительно КТ-1 или ОСМ, вместе с ИФН-α, в качестве улучшенной противовирусной терапии какого-либо типа вирусной инфекции, и особенно инфекции вирусом гепатита С (ВГС), при которой доказано, что предпочтительная комбинация КТ-1-ИФН-α или ОСМ-ИФН-α является особенно эффективной для ингибирования репликации ВГС.
Цель настоящего изобретения заключается в следующем:
(1) показать, что комбинация ИФН-α с интерлейкином семейства ИЛ-6, предпочтительно с КТ-1 и ОСМ, оказывает более сильное противовирусное действие по сравнению с действием, вызываемым одним цитокином (ИФН или цитокином семейства ИЛ-6), и
(2) показать, что ИФН-α, связанный с цитокином семейства ИЛ-6, особенно с КТ-1 или онкостатином М, способен преодолевать блокирование сигнального каскада ИФН-α (и, следовательно, ослабление эффекта ИФН-α, индуцируемого при репликации вируса, предпочтительно ВГС, в инфицированной клетке).
Описание изобретения
Настоящее изобретение относится, в первую очередь, к применению, по меньшей мере одного цитокина семейства ИЛ-6, семейства gp130, или последовательности ДНК, которая его кодирует, для получения фармацевтической композиции для совместного введения по меньшей мере с одним ИФН-α или последовательностью ДНК, которая его кодирует, при лечении вирусных заболеваний, при этом указанный цитокин выбран из кардиотрофина-1, ИЛ-11, фактора, ингибирующего лейкемию, онкостатина М, цилиарного нейротрофического фактора, кардиотрофиноподобного цитокина, и их комбинаций, и, даже еще более предпочтительно, когда указанный цитокин является кардиотрофином-1 или онкостатином М.
В контексте настоящего изобретения цитокин «семейства ИЛ-6», например КТ-1,относится к:
- полной нативной форме указанного цитокина,
- какой-либо активной фракции указанного цитокина, то есть какой-либо частичной полипептидной последовательности указанного цитокина, которая сохраняет физиологическое действие полного цитокина, заявленного в настоящем изобретении, и
- какому-либо производному указанного цитокина, то есть какой-либо полипептидной последовательности, которая обладает более чем 80% гомологией с указанным нативным цитокином и сохраняет физиологические эффекты полного цитокина, заявленного в настоящем изобретении.
Цитокин семейства ИЛ-6 (полная форма, активная фракция или полипептидное производное) может происходить из обеих форм, нативной формы и какой-либо формы рекомбинантного цитокина, исходя из какой-либо формы полинуклеотида, которая кодирует полный цитокин, активную фракцию или полипептидное производное.
Кроме того, в белке семейства ИЛ-6, в полной форме или в активной фракции, или в рекомбинантном цитокине каким-либо указанным способом можно удалить, заменить или добавить одну или нескольких аминокислот, при условии, что сохраняется их предполагаемая активность по настоящему изобретению.
С другой стороны, согласно настоящему изобретению, ИФН-α по настоящему изобретению является каким-либо типом ИФН-α. В конкретном варианте осуществления изобретения, указанный ИФН-α выбран из ИФН-α-2а, ИФН-α-2b, ИФН-α-5, консенсусного интерферона, очищенного ИФН-α, пэгилированного ИФН-α и их комбинаций. В другом конкретном варианте осуществления изобретения ИФН-α выбран из пэгилированного ИФН-α-2b, пэгилированного ИФН-α-2а, пэгилированного ИФН-α-5 и их комбинаций.
Комбинированное применение ИФН-α и цитокина семейства ИЛ-6 предназначено для лечения предпочтительно вирусного заболевания. В качестве примера вирусных заболеваний, которые можно лечить посредством комбинированного применения интерферона и цитокина семейства ИЛ-6, среди других можно упомянуть следующие: заболевания, вызываемые вирусом энцефаломиокардита, гепатит В и С, ВИЧ, кожные вирусные инфекции (ветряная оспа, опоясывающий лишай, корь), респираторные вирусные инфекции, вирусные инфекции центральной нервной системы, вирусные инфекции печени, вирусные инфекции слюнных желез, инфекционный мононуклеоз и генитальные бородавки.
Предпочтительно, вирусным заболеванием является гепатит С.
Более того, согласно настоящему изобретению, цитокин семейства ИЛ-6, или цитокины, и ИФН-α можно вводить раздельно, в разных фармацевтических композициях, или их можно вводить совместно, в одной и той же фармацевтической композиции.
Таким образом, дополнительным объектом настоящего изобретения является фармацевтическая композиция, которая включает фармацевтически приемлемое количество по меньшей мере одного цитокина семейства ИЛ-6, семейства gp130, или последовательность ДНК, которая его кодирует, и фармацевтически приемлемое количество по меньшей мере одного ИФН-α, или последовательность ДНК, которая его кодирует.
В указанной фармацевтической композиции, которая включает по меньшей мере один ИФН-α или последовательность ДНК, которая его кодирует, и по меньшей мере один цитокин семейства ИЛ-6 или последовательность ДНК, которая его кодирует, цитокин семейства ИЛ-6 предпочтительно выбран из ИЛ-6, ИЛ-11, фактора, ингибирующего лейкоз, онкостатина М, кардиотрофина-1, цилиарного нейротрофического фактора, кардиотрофиноподобного цитокина, и их комбинаций, и даже более предпочтительно, если указанный цитокин является кардиотрофином-1 или онкостатином М.
В фармацевтической композиции настоящего изобретения ИФН-α является каким-либо типом ИФН-α. В предпочтительном варианте осуществления изобретения ИФН-α выбран из ИФН-α-2а, ИФН-α-2b, ИФН-α-5, консенсусного интерферона, очищенного ИФН-α, пэгилированного ИФН-α и их комбинаций. В другом дополнительном предпочтительном варианте осуществления изобретения ИФН-α выбран из пэгилированного ИФН-α-2b, пэгилированного ИФН-α-2а, пэгилированного ИФН-α-5 и их комбинаций.
В специфическом варианте осуществления настоящего изобретения, последовательность ДНК, которая кодирует цитокин семейства ИЛ-6 (который может быть представлен полной формой, активной фракцией или полипептидным производным) или ИФН-α, включена в вектор экспрессии, например, плазмидный или вирусный вектор, который предпочтительно оперативно связан с управляющей последовательностью, которая регулирует экспрессию цитокина или ИФН-α. Конструкцию указанного вектора экспрессии с последовательностью ДНК можно выполнить традиционными методами генной инженерии, приведенными в руководствах, например, «Molecular Cloning: A Laboratory Manual», под ред. J. Sambrook, D.W.Russel, Cold Spring Harbor, 2001, 3-е изд., Нью-Йорк. Эти варианты осуществления фармацевтической композиции представляют интерес для терапий, в которых применяют перенос генов (генная терапия).
Фармацевтическая композиция настоящего изобретения, кроме того, может включать по меньшей мере один эксципиент, который фармацевтически совместим с цитокином семейства ИЛ-6 или последовательностью ДНК, которая его кодирует, и фармацевтически совместим с ИФН-α или последовательностью ДНК, которая его кодирует.
Кроме того, в фармацевтической композиции цитокин семейства ИЛ-6, или последовательность ДНК, которая его кодирует, и ИФН-α, или последовательность ДНК, которая его кодирует, можно вводить в соответствующие носители.
Адекватные примеры фармацевтической композиции настоящего изобретения включают, но ими не ограничиваются, какую-либо твердую композицию (например, таблетки, капсулы, гранулы и т.д.) или жидкую композицию (например, растворы, суспензии, эмульсии и т.д.) для введения каким-либо подходящим способом, например пероральным, назальным, парентеральным, местным, трансдермальным, ректальным и т.д.
В конкретном варианте осуществления настоящего изобретения указанная композиция может быть в фармацевтической форме для перорального введения, либо твердой, либо жидкой. Наглядные примеры фармацевтических форм для перорального введения включают таблетки, капсулы, гранулы, растворы, суспензии и т.д. и могут содержать обычные эксципиенты, например связующий агент, разбавитель, разрыхлитель, смазывающий агент, увлажнитель и др. эксципиенты, и могут быть получены обычными способами. Фармацевтическая композиция также может быть адаптирована для парентерального введения, в форме, например, стерильных растворов, суспензий или лиофилизированных продуктов в соответствующей дозированной форме. В этом случае указанная фармацевтическая композиция будет включать соответствующие эксципиенты, например буферы, поверхностно-активные вспомогательные вещества и т.д. В любом случае эксципиенты выбирают исходя из выбранной фармацевтической формы введения. Обзор различных фармацевтических форм для введения лекарств, для этих и других потенциальных способов введения, и их получение можно найти, например, в кн.: «Tecnologia farmaceutica» [«Pharmaceutical Technology»], под ред. J.L.Vila Jato, Sintesis, Мадрид, 1997, т.I и II, или в «Handbook of Pharmaceutical Manufacturing Formulations», под ред. S.K.Niazi, CRC Press, Бока Ратон, 2004, т.I-VI.
В конкретном варианте осуществления настоящего изобретения фармацевтическая композиция предназначена для парентерального введения, предпочтительно подкожного, внутривенного, внутримышечного или внутрибрюшинного.
В конкретном варианте осуществления фармацевтической композиции по настоящему изобретению ИФН-α представлен в пэгилированной форме. Примеры получения композиций с пэгилированными формами можно найти в US 5762923 и US 5766582. Также возможно коммерческое приобретение некоторых из этих пэгилированных форм, например, таких как PEG-Intron (пэгилированный ИФН-α-2b) фирмы Schering Corporation (Кенилворс, Нью-Джерси, США) и PEGASYS (ИФН-α-2а) фирмы Hoffmann La Roche (Натли, Нью-Джерси, США).
Для применения в терапии и цитокин семейства ИЛ-6, и ИФН-α предпочтительно должны быть в фармацевтически приемлемой форме или в значительной степени чистой форме, т.е. они должны иметь фармацевтически приемлемую степень чистоты, исключая фармацевтически приемлемые эксципиенты, и не должны включать вещество, которое считается токсичным при нормальных дозах введения. Степень чистоты для цитокина семейства ИЛ-6 и ИФН-α предпочтительно превышает 50%, более предпочтительно, превышает 70% и еще более предпочтительно, превышает 90%. В предпочтительном варианте осуществления, степень чистоты превышает 95%.
В общем, подлежащее введению терапевтически эффективное количество цитокина семейства ИЛ-6 и ИФН-α зависит, среди других факторов, от индивидуума, подвергающегося лечению, серьезности заболевания указанного индивидуума, выбранной формы введения и т.д. По этой причине дозы, указанные в настоящем изобретении, должны рассматриваться исключительно в качестве ориентиров для специалистов в данной области, которые должны проводить корректировку этих доз на основе указанных переменных. Однако цитокин семейства ИЛ-6 и ИФН-α можно вводить один или несколько раз в сутки, например, 1,2,3 или 4 раза в сутки.
В качестве наглядного примера, не ограничивающего область охвата настоящего изобретения, в конкретном варианте осуществления, в котором комбинируются кардиотрофин-1 и ИФН-α-2а (или 2b), типичное общее суточное количество кардиотрофина-1 может составлять 1-10 мг/кг массы тела, и обычное общее суточное количество ИФН-α-2а составляет 1,5-10 мМЕ в сутки или от 40 до 300 мкг в неделю пэгилированного ИФН-α. Обычно, уровень доз должен быть выше в течение первых недель лечения с понижением доз в последующие периоды. Более того, введение может осуществляться ежесуточно, три раза в неделю, а также раз в неделю. С другой стороны, кардиотрофин-1 и ИФН-α можно вводить, следуя разным схемам введения (например, разными путями введения или с различной частотой).
Дополнительным объектом настоящего изобретения является фармацевтический набор для лечения вирусных заболеваний, который включает, по меньшей мере:
- первый компонент, который включает по меньшей мере один цитокин семейства ИЛ-6, семейства gp130, (либо полный, либо активную фракцию, либо полипептидное производное, указанные выше) или последовательность ДНК, которая кодирует указанный цитокин, и
- второй компонент, который включает по меньшей мере один ИФН-α или последовательность ДНК, которая кодирует указанный ИФН-α.
Набор по настоящему изобретению предпочтительно включает цитокин семейства ИЛ-6, выбранный из ИЛ-6, ИЛ-11, фактора, ингибирующего лейкоз, онкостатина М, кардиотрофина-1, цилиарного нейротрофического фактора, кардиотрофиноподобного цитокина и их комбинаций, и, даже более предпочтительно, цитокин семейства ИЛ-6 является кардиотрофином-1 или онкостатином М.
Набор по настоящему изобретению включает ИФН-α какого-либо типа, предпочтительно выбранный из ИФН-α-2а, ИФН-α-2b, ИФН-α-5, консенсусного интерферона, очищенного ИФН-α, пэгилированного ИФН-α и их комбинаций. В другом дополнительном предпочтительном варианте осуществления настоящего изобретения ИФН-α выбран из пэгилированного ИФН-α-2b, пэгилированного ИФН-α-2а, пэгилированного ИФН-α-5 и их комбинаций.
В конкретном варианте осуществления настоящего изобретения последовательность ДНК, которая кодирует цитокин семейства ИЛ-6 (либо полный, либо активную фракцию, либо полипептидное производное) или ИФН-α, в наборе включена в состав вектора экспрессии.
В наборе настоящего изобретения, первый компонент и второй компонент могут включать, дополнительно по меньшей мере один фармацевтически приемлемый эксципиент, который совместим с цитокином семейства ИЛ-6, или последовательностью ДНК, которая его кодирует, и с ИФН-α, или последовательностью ДНК, которая его кодирует.
Согласно настоящему изобретению набор, указанный выше, может включать первый и второй компоненты в раздельных фармацевтических композициях, или же первый и второй компоненты могут присутствовать в наборе в одной и той же фармацевтической композиции.
Этот набор также может включить третий компонент, который включает один или несколько эксципиентов, которые фармацевтически совместимы с цитокином семейства ИЛ-6, или последовательностью ДНК, которая его кодирует, и с ИФН-α, или последовательностью ДНК, которая его кодирует.
Указанный третий компонент может включать, дополнительно, один или несколько носителей, которые фармацевтически совместимы с цитокином семейства ИЛ-6, или последовательностью ДНК, которая его кодирует, и с ИФН-α, или последовательностью ДНК, которая его кодирует.
Дополнительным объектом настоящего изобретения является способ лечения вирусного заболевания, который включает введение комбинированным способом терапевтически эффективного количества по меньшей мере одного цитокина семейства ИЛ-6, семейства gp130 (либо полной формы, либо активной фракции, либо полипептидного производного, указанных выше), или последовательности ДНК, которая его кодирует, и терапевтически эффективного количества по меньшей мере одного ИФН-α, или последовательности ДНК, которая его кодирует.
В конкретном варианте осуществления настоящего изобретения последовательность ДНК, которая кодирует цитокин семейства ИЛ-6 или ИФН-α по способу настоящего изобретения включена в вектор экспрессии.
В указанном выше способе вирусное заболевание может вызываться вирусом энцефаломиокардита, может являться гепатитом В и С, вызываться ВИЧ, представлять кожные вирусные инфекции (ветряная оспа, опоясывающий лишай, корь), респираторные вирусные инфекции, вирусные инфекции центральной нервной системы, вирусные инфекции печени, вирусные инфекции слюнных желез, инфекционный мононуклеоз и генитальные бородавки.
Согласно предпочтительному варианту осуществления способа по настоящему изобретению вирусным заболеванием является гепатит С.
По способу настоящего изобретения цитокин семейства ИЛ-6 предпочтительно выбран из ИЛ-6, ИЛ-11, фактора, ингибирующего лейкоз, онкостатина М, кардиотрофина-1, цилиарного нейротрофического фактора, кардиотрофиноподобного цитокина и их комбинаций, и, даже более предпочтительно, цитокин семейства ИЛ-6 является кардиотрофином-1 или онкостатином М.
В указанном способе по настоящему изобретению ИФН-α является каким-либо типом ИФН-α. В предпочтительном варианте осуществления настоящего изобретения он выбран из ИФН-α-2а, ИФН-α-2b, ИФН-α-5, консенсусного интерферона, очищенного ИФН-α, пэгилированного ИФН-α и их комбинаций. В другом дополнительном предпочтительном варианте осуществления настоящего изобретения ИФН-α выбран из пэгилированного ИФН-α-2b, пэгилированного ИФН-α-2а, пэгилированного ИФН-α-5 и их комбинаций.
Кроме того, способ настоящего изобретения может предусматривать комбинированное и одновременное введение цитокина семейства интерлейкинов, предпочтительно кардиотрофина-1, и ИФН-α.
В этом способе цитокин семейства ИЛ-6 (либо полная форма, либо активная фракция, либо полипептидное производное) и ИФН-α могут присутствовать в одной и той же фармацевтической композиции, которая вводится пациенту, или же цитокин семейства ИЛ-6 и ИФН-α могут вводиться в раздельных фармацевтических композициях.
Настоящее изобретение показывает, что если клетки печени, которые содержат полный репликон ВГС, стимулируются ИФН-α и интерлейкином семейства ИЛ-6, особенно кардиотрофином-1 или онкостатином М:
(1) преодолевается ингибирующее действие ВГС на фосфорилирование STAT3, которое происходит, когда клетки инкубируют только с одним ИНФ-α или с одним цитокином семейства ИЛ-6 (например, КТ-1 или ОСМ),
(2) повышается индукция интерферон чувствительных генов (ИЧГ), например, 2'-5'-олигоаденилатсинтазы (2'-5'ОАС), и повышаются уровни STAT1 и STAT3, по сравнению с клетками, которые инкубируются с одним цитокином,и
(3) более эффективно ингибируется репликация вируса, чем при использовании одного цитокина.
(4) проявляется сильное синергетическое взаимодействие ИФН-α и КТ-1, или ИФН-α и ОСМ.
Краткое описание чертежей:
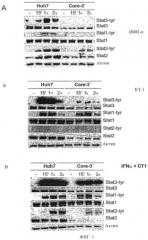
Фиг.1 показывает результаты анализа фосфорилирования STAT1, STAT2 и STAT3. Клетки Huh7 (Huh7) и клетки Huh7, содержащие полный геномный репликон ВГС (Соге-3'), обрабатывали в течение 15, 60 и 120 мин 50 МЕ/мл ИФН-α-2 (ИФН-α) или 20 нг/мл кардиотрофина-1 (КТ-1), или комбинацией ИФН-α-2 и КТ-1, и в клеточных экстрактах с помощью вестерн-блоттинга анализировали количества фосфорилированных STAT1, STAT2 и STAT3.
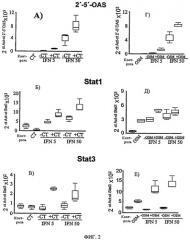
Фиг.2 показывает результаты количественного ОТПЦР-анализа в реальном времени иРНК STAT1, STAT3 и 2'-5'ОАС в клетках Huh7, содержащих полный репликон ВГС, обрабатываемых в течение 3 суток 5 или 50 МЕ/мл ИФН-α-2 (ИФН 5, ИФН 50), одного (- КТ) или в комбинации с 20 нг/мл КТ-1 (+ КТ), и 5 или 50 МЕ/мл ИФН-α-2, одного (- ОСМ) или в комбинации с 20 нг/мл ОСМ (+ ОСМ). Контроль: необработанные клетки.
Фиг.3 показывает количественный ОТПЦР-анализ в реальном времени РНК ВГС в клетках Huh7, содержащих полный репликон ВГС, обрабатываемых в течение 3 суток 5 или 50 МЕ/мл ИФН-α-2 или ИФН-α-5, и 20 нг/мл КТ-1 или ОСМ или ИЛ-6.
Фиг.4 показывает сравнительный противовирусный эффект комбинации ИФН-α-2 или ИФН-α-5 (5 Е/мл) в сочетании с КТ-1 или ОСМ или ИЛ-6 (20 нг/мл), путем ОТПЦР-анализа в реальном времени, РНК ВГС в клетках Huh7, содержащих полный репликон ВГС, обрабатываемых в течение 3 суток указанными цитокинами.
Фиг.5 показывает процент клеток Huh7, защищенных от заражения вирусом энцефаломиокардита. Клетки Huh7 предварительно обрабатывали в течение 24 ч 5 нг/мл или 50 нг/мл КТ-1 и различными количествами ИФН-α-2, и заражали 105 БОЕ вируса энцефаломиокардита (ВЭМК), и, спустя 24 ч, клетки окрашивали кристаллическим фиолетовым, чтобы оценить количество жизнеспособных клеток.
Варианты осуществления изобретения
Эксперимент 1
Исследование эффекта комбинации ИФН-α-2 и КТ-1 на сигнальный каскад в клетках, сохраняющих репликацию ВГС (фиг.1).
В нетрансфецированных клетках Huh7 (клеточная линия гепатомы), добавление 50 МЕ/мл ИФН-α-2 (ИФН-α-2) индуцирует фосфорилирование STAT1, STAT2 и STAT3, с максимальной активацией STAT1 и STAT2 на 1-ый и 2-ой ч, и STAT3 на 1-ый ч (см. фиг.1А). Однако в клетках Huh7, трансфецированных полноразмерным репликоном ВГС, наблюдается заметное ингибирование фосфорилирования STAT1, STAT2 и STAT3 после инкубации с ИФН-α-2. Таким образом, отмечается полное отсутствие активированных STAT3 и STAT1 и заметное ингибирование активации STAT2 (см. фиг.1А).
С другой стороны, в нетрансфецированных клетках Huh7 обнаружено, что добавление 20 нг/мл КТ-1 приводит к активации и STAT3, и STAT1 (более сильной в случае STAT3), с максимальным значением через 15 мин и 1 ч, и значительным снижением через 2 ч (фиг.1Б). Подтверждено, что КТ-1 не индуцирует какой-либо активации STAT2. В клетках Huh7, трансфецированных полным репликоном ВГС, активация STAT3 посредством КТ-1 существенно ниже, а фосфорилирование STAT1 изменяется только незначительно (фиг.1Б).
При инкубировании нетрансфецированных клеток Huh7 со смесью 50 МЕ/мл ИФН-α-2 и 20 нг/мл КТ-1 обнаруживается более интенсивное и длительное фосфорилирование STAT3 и STAT1 по сравнению с клетками, инкубированными с каждым из цитокинов в отдельности. Активация STAT2 близка таковой, обнаруженной только с одним ИФН-α-2. Существенно, что если клетки Huh7, трансфецированные полным репликоном ВГС, инкубируют со смесью ИФН-α-2 (50 МЕ/мл) с КТ-1 (20 нг/мл), происходит фосфорилирование STAT3 без какого-либо нарушения, не только с более интенсивной активацией STAT3, но также более длительной, по сравнению с таковой в случае инкубации нетрансфецированных клеток с одним ИФН-α-2 (фиг.1 В). Этот факт заслуживает внимания, поскольку согласно указанному (и показанному на фиг.1А и 1Б), репликация ВГС в клетках Huh7 значительно понижает активацию STAT3 обоими ИФН-α-2 и КТ-1 пол-отдельности, и остается неясным, почему эта блокировка исчезает при инкубации клеток с двумя цитокинами одновременно. Это открывает новую перспективу для перспективной стратегии лечения вирусных заболеваний. Следует также отметить, что комбинирование ИФН-α-2 и КТ-1 при обработке клеток с репликацией ВГС не только вызывает сильную устойчивую активацию STAT3, но также активацию STAT1, близкую активации, которая обнаружена при инкубации нетрансфецированных клеток с одним КТ-1 и более сильную активацию, чем при инкубации нетрансфецированных клеток с одним ИФН-α-2 (сравните фиг.1А и 1Б). Важно отметить, что ИФН-α-2 не способен активировать STAT1 в клетках с устойчивой репликацией ВГС, тогда как комбинация КТ-1 с ИФН-α-2 может очень эффективно активировать этот важный противовирусный фактор в клетках с репликацией ВГС. Это ясно показывает, что комбинирование ИФН-α-2 и КТ-1 приводит к улучшению противовирусной активности, давая возможность фосфорилированию STAT2, хотя и на уровнях, которые, безусловно, ниже, чем при использовании клеток без репликации ВГС (см. фиг.1В).
Таким образом, если клетки с устойчивой репликацией ВГС отдельно обрабатывают ИФН-α-2, активация STAT1 и STAT3 отсутствует, и наблюдаются только низкие уровни STAT2. Отсутствие активированных STAT1 и STAT3, двух важных индукторов клеточного противовирусного статуса, возможно, предотвращает образование гетеродимеров STAT1-STAT2, гетеродимеров STAT1-STAT3 и гомодимеров STAT1 и STAT3, таким образом, понижая противовирусную защитную реакцию клетки. Применение КТ-1 в комбинации с ИФН-α-2 дает возможность образованию высоких уровней активированных STAT1 и STAT3, таким образом, восстанавливая механизм устойчивости клеток к вирусам.
В экспериментах, показанных на фиг.1, можно видеть, что инфекция ВГС не только приводит к дефектной активации STAT1, но также к редукции уровней белков STAT3 и STAT2. Исследования, представленные на фиг.1, показывают кратковременные эффекты инкубации либо с ИФН-α-2, либо с КТ-1, либо с комбинацией обоих. Эксперименты, описанные ниже, показывают, что при инкубации в течение 72 ч, можно заметить, что обработка комбинацией КТ-1 и ИФН-α-2, или ОСМ и ИФН-α-2 приводит к повышенной экспрессии STAT3, таким образом, противодействуя эффекту ВГС в инфицированных клетках (см. фиг.2).
Экспериментальный метод 1
Создание клеточных линий, несущих полноразмерный репликон ВГС.
Клетки Huh7, которые экспрессируют полноразмерный репликон ВГС, получают согласно описанию [9]. Вкратце, pI389/Core-3'/5.1 линеаризируют с помощью ScaI (фирма New England Biolabs, США) и используют в качестве матриц для синтеза РНК, используя РНК-полимеразу (фирма Promega, США). 20 мкг синтезированной РНК используют для электрофореза 107 клеток Huh7 и спустя 24 ч добавляют 500 мкг/мл G418 (фирма Gibco, США). Два раза в неделю добавленную культуральную среду заменяют G418 и спустя 4 недели после трансфекции отбирают смешанные колонии, резистентные к G418, и используют для последующего анализа.
Вестерн-блот анализ. Клетки Huh7, либо экспрессирующие, либо не экспрессирующие полноразмерный репликон ВГС, засевают при плотности 200000/лунку в 6-луночные планшеты в среду D-MEM (фирма Gibco) с 10% ФТС (фетальная сыворотка теленка) (фирма Gibco). Через различные промежутки времени: 15 мин, 1 ч и 2 ч, добавляют 50 МЕ/мл ИФН-α-2 (фирма Intron A, Schering-Plough), или 20 нг/мл КТ-1 (фирма R&D Systems, Великобритания), или комбинацию ИФН-α-2 (50 МЕ/мл) с КТ-1 (20 нг/мл). Впоследствии клетки Huh7 лизируют в лизирующем буфере (60 мМ Tris-HCl, рН 6,8, 2% ДСН (додецилсульфат натрия), 2,5% глицерина, 0,7 М 2-меркаптоэтанола и 0,02% бромфенола синего). Образцы разделяют в ДСН-полиакриламидных гелях (фирма Bio-Rad Laboratories, Калифорния) при 7,5% в восстанавливающих условиях. После электрофореза их переносят на нитроцеллюлозные мембраны (фирма Bio-Rad Laboratories) и окрашивают раствором пунцового красного (фирма Sigma-Aldrich, Германия), чтобы проконтролировать равную нагрузку белков. Мембраны инкубируют в TBS-T (50 мМ Трис-HCl (рН 7,6), 200 мМ NaCl и 0,1% Твин-20) с 5% сухого молока. Белки выявляют путем инкубации со специфическим первичным антителом в TBS-T в течение 1 ч. Затем мембраны промывают в TBS-T и на 1 ч добавляют конъюгированное с пероксидазой вторичное антитело. Мембраны тщательно промывают в TBS-T и просматривают специфические полосы белков с применением хемилюминесцентной системы детекции "Western Lightning Chemiluminescence Reagent Plus" (фирма Perkin Elmer, США), следуя инструкциям производителя. После этого мембраны подвергают радиоавтографии и проводят количественный анализ полос посредством денситометрического анализа с использованием программы Molecular Analyst/PC (фирма Bio-Rad Laboratories).
Антитела. Антитела против фосфо-STAT1tyr701 и против фосфо-STAT3tyr705, и антитело против IgG кролика, конъюгированные с ПОХ (пероксидазой хрена), приобретены в фирме Cell Signaling Technology (США). Антитела против STAT3, против фосфо-STAT1tyr727, против STAT2 и против фосфо-STAT2tyr689 получены от фирмы Upstate Biotechnology (США). Антитело против STAT1 получено от фирмы Santa Cruz Biotechnology (Санта-Круз, Калифорния). Антитело к актину получено от фирмы Sigma-Aldrich (Германия).
Чтобы установить, приводит ли комбинация цитокина семейства ИЛ-6 с ИФН-α к усилению противовирусного состояния клетки, проводят дополнительные эксперименты по следующему плану: а) проводят оценку, может ли комбинированная терапия с использованием ИФН-α в сочетании с цитокином семейства ИЛ-6 более сильно повышать экспрессию интерферон-чувствительных генов по сравнению с каким-либо из цитокинов самим по себе, б) устанавливают, обладает ли комбинированная терапия с использованием ИФН-α в сочетании с цитокином семейства ИЛ-6 более сильным действием в отношении ингибирования репликации ВГС по сравнению с каждым цитокином по отдельности, в) оценивают, является ли комбинированная терапия с использованием ИФН-α в сочетании с КТ-1 более действенной для защиты клеток против цитопатических эффектов вируса, не относящегося к ВГС, и г) определяют характер взаимодействия между ИФН-α и цитокином семейства ИЛ-6.
Эксперимент 2
Оценка влияния комбинированной терапии ИФН-α-2 в сочетании с КТ-1, или ИФН-α-2 в сочетании с ОСМ, на индукцию интерферон-чувствительных генов (ISG) (Фиг.2)
Исследуют экспрессию ISG 2'-5'ОАС, STAT1 и STAT3 на клетках Huh7, несущих репликон ВГС, после инкубации в течение 72 ч с ИФН-α-2 (5 или 50 МЕ/мл) или КТ-1 (20 нг/мл), или ОСМ (20 нг/мл), или с комбинацией ИФН-α-2 с ОСМ (см. фиг.2А-2Е). Обнаружено, что, хотя КТ-1 или ОСМ сами по себе не способны повышать или слабо повышают экспрессию этих ISG, добавление КТ-1 или ОСМ к низким или высоким дозам ИФН-α-2 приводит к заметному повышению экспрессии ISG, которая указывает, что КТ-1 или ОСМ могут значительно усиливать способность IFN-α-2 в большой степени регулировать противовирусные гены в клетках, поддерживающих репликацию вируса. Хотя три из проанализированных в настоящем изобретении ISG обладают значительным противовирусным действием, увеличение экспрессии STAT3 путем комбинирования КТ-1 или ОСМ и ИФН-α-2 является особенно существенным, поскольку этот фактор не только обладает противовирусными свойствами, но также проявляет сильное цитопротекторное и противовоспалительное действие.
Экспериментальный метод 2
ОТПЦР-анализ в реальном времени экспрессии иРНК ISG. Клетки, экспрессирующие полноразмерный репликон ВГС, засевают при плотности 100000/лунку в 6-луночные планшеты в среду D-MEM (фирма Gibco) с 10% ФТС (фирма Gibco). Добавляют 50 или 5 МЕ/мл одного ИФН-α-2 или в комбинации с 20 нг/мл КТ-1, или