Способ получения препарата с-пептида проинсулина для перорального применения
Иллюстрации
Показать всеИзобретение относится к фармакологии и медицине и представляет собой способ получения препарата С-пептида проинсулина для перорального применения на основе активированного полиэтиленгликоля, отличающийся тем, что полиэтиленгликоль активируют путем облучения ионизирующим излучением в кислой среде в присутствии катионов кальция и/или цинка до конечной концентрации 5-10 мМ, а затем смешивают с С-пептидом проинсулина, при этом берут полиэтиленгликоль с мол. массой 0,4-40 кДа и концентрацией 1,0-50,0% при соотношении С-пептид проинсулина:полиэтиленгликоль, равном 1:(1-500), до конечной концентрации С-пептида проинсулина в смеси 1-10 мг/мл. Изобретение обеспечивает повышение терапевтической активности при пероральном применении в отношении диабетических осложнений. 3 з.п. ф-лы, 1 табл., 2 ил.
Реферат
Изобретение относится к фармакологии и медицине, в частности к эндокринологии, и может быть использовано для получения лекарственных средств, в частности С-пептида проинсулина, предназначенных для перорального применения.
Человеческий С-пептид проинсулина (соединительный пептид) является пептидом, состоящим из 31 аминокислоты со следующей последовательностью: EAEDLQVGQVELGGGPGAGSLQPLALEGSLQ. С-пептид является показателем образования инсулина из проинсулина в бета-клетках островков Лангерганса поджелудочной железы. Инсулин и С-пептид являются конечными продуктами преобразования проинсулина в результате воздействия эндопептидазы.
После пероральной нагрузки глюкозой отмечается 5-6 кратное увеличение уровня С-пептида, которое сохраняется значительно дольше, чем у инсулина. В настоящее время начинают появляться отдельные данные (Cotter M.A, Ekberg К, Wahren J, Cameron N.E. Effects of proinsulin C-peptide in experimental diabetic neuropathy: vascular actions and modulation by nitric oxide synthase inhibition.Diabetes. 2003 Jul; 52(7):1812-7, Wahren J, Ekberg K, Samnegard B, Johansson B.L. C-peptide: a new potential in the treatment of diabetic nephropathy. Curr Diab Rep.2001 Dec; l(3):261-6. Review. PMID: 12643208 [PubMed - indexed for MEDLINE), свидетельствующие об умеренной эффективности С-пептида в лечении сахарного диабета и его осложнений, в частности для профилактики микроангиопатий: нефропатии и ретинопатии. Однако пока основным назначением С-пептида в медицине является его использование преимущественно в диагностических целях, в частности для контроля за функционированием бета-клеток и продуцированной ими инсулина; для оценки остаточной синтетической функции бета- клеток; при подборе дозы инсулина, в особенности в случае неэффективности применения пероральных сахароснижающих препаратов и для подтверждения ремиссии сахарного диабета; и т.д. ("Insulin, C-peptide and proinsulin in nondiabetics and insulin-treated diabetics". Heding LG. // Diabetes 1978; 27 Suppi 1:178-183).
Единственным общепринятым методом лечения сахарного диабета до настоящего времени остается использование препаратов на основе инсулина. Инсулин является полипептидным гормоном с молекулярной массой около 6000. Он оказывает влияние на все виды обмена веществ в организме: повышает проникновение глюкозы в ткани организма и ее использование ими, снижает содержание гликогена в печени и повышает его количество в мышцах, повышает интенсивность синтеза белка и т.д. Однако при инсулинотерапии развивается целый ряд диабетических осложнений, в частности появляется ангиопатия (нефропатия и ретинопатия), нейропатия, выработка антител к инсулину и развитие инсулинорезистентности, следствием чего является неэффективность коррекции гликемии и развитие кетоацидоза.
Для профилактики и лечения диабетической ангиопатии применяют ангиопротекторы пармидин (продектин, ангинин), добезилаткальций (доксиум), этамзилат (дицинон); спазмолитические средства пентоксифиллин (трентал), ксантинола никотинат (теоникол, компламин); препараты, улучшающие мозговое кровообращение,- кавинтон и др. Некоторые из этих препаратов оказывают положительное действие на систему гемостаза и реологические свойства крови, хотя с этой целью специально назначают антикоагулянты, антиагреганты, препараты, влияющие на коронарное кровообращение, гепарин, реополиглюкин, дипиридамол (курантил), ацетилсалициловую кислоту и др. (Старкова Н.Т. Клиническая эндокринология, с.189, М., 1983).
Существует несколько комплексов и схем лечения диабетических осложнений, например сочетанный прием в течение 1-11/2 месяцев курантила, фитина и глутаминовой кислоты; курс внутривенных инфузий реополиглюкина (400 мл), трентала (5 мл), гепарина (раствор для инъекций с активностью 5000 ЕД в 1 мл, 6,5 мл) в течение 7-10 дней; курс из 10-15 ретробульбарных инъекций реополиглюкина (0,3 мл), дексазона (0,2 мл), гепарина (0,2 мл) (Ефимов А.С. Диабетические ангиопатии, М., 1989).
Однако эффективных методов предупреждения и лечения диабетической ангиопатии в настоящее время не существует. Использование многочисленных лекарственных средств, влияющих на состояние сосудистой стенки и системы свертывания крови, при прогрессировании нарушений углеводного обмена, не оказывает существенного профилактического действия на появление и неуклонное прогрессирование диабетической ангиопатии у многих больных сахарным диабетом.
Известно средство для лечения диабета и для предотвращения его осложнений (патент GB 2104382, опубликованный 09.03.1983), представляющее собой смесь инсулина и С-пептида, взятых в определенном весовом соотношении, и в ассоциации с фармацевтически приемлемым носителем.
Однако это средство предназначено исключительно для парентерального введения внутримышечно или внутривенно и не пригодно для перорального применения. С-пептид в кровяном русле в норме очень быстро разлагается под действием ферментов крови. А при сахарном диабете он, как производный проинсулина, вырабатывается в ограниченном количестве.
Известен способ получения препарата С-пептида проинсулина, пригодного для перорального применения (WO 2004083234, on. 30.09.2004), заключающийся в том, что сначала химическим путем активируют олигомер, содержащий гидрофильный участок и/или липофильный участок, в качестве которого используют полиэтиленгликоль, затем обеспечивают контактирование проинсулинового полипептида с активированным олигомером в условиях, достаточных для присоединения олигомера к С-полипептиду и создания конъюгата С- полипептида-олигомер, для чего используют такие растворители, как диметилсульфоксид (dimethylsulfoxide) и триэтиламин (triethylamine). Кроме того, способ требует использования активирующих химических агентов, таких как N-гидроксисукцинимид (N-hydroxysuccinimide), p-нитрофенилхлолроформиат (p-nitrophenylchloroformate), 1,3-дициклогексилкарбодиимид (1,3-dicyclohexylcarbodiimide), гидроксибензотриазид (hydroxybenzotriazide).
Применение высокотоксичных реагентов для химической активации полимеров требует для очистки продуктов синтеза применения сложных и дорогих хроматографических методов очистки. Кроме того, многие из указанных реактивов не производятся в промышленных масштабах и поэтому дороги и малодоступны.
Недостатками известного способа являются технологическая сложность получения коньюгатов С-пептида проинсулина с олигомером, необходимость использования для активации полиэтиленгликоля высокотоксичных химических агентов, от которых необходимо очищать препарат хроматографическими методами, а также высокая стоимость полученных препаратов. Кроме того, авторы изобретения, описанного в заявке WO 2004083234, не подтвердили наличие биологической активности у коньюгатов С-пептида проинсулина с полиэтиленгликолем.
Технической задачей предлагаемого изобретения является упрощение и удешевление способа получения препарата С-пептида проинсулина для перорального применения, а также повышение его терапевтической эффективности при пероральном применении.
Решение поставленной задачи достигается тем, что предложен способ получения препарата С-пептида проинсулина для перорального применения с использованием активированного полиэтиленгликоля, в котором согласно изобретению полиэтиленгликоль активируют путем облучения ионизирующим излучением в кислой среде в присутствии катионов кальция и/или цинка до конечной концентрации 5-10 мМ, а затем смешивают с С-пептидом проинсулина, при этом берут полиэтиленгликоль с мол. массой 0,4-40 кДа и концентрацией 1,0-50,0% в соотношении С-пептид проинсулина:полиэтиленгликоль, равном 1:(1-500), до конечной концентрации С-пептида проинсулина в смеси 1-10 мг/мл.
Полиэтиленгликоль активируют путем облучения потоком ускоренных электронов или гамма-излучением в дозах 1,0-5,0 Мрад.
Для подкисления полиэтиленгликоля берут преимущественно органическую кислоту, например уксусную, лимонную, яблочную, и поддерживают при активации полиэтиленгликоля pH 2,5-4,5.
Для подкисления полиэтиленгликоля можно использовать и другие органические кислоты, например фумаровую, янтарную, молочную и другие, не токсичные для организма кислоты.
В качестве водорастворимого полимера, кроме полиэтиленгликоля можно также использовать декстраны, поливинилпирролидон, изопренолы, полиакриламид, полиуретан молекулярной массы не более 20000 Да, предпочтительно от 400 до 20000 Да и наиболее предпочтительно молекулярной массы от 400 до 4000 Да.
В качестве С-пептида используют выделенный и очищенный натуральный или синтетический, или генно-инженерный рекомбинантный С-пептид проинсулина.
Полученный препарат можно использовать в лиофилизированной форме, или в форме раствора, или таблетированной, или капсулированной форме с содержанием С-пептида в терапевтически эффективном количестве для перорального и/или парэнтерального, и/или ингаляционного применения, например интраназально.
Предлагаемый способ осуществляют следующим образом:
Готовят 1-50% водный раствор полиэтиленгликоля с молекулярной массой от 400 до 4000 Да. Затем раствор подкисляют до рН 2,5-4,5, добавляют катионы кальция и/или цинка до конечной концентрации 5-10 мМ и облучают высокоэнергетическим ионизирующим излучением, преимущественно гамма-излучением или потоком ускоренных электронов в дозах, обеспечивающих протекание свободно-радикальных реакций, преимущественно 1,0-5,0 Мрад. Далее в раствор радиационно-активированного полиэтиленгликоля вводят С-пептид проинсулин до конечной концентрации (по белку) от 1-10 мг/мл в соотношении полиэтиленгликоль: С-пептид проинсулина, равном (1-500):1, смесь перемешивают в течение 10-30 минут до получения однородного прозрачного или слегка опалесцирующего раствора. Полученный препарат нейтрализуют. При облучении в ходе радиационно-химического окисления полиэтиленгликоля образуются высокоактивные карбонильные группы. Активированный таким способом полимер образует с С-пептидом проинсулина водорастворимый препарат, который эффективно уменьшает осложнения течения сахарного диабета, такие как диабетическая стопа, ретинулопатия, нефропатия, в том числе и при пероральном введении.
Экспериментально было показано, что препарат С-пептида проинсулина с полиэтиленгликолем при пероральном применении всасывается в кровь.
Кроме того, оказалось неожиданным, что присутствие при активировании полиэтиленгликоля катионов кальция и цинка позволило увеличить биологическую активность препарата и повысить его устойчивость в кислой среде.
В качестве источника ионизирующего излучения можно использовать электронное излучение (направленный поток ускоренных электронов), гамма-излучение, рентгеновское излучение, лазерное излучение и ультрафиолетовое излучение. Необходимая аппаратура и методики ионизации описаны в следующих публикациях: (Gonchar A.M. and Auslender V.L., 1996; Gonchar A.M. and Auslender V.L., 1998, Vereschagin E.I., et al., 2001).
В наиболее предпочтительном варианте предлагается воздействовать на полиэтиленгликоль направленным потоком ускоренных электронов. В конкретном случае осуществления способа облучение полиэтиленгликоля проводили тормозным излучением, генерируемым ускорителем ИЛУ-6 или ИЛУ-10 с энергией электронов 2,5 МэВ, поглощенная доза от 2 до 10 кГр, скорость набора дозы 1,65 кГр/ч.
Предлагаемое изобретение иллюстрируется следующими примерами конкретного получения предлагаемого препарата, содержащего генно-инженерный (рекомбинантный) С-пептид проинсулина.
Пример 1
10% водный раствор полиэтиленгликоля (ПЭГ) с молекулярной массой 1500 Да (ПЭГ-1500) облучают потоком ускоренных электронов в дозе 2,0 Мрад в кислой среде в присутствии 5 мМ катионов кальция. Подкисление ведут 0,1 М раствором уксусной кислоты до pH 3, а катионы кальция вводят за счет добавления в раствор хлористого кальция до достижения концентрации в пересчете на Са2+ до 5 мМ, проверяют рН и, при необходимости, подтитровывают. В облученный раствор полиэтиленгликоля вносят С-пептид проинсулина (генно-инженерный рекомбинантный) до конечной концентрации 10 мг в 1 мл (соотношение полиэтиленгликоль: С-пептид равно 10:1). Смесь перемешивают 10 мин и получают препарат С-пептида в виде слегка опалесцирующего раствора.
Пример 2
50,0% водный раствор полиэтиленгликоля с молекулярной массой 400 Да облучают тормозным гамма-излучением в дозе 1,0 Мрад в кислой среде рН 2,5 в присутствии катионов цинка. Для чего подкисление ведут 1 М раствором лимонной кислоты и добавляют к раствору полиэтиленгликоля 1 М раствор хлористого цинка до достижения концентрации 10 мМ Zn2+, проверяют рН и, при необходимости, подтитровывают 1М лимонной кислотой. В облученный раствор полиэтиленгликоля вносят С-пептид проинсулина до конечной концентрации 1 мг в 1 мл (соотношение полиэтиленгликоль: С-пептид равно 500:1). Смесь перемешивают 30 минут и получают препарат С-пептида в виде прозрачного раствора.
Пример 3
Для сравнения биологической активности готовили препарат генно-инженерного (рекомбинантного) С-пептида проинсулина, смешанного с раствором полиэтиленгликоля, активированного путем облучения потоком ускоренных электронов в нейтральной среде в отсутствии двухвалентных ионов металлов.
Для этого 10% водный раствор полиэтиленгликоля (ПЭГ) с молекулярной массой 1500 Да (ПЭГ-15 00) облучали потоком ускоренных электронов в дозе 2,0 Мрад. В облученный раствор вносили генно-инженерный С-пептид проинсулина до конечной концентрации 10 мг в 1 мл (соотношение полиэтиленгликоль: С-пептид проинсулина равно 10:1). Смесь перемешивали 10 минут и получали препарат С-пептида проинсулина в виде слегка опалесцирующего раствора.
В таблице представлены данные по исследованию эффективности внутрижелудочного введения препарата человеческого геннно-инженерного (рекомбинантного) С-пептида, полученного как описано в примере 1 (опыт 1), на модели аллоксанового диабета у крыс в сравнении с контролем 1 (физиологический раствор), контролем 2 (геннно-инженерный С-пептид без полиэтиленгликоля) и опытом 2 (геннно-инженерный С-пептид, полученный по примеру 3).
Эксперименты были проведены на 80 крысах-самцах Вистар массой 200-250 г. Аллоксановый диабет индуцировали введением животным 60 мг аллоксана 2 раза энтерально (Spadella C.T, Lerco M.M, Machado J.L, Macedo C.S, Long-term effects of insulin therapy, islet transplantation, and pancreas transplantation in the prevention of glomerular changes in kidneys of alloxan-induced diabetic rats. Transplant Proc. 2005 Oct;37(8):3468-71; Liu J, Yu Y, Fan Y.Z, Chang H, Liu H.M, Cui Y, Chen Q, Wang R. Cardiovascular effects of endomorphins in alloxan-induced diabetic rats. Peptides. 2005 Apr; 26(4):607-14.).
Кровь для исследования забирали из надрезов на хвосте. Содержание глюкозы в крови определяли на приборе "SmartScan" ("Johnson & Johnson company", USA).
Препарат генно-инженерного рекомбинантного С-пептида проинсулина, полученный по примеру 1, вводили ежедневно внутрижелудочно в дозе 10 мг одной группе животных (опыт 1). Препарат генно-инженерного С-пептида проинсулина, полученный по примеру 3, также вводили ежедневно внутрижелудочно в дозе 10 мг другой группе животных (опыт 2). В контрольной группе 1 животным вводили физиологический раствор, в другой контрольной группе 2 животным вводили генно-инженерный С-пептид проинсулина, не содержащий полиэтиленгликоля, в дозе 10 мг.
| ТаблицаЭффект препарата С-пептида проинсулина при пролонгированном энтеральном введении у крыс с аллоксановым диабетом. | ||||
| Контрольная группа 1 (5 мл физиологического раствора ежедневно энтерально в течение 7 дней) | Контрольная группа 2 (10 мг генно-инженерного С-пептида проинсулина ежедневно энтерально в течение 7 дней) | Опытная группа 1 (10 мл препарата по примеру 1, содержащего 10 мг генно-инженерного С-пептида проинсулина, ежедневно энтерально в течение 7 дней) | Опытная группа 2 (10 мл препарата по примеру 3, содержащего 10 мг генно-инженерного С-пептида проинсулина, ежедневно энтерально в течение 7 дней) | |
| 1 | 2 | 3 | 4 | |
| Нормализация уровня гликемии в течение 30 дней | 25% животных | 25% животных | 95% животных | 75% животных |
| Глюкозурия | +++ | +++ | - | + |
| Протеинурия | + | + | - | - |
| Склеротические изменения в поджелудочнойжелезе | ++ | ++ | ||
| Нефропатия | ++ | ++ | - | - |
Как видно из представленных в таблице результатов, препарат С-пептида проинсулина, полученный по примеру 1, при энтеральном введении крысам с аллоксановой моделью диабета нормализовал функцию почек и у 95% животных стабилизировал уровень сахара в крови. Кроме того, из данных в таблице видно, что препарат, полученный предлагаемым способом, позволяет не только снизить, но и стабилизировать уровень глюкозы по сравнению с интактными животными, что свидетельствует о его высокой лечебной эффективности. При морфологическом исследовании также было установлено, что у животных опытной группы (опыт 1) патологические изменения во внутренних органах, связанные с микроангиопатиями, практически отсутствовали. Напротив, у животных контрольных групп 1 и 2 эти изменения были явно выражены, что свидетельствует о высокой лечебной и профилактической активности полученного предлагаемым способом препарата С-пептида в отношении осложнений сахарного диабета.
Исследование фармакокинетики С-пептида (С-пептид проинсулина человеческий рекомбинантный) при подкожном введении проводили на 21 крысах-самцах Вистар массой 430-540 г. При этом одной группе животных (7 особей) вводили нативный препарат С-пептид проинсулина человеческого рекомбинантного, не содержащий полиэтиленгликоль (контроль), другой группе животных (7 особей) вводили препарат С-пептид проинсулина человеческого рекомбинантного, полученного по примеру 1 (опыт 1), и третьей группе животных (7 особей) вводили препарат С-пептида проинсулина человеческого рекомбинантного, полученного по примеру 3 (опыт 2). Животные содержались на стандартном рационе вивария и на время проведения исследования имели свободный доступ к воде и пище в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей. Препараты вводили подкожно в дозе 5 мг/кг (в пересчете на С-пептид проинсулина). Пробы крови (0,3 мл) забирали из хвостовой вены бодрствующих животных в гепаринизированные капилляры, отделяли плазму центрифугированием и до момента анализа плазму хранили при температуре 3-5°С не более 3 сут.
Для количественного определения содержания в плазме С-пептида использовали иммуноферментный тест Mercodia C-peptide ELISA specific.
Пробы крови у каждого животного отбирали в каждой временной точке.
При исследовании фармакокинетики С-пептида забор проб крови проводили до и через 0,25; 0,5; 1; 2; 3; 4, 6 и 12 ч после введения препарата.
Для построения фармакокинетических кривых использовали кратность между исходным содержанием С-пептида (до введения препарата) и найденным содержанием препарата в каждой временной точке.
Выбор временных точек для исследования концентрации С-пептида в крови производили по данным предварительных исследований с учетом рекомендаций [Холодов Л.Е., Яковлев В.П., 1985].
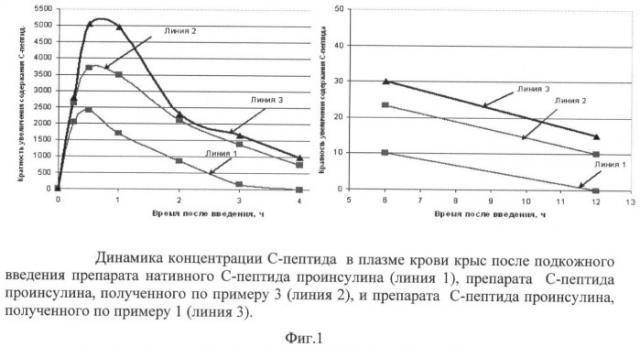
На фиг.1 представлена динамика концентрации С-пептида в плазме крови крыс после подкожного введения препарата нативного С-пептида проинсулина (линия 1), препарата С-пептида проинсулина, полученного по примеру 1 (линия 3), и препарата С-пептида проинсулина, полученного по примеру 3 (линия 2).
Как видно из представленных результатов, содержание С-пептида в крови крыс, получавших препарат, приготовленный по примеру 3, было выше, чем у крыс, получавших нативный С-пептид, через 30 мин в 1.54 раза, через 1 час в 2.1 раза, через 3 часа в 93 раза, через 4 часа в 107 раз. В то же время содержание С-пептида в крови крыс, получавших препарат, приготовленный по примеру 1, было выше, чем у крыс, получавших препарат, приготовленный по примеру 3, через 30 мин в 2,1 раза, через 1 час в 3 раза, через 3 часа в 110 раз, через 4 часа в 140 раз.
Это свидетельствует о том, что препарат С-пептида проинсулина, полученный по примеру 1, более стоек к действию пептидаз крови, чем препарат, полученный по примеру 3. О пролонгированном действии препарата С-пептида проинсулина, полученного по примеру 1, свидетельствует тот факт, что он определялся в крови через 12 часов после введения, нативный - через 6 часов, а препарат, полученный по примеру 3, определялся в крови через 8 часов после подкожного введения.
Определение фармакокинетики С-пептида человеческого генно-инженерного (рекомбинантного) при энтеральном введении.
Исследование фармакокинетики С-пептида (С-пептид проинсулина человеческий рекомбинантный) при энтеральном введении проводили на 15 крысах-самцах Вистар массой 430-540 г. При этом одной группе животных (5 особей) вводили нативный препарат С-пептид проинсулина человеческого рекомбинантного, не содержащий полиэтиленгликоль (контроль), другой группе животных (5 особей) вводили препарат С-пептид проинсулина человеческого рекомбинантного, полученного по примеру 1 (опыт 1), и третьей группе животных (5 особей) вводили препарат С-пептида проинсулина человеческого рекомбинантного, полученного по примеру 3 (опыт 2). Животные содержались на стандартном рационе вивария и на время проведения исследования имели свободный доступ к воде и пище в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей. Препараты вводили внутрижелудочно при помощи зонда в дозе 10 мг/кг (в пересчете на С-пептид). Пробы крови (0,3 мл) забирали из хвостовой вены бодрствующих животных в гепаринизированные капилляры, отделяли плазму центрифугированием и до момента анализа плазму хранили при температуре 3-5°С не более 3 сут.
Для количественного определения содержания в плазме С-пептида использовали иммуноферментный тест Mercodia C-peptide ELISA specific.
Пробы крови у каждого животного отбирали в каждой временной точке.
При исследовании фармакокинетики С-пептида забор проб крови проводили до и через 1; 2; 3; 4, 5, 6 и 12 ч после введения препарата.
Для построения фармакокинетических кривых использовали кратность между исходным содержанием С-пептида (до введения препарата) и найденным содержанием препарата в каждой временной точке.
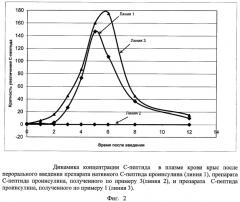
Результаты представлены на фиг.2.
Как видно из представленных результатов, всасывание из желудка происходит только для препаратов С-пептида проинсулина, полученных по примерам 1 и 3. Нативный С-пептид не всасывается и не влияет на концентрацию С-пептида в крови.
Препарат С-пептида, полученный по примеру 3, хорошо всасывается из желудка, его максимальная концентрация в крови достигается через 5 часов и превышает исходный уровень в 147 раз, через 12 часов уровень превышения незначителен. Из желудка всасывалось 17% введенного препарата.
Препарат С-пептида, полученный по примеру 1, также хорошо всасывается из желудка, его максимальная концентрация в крови достигается через 6 часов и превышает исходный уровень в 175 раз, через 12 часов уровень превышения еще заметен. Из желудка всасывалось более 25% веденного препарата.
Эти результаты подтверждают более высокую эффективность препарата С-пептида проинсулина, полученного по примеру 1, при пероральном применении.
Таким образом, приведенные выше примеры показывают, что препарат С-пептида проинсулина, полученный предлагаемым способом, может быть использован для предупреждения диабетических осложнений, а именно уменьшения протеинурии и нефропатии.
Препарат, полученный предлагаемым способом, может вводиться в организм перорально, парэнтерально, а также интраназально и имеет более пролонгированное действие в организме, чем свободный С-пептид проинсулина.
Кроме того, препараты С-пептида проинсулина, полученные предлагаемым способом, сохраняли свою активность при хранении в течение суток при рН 2-3 даже при комнатной температуре.
Заявляемый способ получения препарата С-пептида проинсулина для перорального применения, в отличие от способа-прототипа, отличается простотой и экономичностью, так как его получение состоит всего из двух стадий, активация полиэтиленгликоля ионизирующим излучением в кислой среде в присутствии катионов кальция и/или цинка и смешивание его с С-пептидом проинсулина до требуемой концентрации (активности). Для его осуществления не требуется применение высокотоксичных реактивов. Препарат С-пептида проинсулина, получаемый заявляемым способом, обладает терапевтической активностью, определяемой по уменьшению протеинурии и нефропатии, и может быть использован для перорального, парентерального и интраназального введения.
1. Способ получения препарата С-пептида проинсулина для перорального применения на основе активированного полиэтиленгликоля, отличающийся тем, что полиэтиленгликоль активируют путем облучения ионизирующим излучением в кислой среде в присутствии катионов кальция и/или цинка до конечной концентрации 5-10 мМ, а затем смешивают с С-пептидом проинсулина, при этом берут полиэтиленгликоль с мол. массой 0,4-40 кДа и концентрацией 1,0-50,0%, при соотношении С-пептид проинсулина: полиэтиленгликоль, равном 1:(1-500) до конечной концентрации С пептида проинсулина в смеси 1-10 мг/мл.
2. Способ по п.1, отличающийся тем, что полиэтиленгликоль активируют путем облучения потоком ускоренных электронов или гамма-излучением в дозах 1,0-5,0 Мрад.
3. Способ по п.1, отличающийся тем, что для подкисления полиэтиленгликоля преимущественно берут органическую кислоту, например уксусную, лимонную, яблочную.
4. Способ по п.1, отличающийся тем, что полиэтиленгликоль активируют при рН 2,5-4,5.