Полисульфатированные гликозиды и их соли
Иллюстрации
Показать всеИзобретение относится к группе соединений общей формулы (I), где R1, R2, R3, R4, R5 и R6 независимо друг от друга означают C1-4 алкил, -SO3H, полисульфатированную β-гликозильную или полисульфатированную дигликозильную группу, при условии, что, по меньшей мере, один из R1-R6 представляет собой полисульфатированную β-гликозильную или полисульфатированную дигликозильную группу, или их фармацевтически приемлемым солям, где гликозильная группа содержит молекулу пентопиранозы или гексопиранозы с конфигурацией по выбору, а дигликозильная группа содержит молекулу пентопиранозы или гексопиранозы с конфигурацией по выбору, одна гидроксильная группа которой гликозилирована другой молекулой пентопиранозы или гексопиранозы с конфигурацией по выбору. Изобретение относится также к фармацевтической композиции для использования в лечении острых или хронических воспалительных заболеваний дыхательных путей у млекопитающих на основе указанных соединений или их фармацевтически приемлемых солей. Кроме того, изобретение относится к применению указанных соединений или их фармацевтически приемлемых солей в получении лекарственного средства для лечения острых или хронических воспалительных заболеваний дыхательных путей у млекопитающих. 7 н. и 30 з.п. ф-лы, 4 табл.
Реферат
Настоящее изобретение относится к гликозидам, их солям и фармацевтическим композициям, содержащим такие гликозиды в качестве активных ингредиентов. Более того, изобретение обеспечивает способ профилактики, лечения или облегчения симптомов острых или хронических воспалительных расстройств дыхательных путей у млекопитающих, включая астму и патологии, связанные с астмой.
УРОВЕНЬ ТЕХНИКИ
Воспаление представляет собой многоступенчатый каскадный процесс, который может быть предметом потенциального терапевтического вмешательства. Вкратце, воспаление вызывает инфильтрацию иммунологически компетентных клеток (например, эозинофилов, тучных клеток, активированных T-лимфоцитов) в месте повреждения, где они, вместе с резидентными клетками, высвобождают биологически активные медиаторные вещества (например, гистамин, протеазы, множество цитокинов и хемокинов), которые увеличивают проницаемость близких кровеносных сосудов, привлекают и стимулируют соседние клетки. Измененная проницаемость сосудов приводит к образованию жидкого экссудата в месте повреждения с последующим притоком реактивных лейкоцитов и их потенциальным оттоком в поврежденную область. (Для описания смотрите, Trowbridge and Emling, Inflammation: A Review of the Process Quintessence Pub. Co., 1997). Секреция коллагена и слизи и пролиферация резидентных клеток (гладкомышечные и эпителиальные клетки или фибробласты, стимулированные высвобожденными медиаторами) устанавливают степень выраженности патологических изменений (например, обструкции дыхательных путей) и участвуют в их развитии.
Воспаление связано со множеством легочных состояний, включая, например, эндогенную или экзогенную бронхиальную астму, любое воспалительное заболевание легких, острый или хронический бронхит, легочные воспалительные реакции, вторичные по отношению к хроническому бронхиту, хронические обструктивные заболевания легких, пневмосклероз, а также любые заболевания легких, при которых могут играть роль лейкоциты, включая, но не ограничиваясь, идиопатический пневмосклероз и любые другие аутоиммунные заболевания легких. Астма является одной из наиболее частых форм легочного воспаления, поражающей крупные и мелкие дыхательные пути легких. Ей страдает от 5% до 10% населения, что приводит к предполагаемым 27 миллионам визитов пациентов, 6 миллионам потерянных рабочих дней, и 90,5 миллиона дней ограниченной активности в год. Степень заболеваемости и смертности от астмы увеличивается во всем мире (Plaut and Zimmerman, "Allergy and Mechanisms of Hypersensitivity" in Fundamental Immunology. 3rd Ed, Paul (ed.), Raven Press, New York, NY, at 1399 (1993)).
Обычное лечение от астмы основано на четком избегании всех инициирующих аллергенов, чего по существу трудно достичь, и на терапевтических схемах, основанных на фармакологических агентах, имеющих неблагоприятные побочные эффекты и субоптимальные фармакокинетические свойства. β2-адренергические агонисты, используемые для лечения бронхоспазма, не оказывают эффекта на воспаление дыхательных путей или гиперреактивность бронхов (Palmer et al, New Engl. J. Med. 331:1314 (1994)). Также систематическое или длительное применение β2-адренергических агонистов связано с недостаточным контролем астмы, увеличением гиперреактивности дыхательных путей в ответ на аллерген и сниженной защитой от бронхоконстрикции (Bhagat et al., Chest 108:1235 (1995)). Более того, считается, что хроническое использование β2-адренергических агентов отдельно посредством подавления β2-адренергических рецепторов, будет ухудшать гиперреактивность бронхов. Теофиллин (противоастматический метилксантин) характеризуется существенной вариабельностью всасывания и выведения. Кортикостероиды, хотя являются относительно безопасными у взрослых пациентов, являются токсичными для детей, приводя к подавлению надпочечников и снижению костной плотности и роста (Woolock et al, am. Respir. Crit. Care Med. 153:1481 (1996)). Кромолин, используемый для предотвращения астматических эпизодов, эффективен для предотвращения астматической реакции только при введении перед воздействием (Volcheck et al, Postgrad Med. 104(3): 127 (1998)). Антигистаминные средства периодически предотвращают или останавливают аллергические астматические эпизоды, особенно у детей, но часто являются только частично эффективными, так как гистамин является только одним из множества медиаторов, связанных с воспалением (Cuss, "The Pharmacology of Antiasthma Medications", in Asthma as an Inflammatory Disease. O'Byrne, Ed., Dekker, Inc., New York, at 199 (1990)) and O'Byrne, "Airway Inflammation and Asthma", in Asthma as an Inflammatory Disease. O'Byrne, Ed., Dekker, Inc., New York, NY, 143 (1990)).
Следовательно, существующие возможности лекарственных средств имеют ряд недостатков. В общем, обычные агенты имеют относительно небольшую продолжительность действия и могут быть частично или полностью неэффективными при введении после возникновения антигенной стимуляции. Более того, из-за серьезных побочных эффектов, связанных с применением агентов, таких как β2-адренергические агонисты и кортикостероиды, терапевтические границы диапазона безопасности таких агентов являются относительно узкими, и за пациентами, использующими такие агенты, необходимо тщательно наблюдать (смотрите, например, WO 94/06783, WO 99/06025, патенты США №№ 5690910 и 5980865). В последнем клиническом исследовании ингаляционных кортикостероидов у детей 5-11 лет возникало только временное улучшение функции дыхательных путей с астмой после первого года лечения, с уменьшением до наблюдаемого при использовании плацебо в течение последующих 3 лет (The Childliood Asthma Management Program Research Group, N. Engl. J. Med., 343:1054 (2000)). Такое снижение наилучшим образом может быть объяснено перестроечными изменениями (характерным свойством астмы), возникающими в дыхательных путях, которые являются устойчивыми к кортикостероидам (Davies, Curr. Opin. Allergy Clin. Immunol, 1:67 (2001)).
Из соответствующей литературы известно, что определенные смеси полисульфатированных дисахаридов, имеющих структуру, тесно связанную с таковой согласно настоящему изобретению, и которые были синтезированы обработкой азотистой кислотой таких естественных продуктов, как, например, гепарин или сульфат гепарина, с последующим восстановлением боргидридом и последующим сульфатированием частично очищенных образцов (US 5690910; US 5980865 и WO 02/083700) - проявляли противовоспалительный эффект на различных моделях астмы.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым гликозидам и способам получения таких соединений и фармацевтических композиций, содержащих такие соединения, с четко определенной химической структурой, которые имеют более благоприятные фармакологические свойства и меньше нежелательных побочных эффектов, чем известные противоастматические средства. Изобретение, кроме того, относится к способам лечения пациентов, нуждающихся в лечении, включающим введение новых гликозидов и композиций указанных гликозидов указанным пациентам.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
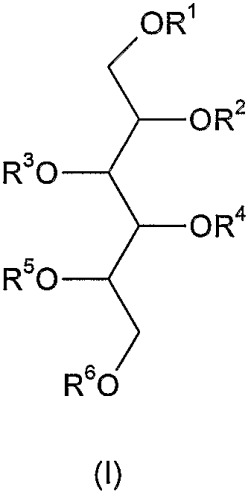
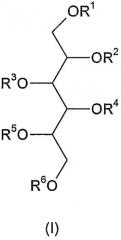
В соответствии с упомянутыми выше фактами изобретение относится к новым полисульфатированным гликозидам формулы (I),
где R1, R2, R3, R4, R5 и R6 независимо друг от друга означают -H, C1-4 алкил, -SO3H, сульфатированную или несульфатированную гликозильную или сульфатированную или несульфатированную дигликозильную группу, при условии, что, по меньшей мере, один из R1-R6 представляет собой сульфатированную или несульфатированную гликозильную или сульфатированную или несульфатированную дигликозильную группу - а также их возможные изомеры и фармацевтически приемлемые соли. Термин "фармацевтически приемлемые соли" включает, например, соли щелочных металлов и соли щелочноземельных металлов и любых других фармацевтически приемлемых противоиона или противоионов, связанных с одной или более сульфатными группами в молекуле.
Так как все четыре вторичных атома углерода сахарного спирта представляют собой хиральные центры, очевидно, все возможные стереоизомеры (аллит, галактит, идит, маннит, глюцит и талит), а также их D- и L-энантиомеры охватываются формулой (I). Термин "изомер" в настоящем описании включает все такие соединения и их варианты в соединении формулы (I).
Значением сульфатированной гликозильной группы может быть молекула пентопиранозы или гексопиранозы с конфигурацией по выбору, одна или более гидроксильных групп которой присутствуют в виде O-сульфатного сложного эфира, и компонент сахара прикреплен к агликону его аномерным атомом углерода посредством α- или β-связи. Несульфатированная гликозильная группа содержит все гидроксильные группы или их защищенные варианты. Несульфатированные соединения являются применимыми в качестве промежуточных соединений для получения сульфатированных соединений, указанных в настоящем описании.
Значением полисульфатированной дигликозильной группы может быть молекула пентопиранозы или гексопиранозы с конфигурацией по выбору, одна из гидроксильных групп которой является гликозилированной дополнительной молекулой пентопиранозы или гексопиранозы с конфигурацией по выбору, и все гидроксильные группы образованного таким образом дигликозильного компонента присутствуют в виде O-сульфатных сложных эфиров, а сахарный компонент прикреплен к агликону своим аномерным атомом углерода посредством α- или β-связи.
Все возможные стереоизомеры (арабино-, ликсо-, рибо- и ксило-) включены в структуру пентоз, а также их D- и L-энантиомеров. Подобным образом все возможные стереоизомеры (алло-, альтро-, галакто-, глюко-, гуло-, идо-, манно- и талло-) включены в структуру гексоз, а также их D- и L-энантиомеров. Термин "изомер" включает все такие соединения и их варианты в соединение формулы (I).
Значением C1-4 алкильной группы являются группы метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил предпочтительно метильная группа.
Соли щелочных металлов и соединений по изобретению означают соли Na, К или Li, тогда как соли щелочноземельных металлов предпочтительно представляют собой соли Мg и Са.
Такие соединения формулы (I), а также их соли щелочных металлов и щелочноземельных металлов, где значением R1 является полисульфатированная гликозильная или дигликозильная группа, а значением R2-R6 является -SO3Н, представляют собой предпочтительную группу соединений по изобретению.
Такие соединения формулы (I), а также их соли щелочных металлов и щелочноземельных металлов, где значением R1, R2, R4, R5 и R6 является -SO3H, а значением R3 является полисульфатированная гликозильная или дигликозильная группа, представляют собой дополнительную предпочтительную группу соединений по изобретению.
Такие соединения формулы (I), а также их соли щелочных металлов и щелочноземельных металлов, где значением R1, R2, R3, R5 и R6 является -SO3H, а значением R4 является полисульфатированная гликозильная или дигликозильная группа, представляют собой дополнительную предпочтительную группу соединений по изобретению.
Такие соединения формулы (I), а также их соли щелочных металлов и щелочноземельных металлов, где значением R1 и R3 является полисульфатированная гликозильная группа, а значением R2, R4, R5 и R6 является -SO3H, представляют собой другую предпочтительную группу соединений по изобретению.
Такие соединения формулы (I), а также их соли щелочных металлов и щелочноземельных металлов, где значением R1 и R6 является полисульфатированная гликозильная или дигликозильная группа, а значением R2, R3, R4 и R5 является -SO3H, представляют собой другую предпочтительную группу соединений по изобретению.
Такие соединения формулы (I), а также их соли щелочных металлов и щелочноземельных металлов, где значением R1 является полисульфатированная гликозильная или дигликозильная группа, значением R3 и R4 является C1-4 алкильная группа, тогда как значением R2, R5 и R6 является -SO3H, представляют собой другую предпочтительную группу соединений по изобретению.
Такие соединения формулы (I), а также их соли щелочных металлов и щелочноземельных металлов, где значением R1 и R6 является полисульфатированная гликозильная или дигликозильная группа, значением R3 и R4 является C1-4 алкильная группа, тогда как значением R2 и R5 является -SO3H, представляют собой другую предпочтительную группу соединений по изобретению.
Особенно предпочтительными представителями соединений формулы (I) по настоящему изобретению являются - без ограничения - следующие:
нона-калиевая соль 2,3,4,5,6-пента-О-сульфато-1-О-(2,3,4,6-тетра-О-сульфато-β-D-глюкопиранозил)-D-маннита,
нона-калиевая соль 1,2,3,4,5-пента-O-сульфато-6-O-(2,3,4,6-тетра-O-сульфато-β-D-глюкопиранозил)-D-глюцитола,
нона-калиевая соль 2,3,4,5,6-пента-О-сульфато-1-О-(2,3,4,6-тетра-О-сульфато-β-D-глюкопиранозил)-D-глюцитола,
нона-калиевая соль 1,2,4,5,6-пента-O-сульфато-3-O-(2,3,4,6-тетра-O-сульфато-β-D-глюкопиранозил)-D-глюцитола,
нона-калиевая соль 1,2,3,5,6-пента-О-сульфато-4-О-(2,3,4,6-тетра-О-сульфато-α-D-глюкопиранозил)-D-глюцитола,
нона-калиевая соль 1,2,3,5,6-пента-О-сульфато-4-О-(2,3,4,6-тетра-О-сульфато-β-D-глюкопиранозил)-D-глюцитола,
нона-калиевая соль 1,2,3,5,6-пента-О-сульфато-4-О-(2,3,4,6-тетра-О-сульфато-β-D-галактопиранозил)-D-глюцитола,
додека-калиевая соль 2,4,5,6-тетра-О-сульфато-1,3-бис-О-(2,3,4,6-тетра-О-сульфато-β-D-глюкопиранозил)-D-глюцитола,
додека-калиевая соль 2,4,5,6-тетра-О-сульфато-1,6-бис-О-(2,3,4,6-тетра-О-сульфато-β-D-глюкопиранозил)-D-маннита,
октадека-калиевая соль 2,4,5,6-тетра-O-сульфато-1,6-бис-O-(2,3,4,2',3',4',6'-гепта-O-сульфато-β-гентиобиопиранозил)-D-маннита,
додека-калиевая соль 2,3,4,5,6-пента-О-сульфато-1-О-(2,3,4,2',3',4',6'-гепта-О-сульфато-β-гентиобиопиранозил)-D-маннита,
гепта-калиевая соль 3,4-ди-O-метил-2,5,6-три-O-сульфато-1-O-(2,3,4,6-тетра-O-сульфато-β-D-глюкопиранозил)-D-маннита,
дека-калиевая соль 3,4-ди-О-метил-2,5-ди-О-сульфато-1,6-бис-О-(2,3,4,6-тетра-О-сульфато-β-D-глюкопиранозил)-D-маннита,
дека-калиевая соль 3,4-ди-O-метил-2,5,6-три-О-сульфато-1-O-(2,3,4,2',3',4',6'-гепта-O-сульфато-β-гентиобиопиранозил)-D-маннита,
гексадека-калиевая соль 3,4-ди-О-метил-2,5-ди-О-сульфато-1,6-бис-О-(2,3,6,2',3',4',6'-гепта-О-сульфато-β-лактозил)-D-маннита,
окта-калиевая соль 2,3,4,5,6-пента-О-сульфато-1-О-(2,3,4-три-О-сульфато-α-D-арабинопиранозил)-D-маннита,
окта-калиевая соль 2,3,4,5,6-пента-О-сульфато-1-О-(2,3,4-три-О-сульфато-β-D-ксилопиранозил)-D-маннита,
додека-калиевая соль 2,4,5,6-тетра-O-сульфато-1,6-бис-O-(2,3,4,6-тетра-O-сульфато-β-D-глюкопиранозил)галактитола,
нона-натриевая соль 1,2,4,5,6-пента-О-сульфато-3-О-(2,3,4,6-тетра-О-сульфато-β-D-глюкопиранозил)-D-глюцитола.
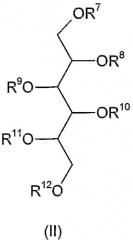
Соединения формулы (I) по настоящему изобретению могут быть синтезированы из соединений формулы (II)
где R7, R8, R9, R10, R11 и R12 независимо друг от друга означают атом водорода, С1-4 алкильную, гликозильную или дигликозильную группу и, по меньшей мере, один из R7-R12 представляет собой гликозильную или дигликозильную группу;
преобразованием его свободных гидроксильных групп в сульфатные сложные эфиры с использованием известных способов.
Триоксид серы или его аддукт, образованный с органическим основанием (например, триэтиламином или пиридином) или с диметилформамидом, может быть использован для получения O-сульфатных сложных эфиров.
Необязательно монофункциональные кислые сложные эфиры, полученные вышеуказанными способами, могут быть преобразованы в соли, например, с ацетатами щелочных металлов или щелочноземельных металлов. После очистки соли могут быть получены лиофилизацией, осаждением или кристаллизацией.
Некоторые из соединений формулы (II), используемые в виде исходных веществ в вышеуказанных процессах для синтеза соединений формулы (I) по настоящему изобретению, могут быть синтезированы, например, следующими, известными способами.
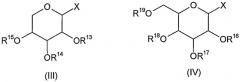
Такие соединения формулы (II), где один из R7 и R8 представляет гликозильную группу и другой представляет собой атом водорода, а также значениями R9-R12 является атом водорода, могут быть синтезированы, например, с использованием соединения формулы (III) или (IV)
где X означает атом галогена, трихлорацетимидат или фенилтиогруппу и R13-R19 представляют собой алифатический или ароматический сложный эфир или группу простого эфира,
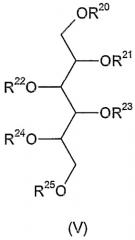
в качестве молекулы-донора, и соединения формулы (V)
где R20 и R21 означают атомы водорода, R22-R25 представляют собой защитные группы типа простого эфира, в качестве акцептора, и гликозилирование проводят в присутствии соответствующих активаторов. Затем защитные группы отщепляют от полученного таким образом соединения формулы (V), где R22-R25 означают защитную группу типа простого эфира, тогда как один из R20 и R21 представляет собой защищенную гликозильную группу и другая является атомом водорода.
В соответствии с другим способом соединение формулы (V) используют в вышеуказанной реакции, в которой R20 и R22 означают атом водорода, тогда как R21, R23, R24 и R25 представляют собой защитные группы типа простого эфира, затем защитные группы отщепляют от полученного таким образом соединения формулы (V), где R21, R23, R24 и R25 являются защитными группами типа простого эфира, R20 представляет собой защищенную гликозильную группу и R22 является атомом водорода.
Такие соединения формулы (II), где R7 и R9 означают гликозильную группу, тогда как R8, R10, R11 и R12 представляют собой атом водорода, могут быть синтезированы, например, проведением гликозилирования в соответствии со способом b), но с использованием молекулы-донора в избытке, и защитные группы отщепляют от образованного таким образом соединения общей формулы (V), где R20 и R22 представляют собой защищенные гликозильные группы и R21, R23, R24 и R25 являются защитными группами типа простого эфира.
Такие соединения формулы (II), где один из R7 и R8 представляет собой дигликозильную группу, другой является атомом водорода, а R9-R12 означают атомы водорода, могут быть синтезированы, например, с использованием соединения формулы (VI) или (VII)
где X означает атом галогена, трихлорацетимидат или фенилтиогруппу и R26-R32 представляют собой алифатический или ароматический сложный эфир или группу простого эфира,
в качестве молекулы-донора, и соединения формулы (V), где R20 и R21 означают атом водорода, R22-R25 представляют собой защитные группы типа простого эфира, в качестве акцептора, и гликозилирование проводят в присутствии соответствующих активаторов. Затем защитные группы отщепляют от полученного таким образом соединения общей формулы (V) - где R22-R25 являются защитными группами типа простого эфира, тогда как один из R20 и R21 представляет собой защищенную гликозильную группу и другой является атомом водорода.
Такие соединения формулы (II), где R7 означает дигликозильную группу, могут быть синтезированы, например, с использованием соединения формулы (V), где R20 и R25 являются атомами водорода, R21 и R24 представляют собой защитные группы типа сложного эфира, тогда как R22 и R23 являются защитными группами типа простого эфира, в качестве акцептора в вышеуказанной реакции, затем защитные группы отщепляют от полученного таким образом соединения формулы (V), где R21 и R24 представляют собой защитные группы типа сложного эфира, тогда как R22 и R23 представляют собой защитные группы типа простого эфира, R20 представляет собой защищенную дигликозильную группу и значением R25 является атом водорода.
Такие соединения формулы (II), где R7 и R12 означают дигликозильную группу, и R8-R11 представляют собой атом водорода, могут быть синтезированы, например, с использованием соединения формулы (VI) или (VII), где X означает атом галогена, трихлорацетимидат или фенилтиогруппу и R26-R32 представляют собой алифатический или ароматический сложный эфир или группу простого эфира; в качестве молекулы-донора в избытке, и соединения формулы (V), где R20 и R25 означают атом водорода, R21 и R24 представляют собой защитные группы типа сложного эфира, тогда как R22 и R23 представляют собой защитные группы типа простого эфира, в качестве акцептора, и гликозилирование проводят в присутствии соответствующих активаторов. Затем защитные группы отщепляют от полученного таким образом соединения формулы (V) - где R21 и R24 представляют собой защитные группы типа сложного эфира, R22 и R23 представляют собой защитные группы типа простого эфира, тогда как R20 и R25 являются защищенными дигликозильными группами.
В вышеуказанных реакциях гликозилирования, соли ртути или серебра, диэтиловый этерат трифтористого бора, N-йодсукцинимид и трифторметансульфоновая кислота или смесь двух последних также могут использоваться в качестве активаторов.
Отщепление защитных групп может проводиться кислым гидролизом или восстановлением в присутствии катализатора в случае простых эфиров и ацеталей, тогда как в случае сложных эфиров может использоваться метод Цемплена (транс-эстерификация, катализируемая основанием) или гидролиз в присутствии основания.
Сокращения и выражения, используемые в описании:
Ac = ацетил
Bz = бензоил
Me = метил
Ph = фенил
NIS = N-йодсукцинимид
ТfОН = трифторметансульфоновая кислота
Как используется в настоящем описании, формы единственного числа также охватывают формы множественного числа терминов, к которым они относятся, если только из содержания явно не следует другое. Например, ссылка на "модулятор" включает смесь модуляторов.
Как используется в настоящем описании, или в промежуточной фразе, или в тексте формулы изобретения, термины "включает" и "включающий" должны интерпретироваться как имеющие открытое значение. А именно термины должны интерпретироваться однозначно с фразами "имеющий, по меньшей мере" или "включающий, по меньшей мере". При использовании в контексте способа термин "включающий" означает, что способ включает, по меньшей мере, указанные стадии, но может включать дополнительные стадии. При использовании в контексте соединения или композиции термин "включающий" означает, что соединение или композиция включает, по меньшей мере, указанные свойства или компоненты, но также может включать дополнительные свойства или компоненты.
Термин "около" используется в настоящем описании для обозначения приблизительно, в области, ориентировочно или примерно. Когда термин "около" используют в связи с областью числовых значений, он определяет, что указывается диапазон с расширенными границами выше и ниже указанной области числовых значений. В общем, термин "около" используется в настоящем описании для модификации области числовых значений выше и ниже указанного значения с отклонением 20%.
Как используется в настоящем описании, если особенно не указано иначе, слово "или" используется с "включительным" смыслом "и/или" и не "исключающим" смыслом "или/или."
Как используется в настоящем описании, термины "лечение" или "излечение" используют для указания снижения, облегчения, профилактики, ингибирования развития и/или обращения симптомов состояния. Состояния для лечения способами и композициями по изобретению включают любое состояние, характеризующееся или включающее острые и хронические воспалительные расстройства дыхательных путей. Следовательно, термины "воспалительное расстройство" или "воспалительные расстройства дыхательных путей" охватывают любые воспалительные заболевания легких, включая астму, эндогенную или экзогенную бронхиальную астму, обострение хронического бронхита, аллергический ринит, легочные воспалительные и структурные реакции, вторичные по отношению к хроническому бронхиту, хронические обструктивные заболевания легких, пневмосклероз. Изобретение также применимо для состояний легких, при которых могут играть роль лейкоциты и перестройка дыхательных путей, включая, без ограничения перечисленными, идиопатический пневмосклероз и любое другое аутоиммунное заболевание легких.
Под "астмой" подразумевают состояние аллергического происхождения, симптомы которого включают непрерывную или пароксизмальную одышку, сопровождаемую хрипами, ощущением сдавления в грудной клетке, и частыми приступами кашля или затрудненного дыхания. Под "патологией, связанной с астмой" подразумевают состояние, чьи симптомы являются преимущественно воспалительными по природе со связанным бронхоспазмом. Следовательно, и астма, и патологии, связанные с астмой, характеризуются симптомами, которые включают сужение дыхательных путей, обусловленное различными степенями сокращения (спазма) гладких мышц, отеком слизистой, включая таковую верхних дыхательных путей и слизистой оболочки в просвете бронхов и бронхиол. Неограниченные характерные примеры "патологий, связанных с астмой" включают неастматические состояния, характеризующиеся гиперреактивностью дыхательных путей (например, хронический бронхит, эмфизема, муковисцидоз и респираторный дистресс-синдром).
Композиции и способы, указанные в настоящем описании, являются примерными для астмы. Однако изобретение не должно рассматриваться как ограниченное таким определенным заболеванием легких. Астма дает преимущество тщательного исследования и обеспечивает несколько приемлемых моделей для оценки изобретения. Известно, что сенсибилизация и введение аллергена ведет к гиперреактивности дыхательных путей на различные агонисты. Следовательно, ацетилхолин, известный как спазмогенный агент, способен вызывать более сильные сокращения мышечных клеток в тканях, полученных из трахеи умерщвленных животных (которые были сенсибилизированы для провокации гиперреактивности дыхательных путей), чем от контрольных животных после введения аллергена (смотрите, например, Tokuoka et at, Br. J. Pharmacol. 134:1580 (2001); Nakata et al, Int. Immunol. 13:329 (2001); Emala и Hirshman, Monogr. Allergy 33:35 (1996)).
Наиболее явной характеристикой астмы является бронхоспазм, или сужение дыхательных путей. У пациентов с астмой развивается выраженное сокращение гладких мышц крупных и мелких дыхательных путей, увеличенная продукция слизи, и увеличенное воспаление (Plaut и Zimmerman, выше). Воспалительный ответ при астме является типичным для тканей, покрытых слизистой оболочкой и характеризуется расширением кровеносных сосудов, выпотом плазмы, привлечением воспалительных клеток, таких как нейтрофилы, моноциты, макрофаги, лимфоциты и эозинофилы, к месту воспаления, и высвобождением воспалительных медиаторов местными тканевыми клетками (например, тучными клетками или эпителиальными клетками дыхательных путей) или миграцией воспалительных клеток (Hogg, "Pathology of Asthma", in Asthma as an Inflammatory Disease. O'Byrne (ed.), Marcel Dekker, Inc., New York, NY, at 1 (1990)). Астму могут запускать ряд причин, таких как аллергические реакции, вторичный ответ на инфекции, производственные или профессиональные воздействия, потребление определенных химических веществ или лекарственных веществ, физические нагрузки (Hargreave et al, J. Allergy Clin. Immunol. 83:1013 (1986)).
Соединения формулы (I) в соответствии с изобретением также были обнаружены как эффективные в снижении продукции слизи эпителиальными клетками бронхов и ингибировании пролиферации гладкомышечных клеток, опосредованной факторами роста.
Увеличение гиперреактивности бронхов (AHR), признак более тяжелой формы астмы, может быть индуцировано и антигенными и неантигенными раздражителями дыхательных путей. Ответ поздней фазы и постоянная гиперреактивность при астме, индуцированной аллергеном, ассоциированы с привлечением лейкоцитов и особенно эозинофилов в воспаленную ткань легких (Abraham et al, Am. Rev. Respir. Dis. 138:1565 (1988)). Эозинофилы высвобождают несколько медиаторов воспаления, включая 15-HETE, лейкотриен C4, PAF, катионные белки, эозинофильную пероксидазу.
Термины "антиген" и "аллерген" используют взаимозаменяемо для описания таких молекул, как пыль или пыльца, которые могут вызывать аллергические и/или индуцировать астматические симптомы у пациента, страдающего от астмы. Таким образом, пациент с астмой "при воздействии" аллергена или антигена подвергается воздействию достаточного количества аллергена или антигена, чтобы вызвать астматический ответ. Было обнаружено, что соединения формулы (I) по изобретению эффективны для лечения AHR после сенсибилизации яичным белком и воздействия антигена.
Биологическая активность соединений формулы (I) по настоящему изобретению на различных животных моделях продемонстрирована ниже:
Модель 1
Изучение эффекта вводимых местно полисульфатированных гликозидов на гиперреактивность дыхательных путей ex vivo
Воспаление дыхательных путей может вести к гиперреактивности бронхов, что является характерным признаком астмы.
Коричневых Норвежских (BN) крыс активно сенсибилизировали яичным белком (OA) посредством подкожной инъекции 0,5 мл гелевой смеси OA/Al(OH)3 (2 мг OA + 10 г Al(OH)3/100 мл физиологического раствора) в день 1 с последующими подкожными инъекциями (10 мг OA + 10 г Al(OH)3/100 мл физиологического раствора), вводимыми в дни 14 и 21. В день 28 животные получали соединение, описанное в примере 4, интратрахеально (дозу 0,01, 0,1 или 1,0 мг/кг) за 2 часа до воздействия антигена. Раздражение антигеном проводили ингаляцией распыленного яичного белка (1% раствор антигена, вводимый в системе для ингаляций TSE в течение 1 часа). Животных умерщвляли через 48 часов после воздействия антигена, затем удаляли трахеи в кювету для органов. Иссеченным трахеям позволяли уравновеситься в течение 30 минут до измерения кривых спазмогенного ответа трахеи на ацетилхолин (Ach).
Как показано в таблице 1 раздражение яичным белком сенсибилизированных животных в этой модели вызывало существенную гиперреактивность трахеи на ацетилхолин, когда ответ на спазмогенный агент определяли через 48 часов после воздействия антигена. Соединение, описанное в примере 4, в дозе 0,01 мг/кг, возвращало это повышение обратно почти до контрольного уровня.
| Таблица 1 Эффект воздействия антигена и интратрахеального предварительного лечения соединением примера 4 на сокращение трахеи в ответ на ацетилхолин у BN крыс | ||||
| Параметры | Контроль | Плацебо | Исследуемое соединение | |
| 0,01 мг/кг | 1,0 мг/кг | |||
| ED50* | 4,73±0,05 | 5,51±0,21 | 4,40±0,30 | 4,60±0,55 |
| р | 0,032 | <0,05 | <0,05 | |
| MAX** | 100±0 | 334±68 | 134±26 | 116±37 |
| р | 0,006 | <0,05 | <0,05 |
* -log M ацетилхолина (Ach), вызывающего 50% сокращение по отношению к контролю (среднее ± SEM)
** Сокращение при максимальной концентрации Ach по отношению к контролю (среднее ± SEM)
Модель 2
Исследование эффекта полисульфатированных гликозидов на продукцию слизи эпителиальными клетками дыхательных путей, стимулированную аллергеном
У сенсибилизированных животных антигенная стимуляция приводила к продукции слизи эпителиальными клетками дыхательных путей, что является характерным свойством аллергической астмы.
Сенсибилизированным BN крысам вводили интратрахеально различные (0,01-1,0 мг/кг) дозы соединения, описанного в примере 4, за два часа перед антигенной стимуляцией, с использованием подобного протокола, описанного в модели 1. Легкие получали через 48 часов после стимуляции и фиксировали в 8% фосфатном буферном формальдегиде. Затем образцы обрабатывали для гистохимии обычным образом. Сечения толщиной 5 мкм окрашивали реагентами периодической кислоты Шиффа (PAS) и докрашивали гематоксилином-эозином. На сечениях все эпителиальные клетки дыхательных путей подсчитывали в цельном препарате с увеличением 400×. Количество PAS(+) [продуцирующих слизь] эпителиальных клеток выражали по отношению к общему количеству эпителиальных клеток.
Как показано в таблице 2, воздействие аллергена стимулировало продукцию слизи эпителиальными клетками дыхательных путей (контроль vs. воздействие). Соединение существенно снижало количество PAS(+), продуцирующих слизь клеток в применяемой более высокой дозе.
| Таблица 2 Эффект антигенного воздействия и интратрахеального лечения соединением примера 4 на продукцию слизи эпителиальными клетками дыхательных путей, индуцированную аллергеном у BN крыс | |||
| Группы | Доза, мг/кг | %* | Значение р |
| Контроль | 2,2±0,9 | <0,001 | |
| Воздействие | 15,8±2,8 | - | |
| Леченные | 0,01 мг/кг | 15,0±2,7 | NS |
| 0,1 мг/кг | 6,3±1,5 | <0,001 |
* - количество PAS(+) клеток, как процент от общего количества клеток (среднее ± SEM)
Модель 3
Изучение эффекта полисульфатированных гликозидов на степень периваскулярного отека, развивающегося в астматической легочной ткани
У сенсибилизированного животного воздействие антигена, в результате развития воспалительного процесса, увеличивает проницаемость кровеносных сосудов, приводя к экссудации плазмы вокруг периферической части сосудистого русла.
Сенсибилизированные BN крысы получали лечение интратрахеально различными дозами (0,01-1,0 мг/кг) соединения, описанного в примере 4, за два часа до воздействия антигена, с использованием подобного протокола, описанного в модели 1. Легкие получали через 48 часов после воздействия и фиксировали в 8% фосфатном буферном формальдегиде. Затем образцы обрабатывали для гистохимии обычным образом. Сечения толщиной 5 мкм окрашивали реагентами периодической кислоты Шиффа (PAS) и докрашивали гематоксилином-эозином. На сечениях 5 мкм определяли площадь соединительной ткани вокруг сосудистого русла и выражали как соотношение к площади соответствующего кровеносного сосуда как такового.
Как показано в таблице 3, воздействие аллергена вызывает отек вокруг сосудистой сети, степень которого была существенно снижена даже при наименьшей дозе исследуемого соединения.
| Таблица 3 Эффект воздействия антигена и интратрахеального лечения соединением по примеру 4 на степень развития астмы у BN крыс | |||
| Группы | Доза, мг/кг | Отек* | p-значение |
| Контроль | 55±6 | <0,001 | |
| Воздействие | 209±12 | - | |
| Лечение | 0,01 мг/кг | 113±7 | <0,001 |
| 0,1 мг/кг | 106±8 | <0,001 |
* - площадь отека относительно площади сосудистого русла (среднее ± SEM)
Модель 4
Антагонистический эффект полисульфатированых гликозидов к рецептору IP-3
Гликозиды по настоящему изобретению, в зависимости от их химической структуры, ингибируют связывание инозитол-1,4,5-трифосфата (IР3) с его рецептором в препаратах микросомальных мембран. Так как IP3 является молекулой-мессенджером, играющей известную роль в активации различных клеток, вмешательство в эту функцию может объяснить антиастматический эффект таких полисульфатированных гликозидов.
Антагонистический к IP3 эффект полисульфатированных гликозидов определяли с использованием препаратов мембран мозжечка крыс в соответствии с Worley et al. (JBC 262, 12132, 1987). Как показано в таблице 4, все соединения, описанные в примерах 1-16, обладают различной антагонистической к IP3 активностью.
| Таблица 4 Антагонистический к рецептору IP-3 эффект полисульфатированных гликозидов | ||
| Соединение (номер примера) | IC50 (мкг/мл) Среднее ± SEM (n) | Средняя IC50 (нM) |
| 1 | 0,14±0,03 (4) | 100 |
| 2 | 1,99±0,51 (3) | 1413 |
| 3 | 0,57±0,12 (3) | 405 |
| 4 | 0,23±0,06 (4) | 163 |
| 5 | 0,37±0,18 (4) | 263 |
| 6 | 0,36±0,10 (5) | 256 |