Термостабильная днк-лигаза из археи рода acidilobus
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой рекомбинантную термостабильную ДНК-лигазу Acidilobus sp 1904, проявляющую лигазную активность в присутствии ионов магния, в диапазоне значений рН от 6.8 до 7.4, концентраций натрия хлорида от 0 до 100 мМ. ДНК-лигаза состоит из 607 аминокислот и имеет массу 68 кДа, определенную методом электрофореза в полиакриловом геле, и имеет аминокислотную последовательность SEQ ID NO:2. Изобретение относится также к ДНК, кодирующей ДНК-лигазу Acidilobus sp 1904, и способу получения такой лигазы. Изобретение позволяет расширить ассортимент ДНК-лигаз. 3 н.п. ф-лы, 4 ил.
Реферат
Область применения
Изобретение относится к области молекулярной диагностики и генетической инженерии и касается термостабильных ферментов с активностью ДНК-лигаз. Предлагается новая ДНК-лигаза из архей рода Acidilobus и способ ее выделения.
Актуальность
Ферменты-биокатализаторы широко используются в различных отраслях промышленности, сельского хозяйства и медицины. Одним из наиболее быстрорастущих рынков является производство ферментов для молекулярно-биологических исследований в самых различных областях деятельности, от медицины до криминалистики. В качестве примера можно привести термофильные ДНК-полимеразы, используемые в полимеразной цепной реакции (ПЦР), внедрение которой в практику в 1990-х годах совершило по существу революцию в диагностике инфекционных заболеваний.
Наряду с ПЦР, известен ряд других методов детекции и амплификации специфических последовательностей ДНК. К ним относится метод лигазной цепной реакции (ligase chain reaction, LCR), эффективный для детекции ДНК-полиморфизмов, мутаций, генетических аномалий. Несмотря на то, что метод LCR известен уже давно и активно применяется в диагностической практике, например в США, в России он практически не используется, в значительной степени из-за отсутствия термостабильных ДНК-лигаз на Российском рынке. Другой областью использования термостабильных лигаз является их использование для «сборки» синтетических генов из олигонуклеотидов, проводимой при повышенной температуре для снижения вероятности образования неспецифических продуктов лигирования.
Возрастающая потребность в термостабильных ДНК-лигазах с различными характеристиками стимулирует интерес крупнейших исследовательских центров и ведущих биотехнологических компаний во всем мире к поиску и созданию новых ДНК-лигаз, обладающих улучшенными либо новыми свойствами - высокой термостабильностью, удельной активностью, устойчивостью к ингибиторам и т.д.
Уровень техники
ДНК-лигазы играют важную роль в репликации, рекомбинации и репарации ДНК [Lehman, 1974]. Они присутствуют у эукариот, бактерий и архей и могут быть разделены на два семейства в соответствии с используемыми высокоэнергетическими кофакторами: АТФ-зависимые ДНК-лигазы (КФ 6.5.1.1) и НАД-зависимые лигазы (КФ 6.5.1.2). ДНК-лигазы катализируют присоединение 5'-Р донорного конца к 3'-ОН акцепторному концу в результате трех последовательных реакций переноса [Lehman, 1974; Engler and Richardson, 1983]. Все известные в настоящее время эукариотические и архейные ДНК-лигазы, а также лигазы из бактериофагов и вирусов, являются АТФ-зависимыми и содержат специфические мотивы в их аминокислотных последовательностях [Georlette et al., 2000].
Известны АТФ-зависимые ДНК-лигазы из различных гипертермофильных архей, в том числе Thermococcus kodakaraensis [Nakatani et al., 2000], Thermococcus fumicolanus [Rolland et al., 2004], Staphylothermus marinus [Seo et al., 2007], Sulfolobus shibatae [Lai et al., 2002] и Sulfophobococcus zilligii [Sun et al., 2008].
Известны термостабильные лигазы, выделенные из археи Pyrococcus furiosus. Фермент может быть использован для амфплификации ДНК в лигазной цепной реакции (ЛЦР) [Патент США 6280998, опубл. 2001.08.28]. Также известны рекомбинантные термостабильные белки, имеющие ДНК-лигазную активность. Белок выделен из Thermococcus sp.(штамм 9 0N-7), является АТФ-зависимым и сохраняет активность при 100°С [WO 2007035439, опубл. 2007-03-29].
Настоящее изобретение касается выделения и характеристики новой ДНК-лигазы LigAc1904 из гипертермофильной археи, выделенной из горячего источника в районе вулкана Мутновский на Камчатке, характеризующегося кислым значением рН, а также разработки способа ее получения.
С помощью метода полимеразной цепной реакции был идентифицирован и затем секвенирован ген ДНК-лигазы из термофильных археи рода Acidilobus (штамм 1904), имеющий нуклеотидную последовательность SEQ ID NO1. Методом культивирования рекомбинантного штамма E.coli DLT1270, содержащего плазмиду pRARE, трансформированного вектором pQE30, содержащим нуклеотидную последовательность SEQ ID NO 1, была выделена и очищена методом металл-афинной хроматографии новая рекомбинантная термостабильная ДНК-лигаза, проявляющая лигазную активность в присутствии ионов магния, при значении рН в диапазоне от 6.8 до 7.4, в широком диапазоне концентраций натрия хлорида (0-100 мМ), состоящая из 607 аминокислот, имеющая массу 68 кДа, определенную методом электрофореза в полиакриловом геле, и содержащая аминокислотную последовательность SEQ ID NO 2, получаемую из рекомбинантного штамма E.coli.
Раскрытие изобретения
Лигаза LigAc1904 выделена из археи Acidilobus штамм 1904 и характеризуется тем, что состоит из 607 аминокислот и имеет массу 68 кДа, определенную методом электрофореза в полиакриловом геле. По аминокислотной последовательности LigAc1904 существенно отличается от других известных ДНК-лигаз, ближайшими гомологами являются АТФ-зависимые ДНК-лигазы архей Staphylothermus marinus (63% идентичности) и Sulfolobus shibatae (57% идентичности). Анализ аминокислотной последовательности LigAc1904 выявил три характерных домена АТФ-зависимых ДНК-лигаз. Первый домен, N-концевой район ДНК-лигазы (DNA_Ligase_A_N), встречается в большинстве, но не во всех АТФ-зависимых ДНК-лигазах. Этот регион необходим для связывания фермента с ДНК и участвует в катализе реакции. Второй домен - DNA_Ligase_A_M, встречается в ДНК-лигазах, точные функциональные свойства его неизвестны. Третий, С-концевой домен (DNA_Ligase_A_C), составляет основную часть каталитического центра АТФ-зависимых ДНК-лигаз.
Одной из основных областей практического применения термостабильных ДНК-лигаз является амплификация ДНК в лигазной цепной реакции (ЛЦР). Проведение ЛЦР требует высокой термостабильности фермента, которой обладает LigAc1904, сохраняющей более 50% своей активности после инкубации в течение 30 минут при температуре 94°С. Помимо этого, новый фермент неожиданно обнаруживает ряд полезных свойств, - он обеспечивает лигирование лишь фрагментов ДНК, имеющих протяженные (12-нт в случае BstEII-фрагментов фага лямбда), но не короткие (4-нт концы HindIII фрагментов фага лямбда) липкие концы, и не способен лигировать фрагменты ДНК с «тупыми» концами. Поэтому одним из перспективных применений нового фермента может быть «сборка» синтетических генов из олигонуклеотидов. Проведение реакции лигирования при повышенной температуре (60-70°С) должно повысить эффективность «сборки» фрагмента ДНК из олигонуклеотидов за счет снижения вероятности образования неспецифических продуктов лигирования. Такие продукты могут образовываться при использовании обычной мезофильной ДНК лигазы (например, ДНК лигазы фага Т4) в результате отжига случайным образом слипшихся коротких комплиментарных участков олигонуклеотидов, использованных для синтеза гена. Термостабильность LigAc1904 и ее способность лигировать лишь протяженные липкие концы должны снизить вероятность образования неспецифических продуктов при «сборке» генов с ее применением.
Краткое описание чертежей
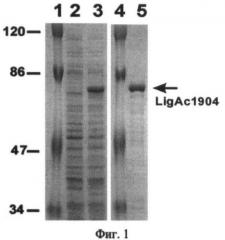
Фиг.1. Экспрессия LigAc1904 в E.coli и очистка белка.
Приведены результаты электрофоретического анализа белковых препаратов:
1 и 4 - маркеры молекулярной массы, размеры указаны в кДа,
2 - суммарный белковый препарат, выделенный из клеток штамма DLT1270/pRARE, содержащего плазмиду pQE30 - LigAc1904, до индукции синтеза LigAc1904,
3 - то же, что на дорожке 2, но через 3 часа после индукции синтеза LigAc1904 внесением в среду 1 мМ изопропил-бета-D-тиогалактозида (ИПТГ),
5 - белковый препарат LigAc1904 после очистки.
Фиг.2. Анализ способности LigAc1904 лигировать фрагменты, образованные при обработке ДНК фага λ эндонуклеазой BstEII.
Приведены результаты анализа препаратов ДНК с помощью гель-электрофореза в агарозном геле.
1 - маркер молекулярной массы ДНК (длины фрагментов указаны в т.п.н.).
2 - ДНК фага λ после обработки рестриктазой BstEII.
3 - препарат BstEII-фрагментов ДНК фага (после инкубации в течение 1,5 ч при 45°C с 500 нг лигазы LigAc1904 в реакционном буфере (40 мМ трис-HCl рН 7,0, 5 мМ MgCl2), не содержащем АТФ.
4 - 9, - то же, что на дорожке 3, но буфер для лигирования дополнительно содержал АТФ в различных концентрациях: дор. 4 - 1000 µМ, дор. 5 - 100 µM, дор. 6 - 10 µМ, дор. 7 - 1 µM, дор. 8 - 0.1 µM, дор. 9 - 0.01 µM АТФ.
10 - препарат BstEII-фрагментов ДНК фага λ после инкубации в течение 1,5 ч. при 37°C с ДНК-лигазой Т4 в буфере без АТФ.
11 - то же, что на дор. 5, но буфер для лигирования дополнительно содержал 100 µM АТФ. Справа стрелками показаны концевые BstEII-фрагменты А (5678 п.н.) и Б (8453 п.н), а также продукт их лигирования, С (14131 п.н.).
Фиг.3. Ферментативная характеристика ДНК лигазы LigTh1519.
А - структура синтетического субстрата, использованного для определения эффективности лигирования однонитевого разрыва. Положение γ32Р - радиоактивной метки, введенной на 5'-конец олигонуклеотида LA30, указано звездочкой.
На панелях Б-Е приведены результаты электрофоретического анализа продуктов лигирования.
Б - влияние концентрации NaCl на активность LigTh1519.
В - влияние концентрации MgCl2 на активность LigTh1519.
Г - влияние величины рН реакционного буфера на активность LigTh1519.
Д - влияние температуры проведения реакции на активность LigTh1519.
Е - характеристика термостабильности LigTh1519. Показано влияние времени предынкубации LigTh1519 при 94°С на активность фермента.
На панелях Б-Е продукты контрольной реакции (без добавления фермента) показаны на дорожке «к».
Фиг.4. Зависимость активности ДНК лигазы LigAc1904 от АТФ.
(А) Результаты электрофоретического анализа продуктов лигирования.
1 и 2 - контрольные реакции без фермента.
3 - лигазная реакция, проведенная без добавления АТФ.
4-7, - лигазные реакции, проведенные в присутствии АТФ: дор. 4 - 1000 µМ, дор. 5 - 100 µM, дор. 6 - 10 µM, дор. 7 - 1 µM АТФ.
(Б) - диаграмма, показывающая относительную активность ДНК лигазы LigAc1904 в различных условиях, определяемую по соотношению интенсивностей полос, соответствующих LA70 (продукт) и LA30 (субстрат).
Осуществление изобретения
Пример 1. Молекулярная идентификация штамма 1904.
Штамм 1904 был выделен из горячего источника в районе вулкана Мутновский на Камчатке, характеризующегося кислым значением рН, и поддерживался в коллекции Лаборатории гипертермофильных микробных сообществ ИНМИ РАН. Штамм 1904 является облигатным анаэробом, органотрофом, использующим пептон или крахмал в качестве субстратов роста. Присутствие в среде элементной серы, которую микроорганизм восстанавливает в сероводород, стимулирует рост. Оптимальная температура роста 85°С, оптимальный рН среды 3.8. Культивирование проводили в 15 мл пробирках Хангейта на среде следующего состава (г/л): NH4Cl - 0.33, KCl - 0.33, KH2PO4 - 0.33, CaCl2*2H2O - 0.33, MgCl2*6H2O - 0.33, дрожжевой экстракт - 2.0, элементная сера - 10.0; Na2S*9Н20 - 0.5, раствор микроэлементов [Кевбрин и Заварзин, 1992] - 1 мл/л, витамины [Wolin et al., 1963] - 1 мл/л. Анаэробно приготовленная среда (рН 3.8) разливалась под током очищенной от кислорода смеси N2/CO2 (80:20) порциями по 10 мл и автоклавировалась при избыточном давлении (0.5 атм), температура инкубации 85°С.
Геномную ДНК штамма 1904 выделяли стандартными методами [Ausubel et al., 1997], последовательность гена 16S рРНК определяли, как описано в работе [Sokolova et al., 2002]. Сравнение последовательности гена 16S рРНК штамма 1904 с представленными в GenBank последовательностями показало, что штамм 1904 относится к отделу Crenarchaeota, классу Thermoprotei, порядку Desulfurococcales, семейству Desulfurococcaceae и роду Acidilobus.
Пример 2. Выделение гена ДНК-лигазы Acidilobus sp 1904.
Анализ представленных в базе данных GenBank нуклеотидных последовательностей генов ДНК-лигаз архей выявил несколько консервативных участков, два из которых были использованы для создания пары специфических праймеров на гены ДНК-лигазы: BO-2F [GA(t/g)TA(t/c)AAATA(t/c)GATGG(a/g)GA(g/a)(a/c)G] и BO-3R [T(g/t)ACTT(t/c)CT(c/t)TT(t/c)CT(g/a)TGCAT]. С помощью этих праймеров на суммарной ДНК Acidilobus sp 1904 был амплифицирован фрагмент длиной около 250 п.н. Была использована следующая программа проведения ПЦР: 94°С - 1 мин, 45°С - 140 с и 72°С - 1,5 мин, всего 40 циклов. Нуклеотидная последовательность полученного фрагмента имела высокую гомологию с последовательностями генов АТФ-зависимых ДНК-лигаз архей. Для клонирования полноразмерного гена ДНК-лигазы LigAC1904 был использован метод «инверсного» ПЦР.
Для определения последовательности 5'-конца гена была использована пара направленных в противоположные стороны праймеров 1904-1R (AGCCTTCTGGA-GAATATCTTTATC) и 1904-2F (CTATGTACCCTGATATAGCTGA), расположенных в просеквенированном 250-нт фрагменте. ДНК Acidilobus sp 1904 обрабатывали ферментом SacI, полученные фрагменты замыкали в кольцо, обрабатывая Т4 ДНК-лигазой и использовали в качестве матрицы для ПЦР с парами праймеров 1904-1R и 1904-2F. Полученный ПЦР-фрагмент длиной 1,2 т.п.н. был просеквенирован; как оказалось, он содержал полную последовательность 5'-участка гена до стартового кодона и прилегающий участок геномной ДНК.
Для определения последовательности 3'-района гена LigAC1904 геномную ДНК обрабатывали рестриктазой HindIII, полученные фрагменты замыкали в кольцо, обрабатывая Т4 ДНК-лигазой и использовали в качестве матрицы для ПЦР с парами праймеров 1904-1R и 1904-2F. Полученный ПЦР-фрагмент длиной 1,1 т.п.н. был просеквенирован; однако он не включал всю последовательность 3'-района гена. Поэтому на следующем этапе вблизи правого конца определенной последовательности 3'-района был выбран ориентированный в сторону 3'-конца гена праймер 1904-4F (TCGGACACTGTGGACCTAGT), с которым был поставлен ПЦР на геномной ДНК Acidilobus sp 1904. Полученный ПЦР-фрагмент длиной около 1.1 т.п.н. являлся результатом специфического связывания праймера 1904-4F с выбранным участком гена ДНК лигазы и неспецифического связывания с районом генома, расположенным за 3'-концом гена. В результате секвенирования этого фрагмента была определена последовательность 3'-района гена ДНК лигазы до терминирующего кодона и прилегающего участка геномной ДНК.
В результате объединения трех полученных последовательностей была определена полная нуклеотидная последовательность гена ДНК-лигазы Acidilobus sp 1904 длиной 1824 нт, представленная в SEQ ID NO 1.
Пример 3. Получение штамма Е.coli - продуцента ДНК-лигазы Acidilobus sp 1904, выделение и очистка фермента.
Праймеры 1904-BamHI (GAGGATCCTTGCCCTCAGACATGATGTTCG) и 1904-SphI (CAGCATGCTTAGGCCTCGCCCTCC) были использованы для ПЦР-амплификации полноразмерного гена LigAC1904, в качестве матрицы использовали геномную ДНК Acidilobus sp 1904. Полученный фрагмент обрабатывали рестриктазами BamHI и SphI и клонировали по сайтам BamHI и SphI в экспрессионном векторе pQE30 (Qiagen), позволяющем экспрессировать целевой белок, слитый с 6 аминокислотными остатками гистидина на N-конце. В результате был получен рекомбинантный экспрессионный вектор pQE30-LigAc1904.
Штамм Е.coli DLT1270, являющийся производным штамма DH10B [Grant et al., 1990], содержит ген репрессора лактозного оперона lacI, интегрированный в хромосому. Штамм DLT1270/pRARE, содержащий плазмиду pRARE-2 (Novagen), кодирующую «редкие» для Е.coli т-РНК, был использован для экспрессии ДНК-лигазы LigAc1904. Для этого pQE30-LigAc1904 вводили в штамм Е.coli DLT1270/pRARE.
Указанный штамм, содержащий рекомбинантную плазмиду pQE30- LigAc1904, выращивали на шейкере при 37°С до достижения OD600~0.5, затем индуцировали синтез рекомбинантного белка внося изопропил-β-D-тиогалактопиранозид (ИПТГ) до 1 мМ, и продолжали выращивать культуру в течение 18 ч при 37°С. Выделение и очистку лигазы LigAc1904 осуществляли методом металл-афинной хромотографии с помощью набора Spin-NTA KIT (Qiagen, Германия). В результате был получен гомогенный препарат белка LigAc1904 (фиг. 1).
Пример 4. Определение активности ДНК-лигазы LigAc1904.
Для определения лигазной активности in vitro использовали два метода. Во-первых, метод, описанный в работе [Muerhoff et al., 2004], который основан на лигировании BstEII - фрагментов ДНК фага λ. Концевые фрагменты длиной 8453 п.н. и 5678 п.н., содержащие когезивные концы длиной 12 нуклеотидов, образуют стабильный дуплекс при температуре 45°С. Анализ лигазной активности проводили в буфере, содержащем 40 мМ трис-HCl (рН 7.0), 5 мМ MgCl2 и АТФ (в диапазоне от 0 до 1 мМ). 0.5 мкг ДНК фага λ, обработанной BstEII, инкубировали с 500 нг белка LigAc1904 в 50 мкл указанного буфера, реакцию проводили при 45°С в течение 1 ч. Если тестируемый фермент обладает лигазной активностью, то из двух концевых BstEII - фрагментов длиной 8453 нт и 5678 нт, образуется фрагмент длиной 14131 нт. Реакцию лигирования останавливали добавлением 50 мМ ЭДТА и прогревали в течение 10 мин при 70°С для денатурации нелигированных концов. Пробы анализировали с помощью электрофореза в 0.7%-ном агарозном геле (фиг.2).
Представленные на фиг.2 результаты показывают, что рекомбинантный белок LigAc1904 действительно обладает активностью ДНК-лигазы. Высокая эффективность лигирования наблюдалась в том числе и в отсутствие вносимого в реакцию АТФ (фиг.2, дорожка 5), что свидетельствует о наличии значительной фракции предаденилированного фермента в препарате. Также было выявлено, что высокая концентрация АТФ (1 мМ, дорожка 6 на фиг.2) ингибирует лигазную активность, оптимум которой достигался при концентрациях АТФ от 1 до 100 µM.
Отметим, что лигирование остальных (не концевых) рестрикционных фрагментов не наблюдалось ни в описанном эксперименте с BstEII, ни в случае обработки ДНК фага λ рестриктазой HindIII, образующей липкие концы длиной 4 нт.
Второй метод, описанный в работе [Nakatani et al., 2000], позволял количественно определять лигазную активность по «зашиванию» однонитевого разрыва в двунитевом фрагменте ДНК. В качестве субстрата использовали дуплекс, образованный в результате отжига трех синтетических олигонуклеотидов:
LA-30 (CAGAGGATTGTTGACCGGCCC GTTTGTCAG), LA-40 (CGCACCGTGACGCCA AGCTTGCATTCCTACAGGTCGACTC) и LA-80 (CGTTGCTGACAAACGGGCCGGTCA ACAATCCTCTGGAGTCGACCTGTAGGAATGCAAGCTTGGCGTCACGGTGCGCCAAC).
В олигонуклеотид LA-30 с помощью Т4 полинуклеотид киназы вводили радиоактивную метку на 5'-конец. Лигазную реакцию проводили при 70°С в течение 15 мин, состав буфера и температуру меняли для определения оптимальных условий реакции, по окончании реакции денатурировали ДНК прогреванием в течение 15 мин при 94°С. Продукты реакции анализировали с помощью электрофореза в денатурирующем полиакриламидном геле и радиоавтографии. В результате «зашивания» однонитевого разрыва ДНК-лигазой радиоактивно меченный праймер LA30 соединялся с LA40, что приводило к образованию олигонуклеотида длиной 70 нуклеотидов, детектируемого при помощи электрофореза с последующей радиоавтографией.
Пример 5. Влияние температуры, рН, концентрации солей и концентрации АТФ на активность ДНК лигазы LigAc1904.
Полуколичественное определение лигазной активности LigAc1904 проводили на полученном в результате отжига трех олигонуклеотидов фрагменте ДНК, содержащем однонитевой разрыв в одной из цепей (фиг.3А). Эффективность лигирования определяли по способности фермента «зашивать» этот разрыв и образованию продукта лигирования - олигонуклеотида длиной 70 нт [Nakatani et al., 2000]. Определяли зависимость активности LigTh1519 от рН буфера, концентраций АТФ, NaCl и MgCl2, а также температуры.
Представленные на фиг.3 результаты показывают, что LigAc1904 активен в широком диапазоне концентраций NaCl (0-100 мМ) при значениях рН в диапазоне от 6.8 до 7.4. Мы установили, что для лигазной активности LigAc1904 необходимо наличие в среде двухвалентного катиона (Mg+), причем фермент активен в диапазоне концентраций MgCl2 от 5 до 25 мМ. ДНК лигаза LigAc1904 проявляла активность в широком диапазоне температур. Хотя оптимальная температура реакции составляла 65-70°С (фиг.3), фермент активен при температурах от 50 до 70°С, а, возможно, и выше, поскольку при температурах выше 70°С денатурация субстрата не позволяет проводить определение активности фермента.
Термостабильность LigAc1904 оценивали, инкубируя фермент в реакционном буфере (без АТФ) при 94°С, затем активность фермента определяли в стандартной реакции (40 мМ Трис-HCl buffer (рН 7.0), 5 мМ MgCl2, 1 мМ АТФ) при 70°С. Мы установили, что фермент терял половину своей активности в результате инкубации в течение 30 мин при 94°С (фиг.3). Таким образом, уровень термостабильности LigAc1904 выше, чем у ДНК-лигазы Sulfolobus shibatae (время 50% инактивации 10 мин при 90°С) [Lai et al., 2002], но ниже, чем у ДНК лигазы Staphylothermus marinus (время 50% инактивации 2,8 ч при 100°C) [Seo et al., 2007].
Пример 6. ДНК-лигазная активность LigAcl904 зависит от АТФ.
Ферментативная активность всех ДНК-лигаз требует в качестве источника энергии наличие высокоэнергетического кофактора, в качестве которого может выступать АТФ (для ДНК-лигаз эукариот, архей и вирусов) или НАД+(бактериальные ДНК-лигазы). Известны ДНК-лигазы архей, которые могут использовать, помимо АТФ, также один или несколько других кофакторов - АДФ, дАДФ, ГТФ и НАД+.
Представленные в примере 4 эксперименты показали, что LigAc1904 проявляет лигазную активность даже без добавления АТФ, что, вероятно, объясняется наличием преаденилированной фракции белка в выделенном из штамма Е.coli - продуцента белковом препарате. Поэтому для тестирования зависимости активности LigAc1904 от АТФ фермент предварительно проинкубировали в стандартных реакционных условиях (метод 2 в примере 4), но с немеченым олигонуклеотидным субстратом, для того, чтобы преаденилированная фракция лигазы израсходовала АМФ, ковалентно связанный в активном центре фермента. Затем в реакционную смесь добавляли радиоактивно меченный субстрат и АТФ в различных концентрациях. Полученные результаты (фиг.4) показали, что активность LigAc1904 зависит от АТФ, причем оптимальная концентрация этого кофактора составляет от 10 до 100 µМ (дорожки 5 и 6 на фиг.4), а более высокие концентрации АТФ ингибируют лигазную активность.
СПИСОК ЛИТЕРАТУРЫ
1. Рекомбинантная термостабильная ДНК-лигаза Acidilobus sp 1904, проявляющая лигазную активность в присутствии ионов магния, в диапазоне значений рН от 6,8 до 7,4, концентраций натрия хлорида от 0 до 100 мМ, состоящая из 607 аминокислот, имеющая массу 68 кДа, определенную методом электрофореза в полиакриловом геле и содержащая аминокислотную последовательность SEQ ID NO:2, получаемая из рекомбинантного штамма E.coli.
2. Выделенная нуклеотидная последовательность ДНК, кодирующая термостабильную ДНК-лигазу по п.1, включающая нуклеотидную последовательность SEQ ID NO:1.
3. Способ получения термостабильной ДНК-лигазы по п.1, включающий культивирование рекомбинантного штамма E.coli DLT1270, содержащего плазмиду pRARE, трансформированного вектором pQE30, содержащим нуклеотидную последовательность SEQ ID NO:1, кодирующую ДНК-лигазу Acidilobus sp 1904, выделение и очистку ДНК-лигазы методом металл-афинной хроматографии.