Неинвазивная система доставки лекарственного средства к ткани заднего сегмента глаза с применением твердой композиции
Иллюстрации
Показать всеЗаявленная группа изобретений относится к медицине, а именно к офтальмологии, и может быть использована для улучшения перемещения лекарства к ткани заднего сегмента глаза посредством мукоадгезивной субстанции при лечении заболеваний глаз. Для этого в конъюнктивальный мешок вводят терапевтически эффективное количество твердой композиции, содержащей выбранное лекарство и мукоадгезивную субстанцию. При этом используют мукоадгезивную субстанцию, адгезионная прочность которой составляет от 200 до 1000 g. Заявленная группа изобретений обеспечивает эффективное лечение заболеваний заднего сегмента глаза за счет создания условий для длительной и высокой концентрации лекарства в соответствующих тканях глаза. 2 н. и 11 з.п. ф-лы, 8 ил., 1 табл.
Реферат
Область техники
Настоящее изобретение относится к неинвазивной системе доставки лекарственного средства к ткани заднего сегмента глаза, такой как сетчатка, хориоид (собственно сосудистая оболочка глаза), склера, зрительный нерв, ткань около зрительного нерва или стекловидное тело.
Предшествующий уровень техники
Многие болезни тканей заднего сегмента глаза, таких как сетчатка, хориоид, склера, зрительный нерв, ткань около зрительного нерва и стекловидное тело, являются трудноизлечимыми болезнями, а среди них немало болезней проявляют серьезные симптомы, которые могут послужить причиной потери зрения. Типичные примеры таких болезней включают возрастную дегенерацию желтого пятна, диабетическую ретинопатию, диабетический отек желтого пятна, увеит, пигментную дегенерацию сетчатки, пролиферативную витреоретинопатию, закупорку главной ретинальной вены, закупорку ветви ретинальной вены, закупорку главной ретинальной артерии, закупорку ветви ретинальной артерии, отслоение сетчатки, цитомегаловирусный ретинит, нарушения зрительного нерва, сопровождающие глаукому и тому подобное. Все эти болезни могут служить причиной ухудшения или потери зрения, и необходима разработка способа эффективного лекарственного лечения таких болезней заднего сегмента глаза.
Примеры эффективного лекарственного средства при болезнях заднего сегмента глаза включают многие препараты, например стероиды, такие как бетаметазон и дексаметазон, противовоспалительные препараты, такие как бромофенак, антибактериальные средства, такие как соединения хинолона и эритромицин, противовирусные препараты, такие как ганцикловир и ацикловир, противоопухолевые препараты, такие как мстотрексат и ингибиторы ММР, ингибиторы ангиогенеза, такие как эндостатин и ингибиторы VEGF, нейропротективные препараты, такие как МК-801 и тимолол, антиоксиданты, такие как катехин и витамин Е, ингибиторы резорбции кости, такие как бисфосфанат, вещества, участвующие в поддержании зрительной функции, такие как ретиноевая кислота и ее производные, и тому подобное. Утверждены многие пригодные препараты, однако ткань заднего сегмента глаза, которая является больной областью, расположена в задней части глаза, и очень трудно транспортировать препарат в данную область, что являлось задачей при разработке способа лекарственного лечения болезней заднего сегмента глаза.
Что касается лекарственного лечения глазных болезней, в большинстве случаев лечение осуществляют посредством капельного введения (инсталляции), которое является весьма удобным. Однако капельное введение имеет проблему, состоящую в том, что лекарство трудно переправить в ткань заднего сегмента глаза.
В качестве способа введения лекарства при болезнях заднего сегмента глаза было опробовано системное введение, такое как внутривенная инъекция или оральное применение. Однако количество препарата, доставленного к ткани заднего сегмента глаза, которая представляет собой нездоровую область, с помощью такого способа введения, является небольшим. Поэтому необходимо вводить лекарство в высокой дозе и с высокой частотой для того, чтобы доставить необходимое количество лекарства к ткани заднего сегмента глаза, а в плане эффективности с точки зрения лекарственного лечения ткани заднего сегмента глаза это является проблемой.
С другой стороны, также были опробованы такие способы введения, как интраветриальное (введение в стекловидное тело), субтеноновая (sub-Tenon) или подконъюнктивальная инъекция и имплантат, в качестве способа лекарственного лечения болезней заднего сегмента глаза. Например, Journal of ocular pharmacology and therapeutics, (2001) 17/4 393-401, описывает систему доставки лекарства к ткани заднего сегмента глаза посредством интраветриальной инъекции. JP-A-2003-313119 и JP-A-2005-097275 описывают систему доставки лекарства к ткани заднего сегмента глаза посредством подконъюнктивального введения содержащих лекарство микрочастиц с контролируемым высвобождением и систему доставки лекарства к ткани заднего сегмента глаза посредством субтенонового (sub-Tenon) введения микрочастиц, содержащих лекарство. Затем JP-T-2004-535886 описывает биосовместимый имплантат для переноса лекарства к ткани заднего сегмента глаза. При этих способах введения вещество прямо вводят или имплантируют в нездоровую область или в ткань, близко расположенную к нездоровой области, поэтому эти способы имеют такое преимущество, что в нездоровую область может быть передано достаточное количество лекарства. При этом в способе введения и методике доставки, связанной с вторжением в ткани глаза, иногда пациент ощущает давление или боль после введения. Более того, данные способы введения не могут быть выполнены самим пациентом, а нуждаются в выполнении исключительно доктором, следовательно, они менее удобны.
Раскрытие изобретения
Цели изобретения
Таким образом, требуется создание неинвазивной системы доставки лекарства, которая не демонстрирует инвазивность ткани после введения, сопутствующей таким способам введения, как инъекция или имплантат, и может эффективно переместить лекарство к нездоровой области.
То есть важным вопросом является создание системы доставки лекарства посредством неинвазивного введения, которая является наиболее эффективной для перемещения лекарства к ткани заднего сегмента глаза.
Средства для решения задач
Настоящие изобретатели провели интенсивные исследования и в результате неожиданно обнаружили, что способ введения твердой композиции, содержащей лекарство и мукоадгезивную субстанцию, имеющую адгезионную прочность от 200 до 1000 g, в конъюнктивальный мешок является весьма пригодным в качестве неинвазивной системы доставки лекарства, прекрасной для перемещения лекарства к ткани заднего сегмента глаза.
Так как система доставки лекарства настоящего изобретения является неинвазивной системой доставки лекарства, она не демонстрирует инвазивность ткани введением в отличие от способа введения, обычно применяемого в медицине, такого как инъекция или имплантат. Более того, пациент не ощущает давление или боль, сопровождающие введение посредством инъекции или имплантата.
Твердая композиция, используемая в системе доставки лекарства настоящего изобретения, должна быть введена в конъюнктивальный мешок и не требует профессиональных технических приемов при введении в отличие от инъекции или имплантата, которые обычно используют в медицине, следовательно, она является превосходной в плане удобства.
То есть настоящее изобретение относится к:
(1) неинвазивной системе доставки лекарства в ткань заднего сегмента глаза, отличающейся введением твердой композиции, содержащей лекарство и мукоадгезивную субстанцию, в конъюнктивальный мешок, в которой адгезионная прочность мукоадгезивной субстанции находится в пределах от 200 до 1000 g;
(2) твердой композиции, которая содержит лекарство и мукоадгезивную субстанцию и должна быть введена в конъюнктивальный мешок, в которой перемещение лекарства в ткань заднего сегмента глаза улучшено вследствие включения мукоадгезивной субстанции, причем адгезионная прочность мукоадгезивной субстанции от 200 до 1000 g;
(3) системе доставки лекарства в соответствии с вышесказанным (1) или твердой композиции в соответствии с вышесказанным (2), в которой адгезионная прочность мукоадгезивной субстанции находится в пределах от 300 до 900 g;
(4) неинвазивной системе доставки лекарства или твердой композиции в соответствии с вышесказанным (3), в которой перемещение лекарства к ткани заднего сегмента глаза является перемещением через местную ткань глаза;
(5) неинвазивной системе доставки лекарства или твердой композиции в соответствии с вышесказанным (3), в которой перемещение через местную ткань глаза является перемещением через конъюнктивальную ткань и склеральную ткань;
(6) неинвазивной системе доставки лекарства или твердой композиции в соответствии с вышесказанным (3), в которой мукоадгезивная субстанция представляет собой один член или комбинацию множества членов, отобранных из производных полиакриловой кислоты, производных целлюлозы и солей этого;
(7) неинвазивной системе доставки лекарства или твердой композиции в соответствии с вышесказанным (6), в которой производное полиакриловой кислоты является карбоксивиниловым полимером или полиакриловой кислотой;
(8) неинвазивной системе доставки лекарства или твердой композиции в соответствии с вышесказанным (6), в которой производное целлюлозы представляет собой гидроксипропилцеллюлозу;
(9) неинвазивной системе доставки лекарства или твердой композиции в соответствии с вышесказанным (3), в которой мукоадгезивная субстанция представляет собой один член или комбинацию множества членов, отобранных из карбоксивиниловых полимеров и гидроксипропилцеллюлозы;
(10) неинвазивной системе доставки лекарства или твердой композиции в соответствии с вышесказанным (3), в которой тканью заднего сегмента глаза является сетчатка, хориоид, склера, зрительный нерв, ткань вокруг зрительного нерва или стекловидное тело;
(11) неинвазивной системе доставки лекарства или твердой композиции в соответствии с вышесказанным (3), в которой лекарство является лекарством для лечения или предотвращения болезни сетчатки, хориоида, склеры, зрительного нерва, ткани вокруг зрительного нерва или стекловидного тела;
(12) неинвазивной системе доставки лекарства или твердой композиции в соответствии с вышесказанным (3), в которой лекарство является противовоспалительным препаратом, иммунодепрессантом, противовирусным препаратом, противоопухолевым препаратом, антитромботическим препаратом, ингибитором ангиогенеза, глазным нейропротективным препаратом, антибактериальным средством, противогрибковым средством или антиоксидантом; и
(13) неинвазивной системе доставки лекарства или твердой композиции в соответствии с вышесказанным (3), в которой твердая композиция находится в виде пленки, шарика, таблетки, палочки, частицы или сферы.
Мукоадгезивная субстанция, используемая в настоящем изобретении, означает субстанцию, имеющую такую отличительную черту, что она становится смягченной, раздутой или тому подобное при вступлении в контакт со слезной жидкостью после введения в конъюнктивальный мешок и прилипания к конъюнктивальной ткани. Конкретные примеры этого включают производные полиакриловой кислоты и соли этого, такие как карбоксивиниловые полимеры, полиакриловую кислоту и полиакрилат натрия; поливиниловый спирт, поливинилпирролидон; производные целлюлозы и соли этого, такие как производные гидроксиалкилцеллюлозы (включая гидроксиэтилцсллюлозу, гидроксипропилцеллюлозу и тому подобное), производные гидроксиалкилалкилцеллюлозы (включая гидроксиэтилметилцеллюлозу, гидроксипропилметилцеллюлозу и тому подобное), производные алкилцеллюлозы (включая метилцеллюлозу, этилцеллюлозу и тому подобное), производные карбоксиалкилцеллюлозы и соли этого (включая карбоксиметилцеллюлозу, натрийкарбоксиметилцеллюлозу и тому подобное); альгиновую кислоту и соли этого; полисахариды, такие как хитозан, агар, декстран, геллановая камедь, ксантановая смола и пектин, и производные этого, комбинации этого и тому подобное.
Адгезионная прочность мукоадгезивной субстанции настоящего изобретения означает, хотя это будет подробно описано в приведенном ниже Тесте 5, значение, полученное следующим методом измерения. (1) Приготовьте диск из мукоадгезивной субстанции и две силиконовые пробки (⌀ 14 мм). (2) Поместите 100 мкл физиологического раствора по каплям на одну из силиконовых пробок и вслед за этим поместите диск мукоадгезивной субстанции. Кроме того, поместите 100 мкл физиологического раствора по каплям на диск и вслед за тем поместите оставшуюся силиконовую пробку. Затем дайте этому постоять в течение 1 минуты и затем сожмите их с силой 667 g в течение установленного времени (10 минут), таким образом приклеивая друг к другу. (3) Измерьте силу, при которой слипание снимается, используя прибор для измерения силы (произведенный Imada Inc.). Полученное значение и является адгезионной прочностью (g) мукоадгезивной субстанции. Адгезионная прочность мукоадгезивной субстанции находится предпочтительно в интервале от 200 до 1000 g, более предпочтительно от 250 до 900 g, далее более предпочтительно от 300 до 900 g. Когда значение меньше чем 200 g, адгезионная прочность низкая, поэтому желательное перемещение лекарства не может быть получено. С точки зрения изготовления не является предпочтительным, когда значение превышает 1000 g.
Мукоадгезивная субстанция настоящего изобретения, имеющая адгезионную прочность от 200 до 1000 g, означает мукоадгезивную субстанцию, адгезионная прочность которой находится в интервале от 200 до 1000 g. Конкретные примеры этого включают карбоксивиниловые полимеры, поливиниловый спирт, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу и соли этого, полиакриловую кислоту и соли этого, комбинации этого и тому подобное и предпочтительно являются карбоксивиниловыми полимерами, поливиниловым спиртом, гидроксиэтилцеллюлозой, гидроксипропилцеллюлозой, гидроксипропилметилцеллюлозой, натрийкарбоксиметилцеллюлозой, полиакриловой кислотой и комбинациями этого, более предпочтительно являются карбоксивиниловыми полимерами, гидроксипропилцеллюлозой, полиакриловой кислотой и комбинацией карбоксивинилового полимера и гидроксипропилцеллюлозы (при весовом соотношении от 100:1 до 1:100, предпочтительно от 10:1 до 1:10, более предпочтительно от 3:1 до 1:3).
В настоящем изобретении смешиваемое количество мукоадгезивной субстанции изменяется в зависимости от типа субстанции, которая используется в твердой композиции, и является выбранной в соответствии с типом вещества, которое включается в состав, эффективной терапевтической концентрацией лекарства или тому подобным.
Система доставки лекарства настоящего изобретения является превосходной в перемещении лекарства к ткани заднего сегмента глаза и является особенно превосходной в прямом перемещении лекарства к ткани заднего сегмента глаза. Здесь прямое перемещение лекарства к ткани заднего сегмента глаза означает, что лекарство переносится к ткани заднего сегмента глаза не системным путем, а через местную ткань глаза. То есть система доставки лекарства настоящего изобретения является превосходной в перемещении лекарства к ткани заднего сегмента глаза через местную ткань глаза. Подробно, система доставки лекарства настоящего изобретения является превосходной в перемещении лекарства к ткани заднего сегмента глаза через конъюнктивальную ткань и склеральную ткань.
Твердая композиция согласно настоящему изобретению находится в твердом состоянии при введении в конъюнктивальный мешок, однако после введения она смягчается, разбухает или тому подобное при соприкосновении со слезной жидкостью и прилипает к конъюнктивальной ткани. Один раз прилипшая к конъюнктивальной ткани, композиция не удаляется легко из области прилипания морганием или тому подобным. Считается, в течение прилипания твердой композиции настоящего изобретения к конъюнктивальной ткани таким способом может быть сохранено состояние, при котором слезная жидкость, присутствующая между композицией и конъюнктивальной тканью, редко заменяется, и кроме того, может быть сохранено состояние, в котором лекарство находится на конъюнктивальной ткани при высокой концентрации. Полагают, что это улучшает прямое перемещение лекарства к ткани заднего сегмента глаза через местную ткань глаза посредством использования градиента концентрации лекарства. Наоборот, полагают, что твердая композиция, которая не обладает мукоадгезивностью, может удерживать композицию в конъюнктивальном мешке в течение заданного времени, будучи введенной в конъюнктивальный мешок, однако так как состояние, как описано выше, не может быть сохранено на конъюнктивальной ткани, прямое перемещение лекарства к ткани заднего сегмента глаза через местную ткань глаза не улучшается. Более того, полагают, что даже в случае твердой композиции с мукоадгезивностью, если ее адгезионная прочность невысока, состояние, как описано выше, не может быть сохранено на конъюнктивальной ткани, следовательно, прямое перемещение лекарства к ткани заднего сегмента глаза через местную ткань глаза не улучшается.
Систему доставки настоящего изобретения применяют для лечения или предотвращения болезни ткани заднего сегмента глаза, особенно сетчатки, хориоида, склеры, зрительного нерва, ткани вокруг зрительного нерва или стекловидного тела. Конкретные примеры болезни включают воспаления вследствие различных причин, вирусные или бактериальные инфекции, болезни, вызванные хориоидальной и ретинальной неоваскуляризацией, болезни, вызванные ретинальной ишемией и нарушениями зрительного нерва, вызванными глаукомой. Более конкретные примеры этого включают увеит, цитомегаловирусный ретинит, возрастную дегенерацию желтого пятна, диабетическую ретинопатию, диабетический отек желтого пятна, пролиферативную витреоретинопатию, отслоение сетчатки, пигментную дегенерацию сетчатки, закупорку главной ретинальной вены, закупорку ветви ретинальной вены, закупорку главной ретинальной артерии, закупорку ветви ретинальной артерии и тому подобное.
Лекарство для включения в твердую композицию настоящего изобретения, не ограничивается особым образом, и может быть выбрано вещество, пригодное для болезни-мишени. Конкретные примеры этого включают стероиды, такие как бетаметазон, дексаметазон, триамцинолон, преднизолон, фторметолон, гидрокортизон и фторцинолон ацетонид и производные этого; гормоны, такие как прогестерон и тестостерон и производные этого; противовоспалительные вещества, такие как бромофенак и диклофенак; ингибиторы цитокинов, такие как ингибиторы TNF-α, анти-TNF-α; антитела, ингибиторы PDE-IV и ингибиторы ICE; иммуносупрессивные вещества, такие как циклоспорин и такролимус; противовирусные средства, такие как ганцикловир, ацикловир и интерферон-β; антибактериальные средства, такие как соединения хинолона, кларитромицин и эритромицин; ингибиторы АСЕ, такие как каптоприл; ингибиторы НМG-СоА редуктазы, такие как правастатин и симвастатин; противоопухолевые средства, такие как фторурацил, метотрексат и ингибиторы ММР; ингибиторы ангиогенеза, такие как эндостатин, ингибиторы VEGF, анти-VEGF антитела, антисмысловые олигонуклеотиды, ингибиторы РКС, ингибиторы фактора адгезии и ангиостатические стероиды; нейропротективные средства и нейротрофические факторы, такие как МК-801, тимолол, креатин, таурин и BDNF; ингибиторы карбонатдегидратазы, такие как ацетазоламид; тромболитические средства, такие как урокиназа; средства, улучшающие циркуляцию; противогрибковые вещества; антиоксиданты, такие как катехин и витамин Е; ингибиторы резорбции костей, такие как бисфосфанат; вещества, участвующие в поддержании зрительной функции, такие как ретиноевая кислота и производные этого; и тому подобное.
Настоящее изобретение также относится к способу улучшения перемещения лекарства к ткани заднего сегмента глаза посредством мукоадгезивной субстанции, включающему введение фармацевтически эффективного количества твердой композиции, содержащей лекарство и мукоадгезивную субстанцию, в конъюнктивальный мешок пациента-человека, согласно которому адгезионная прочность мукоадгезивной субстанции находится в интервале от 200 до 1000 g, и способу лечения болезни глаза, включающему введение терапевтически эффективного количества твердой композиции, содержащей лекарство и мукоадгезивную субстанцию, в конъюнктивальный мешок пациента-человека, согласно которому адгезионная прочность мукоадгезивной субстанции находится в интервале от 200 до 1000 g и перемещение лекарства к ткани заднего сегмента глаза улучшено посредством мукоадгезивной субстанции.
Количество лекарства, включенного в твердую композицию настоящего изобретения, может быть соответствующим образом увеличено или уменьшено в зависимости от типа лекарства, эффективной терапевтической концентрации этого, периода высвобождения лекарства, симптомов и тому подобного. Содержание лекарства находится в пределах от 0,01 до 95%, предпочтительно от 0,1 до 30% от веса твердой композиции. Доза лекарства изменяется в зависимости от типа лекарства, однако она обычно находится в пределах приблизительно от 1 до 100 мг за один раз.
Твердая композиция согласно настоящему изобретению может находиться в форме, допускающей введение в конъюнктивальный мешок, и особой форме с улучшенным удобством после введения или пригодностью (fitness) после введения, или тому подобное также включено. Предпочтительные примеры формы твердой композиции включают форму пленки, форму шарика, форму таблетки, форму палочки, форму частицы, сферическую форму и тому подобное. Такая композиция может быть приготовлена с применением обычно используемой методики. Например, она может быть приготовлена с использованием такого метода, как мокрое или сухое прессование, формование плавлением или отливкой растворителем (solvent casting), и если необходимо, могут быть также добавлены любые из различных фармацевтических добавок, такие как эксципиент, связующее вещество, дезинтегрирующее вещество, смазочное вещество, флюидизатор, стабилизатор и вещество, регулирующее pH. Более того, в качестве конкретного примера изготовления твердой композиции настоящего изобретения, в приведенных ниже примерах будет показана твердая композиция, использующая карбоксивиниловый полимер и гидроксипропилцеллюлозу в качестве мукоадгезивных субстанций и тому подобное. Твердые композиции, приготовленные в примерах, были оценены с помощью легкого и чувствительного метода, обычно используемого в качестве метода оценки перемещения лекарства к ткани заднего сегмента глаза, то есть с использованием вместо лекарства флюоресцеина или родамина В, который является флуоресцентным красителем.
Твердая композиция для использования в системе доставки настоящего изобретения может быть введена в конъюнктивальный мешок. Кроме того, для того чтобы далее упростить введение, также может быть использовано вспомогательное устройство для исключительного применения или тому подобное. Введение твердой композиции не требует профессиональной техники, такой как интраветриальная или подконъюнктивальная инъекция или имплантат.
Частота введения твердой композиции настоящего изобретения может быть соответствующе выбрана в зависимости от симптомов, возраста, основания или растворителя или тому подобного, однако она может быть введена от одного до нескольких раз (например, от одного до шести раз) в день или один раз в несколько дней или несколько месяцев (от одной до нескольких частей твердой композиции за один раз).
Преимущество изобретения
Как подробно будет описано ниже в разделе тест, при введении твердой композиции, содержащей флуоресцентный краситель и полиакриловую кислоту, карбовиниловый полимер, гидроксипропилцеллюлозу или комбинацию этого в качестве мукоадгезивной субстанции, имеющей адгезионную прочность 200 g или больше, в конъюнктивальный мешок, наблюдается явное различие в концентрации флуоресцентного красителя, присутствующего в хориоиде и сетчатке или стекловидном теле, между обработанными глазами и необработанными глазами. Кроме того, подтверждено, что твердая композиция, содержащая мукоадгезивную субстанцию, показывает очевидно лучшее перемещение флуоресцентного красителя к такой ткани заднего сегмента глаза, как хориоид и сетчатка или стекловидное тело, по отношению к глазным каплям, твердой композиции, не содержащей мукоадгезивную субстанцию, и твердой композиции, содержащей мукоадгезивную субстанцию, имеющую адгезионную прочность меньше чем 200 g. То есть прямое перемещение лекарства к ткани заднего сегмента глаза через местную ткань может быть улучшено введением в конъюнктивальный мешок твердой композиции, содержащей лекарство и мукоадгезивную субстанцию, имеющую адгезионную прочность 200 g или больше.
Лучший вариант осуществления изобретения
Ниже будут описаны приготовление твердой композиции настоящего изобретения, тест для измерения концентрации флуоресцентного красителя в ткани заднего сегмента глаза, тест для измерения адгезионной прочности мукоадгезивной субстанции и примеры приготовления, однако эти примеры описаны с целью лучшего понимания настоящего изобретения и не предназначены для ограничения рамок настоящего изобретения.
1. Тест 1
Исследовали перемещение флуоресцентного красителя к ткани заднего сегмента глаза через местную ткань глаза с использованием твердой композиции (в виде шарика), содержащей флуоресцентный краситель и мукоадгезивную субстанцию, и глазных капель, содержащих тот же самый тип флуоресцентного красителя.
1-1. Изготовление препарата
Пример 1
Гидроксипропилцеллюлозу (в дальнейшем упоминаемую как "НРС") и карбоксивиниловый полимер (в дальнейшем упоминаемый как "CVP") взвесили в весовом соотношении 1:2, поместили в ступку и перемешали до однородности. Взвесили 95 мг этого порошка, к этому добавили флюоресцеин (5 мг), который является флуоресцентным красителем, затем эти вещества поместили в ступку и перемешали. Потом взвесили 75 мг этого порошка и запрессовали в форме диска прессованием (10 кг/см2, 10 мин). Приготовленный таким образом диск разрезали на части размером 1×2 мм, тем самым был получен препарат HPC/CVP (1/2), содержащий 5% (в/в) флюоресцеина (твердая композиция в виде шарика). В дальнейшем данный препарат упоминается как Тестовый препарат 1. Кстати, в качестве НРС использовали гидроксипропилцеллюлозу, изготовленную Wako Pure Chemical Industries, Ltd., и в качестве CVP, использовали карбоксивиниловый полимер 934Р, изготовленный BASF.
Сравнительный пример 1
Флюоресцеин (16 мг), который является флуоресцентным красителем, взвесили в ступке. После того как его поместили в ступку, туда постепенно по каплям добавили раствор фосфатного буфера (2 мл), содержащий полисорбат 80 0,1% (в/в), чтобы суспендировать его, тем самым были получены суспензионные глазные капли, содержащие 0,8% (в/в) флюоресцеина. В дальнейшем данный препарат упоминается как Сравнительный препарат 1.
1-2. Метод испытаний
Тестовый препарат 1, приготовленный в Примере 1, был введен в конъюнктивальный мешок одного глаза (правый глаз) каждой крысы (доза флюоресцеина: 20 мкг/глаз). Затем крыс забивали через 0,5, 1,5 и 4,5 часа после введения, оба глаза, т.е. обработанный глаз и необработанный глаз, иссекали и получали хориоид, сетчатку и стекловидное тело соответственно. Хориоиды и сетчатки, полученные из двух глаз, были объединены, чтобы образовать один образец, и к этому было добавлено 250 мкл смешанного раствора метанола и воды (1/1). После смесь гомогенизировали и центрифугировали (13000 об/мин, 10 мин), нерастворимое вещество удаляли. Затем измеряли интенсивность флуоресценции (Em: 485 нм, Ех: 530 нм) и вычисляли концентрацию флюоресцеина в хориоиде и сетчатке. Стекловидные тела, полученные из двух глаз, объединяли, чтобы создать один образец, из образца забирали часть 40 мкл и к этому добавляли 200 мкл смешанного раствора метанола и воды (1/1). После смесь гомогенизировали и центрифугировали (13000 об/мин, 10 мин), нерастворимое вещество удаляли. Затем измеряли интенсивность флуоресценции (Em: 485 нм, Ех: 530 нм), и вычисляли концентрацию флюоресцеина в стекловидном теле. Вычисление концентрации флюоресцеина выполняли, используя калибровочную кривую. Калибровочная кривая была построена с использованием смешанного раствора метанола и воды (1/1) с растворенным в нем флюоресцеином в качестве стандартного раствора посредством добавления стандартного раствора к хориоиду и сетчатке и стекловидному телу нормальных глаз и выполнения той же самой процедуры сбора, как описано выше.
Кровь собирали перед тем, как крыс умерщвляли в вышеупомянутой процедуре. Полученный образец центрифугировали (13000 об/мин, 10 мин), а нерастворимое вещество удаляли. Затем измеряли интенсивность флуоресценции (Em: 485 нм, Ex: 530 нм) и вычисляли концентрацию флюоресцеина в плазме. Калибровочная кривая была построена с использованием смешанного раствора метанола и воды (1/1) с растворенным в нем флюоресцеином в качестве стандартного раствора посредством добавления стандартного раствора к плазме и выполнения той же самой процедуры сбора, как описано выше.
Далее Сравнительный препарат 1 вливали по капле в один глаз (правый глаз) каждой крысы (доза флюоресцеина: 40 мкг/глаз). После этого выполняли ту же самую процедуру, как описано выше, и вычисляли концентрацию флюоресцеина в хориоиде и сетчатке, стекловидном теле и плазме через 0,5, 1,5 и 4,5 часа после введения.
1-3. Результаты испытаний и обсуждение
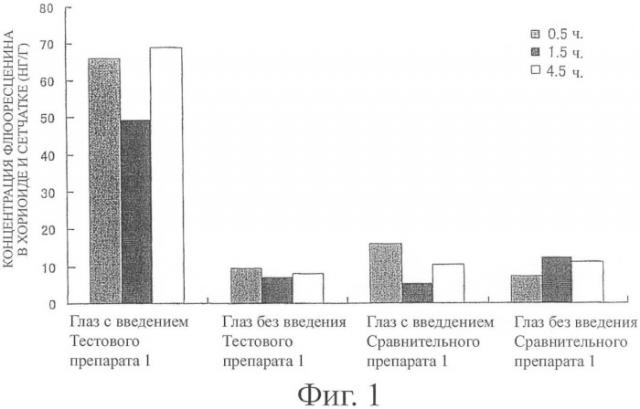
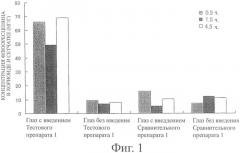
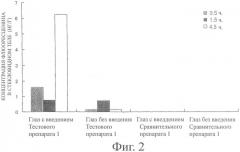
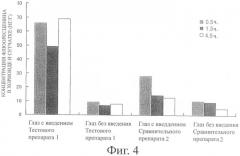
Фиг.1 показывает концентрацию флюоресцеина в хориоиде и сетчатке обработанного глаза и необработанного глаза после периода заранее установленного времени (0,5, 1,5 и 4, часа) после введения Тестового препарата 1 или Сравнительного препарата 1 (количество случаев: 6 глаз, 3 случая). Фиг.2 и 3 показывают концентрацию флюоресцеина в стекловидном теле и концентрацию флюоресцеина в плазме после периода заранее установленного времени (0,5, 1,5 и 4,5 часа) после введения Тестового препарата 1 или Сравнительного препарата 1 соответственно (количество случаев: 6 глаз, 3 случая).
Как видно из фиг.1, в то время как при использовании Сравнительного препарата 1 почти не наблюдалось различия в концентрации флюоресцеина в хориоиде и сетчатке между обработанным глазом и необработанным глазом, при использовании Тестового препарата 1 концентрация флюоресцеина в хориоиде и сетчатке обработанного глаза показала явно более высокое значение, чем у необработанного глаза. То есть было найдено, что при введении Тестового препарата 1, который представляет собой твердую композицию, содержащую мукоадгезивную субстанцию настоящего изобретения, в конъюнктивальный мешок флуоресцентный краситель эффективно переносится к ткани хориоида и сетчатки.
Как видно из фиг.2, в то время как при использовании Сравнительного препарата 1 концентрация флюоресцеина в стекловидном теле была не выше предела обнаружения и у обработанного глаза и у необработанного глаза, при использовании Тестового препарата 1 концентрация флюоресцеина в стекловидном теле обработанного глаза показала более высокое значение, чем у необработанного глаза. Особенно очевидно высокое значение было показано через 4,5 часа после введения. То есть было найдено, что при введении Тестового препарата 1, который представляет собой твердую композицию, содержащую мукоадгезивную субстанцию настоящего изобретения, в конъюнктивальный мешок флуоресцентный краситель эффективно переносится к ткани стекловидного тела.
Как видно из фиг.3, в то время как при использовании Сравнительного препарата 1 концентрация флюоресцеина в плазме показала высокое значение с начального периода после введения, при использовании Тестового препарата 1 концентрация флюоресцеина в плазме показала низкое значение до 1,5 часов после введения, а показала высокое значение только через 4,5 часа после введения. С другой стороны, на фиг.1 и 2, как описано выше, концентрация флюоресцеина в хориоиде и сетчатке и стекловидном теле обработанного глаза с Тестовым препаратом 1 показала очевидно более высокое значение, чем у необработанного глаза, и различие в концентрации флюоресцеина не наблюдалось между обработанным глазом со Сравнительным препаратом 1 и необработанным глазом. Это показывает, что флюоресцеин, содержащийся в Тестовом препарате 1, который представляет собой твердую композицию, содержащую мукоадгезивную субстанцию настоящего изобретения, доставляется к ткани заднего сегмента глаза преимущественно через местную ткань глаза, а Сравнительный препарат 1, который представляет собой суспензионные глазные капли, доставляется к ткани заднего сегмента глаза преимущественно через системный путь. Кстати, на фиг.3 полагается, что причиной того, почему высокое значение было показано через 4,5 часа после введения в Тестовом препарате 1, является то, что Тестовый препарат 1 расщеплялся в месте введения, давая в результате увеличение флюоресцеина, вымываемого слезной жидкостью.
Как следует из вышеприведенных результатов, было показано, что при введении твердой композиции, содержащей лекарство и мукоадгезивную субстанцию, в конъюнктивальный мешок лекарство может быть эффективно перенесено в ткань заднего сегмента глаза, такую как ткань хориоида и сетчатки или ткань стекловидного тела, и прямое перемещение лекарства к ткани заднего сегмента глаза через местную ткань глаза улучшается.
2. Тест 2
С использованием твердой композиции (в форме шарика), содержащей мукоадгезивную субстанцию, и твердой композиции (в форме шарика), не содержащей мукоадгезивную субстанцию, было исследовано влияние присутствия или отсутствия мукоадгезивной субстанции на перемещение флуоресцентного красителя к ткани заднего сегмента глаза. В качестве флуоресцентного красителя, включенного в твердую композицию, в Тесте 2 использовали флюоресцеин тем же самым способом, как в Тесте 1, а в Тесте 3, упомянутом ниже, для подтверждения важности мукоадгезивной субстанции вместо флюоресцеина использовали родамин В, который является другим флуоресцентным красителем.
2-1. Изготовление препарата
Сравнительный пример 2
Порошок флюоресцеина (50 мг) и этилен/винилацетат сополимер (в дальнейшем упоминаемый как "EVA") (50 мг) были смешаны плавлением при 150°С, смесь была спрессована так, чтобы получить слой около 1 мм, и формовое изделие порезали на части размером 1×2 мм, посредством чего был получен препарат EVA, содержащий 50% (в/в) флюоресцеина (твердая композиция в форме шарика), в качестве твердой композиции, не содержащей мукоадгезивную субстанцию. В дальнейшем данный препарат упоминается как Сравнительный препарат 2. Кстати, в качестве EVA использовали поли(этилен-со-винилацетат), 33 вес.% винилацетат, произведенный Aldrich Inc.
2-2. Метод испытаний
С использованием Тестового препарата 1 и Сравнительного препарата 2 была выполнена та же самая процедура, как описано в "1-2. Метод испытаний", и была вычислена концентрация флюоресцеина в хориоиде и сетчатке и стекловидном теле через 0,5, 1,5 и 4,5 часа после введения. Тестовый препарат 1 и Сравнительный препарат 2 были разработаны так, что они показали сходное поведение при элюировании.
2-3. Результаты испытаний и обсуждение
Фиг.4 показывает концентрацию флуоресцеина в хориоиде и сетчатке обработанного и необработанного глаза после периода заранее установленного времени (0,5, 1,5 и 4,5 часа) после введения Тестового препарата 1 и Сравнительного препарата 2 (количество случаев: 6 глаз, 3 случая). Далее фиг.5 показывает концентрацию флуоресцеина в стекловидном теле обработанного и необработанного глаза после периода заранее установленного времени (0,5, 1,5 и 4,5 часа) после введения Тестового препарата 1 и Сравнительного препарата 2 (количество случаев: 6 глаз, 3 случая).
Как видно из фиг.4, при использовании Сравнительного препарата 2, несмотря на то что наблюдалось небольшое различие в концентрации флуоресцеина в хориоиде и сетчатке между обработанным глазом и необработанным глазом через 0,5 часа после введения, через 1,5 и 4,5 часа после введения различия почти не было. С другой стороны, у обработанного глаза с Тестовым препаратом 1 концентрация флуоресцеина в хориоиде и сетчатке показала очевидно более высокое значение, чем у необработанного глаза. То есть было обнаружено, что мукоадгезивная субстанция, включенная в твердую композицию, является важным фактором, способствующим перемещению флуоресцентного красителя в ткань хориоида и сетчатки через местную ткань глаза.
Как видно из фиг.5, в то время как при использовании Сравнительного препарата 2 почти не наблюдалось различие в концентрации флуоресцеина в стекловидном теле между обработанным глазом и необработанным глазом, у обработанного глаза с Тестовым препаратом 1 концентрация флуоресцеина в стекловидном теле показала более высокое значение, чем у необработанного глаза. Особенно явно высокое значение было показано через 4,5