Катализатор и способ глубокой очистки газовых смесей от сероводорода в его присутствии
Иллюстрации
Показать всеИзобретение относится к каталитическим способам газовых смесей от сероводорода. Описан катализатор глубокой очистки газовых смесей от сероводорода, содержащий активированную матрицу кремнезема, полученную кислотным травлением природного вермикулита, и наноразмерные частицы оксида железа или меди или их смесь, в количестве 0,1-2,5 мас.% по отношению к массе кремнезема и при соотношении меди к железу в их смеси, равном 0,3. Описан также способ каталитической глубокой очистки газовых смесей от сероводорода путем его окисления кислородом воздуха до элементной серы, причем в качестве газовых смесей используют смеси с содержанием сероводорода до 1 об.%, а процесс ведут в присутствии описанного выше катализатора до остаточного содержания серы не более 1 ppm. Технический результат - описанный катализатор обеспечивает конверсию сероводорода, равную 95-99%. 2 н. и 3 з.п. ф-лы, 4 табл., 3 ил.
Реферат
Настоящее изобретение относится к нанотехнологиям в гетерогенном катализе, а именно к способу глубокой очистки природного газа от сероводорода, и может быть использовано с целью подготовки природного газа для последующих процессов конверсии в водород и синтез-газ.
На сегодняшний день и ближайшую перспективу получение водорода и синтез-газа базируется главным образом на каталитических процессах конверсии, в том числе паровой конверсии природного газа, в котором в качестве основного компонента катализатора выступает никель, нанесенный на подложки различной природы в виде оксида.
Однако никелевые компоненты катализатора проявляют высокую чувствительность к отравлению серосодержащими компонентами и в том числе сероводородом, присутствующем в природном газе многих месторождений. Так, содержание сероводорода в природном газе порой достигает 15-20%. В то время как уровень необходимой очистки природного газа, поступающего на процессы каталитической конверсии метана и оцененного по остаточной концентрации водорода, не должен превышать 1-2 ррм.
В этой связи одной из важнейших проблем в области производства водорода и синтез-газа из природного газа является степень его очистки от сероводорода. Например, уже после аминной очистки содержание сероводорода в метане составляет от 2 до 6 ррм. Этого количества вполне достаточно, чтобы необратимо отравить дорогостоящие катализаторы конверсии метана.
Исчерпывающую очистку метана ведут путем стехиометрического взаимодействия сероводорода с дорогостоящим оксидом цинка, являющимся на этой стадии реагентом, процесс регенерации которого является энергоемким и дорогостоящим.
Таким образом, все вышеотмеченные проблемы обусловливают чрезвычайную актуальность разработки процессов прямой, исчерпывающей каталитической очистки реакционных отходящих газов и газов бытового назначения от сероводорода.
Одним из перспективных методов исчерпывающей очистки газов от сероводорода является прямое окислительное каталитическое разложение на ряде металлсодержащих катализаторов.
Первые работы в этой области относятся к использованию никель-, молибден-, хром-, ванадий- и др. металлсодержащих каталитических систем на основе традиционных носителей, таких как оксиды алюминия, кремния, алюмосиликаты. Получают такие катализаторы, как правило, методом пропитки носителей из водных растворов неорганических солей, преимущественно азотнокислых.
Главной особенностью процесса является селективное окисление сероводорода в среде воздуха до элементной серы:
H2S+1/2O2→S+H2O
Как видно из химического уравнения, воздушная среда необходима для подачи стехиометрического количества кислорода с целью обеспечения термодинамически благоприятных условий протекания процесса. Однако кинетика протекания реакции по кислороду ниже первого порядка. Это указывает на то, что в реакции участвует активный кислород поверхности катализатора, в то время как молекулярный кислород, по всей вероятности, необходим для насыщения поверхности (залечивания дефектов). Температура процессов разложения H2S на известных катализаторах не превышает 300°С.
В то же время следует отметить, что более высокие температуры, чем 300°С, или избыток молекулярного кислорода могут привести к окислению серы до SO2:
H2S+1,5O2→H2O+SO2
Сероемкость таких катализаторов, как правило, невелика, что обуславливает малую производительность и частую регенерацию, а сами способы их получения энергоемки и экологически опасны. Поэтому эти способы разложения сероводорода скорее носят принципиальный характер для изучения механизма самого каталитического разложения и вряд ли по экономическим соображениям могут быть использованы в промышленности.
Известны также металлсодержащие катализаторы очистки газов от сероводорода на основе углеродных носителей.
Например, ранее в авт. свид. СССР №1761236, 1992 было предложено для очистки газов от сероводорода путем его окислительного разложения использование в качестве катализаторов остатков гидрогенизации бурого угля, содержащих никель или железо, а в патенте РФ №2172647, 2001 предложен железоуглеродный катализатор селективного окислительного разложения сероводорода.
Главным недостатком таких катализаторов является их пожароопасность, особенно учитывая то, что процесс прямого окисления сероводорода является экзотермическим с большим тепловым эффектом (Q=53 ккал/моль).
В патенте US №2003194366 от 2003 г. был описан способ очистки сероводорода, содержащегося в широком ряде органических субстратов, таких как газообразные углеводороды, ароматические и кислородсодержащие соединения, в присутствии чрезвычайно широкого (практически вся Периодическая система элементов) оксидов металлов (оксид алюминия, кремния, титана, модифицированных Fe, Со, Mn, Cr, Cu, Мо, Nb и др.) или их смесей при температурах, близких к 400°С, до серы и оксидов серы. Несмотря на широкий охват возможных условий, патент обладает рядом существенных недостатков, главным из которых является то, что только специфическая форма оксидов, закрепленных на поверхности носителей, позволяет провести глубокое и селективное окисление сероводорода до серы. Вызывает критику и высокие температуры предлагаемого процесса. Оксиды металлов, таких как Mn, Cr, при этих температурах окисляют сероводород до оксидов серы, что является неприемлемым в процессе очистки газа. Оксиды меди и молибдена проявляют низкую активность, если они не представлены в специфической форме наноразмерных частиц. Массивные оксиды железа и кобальта быстро подвергаются осернению и теряют активность. Причем стабильные сульфидные формы не оставляют возможности их регенерации. Рассматриваемый патент в большей степени подходит для первой стадии Клаус-процесса, в которой часть сероводорода нужно окислить до диоксида серы. В этом аналоге не указывается глубина очистки от сероводорода, что является важным технологическим и экологическим фактором для последующего использования газа. Таким образом, рассмотренный аналог не является решением для глубокой очистки газа от сероводорода.
Наиболее близким аналогом являются катализатор и способ по патенту РФ №2114685 от 10.07.1998.
В катализаторе глубокой очистки газовых смесей от сероводорода по этому патенту предлагается использовать в качестве носителя (матрицы) материал, состоящий из оксида кремния (кремнезема) и содержащий в качестве активных компонентов один или несколько оксидов переходных металлов, таких как Ni, Co, Fe, Cu, Ag, Mn, Mo, Cr, W, V.
Способ глубокой очистки газовых смесей от сероводорода по этому патенту в присутствии этого катализатора включает окисление сероводорода до элементарной серы путем контактирования исходной смеси газов и газа, содержащего свободный кислород в количестве, обеспечивающем молярное отношение О2: H2S 0,5-3,0 с катализатором селективного окисления сероводорода в серу при 50-180°C с осаждением образующейся серы на катализаторе и получением газового потока, практически не содержащего сероводород, регенерации катализатора, заполненного серой, продувки газом, не содержащим свободный кислород, при температуре, достаточной для испарения серы, осажденной на катализаторе.
К основным замечаниям к этим катализатору и способу можно отнести недостаточную стабильность катализатора, сложность технологии, высокую энергоемкость регенерации катализатора.
Задача предлагаемого изобретения заключается в создании катализатора, проявляющего высокую активность, селективность и стабильность в процессе глубокой очистки газовых смесей от сероводорода, а также удешевления и упрощения технологии за счет снижения энергоемкости регенерации катализатора.
Поставленная задача решается тем, что предложен катализатор глубокой очистки газовых смесей от сероводорода, содержащий матрицу кремнезема и частицы оксида железа или меди или их смесь, который содержит активированную матрицу кремнезема, полученную кислотным травлением природного вермикулита и наноразмерные частицы оксида железа или меди или их смеси, в количестве 0,1-2,5 мас.% в расчете на металл по отношению к массе кремнезема и при соотношении меди к железу в их смеси, равном 0,3.
Поставленная задача решается также тем, что предложен способ каталитической глубокой очистки газовых смесей от сероводорода путем его окисления кислородом воздуха до элементной серы, в котором процесс ведут в присутствии предложенного катализатора до остаточного содержания серы не более 1 ppm. Процесс ведут при температуре 25-250°С, объемной скорости подачи газовой смеси на катализатор, равной 1000-4000 ч-1, с использованием газовых смесей с содержанием сероводорода до 1 об.%.
Причем, когда процесс ведут при температурах ниже 120°С, после пропускания 14000 объемов газа на 1 объем катализатора, не прекращая подачи реагентов, проводят периодическую регенерацию катализатора. С этой целью температуру в реакционной зоне повышают до 250°С, ведут процесс окисления при этой температуре в течение 2-х часов, после чего температуру вновь снижают до первоначальной.
Активированную матрицу кремнезема получают путем кислотного травления природного вермикулита согласно методике, описанной в авт.свидетельстве СССР №1042794, Б.И. №35,1983; РАН (сер. хим.), 1984, 6, с.1237-1241; Журнал физической химии, 2007, Т.81, №5, 781- 787.
Ступенчатое травление вермикулита позволяет получить высокоочищенный кремнезем с развитой мезопористой структурой.
Ранее авторами предлагаемого изобретения было найдено, что матрица кремнезема, полученная путем кислотного травления вермикулита, проявляет сродство к металлам VIII группы, включая их в структуру кремнезема при взаимодействии его поверхности с комплексами соответствующих металлов, и становится активной в ряде реакций в результате включения ионов металлов в межслоевое пространство матрицы, о чем было опубликовано в ряде работ: А.с. №1039534, Б.И. №33, 1983; Физико-химия ультрадисперсных систем. Сборник под ред. акад. Тананаева И.В., Наука, с.132-139, 1987; Изв. РАН (сер. хим.), 6, с.1724-1728; Hyperfme Interaction, 1990, 57, р.1983-1986; Изв. РАН (Сер. Хим.), 2004, №6, 1376-1382; Неорганические материалы, 2006, Том 42, №4, 1-4.
Например, полученная, таким образом, железосодержащая матрица проявляет активность в реакции гидрирования СО в углеводороды «Включение железа в модифицированный слоистый силикат и влияние его состояния на селективность в реакции гидрирования СО», Изв. РАН (сер. хим.), 12, с.2666-2670, 1986.
Однако ранее известно не было, что металлсодержащая матрица кремнезема проявляет повышенную активность и стабильность в окислительном разложении сероводорода в серу.
Повышенная стабильность предложенных каталитических систем обусловлена сильным взаимодействием матрицы кремнезема и ионов металлов, включенных в ее структуру, которая не позволяет ионам металлов при воздействии сероводорода перейти в неактивные формы сульфидов металлов, такие как пирротит и пирит, образование которых на поверхности катализатора приводит к его осернению и, как следствие, потере активности.
Нижеследующие примеры иллюстрируют изобретение, но никоим образом не ограничивают его область.
Приготовление носителя
Пример 1.
Обожженный природный вермикулит с фракционным составом 60-80 меш. в количестве 100 г подвергают 2-ступенчатому травлению, в котором на 1-й стадии используют разбавленную 5-7% соляную кислоту в количестве 300 г при температуре 50-60°С при перемешивании в течение 2-х часов, а затем на 2-й стадии обрабатывают 2-кратным объемом концентрированной соляной кислоты (d=1,18 г/см3) при 70-80°С в течение 4-х часов.
После окончания травления выгружают 50-60 г сорбента, который промывают дистиллированной водой до нейтральной реакции (рН 6-7 на лакмусовый индикатор) и в зависимости от необходимого вида, порошок или таблетки, либо сушат на воздухе, либо в мокром виде подвергают прессованию в таблетки, после чего таблетки высушивают в вакуумном шкафу при 100°С и затем прокаливают в муфельном шкафу при 200°С не менее 2-х часов, 350°С в течение 2-х часов и при 500°С в течение 4-х часов.
Получают активированную матрицу кремнезема, пористая структура которого характеризуется величиной удельной поверхности 320-350 м2/г и размером пор 3-4 нм.
Пример 2.
Проводят первую стадию травления 100 г обожженного вермикулита, как в примере 1.
На второй стадии носитель подвергают травлению 2-кратным избытком 40%-ной серной кислоты при температуре 80-90°С в течение 2-3 часов.
Далее поступают, как описано в примере 1.
Пористая структура активированной матрицы кремнезема характеризуется величиной удельной поверхности 430 м2/г и супермикропорами размером 1,0-2 нм.
Пример 3.
Проводят первую стадию травления 100 г обожженного вермикулита, как в примере 1.
На второй стадии используют 40%-ную ортофосфорную кислоту в 2-кратном избытке по объему, проводят травление и ступенчато прокаливают, как в примере 1.
Пористая структура активированной матрицы кремнезема характеризуется величиной удельной поверхности 420-430 м2/г и супермикропорами размером 1,0-2 нм.
Пример 4.
Проводят первую стадию, как в примере 1. На второй стадии сорбент при перемешивании обрабатывают 3-кратным избытком смеси, состоящей из 30-50%-ной серной кислоты и 60%-ной азотной кислоты, взятых в количестве 60 и 40 об.% соответственно. Затем сушат и прокаливают, как в примере 1.
Пористая структура активированной матрицы кремнезема характеризуется величиной удельной поверхности 350 м2/г и малыми мезопорами с размером 4-6 нм.
Пример 5.
Первую стадию травления природного вермикулита проводят, как в примерах 1 и 2.
После промывки носитель подвергают ступенчатой сушке вначале на воздухе, затем в вакуумном шкафу при температуре 100°С, после чего обрабатывают в муфельной печи при температурах 250, 350 и 550°С.
Затем без доступа влаги носитель выгружают в пропиточный сосуд, в который при перемешивании добавляют 2%-ный водный раствор мочевины, карбоната или ацетата аммония и пропитывают в течение 2-х часов. Адсорбционная емкость матрицы, оцененная объемом поглощаемой воды на 100 г сорбента, увеличивается с 0,28 см3/г для образцов, полученных в примерах 2-4, до 40 г водного раствора на 100 г носителя.
После пропитки носитель высушивают сначала на воздухе, а потом в вакуумном шкафу при 80-100°С. Затем носитель помещают в муфельную печь и выдерживают при температуре 400-450°С в течение 30 мин, после чего носитель вынимают из печи и охлаждают до комнатной температуры.
Полученная таким образом активированная матрица кремнезема характеризуется величиной удельной поверхности 350-400 м2/г и размером пор 2-4 нм.
Пример 6.
Проводят первую стадию травления вермикулита, как в примере 1. После травления выгружают 80 г кремнезема, промывают дистиллированной водой до нейтральной реакции на индикатор и подвергают термической обработке, как в примере 1.
Величина удельной поверхности активированной матрицы кремнезема, выгруженной после одноступенчатого травления разбавленной соляной кислотой, составляет 450-470 м2/г и размер пор 1,0-1,5 нм.
Пример 7.
Вермикулит, взятый как в примере 1, подвергают одноступенчатому травлению 3-кратным количеством концентрированной соляной кислоты при температуре 70-80°С при перемешивании в течение 4-х часов.
Затем матрицу выгружают, промывают дистиллированной водой до нейтральной реакции на индикатор и подвергают термической обработке, как в примере 1.
Величина удельной поверхности активированной матрицы кремнезема составляет 250 м2/г со средним значением размера пор 6-8 нм.
Результаты приведенных примеров представлены в таблице 1.
Способ постадийной обработки природного вермикулита заключается в следующем.
На первой стадии из природного вермикулита вытравливается основная масса неэмпирических включений, основные из которых представляют ионы Al, Mg и Fe. При этом мягкое травление приводит к зарождению микропор. Удельная поверхность кремнезема, полученного после первой стадии травления вермикулита, составляет 450-470 м2/г.
| Таблица 1 | |||||
| Пористая структура и характеристическая энергия адсорбции матриц, полученных на основе вермикулита | |||||
| N/N примеров приготовления активированной матрицы | Объем пор, V, см3·г | Удельная поверхность, м2/г | Характеристическая энергия адсорбции ккал/моль | ||
| Vмикро | Vмезо | Vмакро | |||
| 1 | 0,110 | 0,377 | 0,010 | 350 | 1,6 |
| 2 | 0,106 | 0,311 | 0,05 | 430 | 1,3 |
| 3 | 0,110 | 0,300 | 0,1 | 420-430 | |
| 4 | 0,097 | 0,249 | 0,08 | 410 | 1,1 |
| 5 | 0,055 | 0,260 | 0,5 | 300 | |
| 6 | 0,250 | 0,050 | 0,01 | 420 | |
| 7 | 0,01 | 0,150 | 0,100 | 90 |
Травление концентрированными кислотами на второй стадии происходит, главным образом, по микропорам и приводит к их увеличению, а также к возрастанию суммарного адсорбционного объема активированной матрицы кремнезема. Если на первой стадии, несмотря на большую величину удельной поверхности, адсорбционный объем не превышает 0,15-0,2 см3 бензола на 1 г носителя, то на второй стадии адсорбционный объем пор возрастает до 0,5 см3/г.
При травлении в одну стадию концентрированной кислотой происходит разрушение макроструктуры матрицы, и в конечном итоге активированная матрица кремнезема характеризуется низкой адсорбционной способностью по отношению к органическим продуктам.
Согласно примеру 5 происходит направленное развитие адсорбционного объема при сохранении высокого сродства активированной матрицы кремнезема к адсорбции углеводородов. В этом примере адсорбция неорганических сорбатов осуществляется в микропорах, сформированных на первой стадии травления разбавленной кислотой. В ходе последующего термического воздействия (термоудара) происходит разложение адсорбированных солей аммония, в результате чего происходит частичное разрушение микропор и их увеличение с формированием мезопор. При этом макроструктура активированной матрицы кремнезема остается близкой к природному соединению.
Получение катализатора разложения сероводорода
После травления активированную матрицу кремнезема промывают дистиллированной водой до нейтральной среды, фракционируют, отбирают фракцию с размерами 0,1-0,4 мм и наносят оксиды металлов из органических растворов их металлокомплексных предшественников, например, ацетилацетонатов, ацетатов, формиатов или пиволатов, с последующей просушкой на воздухе, вакуумированием и ступенчатой термообработкой при температуре 300, 400 и 600°С в течение одного часа при каждой температуре.
Примеры 8-11.
На активированную матрицу кремнезема, полученную, как описано в примере 1, путем пропитки наносят 0,1; 1,5; 2,5 и 5% железа из 50 см3 растворов, содержащих соответствующие количества ацетилацетоната железа [Fе(асас)3] в толуоле, при комнатной температуре и перемешивании течение 4-х часов до обесцвечивания раствора.
После пропитки железосодержащую матрицу просушивают в атмосфере и затем ступенчато нагревают до 200, 300 и 550°С, выдерживая при каждой температуре в течение двух часов.
Примеры 12-14.
Получают катализатор, содержащий 1,5% Fe, как описано в примере 9, используя активированную матрицу кремнезема, полученную по примерам 3-5 соответственно.
Примеры 15-16.
Получают катализатор, содержащий 1,5% Fe, как описано в примере 9 с использованием активированной матрицы кремнезема, полученного по примерам 6 и 7 соответственно.
Пример 17.
Ацетилацетонат меди (Сu2+), перемешивая, растворяют в 0,5 см3 моноэтаноламина - получают раствор 1, который затем разбавляют толуолом и получают раствор 2.
В раствор 2 добавляют ацетилацетонатный комплекс железа для получения раствора 3.
Активированную матрицу кремнезема, полученную по примеру 1, пропитывают раствором 3 при перемешивании в течение 2-х часов, после чего каталитическую систему сушат, как описано в примерах 7-10.
Ацетилацетонат меди (Сu2+) и ацетилацетонатный комплекс железа берут в количествах, необходимых для получения катализатора, содержащего 1,5 мас.% Fe и 0,5 мас.% Cu.
Пример 18.
Готовят катализатор, как описано выше, содержащий в качестве активного компонента только оксид меди в количестве 1,5% в расчете на медь, по отношению к активированной матрице кремнезема, полученной по примеру 1.
Пример 19.
Готовят железомедный катализатор, как в примере 17, с использованием активированной матрицы кремнезема, полученной по примеру 1, с нанесением активных компонентов из растворов формиатных комплексов железа и меди в толуоле.
Пример 20.
Готовят железомедный катализатор, как в примере 17, с использованием карбоксилатных комплексов (пиволатов) железа и меди и активированной матрицы кремнезема, полученной в примере 1.
Очистка газовых смесей от сероводорода
Очистку газовых смесей от сероводорода путем его окисления до элементной серы проводят с использованием двух модельных газовых смесей: первой, состоящей из метана, содержащего 0,5 об.% H2S и стехиометрического по отношению к сероводороду количества кислорода воздуха (1,5%) и второй, соответствующей отходам «Клаус-процесса» и содержащей 30% водяных паров, 0,5% H2S; 0,5% О2, остальное N2.
Опыты по окислению сероводорода проводят в стеклянной установке проточного типа с неподвижным слоем катализатора. В реактор загружают 5 см3 крошки катализатора, размер которой d=3 мм. Для этого железосодержащую активированную матрицу кремнезема перетирают в агатовой ступке, из порошка прессуют таблетки размером 8×3 мм, которые затем разламывают. Опыты проводят при температуре от 25-250°С и объемной скорости подачи газовой смеси на катализатор, равной 1000-4000 ч-1.
Загруженный катализатор предварительно обрабатывают инертным газом (N2) при температуре 400°С в течение 2 часов.
Из реактора газ проходит через холодильник и барботирует через 10% раствор CdCl2. Конверсию Н2S определяют весовым методом: проскок сероводорода фиксируют по образованию осадка сульфида кадмия, который отфильтровывают, высушивают и взвешивают.
Степень конверсии сероводорода определяют по формуле:
αH2S=[1-1,39а]100,
где α - степень конверсии H2S, об.%; a - количество образующегося в растворе CdS, г.
Примеры 21-24.
Окисление сероводорода, содержащегося в метане (0,5 об.%) проводят при температуре 100°С и объемной скорости подачи газа 1000 ч-1 в присутствии катализаторов, содержащих 0,5; 1,5; 2,5 и 5% железа, полученных согласно примерам 8-11.
Результаты испытаний прямого окисления сероводорода, содержащегося в метане, в соответствии с примерами 21-32 представлены в таблице 2.
| Таблица 2 | |||||
| N/N примеров по окислению H2S | № примеров приготовления катализаторов | Температура, °С | Объемная скорость подачи газа, ч-1 | Конверсия Н2S, % | Удельный объем газа, пропущенного до проскока, об. газа/об. кат |
| 21 | 8 | 100 | 1000 | 95 | 15000 |
| 22 | 9 | 100 | 1000 | >99,9 | >20000 |
| 23 | 10 | 100 | 1000 | >99,9 | >20000 |
| 24 | 11 | 100 | 1000 | 92 | 10000 |
| 25 | 12 | 120 | 80 | 5000 | |
| 26 | 13 | 120 | >99,9 | >20000 | |
| 27 | 14 | 120 | >99,9 | >20000 | |
| 28 | 15 | 120 | 70 | 10000 | |
| 29 | 16 | 120 | 60 | 5000 | |
| 30 | 8 | 150 | 2500 | Остаточная концентрация - 10 ppb | >50000 |
| 31 | 8 | 150 | 4000 | Остаточная концентрация - 10 ppb | >50000 |
| 32 | 8 | 25-30 | >99,9 | 13000 (1 цикл), 13000 (2 цикл), 13000 (3 цикл) |
Как видно, каталитическая активность железосодержащего кремнезема возрастает при увеличении содержания активного компонента до 1,5%, что выражается в большей сероемкости и количестве газа (до 20000 об/об. катализатора), прошедшего через слой катализатора до проскока при исчерпывающем превращении сероводорода. Повышение содержания активного компонента до 2,5% не приводит к изменению ресурса используемой системы. В то же время при 5% железосодержащего компонента активность системы падает, что, как показало исследование методами мессбауэровской спектроскопии и магнитной восприимчивости, связано с укрупнением частиц активной фазы оксида железа.
Так, при содержании в образце катализатора железа до 2,5% около 20% его содержания в образце представляют собой ионы (Fe3+), связанные с кислородом поверхности кремнезема, а остальные 80% находятся в межслоевом пространстве кремнезема в виде суперпарамагнитых частиц гамма оксида железа с размером 2-4 нм, также сильно взаимодействующих с поверхностным кислородом матрицы кремнезема, что и обеспечивает повышенную стабильность предложенного катализатора.
При более высоком содержании (более 2,5 мас.%) железо представлено укрупненными частицами гамма оксида железа и магнетита с размером 6-8 нм. Такие частицы не столь сильно взаимодействуют с поверхностью кремнезема и при воздействии сильного окислителя, такого как H2S, переходят в сульфидные фазы пирротита и пирита, т.е. происходит осернение катализатора и потеря его активности.
Примеры 25-27.
Проводят окисление сероводорода, содержащегося в метане, в присутствии катализаторов, содержащих 1,5% железа и полученных по примерам 12-14 соответственно.
Как видно из таблицы 2, активность каталитической системы не уступает железосодержащему катализатору, полученному в примере 1.
Примеры 28-29.
Проводят окисление сероводорода, содержащегося в метане, в присутствии катализаторов, содержащих 1,5% железа, полученных по примерам 15-16 соответственно.
Как видно из таблицы 2, катализатор, приготовленный на основе матрицы кремнезема, полученной в результате одноступенчатого кислотного травления вермикулита, обладает более низкой каталитической активностью по сравнению с катализаторами, испытанными в примерах 21-24.
Проскок сероводорода происходит после пропускания 10000 об. газа на 1 об. катализатора.
Снижение каталитической активности катализаторов, приготовленных в примерах 15 и 16, по всей вероятности, объясняется более низким адсорбционным объемом исходной матрицы кремнезема, полученной в результате одноступенчатого кислотного травления.
Таким образом, наиболее оптимальным катализатором окисления сероводорода в серу, как с позиции каталитической активности, так и с точки зрения простоты и удешевления процесса его приготовления, является система, полученная в примере 8 на основе активированной матрицы кремнезема, полученного двухступенчатым травлением соляной кислотой, согласно примеру 1.
Пример 30.
С целью глубокой очистки метана от сероводорода проводят окисление сероводорода в присутствии оптимального образца катализатора, полученного в примере 8, для газовой смеси метана, содержащего 0,1% H2S. В этом опыте через 5 см3 катализатора пропускают 240 л метана, содержащего сероводород, при 150°С и с объемной скоростью 2500 ч-1.
Глубину очистки газа оценивают по содержанию серы в твердом остатке водного раствора CdCl2 с поправкой на примеси серы в исходном хлористом кадмии. Последнее определяют на основе сероводорода, провзаимодействовавшего с CdCl2 в растворе барботера на выходе из реактора. Для этого водный раствор CdCl2 упаривают, а сухой остаток сушат. Количество серы сероводорода, провзаимодействовавшего с хлористым кадмием, определяют методом лазерной спектрометрии.
За время проведения опыта не наблюдалось выпадения сульфида кадмия. Анализ сухого осадка, выделенного из барботера, проведенного методом лазерной спектрометрии, показал, что с поправкой на микропримеси в нем обнаружено серы - 0,0005% S - (0,000025 г) в 5 г загруженного CdCl2. Это количество лежит на границе чувствительности метода.
В пересчете остаточная концентрация сероводорода в очищенном метане составляет менее 10 ppb.
Пример 31.
Проводят в условиях, аналогичных примеру 30, но при объемной скорости, равной 4000 ч-1.
Остаточная концентрация сероводорода в очищенном метане составляет менее 10 ppb.
Пример 32.
Проводят очистку метана, содержащего 0,5% сероводорода, в присутствии катализатора, полученного в примере 8, при температуре 25-30°С и объемной скорости подачи газовой смеси, равной 1000 ч-1.
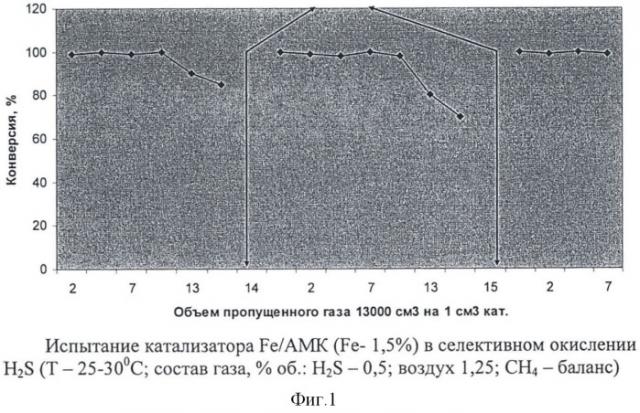
На фиг.1 представлена диаграмма каталитической активности катализатора, из которой видно, что при пониженной температуре без проскока проходит 14000 об. газа на 1 об. катализатора, после чего наблюдается проскок. Регенерация катализатора путем обработки воздухом при 450°С не приводит к восстановлению первоначальной активности. В то же время, если при подаче рабочего газа поднять температуру до 170-180°С и осуществлять окисление сероводорода при этой температуре в течение 2 часов, при последующем снижении температуры до 25-30°С, активность катализатора достигает первоначального уровня. Обработка катализатора рабочей смесью газа при 170-180°С способствует протеканию двух процессов: выплавке серы с поверхности и, по всей вероятности, окислению связанной серы. В результате на поверхности катализатора вновь формируются нестехиометрические кластеры оксида железа, являющиеся активными компонентами окислительного разложения сероводорода до серы.
На основании проведенных испытаний было установлено, что сероемкость катализатора достигает высоких показателей и равна 22 г S на 100 г катализатора.
Следующие примеры иллюстрируют способ очистки газовых смесей от сероводорода для второй модельной смеси, соответствующей отходам «Клаус-процесса» и содержащей 30% водяных паров, 0,5; H2S; 0,5% О2, остальное N2.
Примеры 33-37.
Проводят прямое окисление 1% H2S, содержащегося в пароазотной смеси в присутствии катализаторов, с различным содержанием активного компонента при 250°С. В таблице 3 представлены данные по влиянию количества нанесенного железа на каталитическую активность.
| Таблица 3 | ||
| Влияние содержания Fe (мас.%) на конверсию (мас.%) и селективность (мас.%) в окислении сероводорода в серу | ||
| Содержание Fe | Конверсия | Селективность |
| Следы | 10 | ≥99 |
| 1,0 | 40 | ≥99 |
| 1,5 | 80 | ≥99 |
| 2,5 | 98 | 97 |
| 5,0 | ≥99 | 75 |
Из таблицы 3 видно, что количество нанесенного железа оказывает существенное влияние на показатели процесса. При увеличении количества железа до 2,5% активность возрастает, в то время как дальнейшее повышение активного компонента приводит к существенному снижению селективности процесса в результате глубокого окисления сероводорода до SO2.
Пример 38.
Проводят прямое окисление 1% H2S, содержащегося в пароазотной смеси. Время испытания катализатора в присутствии системы, содержащей 2,5% Fe, составляет 60 часов.
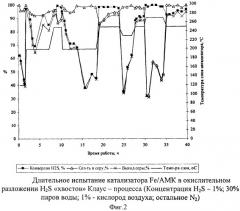
На фиг.2 представлена кривая каталитической активности по превращению сероводорода в течение всего срока испытания катализатора при различных температурах.
Как видно из диаграммы испытаний (фиг.2), наилучшие результаты по изучению активности катализатора были получены при работе в температурном диапазоне 230-255°С, причем температура 250°С является оптимальной. При этой температуре катализатор обеспечивает степень превращения сероводорода, близкую к 100%, селективность и выход серы составляют 90-95%. При температурах ниже 250°С показатели работы катализатора (конверсия сероводорода и выход серы) ухудшаются с течением времени. При подъеме температуры до 250°С конверсия сероводорода и выход серы вновь возрастают и составляют не менее 90%, оставаясь в течение 5 часов неизменными. Тот же эффект обнаруживается и при подъеме температуры от 250 до 270°С и последующем ее возвращении на уровень 250°С. Таким образом, катализатор обладает весьма ценным свойством - способностью восстанавливать свою активность при возвращении к оптимальным условиям процесса.
Полученные результаты мы можем интерпретировать следующим образом: оптимальная температура для работы данного катализатора составляет 250°С, ниже этой температуры тормозящим параметром является степень превращения сероводорода, что вероятнее всего связано с отложением серы, блокирующей активные центры, в узких щелевидных порах катализатора. Выше 250°С при высокой конверсии наблюдается значительное снижение селективности по сере вследствие образования SO2.
Исходя из полученных экспериментальных данных, можно сделать следующие выводы.
Предложенный катализатор отличают высокая селективность в диапазоне температур 230-255°С и высокая активность при оптимальной температуре 250°С, чем он выгодно отличается от многих каталитических систем. Кроме того, катализатор обладает способностью к восстановлению и обеспечению высокой степени конверсии сероводорода, селективности и выхода серы при возвращении к оптимальным условиям.
Примеры 39-41.
С целью расширения температурного интервала работы катализатора используют системы на основе активированной матрицы кремнезема (АМК), в которых в качестве активных компонентов были введены, помимо железа, ионы меди. Катализаторы получают по примерам 9, 17 и 18 путем нанесения ацетилацетонатных комплексов железа, меди и смеси железо- и медьсодержащего комплексов. Суммарное количество активных компонентов в катализаторе по примеру 17 составляет 2,0%, в котором отношение Cu/Fe - 0,3.
Результаты по конверсии H2S и селективности при температуре 230°С процесса очистки, полученные в присутствии катализаторов состава Fe/AMK; Fe-Cu/AMK и Cu/AMK, представлены в таблице 4.
| Таблица 4 | |||
| Результаты по конверсии H2S и селективности при температуре 230°С | |||
| N/N примеров по окислению H2S | № примеров приготовления катализаторов | Конверсия H2S, об.% | Селективность, об.% |
| 39 | 9 | 78 | 99 |
| 40 | 17 | 96 | 99 |
| 41 | 18 | 44 | 99 |
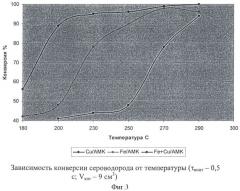
На фиг.3, где условное время контакта τконт - 0,5 с при загрузке катализатора, равной Vкат=9,0 см3, даны зависимости конверсии процесса в присутствии этих же катализаторов при различной температуре, из которого видно, что добавление в качестве активного компонента меди позволяет добиться планомерного возрастания активности катализатора при повышении температуры от 220 до 300°С без потери его селективности.
Это важный фактор, учитывая экзотермичность реакции. При резком возрастании активности могут происходить локальные перегревы, что неизбежно приведет к потере селективности.
В этой связи, с целью расширения температурного интервала, целесообразнее использовать железо-медьсодержащий катализатор. Как видно из фиг.3, конверсия в присутствии гетерометаллической системы составляет 98%, селективность 90-100%, при 200-250°С. По результатам лабораторных исследований гетерометаллический катализатор продемонстрировал лучшие показатели по сравнению с железосодержащим.
Проверка стабильности катализатора на укрупненной установке ВНИИГаз показала, что его активность при температуре 280°С остается практически постоянной в течение всего времени испытания - 60 часов.
Примеры 42-43.
Проводят окисление 1% сероводорода, содержащегося в пароазотной смеси, при температуре 250°С и в присутствии железомедных катализаторов Cu/Fe - 0,3 при суммарном количестве активных компонентов, равном 2,0%, полученных на основе активированной матрицы кремнезема и формиатных и пиволатных комплексов железа и меди, согласно примерам 19 и 20 соответственно.
Независимо от природы металлокомплексных предшественников конверсия H2S составляет 98% при селективности в образовании серы 98-99%.
Таким образом, в предлагаемом изобретении разработан оригинальный катализатор на основе активированной матрицы кремнезема, полученного путем травления природного вермикулита, существенно превосходящий по каталитической активности и селективности известные аналоги и прототип.
Так, предложенный катализатор позволяет проводить процесс при объемной скорости подачи газовых смесей, содержащих с