Новые производные оксазолидинона
Иллюстрации
Показать всеИзобретение относится к производным оксазолидинона формулы (I) или их фармацевтически приемлемым солям, способу их получения и фармацевтическим композициям, содержащим указанные производные, применяемые в качестве антибиотика. Производные оксазолидинона, где R1 и R1 ' независимо обозначают водород или фтор; R2 обозначает -OR7, фтор, монофосфат или металлическую соль фосфата; и R7 обозначает водород, С1-3алкил или ацилированную аминокислотную группу, где аминокислотой является аланин, глицин, пролин, изолейцин, лейцин, фенилаланин, β-аланин или валин; R3 обозначает водород, С1-4алкильную группу, которая является незамещенной или замещенной циано, -(CH2)m-OR7 (m равен 0, 1, 2, 3, 4) или кетогруппой. Производные оксазолидинона формулы (I) обладают антибактериальной активностью против различных патогенов человека и животных. Технический результат - производные оксазолидинона, обладающие ингибирующей активностью в отношении широкого спектра бактерий и имеющие низкую токсичность. 5 н. и 22 з.п. ф-лы, 4 табл.
Реферат
Область техники
Данное изобретение относится к новым производным оксазолидинона, способам их получения и фармацевтическим композициям, их содержащим, для применения в качестве антибиотика.
Уровень техники
Применяемые как вводимые перорально антибактериальные агенты оксазолидиноновые соединения не являются продуктами ферментации, а получаются путем синтеза, известны различные производные этих веществ. Например, производные 3-фенил-2-оксазолидинона, содержащие один или два заместителя, заявлены в патентах США 4948801, 4461773, 4340606, 4476136, 4250318 и 4128654. Производные 3-[(монозамещенного) фенил]-2-оксазолидинона формулы 2 описаны в ЕР 0 312 000, J. Med. Chem. 32, 1673 (1989), J. Med. Chem. 33, 2569 (1990), Tetrahedron, 45, 123 (1989) и т.д.
<Формула 2>
Pharmacia and Upjohn разработали производные оксазолидинона формул 3 и 4 (WO 93/23384, WO 95/14684 и WO 95/07271). Будучи одобренными Food and Drug Administration (FDA) в США производное оксазолидинона формулы 3, называемое «Zyvox», поступило в продажу. Однако было установлено, что эти обычные синтетические оксазолидиноновые соединения имеют недостаток, заключающийся в антибактериальной активности против узкого спектра бактерий, они являются токсичными для людей и имеют невысокую терапевтическую активность in vivo. Zyvox может применяться ограниченно в виде инъекций, так как растворимость Zyvox в воде не подходит для применения в виде инъекций, эта растворимость составляет примерно 3 мг/мл.
<Формула 3>
<Формула 4>
В WO 93/09103 описаны производные фенилоксазолидинона, замещенные гетероциклами, такими как тиазол, индол, оксазол и хинол, а также пиридин, в положении 4 фенильного кольца. Однако известно, что эти производные оксазолидинона обладают недостаточной медицинской активностью, так как гетероциклы замещены простыми заместителями, такими как алкил или аминогруппы.
В WO 01/94342 был описан синтез производных фенилоксазолидинона, содержащих пиридиновую группу или производные фенила в положении 4 фенильного кольца. Полученные соединения обладают ингибирующей активностью против широкого спектра бактерий и превосходят Zyvox в качестве антибиотиков. Однако эти соединения нельзя вводить в виде инъекций, так как их растворимость менее 30 мкг/мл.
Соответственно, интенсивные и тщательные исследования производных оксазолидинона, проведенные изобретателями и направленные на преодоление проблем, встречающихся в уровне техники, привели к созданию производных оксазолидинона, а также их пролекарств, причем пролекарства получаются по реакции аминокислоты или фосфата с производными оксазолидинона, содержащими гидроксильную группу. Кроме того, соли производных оксазолидинона легко синтезируются с применением аминогруппы аминокислоты с получением органической кислоты или неорганической кислоты и применением гидроксильной группы фосфата и элемента, выбранного из натрия и кальция. Производные оксазолидинона имеют превосходные свойства антибиотика, и растворимость их значительно возрастает.
Краткое описание изобретения
Цель данного изобретения состоит в создании новых производных оксазолидинона.
Другая цель изобретения заключается в создании способа получения указанных производных.
Еще одна цель изобретения состоит в получении фармацевтической композиции, содержащей указанные производные, для применения в качестве антибиотика.
Подробное описание изобретения
Данное изобретение предусматривает новые производные оксазолидинона формулы 1, указанной ниже.
<Формула 1>
В формуле 1 Х обозначает углерод или азот;
R1 и R1', соответственно, обозначают водород или фтор;
R2 обозначает -NR5R6, -OR7, триазол, фтор, алкилфосфат, монофосфат или металлическую соль фосфата;
R5 и R6, одинаковые или разные, обозначают водород, С-замещенную С1-4 алкильную группу или ацетил; и
R7 обозначает водород, С-замещенную C1-3 алкильную группу или ацилированную аминокислотную группу. Когда R7 обозначает ацилированную аминокислотную группу, аминокислотой является аланин, глицин, пролин, изолейцин, лейцин, фенилаланин, β-аланин или валин;
Het обозначает гетероциклическое кольцо или гетероароматическое кольцо и относится к пирролу, фурану, пиперазину, пиперидину, имидазолу, 1,2,4-триазолу, тетразолу, пиразолу, пирролидину, оксазолу, изоксазолу, оксадиазолу, пиридину, пиримидину, тиазолу или пиразину;
R3 и R4, одинаковые или разные, обозначают водород, С-замещенную С1-4 алкильную группу, которая является незамещенной или замещенной циано, -(CH2)m-OR7 (m равен 0, 1, 2, 3, 4) или кетогруппой.
Производные оксазолидинона, соответствующие формуле 1, можно применять в виде фармацевтически приемлемой соли, которая представляет собой соль присоединения к кислоте, полученную с использованием фармацевтически приемлемой свободной кислоты. Свободная кислота может быть неорганической или органической. Неорганическая свободная кислота может представлять собой соляную кислоту, бромноватую кислоту, серную кислоту, фосфорную кислоту и т.д. Органическая свободная кислота может быть лимонной кислотой, уксусной кислотой, молочной кислотой, малеиновой кислотой, фумаровой кислотой, глюконовой кислотой, метансульфокислотой, гликолевой кислотой, янтарной кислотой, 4-толуолсульфокислотой, трифторуксусной кислотой, галутуроновой кислотой, эмбоновой кислотой, глутаминовой кислотой и т.п.
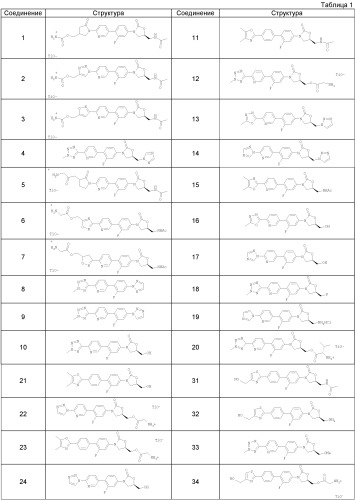
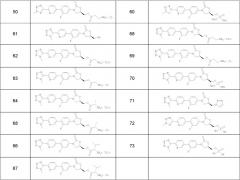
Предпочтительные соединения по данному изобретению включают следующие соединения, которые приведены в Таблице 1:
1) (S)-3-(4-(2-(2-оксо-4-глицилоксиметилпирролидин-1-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинилметилацетамид трифторуксусной кислоты,
2) (S)-3-(4-(2-(4-глицилоксиметил-1,2,3-триазол-1-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинилметилацетамид трифторуксусной кислоты,
3) (S)-3-(4-(2-(5-глицилоксиметилизоксазол-3-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинилметилацетамид трифторуксусной кислоты,
4) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-([1,2,4]-триазол-1-ил)метилоксазолидин-2-он,
5) (S)-3-(4-(2-(2-оксо-3-глицилоксипирролидин-1-ил)пиридин-5-ил)-3-фтор-фенил)-2-оксо-5-оксазолидинилметилацетамид трифторуксусной кислоты,
6) (S)-3-(4-(2-(5-глицилоксиметил-[1,2,4]оксадиазол-3-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинилметилацетамид трифторуксусной кислоты,
7) (S)-3-(4-(2-(5-глицилоксиметил-4,5-дигидроизоксазол-3-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинилметилацетамид трифторуксусной кислоты,
8) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-([1,2,3]-триазол-2-ил)-метилоксазолидин-2-он,
9) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-([1,2,3]-триазол-1-ил)-метилоксазолидин-2-он,
10) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гид-роксиметилоксазолидин-2-он,
11) (S)-3-(4-(4-(4,5-диметилоксазол-2-ил)фенил)-3-фторфенил)-2-оксо-5-окса-золидинилметилацетамид,
12) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-глицил-оксиметилоксазолидин-2-он-трифторуксусная кислота,
13) (R)-3-(4-(2-2-метил-[1,3,4] оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-([1,2,3]триазол-1-ил)-метилоксазолидин-2-он,
14) (R)-3-(4-(2-[1,2,4]триазол-1-ил)пиридин-5-ил)-3-фторфенил)-5-([1,2,3]-триазол-1-ил)-метилоксазолидин-2-он,
15) (S)-3-(4-(2-(4,5-диметилоксазол-2-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинилметилацетамид,
16) (R)-3-(4-(2-2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметилоксазолидин-2-он,
17) (R)-3-(4-(2-[1,2,4]триазол-1-ил-пиридин-5-ил)-3-фторфенил)-5-гидрокси-метилоксазолидин-2-он,
18) (R)-3-(4-(2-2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-фтор-метилоксазолидин-2-он,
19) (S)-3-(4-(2-(имидазол-1-ил)пиридин-5-ил)-3-фторфенил)-5-аминометил-оксазолидин-2-она гидрохлорид,
20) (R)-3-(4-(2-2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-валилокси)метилоксазолидин-2-он-трифторуксусная кислота,
21) (R)-3-(4-(4-(4,5-диметилоксазол-2-ил)фенил)-3-фторфенил)-5-гидрокси-метилоксазолидин-2-он,
22) (R)-3-(4-(2-[1,2,3]триазол-1-ил)пиридин-5-ил)-3-фторфенил)-5-глицил-оксиметилоксазолидин-2-он-трифторуксусная кислота,
23) (R)-3-(4-(4-(4,5-диметилоксазол-2-ил)фенил)-3-фторфенил)-5-глицил-оксиметилоксазолидин-2-он-трифторуксусная кислота,
24) (R)-3-(4-(2-[1,2,3]триазол-1-ил)пиридин-5-ил)-3-фторфенил)-5-гидрокси-метилоксазолидин-2-он,
25) (S)-3-(4-(2-[1,2,3]триазол-2-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинилметилацетамид,
26) (S)-3-(4-(4-(4(S)-гидроксиметил-4,5-дигидрооксазол-2-ил)фенил)-3-фтор-фенил)-2-оксо-5-оксазолидинилметилацетамид,
27) (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фтор-фенил)-5-глицилоксиметилоксазолидин-2-он-трифторуксусная кислота,
28) (S)-3-(4-(4-(4-гидроксиметилтиазол-2-ил)фенил)-3-фторфенил)-2-оксо-5-оксазолидинилметилацетамид,
29) (R)-3-(4-(2-[1,2,3]триазол-2-ил)пиридин-5-ил)-3-фторфенил)-5-гидрокси-метилоксазолидин-2-он,
30) (S)-3-(4-(4-(4-глицилоксиметилтиазол-2-ил)фенил)-3-фторфенил)-2-оксо-5-оксазолидинилметилацетамид трифторуксусной кислоты,
31) (S)-3-(4-(4-(4-цианметилтиазол-2-ил)фенил)-3-фторфенил)-2-оксо-5-окса-золидинилметилацетамид,
32) (R)-3-(4-(4-(4-цианметилтиазол-2-ил)фенил)-3-фторфенил)-5-гидрокси-метилоксазолидин-2-он,
33) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-мет-оксиметилоксазолидин-2-он,
34) (R)-3-(4-(4-(4-цианметилтиазол-2-ил)фенил)-3-фторфенил)-5-глицил-оксиметилоксазолидин-2-он-трифторуксусная кислота,
35) (R)-3-(4-(2-[1,2,3]триазол-2-ил)пиридин-5-ил)-3-фторфенил)-5-глицил-оксиметилоксазолидин-2-он-трифторуксусная кислота,
36) (R)-3-(4-(4-(4-гидроксиметилтиазол-2-ил)фенил)-3-фторфенил)-5-([1,2,3]-триазол-1-ил)метилоксазолидин-2-он,
37) (R)-3-(4-(4-(4-глицилоксиметилтиазол-2-ил)фенил)-3-фторфенил)-5-([1,2,3]триазол-1-ил)метилоксазолидин-2-он-трифторуксусная кислота,
38) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3,5-дифторфенил)-5-гидроксиметилоксазолидин-2-он,
39) (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3,5-дифтор-фенил)-5-гидроксиметилоксазолидин-2-он,
40) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(N,N-диметиламинометил)оксазолидин-2-он,
41) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(N-метиламинометил)оксазолидин-2-он,
42) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-ала-нилокси)метилоксазолидин-2-он-трифторуксусная кислота,
43) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-валилокси)метилоксазолидин-2-она гидрохлорид,
44) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-аланилокси)метилоксазолидин-2-она гидрохлорид,
45) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-глицилоксиметилоксазолидин-2-она гидрохлорид,
46) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-пролинилокси)метилоксазолидин-2-он-трифторуксусная кислота,
47) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-пролинилокси)метилоксазолидин-2-она гидрохлорид,
48) (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-глицилоксиметилоксазолидин-2-она гидрохлорид,
49) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(β-аланилокси)метилоксазолидин-2-он-трифторуксусная кислота,
50) (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(β-аланилокси)метилоксазолидин-2-она гидрохлорид,
51) (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-аланилокси)метилоксазолидин-2-он-трифторуксусная кислота,
52) (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-аланилокси)метилоксазолидин-2-она гидрохлорид,
53) (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-валилокси)метилоксазолидин-2-он-трифторуксусная кислота,
54) (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-валилокси)метилоксазолидин-2-она гидрохлорид,
55) (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-пролинилокси)метилоксазолидин-2-он-трифторуксусная кислота,
56) (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-пролинилокси)метилоксазолидин-2-она гидрохлорид,
57) (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(β-аланилокси)метилоксазолидин-2-он-трифторуксусная кислота,
58) (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(β-аланилокси)метилоксазолидин-2-она гидрохлорид,
59) (R)-[3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинил]метилдинатрийфосфат,
60) (R)-[3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинил]метилдинатрийфосфат,
61) (R)-3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметилоксазолидин-2-он,
62) (R)-3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-или-цилоксиметилоксазолидин-2-он-трифторуксусная кислота,
63) (R)-3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гли-цилоксиметилоксазолидин-2-она гидрохлорид,
64) (R)-3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-аланилокси)метилоксазолидин-2-он-трифторуксусная кислота,
65) (R)-3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-аланилокси)метилоксазолидин-2-она гидрохлорид,
66) (R)-3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-валилокси)метилоксазолидин-2-он-трифторуксусная кислота,
67) (R)-3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-валилокси)метилоксазолидин-2-она гидрохлорид,
68) (R)-3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(β-аланилокси)метилоксазолидин-2-он-трифторуксусная кислота,
69) (R)-3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(β-аланилокси)метилоксазолидин-2-она гидрохлорид,
70) (R)-[3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинил]метилдинатрийфосфат,
71) (R)-3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-([1,2,3]-триазол-1-ил)метилоксазолидин-2-он,
72) моно-[(R)-[3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинил]метил]фосфат и
73) моно-[(R)-[3-(4-(2-(1-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-2-оксо-5-оксазолидинил]метил]фосфат.
В Таблице 1 «Ас» означает ацил и «ТfOН» означает трифторуксусную кислоту.
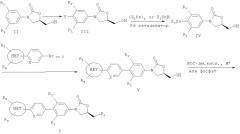
Далее, изобретение предусматривает способ получения производных оксазолидинона формулы 1, который показан на Схеме 1 ниже.
<Схема 1>
На схеме 1 Z обозначает С-замещенную C1-4алкильную группу, X, R1, R'1, R2, R3 и R4 указаны для формулы 1, Y обозначает галоген.
Способ получения производных оксазолидинона по изобретению включает:
замещение атома водорода галогеном в фенильном кольце производного (II) гидроксиметилоксазолидинона с получением соединения (III) (Стадия 1);
замещение атома галогена (Y) станнилом в производном (III) с получением соединения (IV) (Стадия 2);
взаимодействие производного (IV) с пиридиновым или фенильным производным, которое замещено бромом или йодом, с образованием производного (V) оксазолидинона, содержащего пиридиновое кольцо или фенильное кольцо (Стадия 3), и
взаимодействие производного (V) с аминокислотой, содержащей защитную группу, и затем с кислотой для удаления защитной группы и с образованием солей соединений формулы 1, или взаимодействие производного (V) с фосфатом и затем с солью металла с образованием солей соединений формулы 1 (Стадия 4).
Производное (II) гидроксиметилоксазолидинона, используемое на стадии 1, может быть получено обычными методами. Например, такой способ может включать замещение аминогруппы анилина бензилоксикарбонильной группой и взаимодействие замещенного соединения с глицидилбутилатом в виде сильных оснований с получением производного (II). Это основание может быть получено при добавлении сильного основания; предпочтительно сильное основание может включать н-бутиллитий, втор. бутиллитий, трет.бутиллитий и т.д., более предпочтительным является н-бутиллитий. Кроме того, предпочтительно осуществлять этот способ при температуре около -78°С в среде жидкого азота.
Стадию 1 осуществляют для того, чтобы заместить атом водорода фенильной группы производного (II) на атом галогена, предпочтительно атом йода. Когда атом водорода замещается на атом йода, реакцию предпочтительно осуществлять путем добавления монохлорида йода (ICl) или серебряной соли трифторуксусной кислоты (CF3COOAg) и йода при комнатной температуре.
Стадия 2 представляет собой реакцию производного (III) с гексаметилдиоловом, гексабутилдиоловом или трибутилоловогидридом при добавлении палладиевого катализатора с получением производного (IV), атом йода в котором замещается триметилстаннильной группой или трибутилстаннильной группой. Палладиевый катализатор может включать дихлорбистрифенилфосфин палладия (II), тетракис-трифенилфосфин палладия (0) и т.д. Предпочтительно осуществлять Стадию 2 в 1,4-диоксане в качестве растворителя, а также в диметилформамиде, тетрагидрофуране, 1-метил-2-пирролидоне и т.д. при температуре примерно 90-150°С.
На Стадии 3 осуществляют реакцию производного (IV) с соединением, содержащим гетероцикл, присоединенный к фенильному или пиридиновому кольцу с получением производного (V). Палладиевый катализатор, добавляемый на Стадии 3, может быть идентичен палладиевому катализатору на Стадии 2. Предпочтительно осуществлять Стадию 3 в среде диметилформамида, 1-метил-2-пирролидона и т.п. при температуре около 100-120°С.
На Стадии 4 происходит взаимодействие производного (V) с аминокислотой, аминогруппа которой защищена трет. бутоксикарбонилом, дициклогексилкарбодиимидом и 4-диметиламинопиридином с получением производного (I), содержащего аминогруппу.
Аминокислота может включать аланин, глицин, пролин, изолейцин, лейцин, фенилаланин, β-аланин, валин и т.п. Растворителем может быть диметилформамид, 1-метил-2-пирролидон и т.д. Предпочтительно проводить реакцию производного (V) с аминокислотой при перемешивании в течение примерно 5 ч при температуре выше комнатной.
Смесь производного (V) и аминокислоты реагирует с сильной кислотой, такой как трифторуксусная и т.п., для удаления защитной группы. Растворитель удаляют из смеси, смесь при этом кристаллизуется с образованием соли производного оксазолидинона формулы 1. Предпочтительно проводить добавление производного (V) к аминокислоте при перемешивании в течение примерно 2 ч при температуре выше комнатной.
Можно получать соль производного формулы 1, полученного с применением аминокислоты, способом, аналогичным описанному выше. (S)-3-(4-триметил-станнил-3-фторфенил)-2-оксо-5-оксазолидинилметилацетамид, являющийся исходным веществом, известен, и способ описан в WO 01/94342.
Соль фосфата производного (I) может быть получена при добавлении метоксида натрия, гидроокиси натрия и т.п. к составу в среде растворителя, такого как метанол, этанол и т.п., состав получают растворением производного (V) в триметилфосфате или триэтилфосфате, добавлением оксихлорида фосфора и перемешиванием в течение примерно 12 ч при комнатной температуре. Металлическая соль фосфата может быть получена по реакции производного (V) с тетразолом и производными амидита комнатной температуре, окислением полученного соединения, получением производного алкилфосфата, удалением алкильной группы сильной кислотой с получением производного фосфата и превращением производного фосфата в металлическую соль фосфата описанным выше способом.
Кроме того, данное изобретение предусматривает фармацевтическую композицию, содержащую производные оксазолидинона формулы 1, применяемую в качестве антибиотика.
Производные оксазолидинона по настоящему изобретению обладают ингибирующей активностью в отношении широкого спектра бактерий, резистентной к метициллину Staphylococcus aureus (MRSA) и резистентной к ванкомицину Enterococci (VRE), и проявляют превосходную активность антибиотика при довольно низких концентрациях in vivo.
Кроме того, производные согласно данному изобретению могут проявлять сильную антибактериальную активность в отношении различных патогенов у людей и животных, включая грамположительные бактерии, такие как Staphylococci, Enterococci и Streptococci, анаэробные микроорганизмы, такие как Bacteroides и Clostridia, и кислотостойкие микроорганизмы, такие как Mycobacterium tuberculosis и Mycobacterium avium.
Производные оксазолидинона, содержащие гидроксильные группы, реагируют с аминокислотой или фосфатом с получением их пролекарств. Эти пролекарства лучше растворяются в воде, чем соединения, не являющиеся пролекарствами: растворимость пролекарств равна более 28 мг/мл, а растворимость соединений - 10 мг/мл (соединение 10). Пролекарства стабильны в воде и кислом растворе и превращаются в гидроксиметильные соединения под действием эстеразы и фосфатазы в крови, что делает возможным получение состава для инъекции или перорального введения.
Композиция по данному изобретению может включать, по меньшей мере, один активный ингредиент, действующий подобно производным оксазолидинона.
Для получения фармацевтической композиции, по меньшей мере, одно соединение формулы 1 можно смешать с, по меньшей мере, одним фармацевтически приемлемым носителем.
Фармацевтически приемлемый носитель может включать физиологический раствор, стерильную воду, раствор Рингера, забуферированный физиологический раствор, раствор декстрозы, раствор мальтодекстрина, глицерин, этанол и т.п. В соответствии с потребностью пользователя фармацевтическая композиция может содержать обычную добавку, такую как антиокислитель, буфер, очиститель и т.п. Композиции смешиваются также с разбавителями, дезинтегрантами, поверхностно-активными веществами, связующими, смазочными агентами, водным раствором, суспензией и т.д. с получением составов для инъекции, порошков, капсул, гранул, таблеток и т.п. Составы приготавливают подходящими методами, описанными в Remington's Pharmaceutical Science (the newest edition), Mack Publishing Company, Easton PA, с учетом болезней и ингредиентов.
Соединение согласно данному изобретению можно вводить перорально или парентерально, например внутривенно, подкожно, внутрибрюшинно, локально и т.д. Доза соединения может меняться в зависимости от используемого конкретного соединения, метода введения, состояния, степени его серьезности, а также от различных физических факторов, связанных с пациентом, подвергающимся лечению. Удовлетворительные результаты получают, когда соединения по изобретению вводят пациенту, нуждающемуся в этом, с дневной дозой от примерно 10 мг до примерно 25 мг на кг веса, предпочтительно от примерно 13 мг до примерно 20 мг на кг веса, причем более предпочтительно вводить каждую из разделенных доз несколько раз в день.
Летальная доза (LD50) производных оксазолидинона составляет более 1 г/кг при определении острой токсичности, соединения являются стабильными.
Полезные свойства
Производные оксазолидинона по настоящему изобретению обладают ингибирующей активностью в отношении широкого спектра бактерий и имеют низкую токсичность. Пролекарства, полученные по реакции соединения, содержащего гидроксильные группы, с аминокислотой или фосфатом хорошо растворяются в воде.
Кроме того, производные согласно данному изобретению могут проявлять сильную антибактериальную активность в отношении различных патогенов у людей и животных, включая грамположительные бактерии, такие как Staphylococci, Enterococci и Streptococci, анаэробные микроорганизмы, такие как Bacteroides и Clostridia, и кислотостойкие микроорганизмы, такие как Mycobacterium tuberculosis и Mycobacterium avium.
В соответствии с этим композиции, содержащие производные оксазолидинона, используют в качестве антибиотика.
Примеры осуществления изобретения
Примеры приводятся только с целью иллюстрации и не ограничивают данное изобретение, поскольку не выходя за рамки этого изобретения можно осуществить многие его вариации.
Препаративный пример 1: Получение N-карбобензилокси-3-фторанилина
3-фторанилин, 100 г, растворяли в 1 л тетрагидрофурана (THF) и в раствор добавляли 150 г (1,8 М) бикарбоната натрия (NaHCO3). После охлаждения до 0°С к раствору медленно добавляли 154 мл N-карбобензилоксихлорида (CbzCl). Температуру поддерживали при 0°С и перемешивали смесь в течение 2 ч. Затем реакционную смесь для экстракции обрабатывали 0,5 л этилацетата. Органический слой после отделения промывали рассолом, сушили над безводным сульфатом магния (MgSO4) и концентрировали в вакууме. Остаток дважды промывали н-гексаном, получая целевое соединение в виде белых кристаллов (132 г). Выход равен 85%.
Препаративный пример 2: Получение (R)-3-(3-фторфенил)-2-оксо-5-оксазо-лидинилметанола
132 г N-карбобензилокси-3-фторанилина, полученного в препаративном примере 1, растворяли в 1,3 л тетрагидрофурана и охлаждали раствор до -78°С. К этому раствору добавили 370 мл н-бутиллития (n-BuLi, 1,6 М /н-гексан) в атмосфере азота и перемешивали в течение 10 минут. К реакционной смеси медленно добавили 84 мл (R)-(-)-глицидилбутилата, перемешивали при той же температуре в течение 2 ч и оставляли на 24 ч при комнатной температуре. После завершения реакции к раствору добавили раствор хлорида аммония (NH4Cl) и для экстракции прибавили 0,5 л этилацетата при комнатной температуре. Выделенный органический слой промывали рассолом, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток растворяли в 100 мл этилацетата и промывали гексаном с получением белых кристаллов, которые очищали с получением 80 г целевого соединения. Выход составил 70%.
1Н ЯМР (DMSO-d6) δ 7.85 (t, 1Н), 7.58 (dd, 1H), 7.23 (dd, 1H), 4.69 (m, 1H), 4.20 (t, 1H), 3.80 (dd, 1H), 3.60 (br, dd, 2H).
Препаративный пример 3: Получение (R)-3-(4-иод-3-фторфенил)-2-оксо-5-оксазолидинилметанола
В 300 мл ацетонитрила растворяли в 30 г (R)-3-(3-фторфенил)-2-оксо-5-оксазо-лидинилметанола, полученного в препаративном примере 2, и 46 г серебряной соли трифторуксусной кислоты (CF3COOAg) и 43 г иодида добавили к полученному раствору. После перемешивания в течение 1 дня при комнатной температуре к раствору добавили воду и экстрагировали этилацетатом. Выделенный органический слой промывали рассолом и дегидратировали. Затем остаток отфильтровывали, концентрировали в вакууме и сушили с получением 44 г целевого соединения. Выход составил 94%.
1Н ЯМР (DMSO-d6) δ 7.77 (t, 1H), 7.56 (dd, 1H), 7.20 (dd, 1H), 5.20 (m, 1H), 4.70 (m, 1H), 4.07 (t, 1H), 3.80 (m, 1H), 3.67 (m, 2H), 3,56 (m, 3Н).
Препаративный пример 4: Получение (R)-3-(4-трибутилстаннил-3-фтор-фенил)-2-оксо-5-оксазолидинилметанола
В 660 мл 1,4-диоксана растворяли 50 г (R)-3-(4-иод-3-фторфенил)-2-оксо-5-окса-золидинилметанола, полученного в препаративном примере 3. В раствор добавляли 52 г гексабутилдиолова ((Вu3Sn)2) и 9,3 г дихлорбистрифенилфосфинпалладия и перемешивали в течение 2 ч. Раствор фильтровали через целит и концентрировали в вакууме. Остаток очищали на хроматографической колонке и получали 45 г целевого соединения.
1Н ЯМР (DMSO-d6) δ 7.74 (m, 3Н), 5.20 (t, 1H), 4.71 (m, 1H), 4.08 (t, 1H), 3.82 (dd, 1H), 3.68 (m, 1H), 3.52 (m, 1H), 1.48 (m, 6H), 1.24 (m, 6H), 1.06 (m, 6H), 0.83 (t, 9H).
Препаративный пример 5: Получение 2-циан-5-бромпиридина
100 г 2,5-дибромпиридина растворяли в 1 л диметилформамида, к полученному раствору добавляли 32 г цианида меди и 17,8 г цианида натрия и перемешивали раствор при 150°С в течение 7 ч. После охлаждения до комнатной температуры в реакционную смесь добавляли воду и для экстракции добавляли этилацетат. Органический слой промывали рассолом, дегидратировали, фильтровали и концентрировали в вакууме. Получали 54 г целевого соединения. Выход составил 70%.
1Н ЯМР (CDCl3) δ 8.76 (s, 1Н), 7.98 (dd, 1H), 7.58 (dd, 1H).
Препаративный пример 6: Получение 2-(тетразол-5-ил)-5-бромпиридина
10 г 2-циан-5-бромпиридина, полученного в препаративном примере 5, растворяли в 100 мл диметилформамида. При комнатной температуре к полученному раствору добавляли 5,33 г азида натрия и 4,4 г хлорида аммония и перемешивали раствор при 110°С в течение 3 ч. В реакционную смесь добавляли воду и для экстракции добавляли этилацетат. Органический слой промывали рассолом, дегидратировали, фильтровали и концентрировали в вакууме. Получали 10,5 г целевого соединения. Выход составил 85%.
Препаративный пример 7: Получение 2-(1-метилтетразол-5-ил)-5-бромпиридина и 2-(2-метилтетразол-5-ил)-5-бромпиридина
10,5 г 2-(тетразол-5-ил)-5-бромпиридина, полученного в препаративном примере 6, растворяли в 100 мл диметилформамида. К раствору добавляли 6,5 г гидроокиси натрия и при температуре 0°С медленно добавляли 9,3 г иодметана. Раствор перемешивали 6 ч при комнатной температуре, добавляли воду и этилацетат для экстракции. Затем органический слой промывали рассолом, дегидратировали, фильтровали, концентрировали в вакууме и очищали на хроматографической колонке, получая 4 г 2-(1-метилтетразол-5-ил)-5-бромпиридина и 5 г 2-(2-метилтетразол-5-ил)-5-бромпиридина.
1) 2-(1-метилтетразол-5-ил)-5-бромпиридин
1Н ЯМР (CDCl3) δ 8.77 (t, 1H), 8.23 (dd, 1H), 8.04 (dd, 1H), 4.46 (s, 3H).
2) 2-(2-метилтетразол-5-ил)-5-бромпиридина.
1Н ЯМР (CDCl3) δ 8.80 (t, 1H), 8.13 (dd, 1H), 7.98 (dd, 1H), 4.42 (s, 3H).
Препаративный пример 8: Получение 2-(2-метил-[1.3.4]оксадиазол-5-ил)-5-бромпиридина
В 130 мл уксусного ангидрида растворяли 8,6 г 2-(тетразол-5-ил)-5-бромпиридина, полученного в препаративном примере 6. Затем к полученному раствору добавляли 15 мл пиридина и перемешивали в течение 3 ч. К реакционной смеси добавляли этилацетат и экстрагировали органический слой. Затем органический слой промывали водой и рассолом. Органический слой дегидратировали, фильтровали, концентрировали в вакууме, получая 7,3 г целевого соединения. Выход составил 80%.
1H ЯМР (СDСl3) δ 7.99 (t, 1Н), 7.40 (dd, 1H), 7.27 (dd, 1H), 1.83 (s, 3H).
Препаративный пример 9: Получение 2-([1.2.3]триазол-1-ил)-5-бромпиридина и 2-([1.2.3]триазол-2-ил)-5-бромпиридина
20 г 2,5-дибромпиридина растворяли в 200 мл 1-метил-2-пирролидона. В раствор добавляли 35 г карбоната калия и перемешивали в течение 10 ч при температуре 100°С. К реакционной смеси добавляли этилацетат и полученный таким образом органический слой промывали водой и рассолом. Органический слой сушили, фильтровали и концентрировали под вакуумом, получали 6 г 2-([1.2.3]триазол-1-ил)-5-бромпиридина и 4 г 2-([1.2.3]триазол-2-ил)-5-бромпиридина.
1) 2-([1.2.3]триазол-1-ил)-5-бромпиридин
1Н ЯМР (CDCl3) δ 8.53 (dd, 2H), 8.10 (d, 1H), 8.03 (dd, 1H), 7.82 (s, 1H).
2) 2-([1.2.3]триазол-2-ил)-5-бромпиридина
1Н ЯМР (CDCl3) δ 8.60 (t, 1H), 7.97 (s, 2H), 7.87 (s, 2H).
Пример 1: Получение (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметилоксазолидин-2-он (соединение 10)
В 150 мл 1-метил-2-пирролидона растворяли 37 г (R)-3-(4-трибутилстаннил-3-фторфенил)-2-оксо-5-оксазолидинилметанола. В раствор добавляли 19,7 г 2-(2-метилтетразол-5-ил)-5-бромпиридина, 10,44 г хлорида лития и 2,9 г дихлорбистрифенилфосфинпалладия (II) при комнатной температуре и затем перемешивали при 120°С в течение 4 ч. В реакционную смесь добавляли воду и этилацетат. Отделенный органический слой промывали водой, дегидратировали, фильтровали, концентрировали в вакууме и очищали на хроматографической колонке с получением 8 г целевого соединения. Выход составил 26%.
1Н ЯМР (DMSO-d6) δ 8.90 (s, 1H), 8.18 (m, 2H), 7.70 (m, 2H), 7.49 (dd, 1H), 5.25 (t, 1H), 4.74 (m, 1H), 4.46 (s, 3H), 4.14 (t, 1H), 3.88 (dd, 1H), 3.68 (m, 1H), 3,58 (m, 1H).
Пример 2: Получение (R)-3-(4-(2-2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметилоксазолидин-2-она (соединение 16)
Это соединение (6,6 г, выход 30%) получали способом, аналогичным описанному в Примере 1, за исключением того, что в качестве исходного соединения вместо 2-(2-метилтетразол-5-ил)-5-бромпиридина применяли 14,3 г 2-(2-метил-[1,3,4]-оксадиазол-5-ил)-5-бромпиридина.
1Н ЯМР (DMSO-d6) δ 8.93 (s, 1Н), 8.21 (s. 2H), 7.71 (m, 2H), 7.50 (dd, 1H), 5.25 (t, 1H), 4.74 (m, 1H), 4.14 (t, 1H), 3.89 (dd, 1H), 3.68 (m, 1H), 3.59 (m, 1H), 2.64 (s, 3H).
Пример 3: Получение (R)-3-(4-(2-[1,2,4] триазол-1-ил-пиридин-5-ил)-3-фторфенил)-5-гидроксиметилоксазолидин-2-она (соединение 17)
Повторяли процедуру, описанную в Примере 1, но вместо 2-(2-метилтетразол-5-ил)-5-бромпиридина использовали 200 мг 2-([1,2,4] триазол-1-ил)-5-бромпиридина, получали целевое соединение (150 мг, выход 48%).
Пример 4: Получение (R)-3-(4-(4-(4,5-диметилоксазол-2-ил)фенил)-3-фтор-фенил)-5-гидроксиметилоксазолидин-2-она (соединение 21)
Повторяли процедуру, описанную в Примере 1, но вместо 2-(2-метилтетразол-5-ил)-5-бромпиридина использовали 1 г 4-(4,5-диметилоксазол-2-ил) бромбензола, получали 780 мг целевого соединения (выход 76%).
1Н ЯМР (DMSO-d6) δ 7.96 (s, 1H), 7.94 (s, 1H), 7.63 (m, 4H), 7.44 (dd, 1H), 5.23 (t, 1H), 4.72 (m, 1H), 4.12 (t, 1H), 3.87 (dd, 1H), 3.68 (m, 1H), 3.56 (m, 1H), 2.32 (s, 3H), 2.10 (s, 3H).
Пример 5: Получение (R)-3-(4-(2-[l,2,3]триазол-1-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметилоксазолидин-2-она (соединение 24)
Повторяли процедуру, описанную в Примере 1, но вместо 2-(2-метилтетразол-5-ил)-5-бромпиридина использовали 2 г 2-([1,2,3]триазол-1-ил)-5-бромпиридина, получали 1,2 г целевого соединения.
1H ЯМР (DMSO-d6) δ 8.88 (s, 1H), 8.76 (s, 1H), 8.28 (d, 1H), 8.21 (d, 1H), 8.01 (s, 1H), 7.70 (m, 2H), 7.51 (dd, 1H), 5.26 (t, 1H), 4.75 (m, 1H), 4.14 (t, 1H), 3.90 (dd, 1H), 3.68 (m, 1H), 3.58 (m, 1H).
Пример 6: Получение (R)-3-(4-(2-[l,2,3]триазол-2-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиетилоксазолидин-2-она (соединение 29)
Повторяли процедуру, описанную в Примере 1, но вместо 2-(2-метилтетразол-5-ил)-5-бромпиридина использовали 1 г 2-([1,2,3]триазол-2-ил)-5-бромпиридина, получали 0,7 г целевого соединения.
1Н ЯМР (DMSO-d6) δ 8.74 (s, 1H), 8.25 (dd, 1H), 8.23 (s, 1H), 8.11 (d, 1H), 7.69 (m, 3H), 7.49 (dd, 1H), 5.24 (t, 1H), 4.75 (m, 1H), 4.14 (t, 1H), 3.89 (dd, 1H), 3.68 (m, 1H), 3.59 (m, 1H).
Пример 7: Получение (R)-3-(4-(4-(4-цианметилтиазол-2-ил)фенил)-3-фтор-фенил)-5-гидроксиметилоксазолидин-2-она (соединение 32)
Повторяли процедуру, описанную в Примере 1, но вместо 2-(2-метилтетразол-5-ил)-5-бромпиридина использовали 1 г 4-(4-цианметилтиазол-2-ил)бромбензола, получали 520 мг целевого соединения.
1Н ЯМР (DMSO-d6) δ 8.04 (s, 1H), 8.00 (s, 1H), 7.65 (m, 5H), 7.47 (dd, 1H), 5.24 (t, 1H), 4.74 (m, 1H), 4.23 (s, 2H), 4.13 (t, 1H), 3.88 (dd, 1H), 3.68 (m, 1H), 3.59 (m, 1H).
Пример 8: Получение (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3,5-дифторфенил)-5-гидроксиметилоксазолидин-2-она (соединение 38)
Повторяли процедуру, описанную в Примере 1, но вместо (R)-3-(4-трибутил-станнил-3-фторфенил)-2-оксо-5-оксазолидинилметанола использовали (R)-3-(4-трибутилстаннил-3,4-дифторфенил)-2-оксо-5-оксазолидинилметанол.
1Н ЯМР (DMSO-d6) δ 8.81 (s, 1H), 8.25 (d, 1H), 8.10 (d, 1H), 7.54 (d, 2H), 5.25 (t, 1H), 4.77 (m, 1H), 4.47 (s, 3H), 4.13 (t, 1H), 3.89 (dd, 1H), 3.68 (m, 1H), 3.57 (m, 1H).
Пример 9: Получение (R)-3-(4-(2-(2-метил-[1,3,4]оксадиазол-5-ил)пиридин-5-ил)-3,4-дифторфенил)-5-гидроксиметилоксазолидин-2-она (соединение 39).
Повторяли процедуру, описанную в Примере 1, используя в качестве исходных веществ (R)-3-(4-трибутилстаннил-3,4-дифторфенил)-2-оксо-5-оксазолидинилметанол и 2-(2-метил-[1,3,4]оксадиазол-5-ил)-5-бромпиридин.
1Н ЯМР (DMSO-d6) δ 8.83 (s, 1H), 8.25 (d, 1H), 8.15 (d, 1H), 7.55 (d, 2H), 5.25 (t, 1H), 4.77 (m, 1H), 4.13 (t, 1H), 3.89 (dd, 1H), 3.68 (m, 1H), 3.59 (m, 1H), 2.63 (s, 3H).
Пример 10: Получение (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-глицилоксиметилоксазолидин-2-он-трифторуксусной кислоты (соединение 12)
В 25 мл диметилформамида растворяли 4 г (R)-3-(4-(2-(2-метилтетразол-5-ил)-пиридин-5-ил)-3-фторфенил)-5-гидроксиметилоксазолидин-2-она (соединение 10). В раствор добавляли 3,34 г 1,3-дициклогексилкарбодиимида, 2,36 г ВОС-глицина и 0,2 г 4-диметиламинопиридина при комнатной температуре и перемешивали в течение 10 ч.
В реакционную смесь добавляли воду и этилацетат. Выделенный органический слой промывали рассолом, дегидратировали, фильтровали, концентрировали в вакууме и очищали на хроматографической колонке. Полученный остаток растворяли в 70 мл метиленхлорида, добавляли 30 мл трифторуксусной кислоты и перемешивали 2 ч при комнатной температуре. Остаток промывали этанолом и этиловым эфиром, концентрировали в вакууме, получая 4,7 г целевого соединения. Выход 76%.
1Н ЯМР (DMSO-d6) δ 8.92 (s, 1Н), 8.19 (s, 1H), 8.17 (m, 2H), 7.77 (t, 1H), 7.69 (dd, 1H), 7.49 (dd, 1H), 5.00 (m, 1H), 4.46 (m, 2H), 4.47 (s, 3H), 4.24 (t, 1H), 3.92 (dd, 1H), 3.90 (s, 2H).
Пример 11: Получение (R)-3-(4-(2-2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-(L-валилокси)метилоксазолидин-2-он-трифторуксусной кислоты (соединение 20)
Это соединение получали способом, описанным в Примере 10, используя ВОС-валин вместо ВОС-глицина.
1Н ЯМР (DMSO-d6) δ 8.92 (s, 1H), 8.40 (s, 3H), 8.21 (m, 2H), 7.76 (t, 1H), 7.65 (dd, 1H), 7.48 (dd, 1H), 5.05 (m, 1H), 4.63 (dd, 1H), 4.47 (s, 3H), 4.43 (dd, 1H), 4.28 (t, 1H), 4.01 (d, 1H), 3.93 (dd, 1H), 2.14 (m, 1H), 0.98 (d, 3H), 0.95 (d, 3H).
Пример 12: Получение (R)-3-(4-(2-[1,2,3]триазол-1-ил)пиридин-5-ил)-3-фторфенил)-5-глицилоксиметилоксазолидин-2-он-трифторуксусной кислоты (соединение 22)
Это соединение получали, как описано в Примере 10, с использованием соединения 24.
1Н ЯМР (DMSO-d6) δ 8.87 (s, 1H), 8.76 (s, 1H), 8.33 (s, 3H), 8.29 (d, 1H), 8.00 (s, 1H), 7.77 (t, 1H), 7.76 (t, 1H), 7.67 (dd, 1H), 7.47 (dd, 1H), 5.02 (m, 1H), 4.49 (m, 2H), 4.23 (t, 1H), 3.93 (m, 3H).
Пример 13: Получение (R)-3-(4-(4-(4,5-диметилоксазол-2-ил)фенил)-3-фторфенил)-5-глицилоксиметилоксазолидин-2-он-трифторуксусной кислоты (соединение 23)
Это соединение получали, как описано в Примере 10, с использованием соединения 21.