Кристаллические формы соединения тиазолидиндиона и способ его получения
Иллюстрации
Показать всеИзобретение относится к кристаллическим формам гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-Н-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, представленного формулой (I). Изобретение также относится к способам их получения и к фармацевтическим композициям на их основе, обладающим свойством активировать PPARγ. Указанные формы соединения (I) являются более стабильными и могут найти свое применение в медицине для получения лекарственных средств для лечения диабета, рака, сопровождаемого диабетом. 14 н. и 2 з.п. ф-лы, 7 табл., 5 ил.
Реферат
Предпосылки создания изобретения
Область техники, к которой относится изобретение
Настоящее изобретение относится к кристаллическим формам соединения тиазолидиндиона, обладающим значительной способностью активировать γ-рецептор, активируемый пролифератором пероксисом (PPAR), значительной противораковой активностью и свойствами, благоприятными для производства лекарственных средств, высокочистым, легко обрабатываемым и высокостабильным при хранении, способам их получения и лекарственным средствам, содержащим в качестве активного компонента кристаллические формы соединения тиазолидиндиона (в частности, PPARγ-активаторы или противораковые фармацевтические композиции).
Описание предшествующего уровня техники
Японский патент № 3488099 (выложенная международная заявка на патент № 99/18081, патент США № 6432993, европейский патент № 1022272) (Патентный документ 1), выложенный японский патент № 2003-238406 (выложенная международная заявка на патент № WO 03/053440) (Патентный документ 2), выложенный японский патент № 2004-083574 (WO 2004/000356) (Патентный документ 3), выложенный японский патент № 2005-162727 (WO 2004/083167) (Патентный документ 4) и выложенная международная заявка на патент № 2007/091622 (Патентный документ 5) раскрывают соединение тиазолидиндиона, представленное указанной выше формулой (I) (далее в настоящем документе сокращенно называемое соединением (I)). Соединение (I) обладает значительной способностью активировать γ-рецептор, активируемый пролифератором пероксисом (PPAR), и ожидают, что оно окажется полезным в качестве активатора PPARγ или противораковой фармацевтической композиции.
Как правило, вещества, применяемые в фармацевтических продуктах, должны быть высокочистыми во избежание непредсказуемых побочных эффектов, вызываемых загрязняющими примесями в этих веществах. Такие примеси включают побочные продукты (аналогичные вещества), образуемые при получении самих фармацевтических ингредиентов, сырье и растворители, применяемые при производстве фармацевтических ингредиентов, и т.п. Кроме того, эти вещества должны иметь физические и химические свойства, более благоприятные для производства лекарственных средств, такие как кристаллические формы фармацевтических ингредиентов, устойчивые на производственной стадии тепловой обработки и т.п., или высокая растворимость, способствующая повышению абсорбируемости фармацевтических ингредиентов, благодаря чему их эффекты могут проявляться при более низких дозах. Кроме того, важно, чтобы фармацевтические ингредиенты можно было хранить в течение продолжительных периодов времени с сохранением качества. Кроме того, крупномасштабные холодильные установки должны поддерживать качество фармацевтических ингредиентов, если их следует хранить при низких температурах. Поэтому в промышленном отношении важно найти стабильные кристаллические формы, которые можно хранить при комнатной температуре или даже при более высоких температурах.
Как указано выше, необходим промышленный и крупномасштабный способ получения высокочистых фармацевтических ингредиентов, обладающих более благоприятными свойствами для производства лекарственных средств и долго сохраняющихся, при стабильном сохранении их чистоты и свойств в течение продолжительных периодов времени.
[Патентный документ 1] Японский патент № 3488099 (выложенная международная заявка на патент № 99/18081, спецификация патента США № 6432993, спецификация европейского патента № 1022272)
[Патентный документ 2] Выложенный японский патент № 2003-238406 (выложенная международная заявка на патент № WO 03/053440)
[Патентный документ 3] Выложенный японский патент № 2004-083574 (№ WO 2004/000356)
[Патентный документ 4] Выложенный японский патент № 2005-162727 (№ WO 2004/083167)
[Патентный документ 5] Выложенная международная заявка на патент № 2007/091622
Авторы настоящего изобретения провели серьезное исследование соединения (I), которое обладает значительной способностью активировать γ-рецептор, активируемый пролифератором пероксисом (PPAR), от которого ожидают, что оно окажется полезным в качестве активатора PPARγ или противораковой фармацевтической композиции. В результате авторы настоящего изобретения нашли новые кристаллические формы гидратов дигидрохлорида соединения (I), обладающие значительными физическими и химическими свойствами в качестве фармацевтических ингредиентов, превосходно сохраняющие стабильность при комнатной температуре, а также имеющие высокую чистоту, и способ их получения. На основании этих найденных данных авторы создали настоящее изобретение.
Сущность изобретения
Настоящее изобретение относится к следующему:
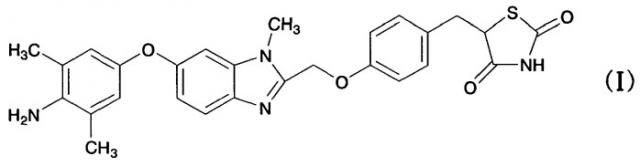
(1) кристаллической форме гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, представленного следующей формулой (I); [формула 1]
(2) кристаллической форме гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, представленного общей формулой (I) согласно приведенному выше п.(1), в котором кристаллическая форма показывает главные пики при межплоскостных расстояниях, равных 7,06, 5,79, 5,43, 4,44, 4,18, 3,97, 3,91, 3,68, 3,61, 3,48, 3,24 и 2,97 ангстрем в порошковой рентгенограмме, полученной с Kα-линией излучения Cu (длина волны λ=1,54 ангстрем) (кристаллическая форма A);
(3) кристаллической форме гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, представленного общей формулой (I) согласно приведенному выше п.(1), в котором кристаллическая форма показывает главные пики при межплоскостных расстояниях, равных 10,42, 5,85, 5,52, 3,84, 3,46 и 2,95 ангстрем в порошковой рентгенограмме, полученной с Kα-линией излучения Cu (длина волны λ=1,54 ангстрем) (кристаллическая форма В);
(4) кристаллической форме согласно приведенному выше п.(2), в которой содержание примесей, измеренное ВЭЖХ, составляет 2,00% или менее;
(5) кристаллической форме согласно приведенному выше п.(2), в которой содержание примесей, измеренное ВЭЖХ, составляет 1,50% или менее;
(6) фармацевтической композиции, содержащей в качестве активного компонента кристаллическую форму гидрата дигидрохлорида соединения тиазолидиндиона, представленного общей формулой (I), согласно любому из приведенных выше пп.(1)-(5);
(7) PPARγ-активатору, содержащему в качестве активного компонента кристаллическую форму гидрата дигидрохлорида соединения тиазолидиндиона, представленного общей формулой (I), согласно любому из приведенных выше пп.(1)-(5);
(8) противораковой фармацевтической композиции, содержащей в качестве активного компонента кристаллическую форму гидрата дигидрохлорида соединения тиазолидиндиона, представленного общей формулой (I), согласно любому из приведенных выше пп.(1)-(5);
(9) фармацевтической композиции для предупреждения или лечения диабета, содержащей в качестве активного компонента кристаллическую форму гидрата дигидрохлорида соединения тиазолидиндиона, представленного общей формулой (I), согласно любому из приведенных выше пп.(1)-(5);
(10) фармацевтической композиции для предупреждения или лечения рака, сопровождаемого диабетом, содержащей в качестве активного компонента кристаллическую форму гидрата дигидрохлорида соединения тиазолидиндиона, представленного общей формулой (I), согласно любому из приведенных выше пп.(1)-(5);
(11) способу получения кристаллической формы согласно приведенному выше п.(2), отличающемуся тем, что 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-дион преобразуют в его водный раствор, и затем к нему по каплям добавляют хлористоводородную кислоту;
(12) способу получения кристаллической формы согласно приведенному выше п.(2), отличающемуся тем, что 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-дион преобразуют в его водный раствор и затем к нему по каплям добавляют хлористоводородную кислоту для получения кристаллической формы гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, который опять растворяют или суспендируют в воде, и затем к нему по каплям добавляют хлористоводородную кислоту; и
(13) способу получения кристаллической формы согласно приведенному выше п.(2), отличающемуся тем, что 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-дион преобразуют в его водный раствор, и затем к нему по каплям добавляют хлористоводородную кислоту для получения кристаллической формы гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, который опять растворяют или суспендируют в воде, и затем к нему добавляют основание для получения раствора или суспензии, и затем к нему по каплям добавляют хлористоводородную кислоту;
(14) способу получения кристаллической формы согласно приведенному выше п.(2), отличающемуся тем, что 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-дион преобразуют в его водный раствор, и затем добавляют затравку кристаллической формы гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, одновременно к нему по каплям добавляя хлористоводородную кислоту;
(15) способу получения кристаллической формы согласно приведенному выше п.(2), отличающемуся тем, что 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-дион преобразуют в его водный раствор, и затем к нему по каплям добавляют хлористоводородную кислоту для получения кристаллической формы гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, который опять растворяют или суспендируют в воде, и затем добавляют затравку кристаллической формы гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, одновременно к нему по каплям добавляя хлористоводородную кислоту;
(16) способу получения кристаллической формы согласно приведенному выше п.(2), отличающемуся тем, что 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-дион преобразуют в его водный раствор, и затем к нему по каплям добавляют хлористоводородную кислоту для получения кристаллической формы гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, который опять растворяют или суспендируют в воде, и затем к нему добавляют основание для получения раствора или дисперсии, и затем добавляют затравку кристаллической формы гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, одновременно к нему по каплям добавляя хлористоводородную кислоту;
(17) способу получения кристаллической формы согласно приведенному выше п.(3), отличающемуся тем, что гидрат дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона кристаллизуют из метанола.
Кристаллическая форма гидрата дигидрохлорида 5-(4-{[6-(4-амино-3,5-диметилфенокси)-1-метил-1-H-бензимидазол-2-ил]метокси}бензил)-1,3-тиазолидин-2,4-диона, представленная выше формулой (I) (далее в настоящем документе может использоваться сокращенно как «кристаллическая форма по настоящему изобретению»), является твердым веществом, внутренняя структура которого состоит из атомов (или их групп) в виде регулярно структурированных 3-мерных повторов. Кристаллическая форма отличается от аморфного твердого вещества, которое не имеет такой регулярно структурированной внутренней структуры.
Даже одно соединение может быть преобразовано в ряд различных кристаллических форм, имеющих различные внутренние структуры и физические и химические свойства (кристаллические полиморфы) в зависимости от условий кристаллизации. Кристаллическая форма по настоящему изобретению может быть любым из кристаллических полиморфов или смесью двух или более кристаллических полиморфов.
Кристаллическая форма по настоящему изобретению может абсорбировать воду и содержать воду, присоединенную из воды, остающейся в атмосфере. Кристаллическая форма по настоящему изобретению, когда ее смешивают с органическим растворителем, может также абсорбировать этот растворитель с образованием сольвата. Кроме того, кристаллическая форма по настоящему изобретению может образовывать полугидрат и даже ее безводную форму, например, при ее нагревании между 25°С и 150°С в нормальных атмосферных условиях.
Кристаллическая форма по настоящему изобретению включает кристаллическую форму с присоединенной водой, кристаллическую форму, состоящую из ее гидрата или сольвата, кристаллическую форму, содержащую ее полугидрат, и кристаллическую форму, содержащую ее безводную форму. Среди этих кристаллических форм в качестве кристаллической формы по настоящему изобретению предпочтительной является кристаллическая форма моногидрата дигидрохлорида соединения (I).
В качестве одной из форм кристаллической формы по настоящему изобретению может быть включена кристаллическая форма А, которая показывает главные пики при межплоскостных расстояниях, равных 7,06, 5,79, 5,43, 4,44, 4,18, 3,97, 3,91, 3,68, 3,61, 3,48, 3,24 и 2,97 ангстрем в порошковой рентгенограмме, полученной с Kα-линией излучения Cu (длина волны λ=1,54 ангстрем), в которой главными пиками являются пики, которые имеют относительные интенсивности, большие чем 30%, считая за 100 интенсивность пика при межплоскостном расстоянии d=7,06 ангстрем, и пики, которые не наблюдают в указанной ниже кристаллической форме В по настоящему изобретению.
Межплоскостное расстояние d рассчитывают согласно уравнению: 2 dsinθ=nλ, в котором n равно 1.
Другой формой кристаллической формы по настоящему изобретению является кристаллическая форма В, которая показывает главные пики при межплоскостных расстояниях, равных 10,42, 5,85, 5,52, 3,84, 3,46 и 2,95 ангстрем в порошковой рентгенограмме, полученной с Kα-линией излучения Cu (длина волны λ=1,54 ангстрем), в которой главными пиками являются пики, которые имеют относительные интенсивности, большие чем 20%, считая за 100 интенсивность пика при межплоскостном расстоянии d=3,46 ангстрем.
Кроме того, указанные выше относительные интенсивности главных пиков могут варьировать согласно различиям во фронтах роста кристаллических форм (в габитусах кристаллов). Такие кристаллические формы признают идентичными в отношении кристаллической формы, и поэтому они включены в настоящее изобретение.
По настоящему изобретению уровень загрязнений, содержащихся в кристаллической форме, можно определять традиционными способами аналитической химии, такими как высокоэффективная жидкостная хроматография (далее может быть сокращенной как ВЭЖХ), в % по массе и, предпочтительно, по отношению площадей пиков, определенных ВЭЖХ. Условия измерений для ВЭЖХ можно выбирать произвольно. Предпочтительные условия измерений описаны ниже.
Условия ВЭЖХ-измерений (1)
Детектор: УФ-абсорбциометр (длина волны: 230 нм)
Колонка: Waters Corporation, XTerra RP18 (4,6 мм × 150 мм)
Температура колонки: 40°C
Подвижная фаза: аммоний-ацетатный буфер (0,01 моль/мл) с ацетонитрилом (65:35)
Скорость потока: 1 мл/мин (в данных условиях соединение (I) показывало время удерживания, составлявшее приблизительно 25 минут)
Инъецируемое количество: 10 мкл
Диапазон измерения площадей пиков: 70 минут после начала инъецирования
Условия ВЭЖХ-измерений (2)
Детектор: УФ-абсорбциометр (длина волны: 230 нм)
Колонка: Waters Corporation, XTerra RP18 (4,6 мм × 150 мм)
Температура колонки: 40°C
Подвижная фаза: аммоний-ацетатный буфер (0,01 моль/мл) с ацетонитрилом (56:44)
Скорость потока: 1 мл/мин (в данных условиях соединение (I) показывало время удерживания, составлявшее приблизительно 8 минут)
Инъецируемое количество: 10 мкл
Диапазон измерения площадей пиков: 70 минут после пика, который элюируется вслед за пиком, время удерживания которого относительно соединения (I) равно 1,48
При ВЭЖХ-измерениях в условиях (1) измеряют отношения площадей пиков соединения (I) и соединений, которые являются загрязняющими примесями, детектированных от минуты 0 до минуты 70. При ВЭЖХ-измерениях в условиях (2) измеряют отношения площадей пиков соединения (I) и соединений, являющихся загрязняющими примесями, детектированных в течение 70 минут после пика, который элюируется вслед за пиком, время удерживания которого относительно соединения (I) составляет 1,48.
Термин «пик» для соединений, являющихся загрязняющими примесями, в настоящем описании относится ко всем пикам, отношение площадей пиков которых измерено на уровне 0,01% или более, исключая пик соединения (I) и пик, который детектируют, когда инъецируют один растворитель.
По настоящему изобретению термин «отношение содержания загрязняющих примесей, измеренное ВЭЖХ», представляет собой отношение интегрированных площадей для всех пиков, отношения площадей которых измерены на уровне 0,01% или более, исключая пик соединения (I) и пик, который детектируют, когда инъецируют один растворитель, к площади пика соединения (I) в указанных выше условиях с использованием ВЭЖХ.
Среди кристаллических форм по настоящему изобретению для кристаллической формы А отношение содержания загрязняющих примесей, измеренное ВЭЖХ, предпочтительно составляет 2% или менее и, более предпочтительно, 1,50% или менее.
Кристаллические формы по настоящему изобретению являются очень чистыми, их цветовой тон белый, они характеризуются превосходной стабильностью при хранении, обрабатываемостью и т.п. Особенно кристаллическая форма А по настоящему изобретению имеет низкое количество остаточного растворителя и является очень чистой, белой по своему цветовому тону, и характеризуется превосходной стабильностью при хранении в форме гидрата при комнатной температуре, поскольку температура дегидратации гидрата является высокой. Кристаллическая форма В по настоящему изобретению имеет более высокую растворимость, чем известное соединение (I). Взятые вместе, кристаллические формы по настоящему изобретению являются полезными в качестве материалов для производства лекарственных средств в массовом производстве (в частности, PPARγ-активаторов, средств предупреждения и/или лечения различных форм рака, средств предупреждения и/или лечения диабета или средств предупреждения и/или лечения различных форм рака, когда они сопровождаются диабетом).
Кроме того, способ получения кристаллических форм по настоящему изобретению является пригодным для получения материалов для лекарственных средств, производимых в массовом масштабе в промышленности, поскольку этот способ может снизить количество остаточного растворителя, производить высокочистую кристаллическую форму и производить белую кристаллическую форму посредством обесцвечивания кристаллической формы.
Краткое описание чертежей
Фиг.1 является порошковой рентгенограммой для кристаллической формы А, полученной в примере 1, на которой вертикальная ось показывает интенсивность дифракции в единицах импульсов, посчитанных в секунду (cps), а горизонтальная ось показывает значения угла дифракции 2θ;
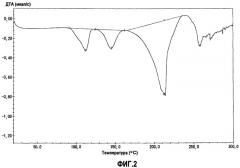
фиг.2 является графиком дифференциального термического анализа (ДТА) для кристаллической формы А, полученной в примере 1, когда температуру повышали со скоростью 5°С в минуту, на котором вертикальная ось показывает тепловой эффект в секунду (мкал/с) (или эндотермический тепловой эффект, когда эта величина отрицательна), а горизонтальная ось показывает температуру (°С);
фиг.3 является порошковой рентгенограммой для кристаллической формы В, полученной в примере 3, на которой вертикальная ось показывает интенсивность дифракции в единицах импульсов, посчитанных в секунду (cps), а горизонтальная ось показывает значения угла дифракции 2θ;
фиг.4 является графиком дифференциального термического анализа (ДТА) для кристаллической формы В, полученной в примере 3, когда температуру повышали со скоростью 5°С в минуту, на котором вертикальная ось показывает тепловой эффект в секунду (мкал/с) (или эндотермический тепловой эффект, когда эта величина отрицательна), а горизонтальная ось показывает температуру (°С);
фиг.5 является порошковой рентгенограммой для соединения, полученного в сравнительном примере 1. На этой фигуре вертикальная ось показывает интенсивность дифракции в единицах импульсов, посчитанных в секунду (cps), а горизонтальная ось показывает значения угла дифракции 2θ.
Подробное описание предпочтительных вариантов осуществления
Указанное выше соединение (I) можно получать способом, раскрытым в японском патенте № 3488099, или способом, аналогичным этому способу.
Кристаллическую форму по настоящему изобретению можно получать путем растворения соединения (I) или различных солей соединения (I), или его различных сольватов, дигидрохлорида соединения (I), или различных его сольватов, или гидрата дигидрохлорида соединения (I) в соответствующем растворителе, с последующим обессоливанием (нейтрализацией), добавлением хлористого водорода или хлористоводородной кислоты, концентрированием раствора, охлаждением, смешиванием с хорошим растворителем и плохим растворителем и т.п., что ведет к условиям перенасыщенности и дает возможность осадить гидрат дигидрохлорида соединения (I) с последующим выделением осажденной кристаллической формы. Кроме того, раствор синтетических неочищенных продуктов, содержащий соединение (I), описанное выше, можно применять в качестве раствора, в котором растворены соединение (I) или различные соли соединения (I), или его различные сольваты, дигидрохлорид соединения (I) или его различные сольваты, или сам гидрат дигидрохлорида соединения (I).
Осаждение кристаллической формы может быть инициировано спонтанно в реакционном контейнере, но оно также может быть инициировано или стимулировано приданием механического стимула, такого как добавление затравки кристаллической формы, стимуляция ультразвуком и трение поверхности реактора.
Полученная кристаллическая форма может быть подвергнута перекристаллизации и суспензионной очистке для дальнейшего улучшения ее чистоты и качества.
В тех случаях, когда применяют различные соли соединения (I) или его различные сольваты, можно проводить обессоливание (нейтрализацию) для обеспечения получения дигидрохлорида соединения (I). В таких случаях для обессоливания обычно применяют основание. Примеры основания не ограничены, пока они осуществляют обессоливание, и они включают гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия или гидроксид цезия, гидроксиды щелочноземельных металлов, такие как гидроксид магния или гидроксид кальция, или амины, такие как аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин или трибутиламин. Предпочтительно, основание является гидроксидом щелочного металла или амином. Более предпочтительно, основание является гидроксидом лития, гидроксидом натрия, гидроксидом калия, трибутиламином или аммиаком.
Основание можно добавлять либо непосредственно, либо после растворения в различных растворителях.
Количество добавляемого основания не ограничено, но обычно оно находится в диапазоне от 1 до 4 эквивалентов на эквивалент различных солей соединения (I).
В тех случаях, когда для кристаллизации гидрата дигидрохлорида соединения (I) добавляют хлористый водород или хлористоводородную кислоту, их количество предпочтительно является большим, чем количество, требуемое для образования дигидрохлорида соединения (I) и осаждения в виде его кристаллической формы. Кроме того, количество добавляемых хлористого водорода или хлористоводородной кислоты обычно находится в диапазоне от 0,1 до 20 эквивалентов и, более предпочтительно, в диапазоне от 2 до 10 эквивалентов на эквивалент соединения (I) для снижения растворимости гидрата дигидрохлорида соединения (I) в растворителях.
Примеры способов концентрирования раствора соединения (I) или его гидрата дигидрохлорида включают способ концентрирования, который позволяет испарить растворитель посредством нагревания при атмосферном давлении или при пониженном давлении с использованием роторного испарителя или т.п., или способ концентрирования с использованием мембраны обратного осмоса. Мембрану обратного осмоса, применяемую для конденсирования раствора, можно выбирать, например, из мембраны полиакрилонитрильного типа, мембраны поливинилспиртового типа, мембраны полиамидного типа, мембраны целлюлозоацетатного типа и т.п.
Температура, при которой кристаллизуют гидрат дигидрохлорида соединения (I), обычно находится в диапазоне от -70 до 150°С и предпочтительно от -70 до 100°С.
Примеры хороших растворителей, применимых в производстве кристаллической формы по настоящему изобретению, включают, например, воду, спирты, такие как метанол или этанол, кетоны, такие как ацетон или метилэтилкетон, простые эфиры, такие как тетрагидрофуран или диоксан, нитрилы, такие как ацетонитрил или пропионитрил, сложные эфиры, такие как метилацетат или этилацетат, амиды, такие как диметилформамид, диметилацетамид или триамид гексаметилфосфорной кислоты, сульфоксиды, такие как диметисульфоксид, или растворители, смешанные из них. Предпочтительно применяют метанол, тетрагидрофуран или эти растворители, смешанные с водой.
Плохие растворители, применяемые для получения кристаллической формы по настоящему изобретению, выбирают соответственно растворителям, применяемым в качестве хороших растворителей. Примеры плохих растворителей включают, например, воду, C2-C4-спирты, такие как этанол, пропанол и бутанол, кетоны, такие как ацетон или метилэтилкетон, простые эфиры, такие как диэтиловый эфир, сложные эфиры, такие как этилацетат и пропилацетат, и нитрилы, такие как ацетонитрил, пропионитрил и бутиронитрил.
В тех случаях, когда получают кристаллическую форму А, эту кристаллическую форму А можно очищать посредством образования водного раствора соединения (I) (предпочтительно, смешанного раствора с тетрагидрофураном и водой), к которому затем по каплям добавляют хлористоводородную кислоту для повышения чистоты кристаллической формы.
После растворения или суспендирования полученной кристаллической формы А в воде к ней можно по каплям добавлять хлористоводородную кислоту для дальнейшего повышения ее чистоты.
В таких случаях эффект очистки можно повысить, в некоторых случаях добавляя основание до начала капельного добавления хлористоводородной кислоты. В тех случаях, когда добавляют основание, примеры оснований не ограничены, но обычно они включают неорганические основания, такие как гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид магния и гидроксид кальция; и органические основания, такие как триметиламин, триэтиламин, диизопропилэтиламин и трибутиламин. Предпочтительно применяют гидроксид натрия или гидроксид калия.
Температура растворения или температура суспендирования в воде не ограничены, но обычно они находятся в диапазоне от 0 до 100°С (температура кипячения с обратным холодильником), предпочтительно в диапазоне от 20 до 100°С (температура кипячения с обратным холодильником) и, более предпочтительно, в диапазоне от 30 до 100°С (температура кипячения с обратным холодильником).
Продолжительность растворения или суспендирования не ограничена, но обычно она находится в диапазоне от 5 минут до 12 часов и, предпочтительно, в диапазоне от 10 минут до 6 часов.
В случае суспендирования капельное добавление хлористоводородной кислоты после суспендирования можно проводить либо после сушки, либо без сушки кристаллической формы, которую выделяют после суспендирования или непосредственно после суспендирования без выделения. Возможен любой вариант.
Количество хлористоводородной кислоты, применяемой после растворения или суспендирования в воде, не ограничено, пока оно больше или равно количеству, необходимому соединению (I) для образования его дигидрохлорида и осаждения его кристаллической формы. Хлористоводородную кислоту обычно добавляют до достижения получаемым раствором значения рН в диапазоне от 2 до 0,5 для понижения растворимости кристаллической формы А в воде.
Кристаллическую форму А можно добавлять в качестве затравки кристаллической формы либо до начала капельного добавления хлористоводородной кислоты, или во время ее капельного добавления. В тех случаях когда добавляют затравку кристаллической формы, количество добавляемой затравки кристаллической формы не ограничено, но обычно оно находится в диапазоне от 0,0001 до 20%, предпочтительно от 0,001 до 10%, и более предпочтительно, от 0,01 до 5% относительно количества очищаемой кристаллической формы А.
Температура, при которой добавляют по каплям хлористоводородную кислоту, обычно находится в диапазоне от 0 до 100°С (температура кипячения с обратным холодильником), предпочтительно в диапазоне от 20 до 100°С (температура кипячения с обратным холодильником) и, более предпочтительно, в диапазоне от 50 до 100°С (температура кипячения с обратным холодильником).
В тех случаях когда получают кристаллическую форму В по настоящему изобретению, дигидрохлорид соединения (I) или его гидрат кристаллизуют из метанола (предпочтительно безводного метанола).
В качестве исходного материала для производства кристаллической формы А по настоящему изобретению можно применять соединение (I), различные соли соединения (I), его различные сольваты, дигидрохлорид соединения (I) или различные сольваты дигидрохлорида соединения (I), или уже выделенный гидрат дигидрохлорида соединения (I). В качестве альтернативы можно применять раствор синтетических неочищенных продуктов, содержащий соединение (I), так как продукт можно очистить кристаллизацией. В качестве исходного материала для производства кристаллической формы В по настоящему изобретению применяют дигидрохлорид соединения (I) или его гидрат.
Осажденные кристаллические формы А или В можно выделить, например, фильтрованием, центрифугированием или декантацией и т.п. Выделенные кристаллические формы при необходимости можно промыть соответствующим растворителем. Для промывания кристаллической формы по настоящему изобретению можно применять растворители, например воду; спирты, такие как метанол, этанол и изопропанол; кетоны, такие как ацетон; сложные эфиры, такие как метилформиат, этилформиат, метилацетат и этилацетат; ароматические углеводороды, такие как толуол и ксилол; нитрилы, такие как ацетонитрил; простые эфиры, такие как диэтиловый эфир и тетрагидрофуран, и растворители, смешанные из них. Предпочтительно, применяют воду, метанол, тетрагидрофуран или смеси растворителей.
Выделенную кристаллическую форму обычно сушат в диапазоне от 0 до 150°С и, предпочтительно, в диапазоне от 20 до 90°С до тех пор, пока масса не остается почти постоянной. Сушку кристаллической формы можно проводить в присутствии осушителей, таких как силикагель или хлорид кальция, или при пониженном давлении, если это необходимо. При пониженном давлении кристаллическую форму можно сушить без дегидратации воды кристаллической формы, регулируя температуру и давление. В таких случаях давление регулируют, устанавливая его относительно высоко для высокой температуры сушки. Например, в случаях когда сушат кристаллическую форму А по настоящему изобретению, давление устанавливают в диапазоне от 0,7 до 50 кПа и, предпочтительно, в диапазоне от 1,8 до 11 кПа для температуры сушки 50°С.
В случаях когда высушенную кристаллическую форму дегидратируют сушкой без регулирования температуры и давления, высушенную кристаллическую форму можно подвергать абсорбции для удаления влаги в основном температурном диапазоне от 0 до 50°С и в диапазоне относительной влажности от 10 до 100% и, предпочтительно, в температурном диапазоне от 10 до 40°С и в диапазоне относительной влажности от 20 до 100% до тех пор, пока масса не останется почти постоянной. Полученную кристаллическую форму можно подвергать перекристаллизации и суспензионной очистке для дальнейшего повышения чистоты и качества кристаллической формы.
Перекристаллизацию кристаллической формы по настоящему изобретению осуществляют способами, обычно применяемыми в синтетической органической химии, такими как (1) растворение при нагревании с последующим охлаждением, (2) способ концентрирования с применением отгонки растворителя после растворения и (3) осаждение кристаллической формы посредством растворения в хорошем растворителе с последующим добавлением к нему плохого растворителя.
В случаях когда кристаллическую форму растворяют в растворителе для перекристаллизации, может происходить дегидрохлорирование. В таких случаях кристаллическую форму по настоящему изобретению можно получить, добавляя хлористый водород или хлористоводородную кислоту.
Суспензионная очистка является способом очистки, при котором кристаллическую форму соединения суспендируют в соответствующем растворителе и снова собирают при взбалтывании суспензии.
Примеры растворителей, применимых для суспензионной очистки кристаллической формы А по настоящему изобретению, включают сложные эфиры, такие как метилацетат и этилацетат; галогенированные углеводороды, такие как метиленхлорид и хлороформ; ароматические углеводороды, такие как толуол и ксилол; этанол; воду; алифатические углеводороды, такие как гексан; простые эфиры, такие как диизопропиловый эфир, диэтиловый эфир и тетрагидрофуран; кетоны, такие как ацетон и метилэтилкетон; нитрилы, такие как ацетонитрил, и смеси растворителей. Предпочтительно применяют воду, метанол, тетрагидрофуран или растворители, смешанные из них. Более предпочтительно, применяют воду.
В случаях когда кристаллическую форму суспендируют в растворителе для суспензионной очистки, может происходить дегидрохлорирование. В таких случаях кристаллическую форму А можно получить, добавляя хлористый водород или хлористоводородную кислоту.
Примеры растворителей, применимых для суспензионной очистки кристаллической формы В по настоящему изобретению, включают кетоны, такие как ацетон и метилэтилкетон; сложные эфиры, такие как метилацетат и этилацетат; нитрилы, такие как ацетонитрил; галогенированные углеводороды, такие как метиленхлорид и хлороформ; ароматические углеводороды, такие как толуол и ксилол; спирты, такие как этанол и изопропанол; амиды, такие как N,N-диметилформамид, воду; алифатические углеводороды, такие как гексан; простые эфиры, такие как тетрагидрофуран, диизопропиловый эфир и диэтиловый эфир, и смеси растворителей. Предпочтительно, применяют воду, метанол, тетрагидрофуран или смеси растворителей. Более предпочтительно, применяют воду.
В случаях когда кристаллическую форму суспендируют в растворителе для суспензионной очистки, может происходить дегидрохлорирование. В таких случаях кристаллическую форму В можно получить, добавляя хлористый водород или хлористоводородную кислоту.
Кристаллическую форму, которую получают перекристаллизацией и суспензионной очисткой, можно выделять и сушить способами, аналогичными способам, указанным выше.
Известно, что соединение (I) и его фармакологически приемлемые соли (особо предпочтительно, его гидрохлоридная соль) обладают значительной способностью активировать γ-рецептор, активируемый пролифератором пероксисом (PPAR), как раскрыто в японском патенте № 3488099 (WO 99/18081, патент США № 6432993, европейский патент № 1022272) (Патентный документ 1), выложенном японском патенте № 2003-238406 (WO 03/053440) (Патентный документ 2), выложенном японском патенте № 2004-083574 (WO 2004/000356) (Патентный документ 3), выложенном японском патенте № 2005-162727 (WO 2004/083167) (Патентный документ 4), WO 2007/091622 (Патентный документ 5) и т.п.
В частности, WO 2007/091622 (Патентный документ 5) раскрывает, что соединение (I) и его гидрохлоридная соль полезны в качестве противораковых фармацевтических композиций для предупреждения или лечения рака желу