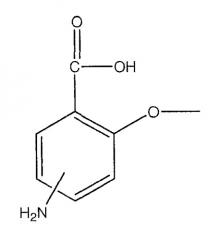
Производные 4- или 5-аминосалициловой кислоты
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным 4- или 5-аминосалициловой кислоты формулы (I) и к фармацевтической композиции на их основе, предназначенных для лечения воспалительных заболеваний кишечника, спастического колита, для профилактики/лечения рака ободочной кишки:
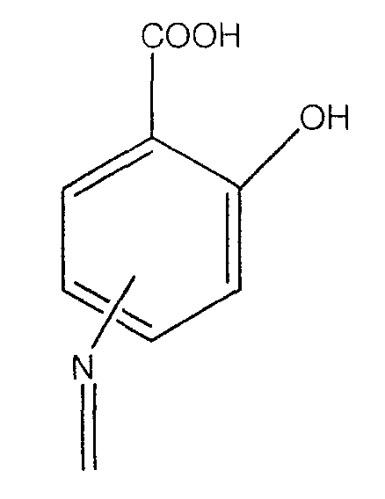
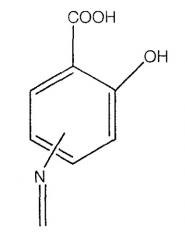
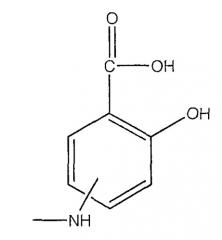
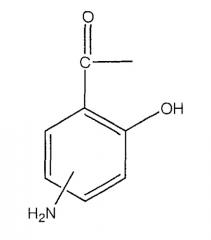
А означает
где -N=, -NH, -NH2 и -NH2, соответственно, находятся в положении 4 или 5;
L означает О, O-С=O, S, N или ковалентную связь; и
R - часть молекулы, которая высвобождает сероводород. Технический результат - получение новых биологически активных субстанций. 6 н. и 15 з.п. ф-лы, 23 ил.
Реферат
Настоящее изобретение относится к соединениям, пригодным для лечения кишечных заболеваний, таких как воспалительное заболевание кишечника (IBD) и спастический колит (IBS), и химиопрофилактики рака ободочной кишки. В частности, были созданы производные 4- и 5-аминосалициловой кислоты, содержащие высвобождающую сероводород часть молекулы, связанную при помощи азогруппы, сложноэфирной, ангидридной, сложнотиоэфирной или амидной связи с молекулой 5- или 4-аминосалициловой кислоты.
Воспалительное заболевание кишечника (IBD) является общим названием заболеваний, вызывающих воспаление тонкой кишки и ободочной кишки. Неспецифический язвенный колит является наиболее распространенным воспалительным заболеванием кишечника, которое поражает разные отделы желудочно-кишечного (GI) тракта, в частности нижний отдел желудочно-кишечного тракта и более конкретно ободочную и/или прямую кишку. Вторым воспалительным заболеванием кишечника является болезнь Крона, которая поражает главным образом тонкую кишку (подвздошную кишку) и толстую кишку (ободочную кишку).
Неспецифический язвенный колит трудно диагностировать, так как симптомы данного заболевания подобны другим заболеваниям кишечника и болезни Крона. Болезнь Крона отличается от неспецифического язвенного колита тем, что вызывает более глубокое воспаление стенки тонкой кишки. Кроме того, болезнь Крона обычно возникает в тонкой кишке, хотя указанное заболевание может также поражать ротовую полость, пищевод, желудок, двенадцатиперстную кишку, толстую кишку, аппендикс и анус.
Неспецифический язвенный колит поражает людей любого возраста, но чаще всего возникает в возрасте 15-30 лет или менее часто в возрасте 50-70 лет. Данное заболевание иногда возникает у детей и подростков. Неспецифический язвенный колит в равной степени поражает мужчин и женщин и, по-видимому, является наследственным заболеванием в некоторых семьях.
Кроме того, важно отметить, что примерно у 5 процентов людей неспецифический язвенный колит является причиной возникновения рака ободочной кишки. Риск возникновения рака повышается в зависимости от продолжительности и степени поражения ободочной кишки. Например, если поражены только нижний отдел ободочной кишки и прямая кишка, риск возникновения рака не превышает среднего показателя. Однако при поражении всей ободочной кишки риск возникновения рака может в 32 раза превышать средний показатель. Таким образом, вполне возможно, что лекарственные средства, пригодные для лечения IBD, могут быть также использованы для профилактики рака ободочной кишки.
Патогенез IBD, по-видимому, определяется многофакторными взаимодействиями генетических факторов, иммунологических факторов и факторов окружающей среды. Недавно полученные данные позволяют предположить, что патологическая активация иммунной системы слизистой оболочки под воздействием антигенов является главным фактором патогенеза IBD.
Вслед за представлением антигена при возникновении воспалительного процесса сразу же происходит образование цитокинов, мелких пептидных молекул гликопротеина, которые направляют сигналы в разные популяции клеток, определяющие направление последующих иммунной и воспалительной реакций. Провоспалительные цитокины включают интерлейкин (IL)-1, IL-6, IL-8 и альфа-фактор некроза опухолей (TNF-α). Макрофаги являются основным источником цитокинов, при этом эпителиальные клетки также способны продуцировать ряд указанных пептидных факторов.
Хелперные Т-клетки (Th) являются еще одним важным источником цитокинов. Th1-клетки, ассоциированные с клеточноопосредованной иммунной реакцией, продуцируют IL-2, гамма-интерферон (IFN-γ) и TNF-α. Ключевой фактор транскрипции, участвующий в регулировании воспаления, NFkB, который специфически определяет патогенез IBD, регулирует количество цитокинов, продуцируемых Th1-клетками (см. публикацию Neurath et al. (1996) Nature Med. 2: 998-1004). Th2-клетки усиливают синтез антител В-клетками и продуцируют IL-4, IL-5, IL-6 и IL-10.
Считается, что хемокины также способствуют патогенезу колита. Хемокины являются провоспалительными белками, которые участвуют в иммунных и воспалительных реакциях в результате хемоаттракции и активации лейкоцитов. Например, RANTES является С-С хемокином, который стимулирует рекрутинг и активацию клеток воспалительного инфильтрата, таких как моноциты, лимфоциты, мастоциты и эозинофилы. Недавно было установлено, что число RANTES увеличивается во время хронической фазы колита (см. публикацию Ajuebor et al. (2001) J Immunol. 166: 552-558).
Лечение неспецифического язвенного колита зависит от тяжести заболевания. Большинство людей проходит курс лекарственного лечения. В тяжелых случаях субъекту может понадобиться хирургическое вмешательство для удаления пораженной ободочной кишки.
Спастический колит (IBS) является распространенным, но плохо исследованным заболеванием, вызывающим разные кишечные симптомы, которые включают боль в брюшной полости, диарею и/или констипацию, вздутие, газообразование и спазмы. Так как указанные симптомы могут быть вызваны целым рядом разных заболеваний кишечника, IBS обычно диагностируют только после исключения более серьезного заболевания. Существует все больше данных, указывающих на роль воспаления в патогенезе IBS.
Проводимое лечение направлено на то, чтобы вызвать и сохранить ремиссию и улучшить качество жизни людей, страдающих IBD/IBS. В настоящее время существует несколько типов лекарственных средств, предназначенных для достижения указанной цели.
Аминосалицилаты, которые являются лекарственными средствами, содержащими 5-аминосалициловую кислоту (5-ASA; мезаламин) или 4-аминосалициловую кислоту (4-ASA), помогают лечить воспаление. Однако мезаламин и 4-ASA могут всасываться при прохождении по желудочно-кишечному тракту, что отрицательно влияет на количество мезаламина, достигающего нижнего отдела желудочно-кишечного тракта, в частности ободочной и прямой кишки. Поэтому были созданы разные препараты на основе мезаламина с целью защиты мезаламина при прохождении препарата по кишечнику и верхнему отделу желудочно-кишечного тракта.
Кроме того, было создано несколько пролекарств мезаламина, которые обеспечивают доставку мезаламина в ободочную кишку. Указанные пролекарства обычно в меньшей степени всасываются в кишечнике и верхнем отделе желудочно-кишечного тракта, благодаря чему они легче достигают ободочной кишки.
Сульфасалазин представляет собой комбинацию сульфапиридина и 5-ASA и используется для достижения и сохранения ремиссии. Сульфасалазин метаболизируется в организме с образованием 5-ASA и сульфапиридина. Сульфапиридиновый компонент доставляет противовоспалительную 5-ASA в тонкую кишку.
Однако сульфапиридин может вызывать побочные эффекты, такие как тошнота, рвота, жжение в сердце, диарея и головная боль. Указанные вредные побочные эффекты обычно приписывают активности сульфапиридина в желудочно-кишечном тракте, а также всасыванию организмом.
Другие лекарственные средства на основе 5-ASA, такие как олсалазин, ипсалазид и балсалазид, которые имеют разные носители, вызывают меньше побочных эффектов и могут быть использованы людьми, плохо переносящими сульфасалазин. В отличие от сульфасалазина распад указанных соединений 5-ASA в кишечнике может не вызывать образования нежелательных продуктов обмена веществ.
Как правило, соединения 5-ASA вводят перорально, с помощью клизмы или в суппозитории в зависимости от места воспаления в ободочной кишке. Большинство людей, страдающих легкой или умеренной формой неспецифического язвенного колита, сначала подвергают лечению указанной группой лекарственных средств. Однако такое лечение нельзя считать оптимальным главным образом из-за плохой эффективности данного лекарственного средства, которое, кроме того, характеризуется плохой совместимостью с организмом субъекта.
Другими применяемыми лекарственными средствами являются кортикостероиды, такие как преднизон, гидрокортизон, будезонид и т.д., и иммуномодуляторы, такие как азатиоприн и 6-меркаптопурин (6-МР). Указанные лекарственные средства могут вызывать побочные эффекты, такие как гипертензия, повышенный риск возникновения инфекций и т.д.
Сульфасалазин, олсалазид и балсалазид являются производными мезаламина, в которых носитель, не являющийся мезаламином, связан с мезаламином при помощи диазосвязи. Указанные пролекарства плохо всасываются в кишечнике и верхнем отделе желудочно-кишечного тракта и поэтому могут достигать ободочной кишки, где они расщепляются азоредуктазами микрофлоры кишечника с высвобождением мезаламина и носителя непосредственно в ободочную кишку.
Другие производные мезаламина включают носитель, присоединенный к мезаламину при помощи карбоксильных и гидроксильных функциональных групп молекулы. Наряду с вышеуказанными лекарственными средствами в научной литературе были описаны препараты на основе сложных эфиров или амидов аминокислот, таких как L-серин и L-глицин, или с добавлением других биологических соединений, таких как таурин. Активность указанных пролекарств основана на действии карбоксипептидаз и аминопептидаз А, вызывающих высвобождение мезаламина (R. Pellicciari et al. (1993) Journal of Medicinal Chemistry, 36, pg. 4201-7).
Большинство ранее известных носителей, присоединенных к мезаламину, являются инертными. Таким образом, к 5-ASA или 4-ASA желательно присоединить носители, которые также являются биологически активными и пригодными для лечения IBD/IBS.
Часть молекулы, способная высвобождать сероводород (H2S) в ткань, обычно связана при помощи азогруппы, сложноэфирной, ангидридной, сложнотиоэфирной или амидной связи с молекулой 4- или 5-аминосалициловой кислоты (4- или 5-ASA) с образованием производного 4- или 5-ASA по настоящему изобретению. Благодаря присоединению H2S-высвобождающей части молекулы к 4- или 5-ASA при помощи ковалентной связи производные по настоящему изобретению могут действовать в качестве пролекарств, которые плохо всасываются в кишечнике и верхнем отделе желудочно-кишечного тракта и, таким образом, могут легко достигать ободочной кишки.
В научной литературе хорошо описаны противовоспалительные свойства 4- или 5-ASA и их применение для лечения неспецифического язвенного колита. 4- или 5-ASA уменьшает воспаление в кишечнике, диарею (частый стул), ректальное кровотечение и боль в желудке. Недавно было установлено, что H2S действует в качестве нейромодулятора и оказывает противовоспалительное действие. Кроме того, установлено, что H2S модулирует ноцицепцию при расширении прямой и ободочной кишки (см. публикацию Distrutti et al. (2005) Evidence That Hydrogen Sulfide Exerts Antinociceptive Effects in the Gastrointestinal Tract by Activating KATP Channels. J. Pharm. and Exp. Ther. 316:325-335, которая включена в настоящее описание изобретения в качестве ссылки). И наконец, как известно, H2S является релаксантом гладких мышц в тканях кишечника (см. публикацию Teague, B. et al. (2002) The Smooth Muscle Relaxant effect of Hydrogen Sulfide In Vitro: Evidence for a Physiological Role to Control Intestinal Contractility. Br. J. Pharmacol. 137: 139-145, которая включена в настоящее описание изобретения в качестве ссылки).
Весьма удивительным является то, что H2S-высвобождающая часть, связанная ковалентной связью с 4- или 5-ASA, характеризуется лучшей способностью высвобождения H2S по сравнению с отдельно используемой частью H2S. Из вышеизложенного следует, что H2S может высвобождаться как в период времени, когда H2S-высвобождающая часть связана ковалентной связью с 4- или 5-ASA, так и после отщепления H2S-высвобождающей части от 4- или 5-ASA в результате гидролиза или расщепления разными ферментами, присутствующими в желудочно-кишечном тракте, с высвобождением двух активных ингредиентов, а именно 4- или 5-аминосалициловой кислоты и H2S-высвобождащей части, которые оказывают дальнейшее действие.
Производные по настоящему изобретению оказывают более эффективное действие по сравнению с отдельно используемой 4- или 5-ASA, отдельно используемой H2S-высвобождающей частью и смесью 4- или 5-ASA и H2S-высвобождающей части в отношении уменьшения воспаления, диареи и скрытой крови в кале у субъектов, страдающих колитом, и ослабления висцеральной боли, обусловленной расширением прямой и ободочной кишки. Кроме того, производные по настоящему изобретению уменьшают также уровни мРНК циклооксигеназы (СОХ)-1, СОХ-2, конститутивной эндотелиальной синтазы оксида азота (eNOS) и индуцибельной NOS (iNOS), которые, как считается, являются ферментами, опосредующими воспаление.
Таким образом, одним объектом настоящего изобретения являются производные по настоящему изобретению, предназначенные для лечения воспалительного заболевания желудочно-кишечного (GI) тракта, такого как воспалительное заболевание кишечника (IBD) и спастический колит (IBS). Не ограничивая себя какой-либо теорией, можно отметить, что сероводород, высвобождаемый из части молекулы, высвобождающей сероводород, оказывает противовоспалительное действие в результате ингибирования NFkB, фактора транскрипции, регулирующего экспрессию нескольких провоспалительных генов. Кроме того, считается, что антиноцицептивное действие H2S может затрагивать АТР-чувствительные К+ (КАТР) каналы.
Другим объектом настоящего изобретения являются производные 4- или 5-ASA по настоящему изобретению, которые эффективно снижают жизнеспособность раковых клеток НТ-29 в ободочной кишке человека и, таким образом, позволяют предотвращать и/или лечить рак ободочной кишки.
Соединения по настоящему изобретению имеют нижеследующую общую формулу,
,
в которой:
А означает
где -N= находится в положении 4 или 5,
где -NH находится в положении 4 или 5,
где -NH2 находится в положении 4 или 5, или
где -NH2 находится в положении 4 или 5;
L означает О, О-С=О, S, N или ковалентную связь и образует сложноэфирную связь, ангидридную связь, сложнотиоэфирную связь, амидную связь или связующую азогруппу; и
R означает высвобождающую сероводород часть молекулы, которая высвобождает H2S в ткань. Очевидно, что в настоящем изобретении может быть использована любая нетоксичная, эффективно высвобождающая сероводород часть молекулы, которая высвобождает H2S в присутствии ткани.
В предпочтительном варианте осуществления изобретения R выбирают из группы, включающей:
и
Все вышеуказанные части молекулы высвобождают H2S в биологические ткани; однако механизм действия большинства H2S-высвобождающих частей отличается от N-ацетилцистеина. Хорошо известно, что N-ацетилцистеин превращается в цистеин в разных тканях и в результате метаболизма цистеина in vivo образуется H2S. H2S продуцируют главным образом два типа пиридоксиль-5'-фосфат-зависимых ферментов, опосредующих метаболизм L-цистеина, а именно цистатион-γ-лиаза и цистатион-β-синтаза (см. публикацию Fujii et al. (2005) Hydrogen Sulfide as a Endogenous Modulator of Biliary Bicarbonate Excretion in the Rat Liver. Antioxid. Redox. Signal. 7:788-794, которая включена в настоящее описание изобретения в качестве ссылки).
В объем настоящего изобретения входят также фармацевтически приемлемые соли, такие как, например, соли щелочных металлов и щелочноземельных металлов, нетоксичных аминов и аминокислот. Предпочтительными солями являются соли аргинина и агматина. В объем настоящего изобретения входят также фармацевтически приемлемые кислотно-аддитивные соли.
Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая соединения по настоящему изобретению и фармацевтически приемлемый наполнитель или носитель, которая предназначена, в частности, для лечения воспалительного заболевания желудочно-кишечного тракта.
Другие варианты осуществления настоящего изобретения относятся к способам лечения воспалительного заболевания желудочно-кишечного тракта, такого как воспалительное заболевание кишечника (IBD) и спастический колит (IBS), у субъекта, нуждающегося в таком лечении, которые включают введение указанному субъекту эффективного количества производных 4- или 5-ASA и их солей. Кроме того, настоящее изобретение относится к способам лечения или профилактики рака ободочной кишки у нуждающегося субъекта, которые включают введение указанному субъекту эффективного количества производных 4- или 5-ASA и их солей.
Другой вариант осуществления настоящего изобретения относится к применению производных 4- или 5-ASA и их солей по настоящему изобретению для приготовления лекарственного средства, предназначенного для лечения воспалительного заболевания желудочно-кишечного тракта. Настоящее изобретение относится также к применению производных 4- или 5-ASA и их солей для лечения воспалительного заболевания желудочно-кишечного тракта.
Предпочтительные соединения имеют нижеследующие формулы:
2-гидрокси-4- или 5-[4-(5-тиоксо-5Н-[1,2]дитиол-3-ил)фенилазо]-бензойная кислота (II),
4-(5-тиоксо-5Н-[1,2]дитиол-3-ил)фениловый эфир 4- или 5-амино-2-гидроксибензойной кислоты (III),
4- или 5-амино-2-[4-(5-тиоксо-5Н-[1,2]дитиол-3-ил)феноксикарбонилокси]бензойная кислота (IV),
2-гидрокси-4- или 5-[4-(5-тиоксо-5Н-[1,2]дитиол-3-ил)феноксикарбониламино]бензойная кислота (V),
4- или 5-{[(1-карбокси-2-меркаптоэтилкарбамоил}метил]азогидроксибензойная кислота (VI),
(1-карбокси-2-меркаптоэтилкарбамоил)метиловый эфир 4- или 5-амино-2-гидроксибензойной кислоты (VII),
4- или 5-амино-2-[(1-карбокси-2-меркаптоэтилкарбамоил)метоксикарбонилокси]бензойная кислота (VIII),
4- или 5-[(1-карбокси-2-меркаптоэтилкарбамоил)метоксикарбониламино]-2-гидроксибензойная кислота (IX),
ангидрид 4- или 5-амино-2-гидроксибензойной кислоты с N-ацетилцистеином (Х),
4- или 5-(2-ацетиламино-3-меркаптопропиониламино)-2-гидроксибензойная кислота (XI),
2-(2-ацетиламино-3-меркаптопропионилокси)-4- или 5-аминобензойная кислота (XII),
2-гидрокси-4- или 5-({4-[4-(4-метоксифенил)-2,4-дитиоксо-2λ5,4λ5-[1,3,2,4]дитиадифосфетан-2-ил]феноксиметил}азо)бензойная кислота (XIII),
4- или 5-амино-2-{4-[4-(4-метоксифенил)-2,4-дитиоксо-2λ5,4λ5-[1,3,2,4]дитиадифосфетан-2-ил]феноксиметоксикарбонилокси}бензойная кислота (XIV),
2-гидрокси-4- или 5-{4-[4-(4-метоксифенил)-2,4-дитиоксо-2λ5,4λ5-[1,3,2,4]дитиадифосфетан-2-ил]феноксиметоксикарбониламино}бензойная кислота (XV),
4-[4-(4-метоксифенил)-2,4-дитиоксо-2λ5,4λ5-[1,3,2,4]дитиадифосфетан-2-ил]феноксиметиловый эфир 4- или 5-амино-2-гидроксибензойной кислоты (XVI),
4-[4-(4-гидроксифенил)-2,4-дитиоксо-2λ5,4λ5-[1,3,2,4]дитиадифосфетан-2-ил]фениловый эфир 4- или 5-амино-2-гидроксибензойной кислоты (XVII),
4- или 5-амино-2-{4-[4-(4-гидроксифенил)-2,4-дитиоксо-2λ5,4λ5-[1,3,2,4]дитиадифосфетан-2-ил]феноксикарбонилокси}бензойная кислота (XVIII),
2-гидрокси-4- или 5-{4-[4-(4-гидроксифенил)-2,4-дитиоксо-2λ5,4λ5-[1,3,2,4]дитиадифосфетан-2-ил]феноксикарбониламино}бензойная кислота (XIX),
4- или 5-(1-карбокси-3-тиокарбамоилпропилазо)-2-гидроксибензойная кислота (ХХ),
2-(4- или 5-амино-2-гидроксибензоиламино)-4-тиокарбамоилмасляная кислота (XXI),
4- или 5-амино-2-(1-карбокси-3-тиокарбамоилпропилкарбамоилокси)бензойная кислота (XXII),
2-гидрокси-4- или 5-[3-(1-гидроксиметил-3-тиокарбамоилпропил)-уреидо]бензойная кислота (XXIII),
4- или 5-амино-2-(2-амино-4-тиокарбамоилбутирилокси)бензойная кислота (XXIV),
4- или 5-(2-амино-4-тиокарбамоилбутириламино)-2-гидроксибензойная кислота (XXV),
ангидрид 4- или 5-амино-2-гидроксибензойной кислоты с 2-амино-4-тиокарбамоилмасляной кислотой (XXVI),
4-тиокарбамоилфенил-4- или 5-амино-2-гидроксибензоат (XXVII),
4- или 5-амино-2-(4-тиокарбамоилфеноксикарбонилокси)бензойная кислота (XXVIII),
2-гидрокси-4- или 5-(4-тиокарбамоилфеноксикарбониламино)бензойная кислота (XXIX),
тиокарбамоилметиловый эфир 4- или 5-амино-2-гидроксибензойной кислоты (ХХХ),
4- или 5-амино-2-тиокарбамоилметоксикарбонилоксибензойная кислота (XXXI),
2-гидрокси-4- или 5-тиокарбамоилметоксикарбониламинобензойная кислота (XXXII),
ангидрид 4- или 5-амино-2-гидроксибензойной кислоты с моно(2-меркаптоэтиловым) эфиром серной кислоты (XXXIII),
4- или 5-амино-2-(2-меркаптоэтоксисульфонилокси)бензойная кислота (XXXIV) и
4-(5-тиоксо-5Н-[1,2]дитиол-3-ил)фениловый эфир 5-амино-2-гидроксибензойной кислоты (XXXV).
Наиболее предпочтительными соединениями являются нижеследующие соединения:
4-(5-тиоксо-5Н-[1,2]дитиол-3-ил)фениловый эфир 5-амино-2-гидроксибензойной кислоты (XXXV),
4-тиокарбамоилфенил-4- или 5-амино-2-гидроксибензоат (XXVII) и
ангидрид 4- или 5-амино-2-гидроксибензойной кислоты с N-ацетилцистеином (Х).
Краткое описание чертежей
На фиг.1 показана оценка интенсивности заболевания у мышей, страдающих TNBS-индуцированным колитом, после лечения возрастающими дозами мезаламина и соединения XXXV по настоящему изобретению.
На фиг.2 показана активность миелопероксидазы (МРО) у мышей, страдающих TNBS-индуцированным колитом, после лечения возрастающими дозами мезаламина и соединения XXXV по настоящему изобретению.
На фиг.3 показана оценка интенсивности заболевания у мышей, страдающих TNBS-индуцированным колитом, после лечения соединением XXXV, отдельно используемым мезаламином, отдельно используемым 5-п-гидроксифенил-1,2-дитион-3-тионом (ADT-OH) и смесью мезаламина и ADT-OH.
На фиг.4 показана активность миелопероксидазы (МРО) у мышей, страдающих TNBS-индуцированным колитом, после лечения соединением XXXV, отдельно используемым мезаламином, отдельно используемым ADT-OH и смесью мезаламина и ADT-OH.
На фиг.5 показана оценка интенсивности заболевания у мышей, страдающих TNBS-индуцированным колитом, после лечения соединением XXVII, отдельно используемым мезаламином, отдельно используемым 4-гидрокситиобензамидом (4-НТВ) и смесью мезаламина и 4-НТВ.
На фиг.6 показана активность миелопероксидазы (МРО) у мышей, страдающих TNBS-индуцированным колитом, после лечения соединением XXVII, отдельно используемым мезаламином, отдельно используемым 4-НТВ и смесью мезаламина и 4-НТВ.
На фиг.7 показана активность миелопероксидазы (МРО) у мышей, страдающих TNBS-индуцированным колитом, после лечения 50 мг/кг мезаламина и эквимолярной дозой соединения XXXV по настоящему изобретению.
На фиг.8 показана оценка интенсивности заболевания у мышей, страдающих TNBS-индуцированным колитом, после лечения наполнителем (1% СМС), 50 мг/кг мезаламина и эквимолярной дозой соединения XXXV по настоящему изобретению.
На фиг.9 показана экспрессия мРНК фактора некроза опухолей (TNF-α) в ободочной кишке у мышей, страдающих TNBS-индуцированным колитом, после лечения наполнителем (1% СМС), 50 мг/кг мезаламина и эквимолярной дозой соединения XXXV по настоящему изобретению.
На фиг.10 показана экспрессия мРНК гамма-интерферона (IFN-γ) у мышей, страдающих TNBS-индуцированным колитом, после лечения наполнителем (1% СМС), 50 мг/кг мезаламина и эквимолярной дозой соединения XXXV по настоящему изобретению.
На фиг.11 показана экспрессия мРНК интерлейкина (IL), а именно IL-1, -2, -10 и -12, у мышей, страдающих TNBS-индуцированным колитом, после лечения наполнителем (1% СМС), 50 мг/кг мезаламина и эквимолярной дозой соединения XXXV по настоящему изобретению.
На фиг.12 показаны уровни мРНК RANTES в ободочной кишке у мышей, страдающих TNBS-индуцированным колитом, после лечения наполнителем (1% СМС), 50 мг/кг мезаламина и эквимолярной дозой соединения XXXV по настоящему изобретению.
На фиг.13 показана экспрессия мРНК СОХ-1 и СОХ-2 в ободочной кишке у мышей, страдающих TNBS-индуцированным колитом, после лечения наполнителем (1% СМС), 50 мг/кг мезаламина и эквимолярной дозой соединения XXXV по настоящему изобретению.
На фиг.14 показана экспрессия мРНК eNOS и iNOS в ободочной кишке у мышей, страдающих TNBS-индуцированным колитом, после лечения наполнителем (1% СМС), 50 мг/кг мезаламина и эквимолярной дозой соединения XXXV по настоящему изобретению.
На фиг.15(а) и (b) показана оценка восприятия висцеральной боли крысами в животной модели при использовании соответственно мезаламина и соединения XXXV по настоящему изобретению.
На фиг.16(а) и (b) показано давление в прямой кишке в животной модели восприятия висцеральной боли крысами при использовании соответственно мезаламина и соединения XXXV по настоящему изобретению.
На фиг.17 показаны оценки восприятия боли при использовании мезаламина, соединения XXXV и соединения XXVII с глибенкламидом или без указанного лекарственного средства.
На фиг.18 показаны оценки восприятия боли при использовании соединения XXXV, соединения XXVII, мезаламина, ADT-OH и 4-НВТ.
На фиг.19 показана адгезия лейкоцитов в ответ на внутрижелудочное введение аспирина.
На фиг.20 изображена столбчатая диаграмма адгезии лейкоцитов в конце эксперимента (по истечении 60-65 минут).
На фиг.21 изображена столбчатая диаграмма, показывающая образование H2S цистеином, ADT-OH, соединением XXXV, 4-НТВ и соединением XXVII.
На фиг.22 изображена кривая изменения реакции в зависимости от концентрации, показывающая вазорелаксирующее действие H2S-высвобождающих частей молекулы по настоящему изобретению.
Подробное описание предпочтительного варианта осуществления изобретения
Настоящее изобретение далее будет описано со ссылкой на предпочтительные варианты осуществления изобретения. Однако следует отметить, что указанные варианты осуществления изобретения приведены только в целях иллюстрации изобретения и не ограничивают объем изобретения, представленного в формуле изобретения.
Соединения по настоящему изобретению содержат две активные части: 4- или 5-ASA и часть, высвобождающую сероводород, которые связаны друг с другом при помощи азогруппы, сложноэфирной, ангидридной, сложнотиоэфирной или амидной связи. Наличие ферментов азоредуктазы делает возможным высвобождение 4- или 5-ASA из пролекарств, связанных азогруппой, обеспечивая таким образом направленную доставку в ободочную кишку и уменьшение системного всасывания. Аналогичным образом, присутствие карбоксипептидаз и аминопептидаз А также делает возможным высвобождение 4- или 5-ASA из пролекарств, связанных соответственно сложноэфирной и амидной связью. Эстеразы и тиоэстеразы также расщепляют соответственно сложноэфирные и сложнотиоэфирные связи. И наконец, липазы расщепляют ангидридные связи. Соединения по настоящему изобретению могут быть получены при использовании известных исходных веществ и реагентов.
Соединения по настоящему изобретению могут быть использованы для профилактики или лечения разных заболеваний, в частности воспалительных заболеваний желудочно-кишечного тракта, которые включают, не ограничиваясь ими, воспалительные заболевания ротовой полости, такие как воспаление слизистой оболочки, инфекционные заболевания (например, вирусные, бактериальные и грибковые заболевания) и болезнь Крона; воспалительные заболевания пищевода, такие как эзофагит, поражения, вызванные химическими веществами (например, поражение, возникающее при проглатывании щелока), гастроэзофагеальная рефлюксная болезнь, рефлюкс желчной кислоты, язва пищевода Баррета, болезнь Крона и сужение пищевода; воспалительные заболевания, такие как гастрит (например, Helicobacter pyroli, пептический эзофагит и атрофический гастрит), глютеновая болезнь, пептическая язва, предопухолевые состояния желудка, неязвенная диспепсия и болезнь Крона; воспалительные заболевания желудка, такие как болезнь Крона, чрезмерное развитие микрофлоры, пептическая язва и фиссуры тонкой кишки; воспалительные заболевания ободочной кишки, такие как болезнь Крона, неспецифический язвенный колит, спастический колит, инфекционный колит (например, псевдомембранозный колит, в частности колит, вызванный бактериями рода Clostridium difficile, энтерит, вызванный бактериями рода Salmonella, инфекционные заболевания, вызванные шигеллами, йерсиниоз, криптоспиридиоз, микроспиридиоз и вирусные инфекции), лучевой колит, колит у хозяина с ослабленным иммунитетом (например, тифлит), предопухолевые состояния ободочной кишки (например, дисплазия, воспалительные заболевания кишечника и полипозный колит), проктит, воспаление, обусловленное геморроем, прокталгия и трещины прямой кишки; заболевания печени, желчного пузыря и/или желчных протоков, такие как холангит, склерозирующий холангит, первичный цирроз желчных протоков и холецистит; и кишечный абсцесс.
В зависимости от конкретного состояния или заболевания, подлежащего лечению, соединения по настоящему изобретению можно вводить субъектам в любых терапевтически приемлемых, эффективных и безопасных дозах, которые могут быть легко определены специалистом в данной области. Указанные соединения наиболее желательно вводят в количестве от около 1 до около 2000 мг/сутки в виде однократной дозы или разделенных доз, хотя доза может быть изменена в зависимости от массы тела и состояния здоровья подлежащего лечению субъекта и конкретного способа введения. Однако наиболее желательная доза находится в пределах от около 0,1 до около 100 мг/кг, предпочтительно от около 5 до 90 мг/кг и более предпочтительно от около 5 до 50 мг/кг. Тем не менее доза может быть изменена в зависимости от массы тела и состояния здоровья подлежащего лечению субъекта, индивидуальной реакции на указанное лекарственное средство, а также от типа выбранного фармацевтического препарата и времени введения. В некоторых случаях более приемлемой может быть доза ниже нижнего предела вышеуказанного диапазона, в то время как в других случаях могут быть использованы более высокие дозы без возникновения вредных побочных эффектов при условии, что такие большие дозы сначала делят на несколько меньших доз, предназначенных для введения в течение дня.
Соединения по настоящему изобретению можно вводить в виде любого фармацевтического препарата, тип которого зависит от способа введения. Указанные фармацевтические композиции могут быть получены стандартными методами с использованием совместимых фармацевтически приемлемых наполнителей или носителей. Примеры таких композиций включают капсулы, таблетки, чрескожные пластыри, лепешки, пастилки, аэрозоли, сиропы, порошки, гранулы, гели, эликсиры, суппозитории и тому подобные, растворы, приготовленные по индивидуальному рецепту, инъецируемые препараты, ректальные, назальные, глазные, вагинальные и другие препараты. Предпочтительным способом введения является пероральное и ректальное введение.
Для перорального введения можно использовать таблетки, содержащие разные наполнители, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикальцийфосфат и глицин, наряду с разными дезинтеграторами, такими как крахмал (предпочтительно кукурузный крахмал, картофельный крахмал или крахмал из кассавы), альгиновая кислота и определенные комплексные силикаты, и гранулирующими связывающими веществами, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Кроме того, в процессе таблетирования могут быть использованы смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа могут быть также использованы для наполнения желатиновых капсул; предпочтительные вещества, используемые для указанной цели, включают также лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. При получении водных суспензий и/или эликсиров для перорального введения активный ингредиент может быть объединен с подсластителями или ароматизаторами, красителями и при желании с эмульгирующими и/или суспендирующими агентами вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и разные комбинации указанных веществ.
Можно приготовить лекарственную форму с немедленным действием, регулируемым действием, замедленным действием, пролонгированным действием или целенаправленным пролонгированным действием. Определения вышеуказанных терминов известны специалистам в данной области. Кроме того, на профиль действия лекарственной формы может влиять состав полимерной смеси, состав матрицы с покрытием, состав частиц, состав частиц с покрытием, состав ионообменной смолы, осмотические характеристики композиции или биологически разлагающаяся полимерная композиция. Не ограничивая себя какой-либо теорией, можно отметить, что на действие лекарственного препарата может влиять благоприятная диффузия, растворимость, эрозия, ионный обмен, осмос или комбинация вышеуказанных факторов.
Для парентерального введения можно использовать раствор активного соединения в кунжутном или арахисовом масле либо в водном растворе пропиленгликоля. Водные растворы при необходимости должны быть должным образом забуферены (рН предпочтительно выше 8), при этом водный разбавитель прежде всего должен быть изотоническим. Для внутривенных инъекций могут быть использованы водные растворы. Все указанные растворы получают в стерильных условиях, создаваемых стандартными фармацевтическими методами, хорошо известными специалистам в данной области.
Ниже приведены не ограничивающие настоящее изобретение примеры, которые должны позволить специалисту в данной области реализовать и использовать данное из