Способ амплификации специфичных фрагментов нуклеиновых кислот с помощью рекуррентной цепной реакции
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к способу амплификации специфичных фрагментов нуклеиновых кислот. Предложенное изобретение может использоваться при проведении ДНК-диагностики в медицине, ветеринарии, санитарно-эпидемиологических исследованиях, в криминалистике для идентификации преступников. При осуществлении способа амплификации специфичных фрагментов нуклеиновых кислот используют термостабильную ДНК-полимеразу, обладающую цепь-смещающей активностью. Кроме того, при проведении данного способа используют прямой и обратный праймеры, представляющие собой расположенные по типу «голова к хвосту» тандемно повторяющиеся последовательности основного праймера. Предложенное изобретение позволяет проводить амплификацию специфичных фрагментов ДНК или РНК с увеличивающимся с каждым циклом коэффициентом размножения. Благодаря этому быстрее происходит накопление целевых ампликонов, что ведет к сокращению времени реакции и увеличению ее чувствительности. 3 з.п. ф-лы, 8 ил.
Реферат
Изобретение относится к молекулярной биологии и биотехнологии и связано с амплификацией и анализом молекул ДНК и РНК. Оно может быть использовано при секвенировании ДНК, при проведении ДНК-диагностики в медицине, ветеринарии, санитарно-эпидемиологических исследованиях, пищевой промышленности для выявления продуктов питания из генетически модифицированных организмов, определения качества сырья, для обнаружения возбудителей опасных инфекций, включая возможные биотеррористические атаки, в криминалистике для идентификации преступников и т.д.
Существующие способы секвенирования ДНК и ДНК-диагностики основаны преимущественно на амплификации специфических фрагментов ДНК или РНК с помощью полимеразной цепной реакции (ПЦР) и ее модификаций. В последние годы все более широкое применение находит так называемая ПЦР в реальном времени (ПЦР-РВ), когда детекция целевого продукта ведется прямо в ходе амплификации с помощью специальных ДНК-амплификаторов, оснащенных оптическим модулем. Одним из важных преимуществ такого подхода является отсутствие необходимости проведения этапа электрофоретического разделения продуктов реакции, предполагающего открытие пробирок и манипуляции с их содержимым на воздухе, следствием чего могло бы быть загрязнение рабочей зоны помещения продуктами ПЦР-ампликонами, представленными миллиардами или даже триллионами копий, влекущими за собой в ходе последующих анализов получение ложнопозитивных результатов, возникающих из-за того, что новые реакционные смеси могут быть изначально воздушно-капельным путем загрязнены ампликонами, образовавшимися в ходе предыдущих положительных реакций и циркулирующими в воздушной среде. Помимо этого, возможность обходиться без электрофоретического анализа заметно сокращает время всей процедуры. Другим важным преимуществом является возможность точного количественного определения с помощью ПЦР-РВ числа копий той или иной мишени, например содержания в сырье или в продуктах питания генетически модифицированных ингредиентов или каких-либо других примесей.
При использовании для секвенирования продуктов ПЦР желательно иметь дело с одной цепью ДНК, что достигается разными путями. Так, для разделения цепей ампликона, одна из которых несет в составе праймера биотиновую метку, используют магнитные частицы, покрытые стрептавидином [Hultman et al., 1989]. Более простыми способами получить возможность последующего обращения с одной цепью ДНК при секвенировании являются различные варианты асимметричной ДНК амплификации с помощью ПЦР [Gyllensten, Erlich, 1988; Mazars et al., 1991; Sanchez et al., 2006], обеспечивающие однако лишь преимущественное накопление одной из цепей и в целом снижающие эффективность самой ПЦР.
В подавляющем большинстве случаев классическая ПЦР проводится с парой праймеров, которые принято обозначать как "прямой" и "обратный". Последовательности праймеров подбираются с таким расчетом, чтобы они отжигались на соответствующих участках ДНК навстречу друг другу, обеспечивая экспоненциальную амплификацию. Обычно праймеры полностью гомологичны местам отжига, за исключением особых случаев, направленных или на дискриминацию тех или иных фрагментов ДНК, отличающихся единичными или неединичными заменами нуклеотидов, и в этом случае неспаривающиеся нуклеотиды могут располагаться на 3'-конце праймера или вблизи него [Gibbs et al., 1989; Huang et al., 1992]. Другой причиной неполной гомологии праймера участку отжига является проводимый сайт-направленный мутагенез и тогда неспаривающийся нуклеотид, на который хотят изменить конкретную последовательность, располагается обычно в средней части праймера [Hemsley et al., 1989]. Праймеры с неспариваемыми участками на 5'-конце обычно применяют в тех случаях, когда желают использования в молекулярном клонировании [Scharf et al., 1986]. Также неспариваемый участок на 5'-конце праймера может служить в качестве места для отжига некоего универсального гибридизационного зонда [Zhang et al., 2003].
Помимо обычно используемой в ПЦР пары праймеров, в отдельных случаях, преследующих цель добиться повышенной специфичности реакции или ее увеличенную чувствительность, используют две пары праймеров, являющихся по отношению друг к другу внешними и внутренними и такой способ проведения ПЦР называется "вложенным" [Erlich et al., 1991]. Причем при проведении подобной ПЦР есть варианты, рассчитанные на остановку реакции и добавление второй пары праймеров, являющихся внутренними по отношению к первым. Более простым и удобным вариантом является использованием пар праймеров, сильно отличающихся по своей температуре отжига, в результате чего на первой стадии при высокой температуре отжига происходит амплификация только с пары внешних праймеров, тогда как на втором этапе при соответствующем снижении температуры отжига в амплификацию включается уже и вторая пара внутренних праймеров [Yourno, 1992].
Известен также способ амплификации, названный авторами Linked Linear Amplification или сокращенно LLA [Reyes et al., 2001; Killen et al., 2003], в основе которого лежит по сути та же ПЦР, но используются множественные пары "вложенных" праймеров (до 7-9 пар), характеризующиеся тем, что вблизи 3'-конца каждого из них вместо соответствующего азотистого основания находится нереплицируемый элемент, блокирующий построение новой цепи ДНК по нему в следующем цикле. Таким образом, новых мест отжига для этих же праймеров в ходе амплификации не возникает, что не позволяет происходить экспоненциальной амплификации. Тем не менее, благодаря большому числу пар праймеров суммарное размножение центральной части искомого участка ДНК может быть сравнимо с таковым в ПЦР. Другими авторами было замечено, что если делать только один праймер из каждой пары с нереплицируемым элементом, то коэффициент размножения возрастает [Behlke et al., 2006], что, впрочем, не удивительно. Авторами этих работ подчеркивается повышенная специфичность данных реакций, но она достается дорогой ценой, поскольку увеличение числа пар праймеров заметно удорожает реакцию и в случае использования хотя бы части полноценных (без нереплицируемого элемента) праймеров делает ее на самом деле более непредсказуемой.
Таким образом, метод LLA вместе со "вложенной" ПЦР в определенной степени служат прототипами предлагаемой нами новой реакции, в основе которой также лежит ПЦР, но благодаря достаточно резким отличиям, заключающимся главным образом в характере накопления целевых продуктов, превосходящим по этому показателю ПЦР на несколько порядков, мы решили назвать данную реакцию иначе - Рекуррентная Цепная Реакция или сокращенно РЦР. Собственно большинство существующих реакций амплификации нуклеиновых кислот с более чем линейным накоплением целевых продуктов по сути являются рекуррентными или рекурсивными. Однако помимо существующего математического термина "рекуррентный", основное значение этого слова характеризует происходящие события как "повторяющиеся периодически, от случая к случаю", что в определенной степени соответствует характеру отжига праймеров в РЦР. Таким образом, чтобы исключить длинное название данной реакции типа "ПЦР с увеличивающимся с каждым циклом коэффициентом размножения молекул ДНК (или с увеличивающимся с каждым циклом числом мест для отжига праймеров в составе ампликона)" и отличать эту новую реакцию от обычной ПЦР, нами принято решение о том, чтобы назвать ее довольно стандартно и коротко - РЦР. Строго говоря, и название ПЦР недостаточно емко, поскольку в нем упоминается только используемый фермент - полимераза и полностью отсутствует информация о ДНК как о другом не менее важном компоненте реакционной смеси. Еще менее информативно название реакции LLA, например. Поэтому на наш взгляд вводимое обозначение РЦР может иметь право на существование и в случае широкого использования этой реакции, нам кажется, что через некоторое время при упоминании этой аббревиатуры сразу будет понятно о чем идет речь и не надо будет расшифровывать какая это ПЦР.
Цели изобретения состоят в возможности проведения амплификации специфичных фрагментов ДНК (или РНК с участием обратной транскриптазы или ДНК полимеразы, обладающей такой активностью) с увеличивающимся с каждым циклом коэффициентом размножения, благодаря чему заметно быстрее происходит накопление целевых ампликонов, что, с одной стороны, сокращает время реакции, а с другой - увеличивает ее чувствительность, позволяя уверенно детектировать единичные молекулы нуклеиновых кислот всего за 20-25 циклов без использования вложенной ПЦР или без второго этапа ПЦР с аликвотой из первой реакции с новыми ингредиентами. Помимо этого в одном из вариантов данной реакции происходит преимущественное накопление одной из цепей ДНК, что может быть использовано при ферментативном секвенировании ДНК с дидезокситерминаторами.
Сущность изобретения состоит в том, что вместо обычных для стандартной ПЦР праймеров, как правило, полностью гомологичных своим местам отжига, в РЦР в качестве прямого и обратного или только одного из них используются праймеры, представляющие собой тандемно повторяющиеся последовательности одинарного (основного) праймера с расположением повторов в них по типу "голова к хвосту" и состоящие из двух или большего числа таких элементов. Если для обычного праймера всю последовательность нуклеотидов в нем отобразить в виде буквы "а", то дублетный праймер будет обозначаться как "аа", а триплетный - "ааа". В виде нуклеотидной записи они могут быть представлены, например, как 5'-gttcgtcgagtctcgtgtta-3' (обычный, здесь - одинарный или основной), 5'-gttcgtcgagtctcgtgttagttcgtcgagtctcgtgtta-3' (дублетный),
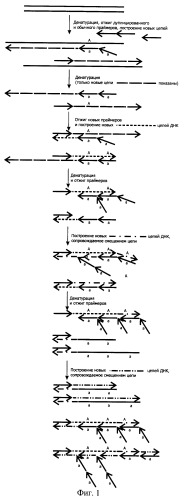
(триплетный), где две подчеркнутые (по-разному) части являются полными копиями неподчеркнутой. Помимо того, что с каждым циклом происходит и удлинение ампликона на длину одинарного праймера (при использовании дублетного или на длину дублетного при использовании триплетного) и увеличение для них мест отжига в составе ампликона, применение термостабильной ДНК-полимеразы типа Vent, обладающей активностью, смещающей цепь ДНК, приводит к возникновению в каждом цикле двуцепочечного ампликона, а также построенных впереди отжегшихся праймеров одиночных цепей ДНК, смещенных такой полимеразой, причем число таких ампликонов в виде одиночных цепей ДНК растет с каждым циклом.
Как можно видеть из фиг.1, при отжиге таких праймеров, состоящих из тандемных повторов одинарного праймера, на исходной нуклеотидной последовательности, несущей только одно место отжига, которое можно обозначить как "А", образуется неспарившийся участок в виде одного из двух "а". Причем, если праймер отожжется своей одинарной частью, расположенной ближе к 3'-концу, то уже через цикл таких участков для отжига праймеров в составе ампликона станет два - "АА" и на них теоретически уже может отжечься, например, два дублетных праймера "аа" и "аа". При этом термостабильная ДНК-полимераза, обладающая смещающей цепь ДНК-активностью в результате удлинения праймера, отжегшегося на внешнем месте отжига, сместит встретившуюся ей на пути цепь ДНК, построенную с помощью праймера, отжегшегося на внутреннем месте, что могло бы несколько напоминать вложенную ПЦР с одновременным отжигом внутренних и внешних праймеров в случае использования ДНК-полимеразы со смещающей цепь ДНК-активностью. Однако во вложенной ПЦР роста числа мест отжига праймера не происходит и каждый из них (внешний и внутренний) "работает" практически независимо от другого. С каждым циклом в РЦР происходит удлинение ампликона за счет увеличения числа мест отжига, благодаря чему все большее число дублетных праймеров "аа" может отжигаться на растущих АА-, AAA-, АААА- и т.д. участках. Аналогичным образом будет происходить увеличение мест отжига и для другой цепи при условии использования в качестве второго праймера, так же как минимум дублетного.
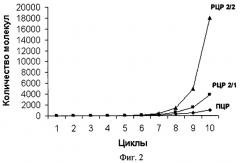
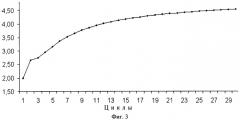
РЦР с использованием одного одинарного (обычного) и одного дублетного праймеров обозначена нами как РЦР 2/1. РЦР с использованием дублетных праймеров в качестве и прямого, и обратного по аналогии обозначена как РЦР 2/2. Рост накопления ампликонов в этих реакциях заметно превосходит таковой для обычной ПЦР, что хорошо видно из фиг.2. Так, для ПЦР максимально теоретически возможный коэффициент размножения равен двум при условии 100%-ной эффективности этой реакции. В РЦР коэффициент размножения молекул ДНК растет с каждым циклом (фиг.3) и к 20 циклу для РЦР 2/2 он теоретически составит в среднем 4,35 при том, что для ампликонов, появившихся, например, в первых циклах, он будет равен 8,5 и 8 к этому моменту также теоретически. Исходя из вышесказанного следует, что по завершении 10-го цикла, например, можно считать, что амплификация исходных последовательностей ДНК в ПЦР с учетом гетерогенных по длине ампликонов, образующихся при отжиге праймеров на исходных цепях ДНК, и самих этих цепей теоретически произойдет в 210 раз или в 1024 раза. За то же количество циклов исходное число специфичных участков ДНК в РЦР 2/1 и РЦР 2/2 теоретически увеличится приблизительно в 4000 и в 18000 раз соответственно и с каждым циклом эта разница будет расти лавинообразно. К 20 циклу разница в кратности амплификации между ПЦР и РЦР 2/2 достигнет 5 миллионов раз, а к 30 циклу она превысит 8 порядков. Для РЦР 2/1 с каждым циклом также увеличивается число одноцепочечных ампликонов, которое уже после 20 цикла теоретически может составить около 1 миллиарда цепей, сразу пригодных для отжига на них секвенирующих праймеров (фиг.4). Причем в РЦР 2/2 также в каждом цикле образуются одноцепочечные ампликоны, однако в данном варианте этой реакции им соответствуют такие же одноцепочечные ампликоны, генерируемые как потомки второй комплементарной цепи исходной ДНК и способные сформировать с аналогичными потомками первой двуцепочечные структуры и тем самым конкурирующие за места отжига с секвенирующим праймером.
В реальности эффективность размножения молекул ДНК даже в начальных циклах РЦР будет заметно отличаться от теоретически рассчитанной ввиду того, что отжиг праймеров на повторяющихся местах отжига происходит как раз рекуррентно и не всегда идеальным образом, отображенном на схеме на фиг.1. Более вероятным событием будет отжиг дублетного праймера с занятием сразу двух мест отжига (когда таковые возникнут), уменьшая, тем самым, число смещаемых цепей. Также возможен отжиг праймера своей второй 5'-концевой частью, приводящий к тому, что таким образом отожженный праймер не будет удлиняться сам и не вызовет смещения цепи ДНК, при условии, что таковая построится с "правильно" отжегшегося праймера своей основной частью, являющегося по отношению к первому внутренним. Но благодаря рекуррентности отжига праймеров в виде происходящего от случая к случаю их "правильного" отжига своей основной одинарной частью, расположенной ближе к 3'-концу, такие события безусловно имеют место, что следует в том числе из фиг.5, на которой показано электрофоретическое разделение продуктов РЦР. В отличие от амплификации с помощью ПЦР с обычными праймерами (дорожка 1) в дорожке 2 наблюдается увеличение длины ампликонов, свидетельствующее что происходит в том числе и планируемый "правильный" отжиг дублетных праймеров. Из фиг.5 видно, что анализ продуктов РЦР по конечной точке с помощью гель-электрофореза из-за множественных полос практически неосуществим, однако проведение РЦР в реальном времени (РЦР-РВ) путем детекции роста флуоресценции специфичного красителя типа SYBR Green I или путем детекции переноса флуоресцентной резонансной энергии от красителя-донора к красителю-акцептору, входящих соответственно в состав прямого и обратного праймеров, при условии отжига последних на мишени на расстоянии, обеспечивающем такой перенос, вполне возможно. На фиг.6 показаны кривые роста флуоресценции интеркалирующего красителя SYBR Green I для ПЦР с обычными праймерами и для РЦР с дублетными праймерами, из которого виден гораздо более ранний подъем кривых для РЦР, причем исходное количество мишеней ДНК было одинаково и составляло для обеих реакций около 20 копий. На фиг.7 показаны кривые роста флуоресценции для ПЦР и РЦР с переносом флуоресцентной резонансной энергии, однако в силу особенностей прибора, настроенного проводить нормализацию получаемых значений, укладывая ее в определенные ныне существующие и разработанные главным образом под ПЦР рамки, рост флуоресценции для РЦР не выглядит очень крутым, при том что рост флуоресценции в ПЦР на фоне значений РЦР выглядит очень незначительным. Однако если убрать полученные значения для РЦР и заставить прибор пересчитать рост флуоресценции только для ПЦР, то он окажется вполне приемлемым и даже крутым (фиг.8). Если соотнести путем экстраполяции выправленный рост флуоресценции для ПЦР с таковым в этом эксперименте для РЦР, то для последней кривая увеличения свечения будет уходить практически вертикально вверх, что в принципе соответствует характеру накопления цепей ампликонов для этих реакций, приведенных на фиг.2.
Предлагаемый способ амплификации с помощью рекуррентной цепной реакции специфичных фрагментов ДНК или РНК вкупе с их детекцией в режиме реального времени и наработкой одноцепочечных ампликонов иллюстрируется нижеследующими примерами.
Краткое описание чертежей
На фиг.1. показана схема протекания РЦР 2/1 - Рекуррентной Цепной Реакции 2/1, где один из праймеров является дуплетным, а второй - одинарным, что приводит к ассиметричному накоплению цепей амплифицируемой ДНК.
На фиг.2. показан характер увеличения числа ампликонов для двух вариантов рекуррентной цепной реакции (РЦР 2/1 и РЦР 2/2) в сравнении с полимеразной цепной реакцией (ПЦР).
На фиг.3. показан рост коэффициента размножения молекул ДНК в РЦР 2/2, увеличивающийся с каждым последующим циклом.
На фиг.4 показан характер копирования с помощью ДНК-полимеразы с цепь-смещающей активностью образовавшегося с использованием одинарного (прямого) и дублетного (обратного) праймеров к двадцатому циклу ампликона. По общему количеству образующихся цепей в виде одного двуцепочечного продукта и 14 одноцепочечных коэффициент размножения можно считать равным 8.
На фиг.5. приведена картина электрофоретического анализа продуктов ПЦР и РЦР в 10%-ном полиакриламидном геле, амплифицированных с помощью термостабильной Vent ехо- ДНК-полимеразы в течение 25 циклов, где цифрой 1 обозначена дорожка с использованием обычных праймеров (ПЦР), а цифрой 2 - дорожка, где один из праймеров - дублетный (РЦР 2/1).
На фиг.6. показан рост кривых флуоресценции в РЦР и в ПЦР, регистрируемый с помощью интеркалирующего красителя SYBR Green I. Цифрой 1 обозначен кривая, характерная для РЦР 2/1, где один из праймеров - дублетный, а цифрой 2 обозначена кривая, характерная для ПЦР с обычными праймерами.
На фиг.7. показан рост кривых флуоресценции в РЦР 2/2 и в ПЦР, регистрируемый с помощью FRET-эффекта (переноса флуоресцентной резонансной энергии), где цифрой 1 обозначена кривая, характерная для РЦР 2/2, где оба праймеры являются дублетными, а цифрой 2 - кривая, характерная для ПЦР с обычными праймерами.
На фиг.8. показан рост кривой флуоресценции при проведении ПЦР в том же эксперименте, что и на фиг.7 после удаления из рассмотрения значений для РЦР 2/2, благодаря чему в результате нормализации прибором (здесь ДНК-термоциклером модели iCycler iQ) имеющихся данных кривая (2) роста флуоресценции приобретает стандартный времени и наработкой одноцепочечных ампликонов иллюстрируется нижеследующими примерами.
Пример 1. Проведение РЦР 2/2 и РЦР 2/1
РЦР проводили в 25 мкл реакционной смеси, содержащей буфер (40 мМ Трис-НСl рН8.0, 2.5 мМ MgCl2, 25 мМ КСl2); 1 ед. акт.Vent ехо-ДНК-полимеразы; по 0.5 пмоль каждого из 2-х дублетных праймеров, меченных каждый своим флуорохромом (донором и акцептором или красителем и гасителем), и соответствующее количество дистиллированной воды. Вместо меченных флуорохромами праймеров использовали также и немеченные и при этом изменение флуоресценции контролировали с помощью интеркалирующего красителя SYBR Green I. РЦР проводили в ДНК-амплификаторе модели iCycler iQ (Bio-Rad Laboratories) при следующих условиях: денатурация двуцепочечной ДНК в первом цикле велась при 95°С в течение 30 сек, затем следовал отжиг праймеров (55°С, 10 сек), их удлинение (72°С, 20 сек) с регистрацией флуоресценции в конце этой стадии, денатурация целевого продукта, 20 сек, количество циклов в разных экспериментах варьировало от 20 до 30.
Проведение РЦР 2/1 отличалось от РЦР 2/2 только использованием одного дублетного праймера, в то время как второй праймер из пары был одинарным, что обеспечивало преимущественное накопление одной из цепей ДНК.
Пример 2. Электрофоретический анализ продуктов РЦР
Электрофоретическое разделение продуктов РЦР проводили в 8%-ном полиакриламидном геле в трис-ацетатном буфере рН 7.8 в неденатурирующих условиях при градиенте напряжения 4V на см длины геля в приборе вертикального типа в течение 4 часов. По завершению электрофореза гель после окрашивания бромистым этидием фотографировали в фотодокументационной системе Gel Camera System (UVP, Inc.).
Литература
Behlke М.А., Walder J.A., Manthey J.A. Polynomial amplification of nucleic acids // US Patent No 7,112,406 B2. Sep.26, 2006.
Erlich H.A., Gelfand D., Sninsky J.J. Recent advances in the polymerase chain reaction // Science. 1991. V.252. P.1643-1651.
Gibbs R.A., Nguyen P.N., Caskey C.T. Detection of single DNA base difference's by competitive oligonucleotide priming // Nucleic Acids Res. 1989. V.17. P.2437-2448.
Gyllensten U.B., Erlich H.A. Generation of single-stranded DNA by the polymerase chain reaction and its application to direct sequencing of the HLA-DQA locus // Proc. Natl. Acad. Sci. USA. 1988. V.85. P.7652-7656.
Hemsley A., Arnheim N., Toney M.D., Cortopassi G., Galas D.J. A simple method for site-directed mutagenesis using the polymerase chain reaction // Nucleic Acids Res. 1989. V.17. P.6545-6551.
Huang M.M., Arnheim N., Goodman M.F. Extension of base mispairs by Taq DNA polymerase: implications for single nucleotide discrimination in PCR // Nucleic Acids Res. 1992. V.20. P.4567-4573.
Hultman Т., Stahl S., Homes E., Uhlen M. Direct solid phase sequencing of genomic and plasmid DNA using magnetic beads as solid support // Nucl. Acids Res. 1989. V.17. P.4937-4946.
Killeen A.A., Breneman J.W., 3rd, Carillo A.R., Ugozzoli L.A., Lowery J.D., Liu J., Hixson C.S. Linked linear amplification for simultaneous analysis of the two most common hemochromatosis mutations // Clin. Chem. 2003. V.49. P.1050-1057.
Mazars G-R., Moyret C, Jeanteur P., Theillet C-G. Direct sequencing by thermal asymmetric PCR//Nucl. Acids Res. 1991. V.19. P.4783.
Reyes A.A., Ugozzoli L.A., Lowery J.D., Breneman J.W., 3rd, Hixson C.S., Press R.D., Wallace R.B. Linked linear amplification: a new method for the amplification of DNA // Clin. Chem. 2001. V.47. P.31-40.
Sanchez J.A., Abramowitz J.D., Salk J.J., Reis A.H., Rice J.E., Pierce K.E., Wangh L.J. Two-temperature LATE-PCR endpoint genotyping // BMC Biotechnol. 2006. V.6. #.44. Scharf S.J., Horn G.T., Erlich H.A. Direct cloning and sequence analysis of enzymatically amplified genomic sequences // Science. 1986. V.233. P. 1076-1078. Yourno J. A method for nested PCR with single closed reaction tubes // PCR Methods Appl. 1992. V.2. P.60-65.
Zhang Y., Zhang D., Li W., Chen J., Peng Y., Cao W. A novel real-time quantitative PCR method using attached universal template probe // Nucleic Acids Res. 2003. V.31. e123.
1. Способ амплификации специфичных фрагментов нуклеиновых кислот, отличающийся тем, что в нем благодаря использованию термостабильной ДНК полимеразы, обладающей цепь-смещающей активностью, и прямого и обратного праймеров, представляющих собой расположенные по типу «голова к хвосту» тандемно повторяющиеся последовательности основного праймера, происходит увеличение числа мест отжига последних, приводящее к постоянному росту коэффициента размножения молекул ДНК в ходе амплификации и ускоренному накоплению ампликонов.
2. Способ по п.1, отличающийся тем, что в состав прямого и/или обратного праймеров входят три и более последовательности основного праймера.
3. Способ по п.1 или 2, отличающийся тем, что регистрация накопления ампликонов ведется по росту флуоресценции в термоциклере с оптическим модулем.
4. Способ по п.1 или 2, отличающийся тем, что один из пары праймеров (прямой или обратный) состоит из одинарной основной последовательности, тогда как другой представляет собой повторенный праймер, обеспечивая асимметричное протекание реакции и появление ампликонов в виде одноцепочечных фрагментов ДНК, пригодных для их секвенирования ферментативным методом.