Способ получения 1-гетарил-2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил) этанов
Иллюстрации
Показать всеИзобретение относится к способу получения гетарильных производных 2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)-этанов общей формулы I
где I а,д,и R1=NO2, R2=H; I б,е,к R1=NO2, R2=Me; I в,ж,л R=CO2Et, R2=H; I е,з,м Rl=CO2Et, R2=Me; I a-г R3 = пиперидинил; I д-з R3 = 1-пирролидинил, I и-м R3 = морфолинил, основанному на реакции нуклеофильного замещения терминального хлора в 2-нитро-1-хлоро-2-(3-фенил-1,2,4-оксадиазол-5-ил)этанах формулы IV 2,5-кратным избытком пиперидина, пирролидина или морфолина, при нагревании и перемешивании в осушенном этаноле и выдерживании при температуре 25°С 2 суток. 2 табл.
Реферат
Изобретение относится к области органической химии, а именно, способу получения новых представителей 1,2,4-оксадиазолов-1-гетарил-2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил) этанов общей формулы I, которые могут быть использованы в качестве потенциальных психотропных препаратов [Патент RU №1746665; Граник В.Г. Основы медицинской химии. М., Вузовская книга, 2004. С. 165-166].
I а,д,и R1=NO2, R2=H; I б,е,к R1=NO2, R2=Me; I в,ж,л Rl=CO2Et, R2=H; I е,з,м Rl=CO2Et, R2=Me; I а-г R3=пиперидинил; I д-з R3=1-пирролидинил, I и-м R3=морфолинил.
Известен способ получения соединений близкого типа, который основан на замене хлора тиогруппой, связанной с пиримидиновым или пиридиновым кольцами [Brizzi V., Franchi G., La Rosa С., Savini L., Mantovani P. Boll. Chim. Farm. 1986. Vol.125, №4. P.100-103].
Техническим результатом является синтез гетарильных производных 2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил) этана с высоким выходом, основанный на реакции нуклеофильного замещения терминального хлора в 5-нитрохлороэтильных производных 1,2,4-оксадиазола пиперидиновым, пирролидиновым или морфолиновым фрагментами, позволяющей расширить базу веществ, обладающих потенциальной психотропной активностью.
Для достижения технического результата в способе получения гетарильных производных 2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил) этана общей формулы I
I а,д,и R1=NO2, R2=H; I б,е,к R1=NO2, R2=Me; I в,ж,л R1=CO2Et, R2=H; I г,з,м R1=CO2Et, R2=Me; I a-г R3=пиперидинил; I д-з R3=1-пирролидинил, I и-м R3=морфолинил.
Замещенные 2-нитро-1-хлоро-2-(3-фенил-1,2,4-оксадиазол-5-ил) этаны IV нагревают 5 ч при перемешивании в осушенном этаноле с 2,5-кратным избытком пиперидина, пирролидина или морфолина и выдерживают при температуре 25°С 2 суток.
Исходные 2-нитро-1-хлоро-2-(3-фенил-1,2,4-оксадиазол-5-ил) этаны IV могут быть получены по известной методике [А.Г.Тырков. Журн. орган. химии. 2000. 36(5), 788; А.Г.Тырков. Журн. орган. химии. 2000. 36(10), 1580] из замещенных 5-нитрометил-1,2,4-оксадиазолов II [А.Г.Тырков, Б.Г.Суйханова. Журн. орган. химии. 1999. 35(9), 1330].
II-IV a R1=NO2, R2=H; б R1=NO2, R2=Me; в R1=CO2Et, R2=H; г R1=CO2Et, R2=Me.
Физические константы, данные элементного анализа и ЯМР1H спектров 2-нитро-1-хлоро-2-(3-арил-1,2,4-оксадиазол-5-ил) этанов IV а-г представлены в таблице 1.
Полученный технический результат позволяет получать с высоким выходом гетарильные производные 2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил) этанов, расширить их ряд, а тем самым и спектр потенциально биологически активных веществ.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого результата.
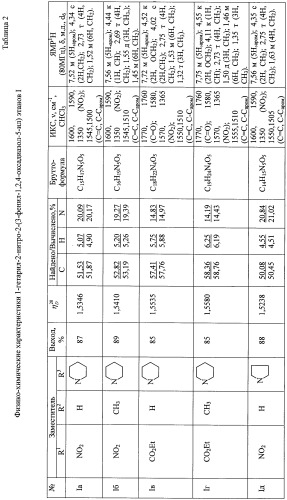
| Таблица 1 | |||||||
| Физико-химические характеристики 2-нитро-1-хлоро-2-(3-фенил-1,2,4-оксадиазол-5-ил) этанов IV | |||||||
| № | Заместитель | Найдено/Вычислено, % | ЯМР1Н, (80 МГц), δ, м.д., d6 | ||||
| R1 | R2 | С | H | N | |||
| IVa | NO2 | H | 1,5220 | 7.65 м (Ph);4.58 с (СН2) | |||
| IVб | NO2 | Me | 1,5365 | 7.67 м (Ph);4.67 к (СН);1.53 д (СН3) | |||
| IVв | CO2Et | H | 1,5480 | 7.74 м (Ph);4.52 к (CH2O);4.17 с (СН2);1.33 т (СН3) | |||
| IVг | CO2Et | Me | 1,5510 | 7.76 м (Ph);4.55 к (CH2O);4.27 к (СН);1.58 д (СН3);1.26 т (СН3) |
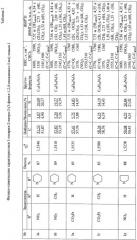
Примеры осуществления заявляемого способа получения гетарильных производных 2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил) этанов I а-м. Выходы, показатели преломления, данные элементного анализа и спектральные характеристики приведены в таблице 2.
Пример 1.
1-[2,2-Динитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)этил] пиперидин (соединение Ia). К раствору 0,9 г (0,003 моль) 5-(2,2-динитро-1-хлороэтил)-3-фенил-1,2,4-оксадиазола в 50 мл осушенного этанола прибавляют 0,8 г (0,008 моль) пиперидина в 10 мл того же растворителя. Реакционную смесь нагревают при перемешивании 5 часов и выдерживают при температуре 25°С 2 суток. Выпавший осадок отфильтровывают, растворитель выпаривают на ротационном испарителе, остаток хроматографируют, собирая элюент бензола.
Пример 2.
1-[1-Метил-2,2-динитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)этил] пиперидин (соединение Iб). Получают аналогично соединению Iа из 0,9 г (0,003 моль) 5-(3,3-динитро-2-хлоропропил)-3-фенил-1,2,4-оксадиазола и 0,8 г (0,008 моль) пиперидина элюент бензол.
Пример 3.
Этил-[2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)]-3-пиперидинопропаноат (соединение Iв). Получают аналогично соединению Iа из 1,0 г (0,003 моль) этил-(3-фенил-1,2,4-оксадиазол-5-ил)нитро(хлорометил)ацетата и 0,8 г (0,008 моль) пиперидина элюент хлороформ.
Пример 4.
Этил-[2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)]-3-пиперидинобутаноат (соединение Iг). Получают аналогично соединению Iа из 1,0 г (0,003 моль) этил-(3-фенил-1,2,4-оксадиазол-5-ил)нитро(1-хлороэтил)ацетата и 0,8 г (0,008 моль) пиперидина элюент хлороформ.
Пример 5.
5-[1,1-Динитро-2-(1-пирролидинил)этил]-3-фенил-1,2,4-оксадиазол (соединение Iд). Получали аналогично соединению Iа из 0,8 г (0,003 моль) 5-(2,2-динитро-1-хлороэтил)-3-фенил-1,2,4-оксадиазола и 0,6 г (0,008 моль) пирролидина элюент бензол.
Пример 6.
5-[1,1-Динитро-2-(1-пирролидинил)пропил]-3-фенил-1,2,4-оксадиазол (соединение Ie). Получали аналогично соединению Iа из 0,9 г (0,003 моль) 5-(3,3-динитро-2-хлоропропил)-3-фенил-1,2,4-оксадиазола и 0,6 г (0,008 моль) пирролидина элюент бензол.
Пример 7.
Этил-[2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)]-3-(1-пирролидинил) пропаноат (соединение Iж). Получали аналогично соединению Iа из 1,0 г (0,003 моль) этил-(3-фенил-1,2,4-оксадиазол-5-ил)нитро(хлорометил)ацетата и 0,6 г (0,008 моль) пирролидина элюент хлороформ.
Пример 8.
Этил-[2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)]-3-(1-пирролидинил) бутаноат (соединение Iз). Получали аналогично соединению Iа из 1,0 г (0,003 моль) этил-(3-фенил-1,2,4-оксадиазол-5-ил)нитро (1-хлороэтил)ацетата и 0,6 г (0,008 моль) пирролидина элюент хлороформ.
Пример 9.
4-[2,2-Динитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)этил] морфолин (соединение Iи). Получали аналогично соединению Iа из 0,9 г (0,003 моль) 5-(2,2-динитро-1-хлороэтил)-3-фенил-1,2,4-оксадиазола и 0,8 г (0,008 моль) морфолина элюент бензол.
Пример 10.
4-[1-Метил-2,2-динитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)этил] морфолин (соединение Iк). Получали аналогично соединению Iа из 0,9 г (0,003 моль) 5-(3,3-динитро-2-хлоропропил)-3-фенил-1,2,4-оксадиазола и 0,8 г (0,008 моль) морфолина элюент бензол.
Пример 11.
Этил-[3-морфолино-2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)]пропаноат (соединение Iл). Получали аналогично соединению Iа из 1,0 г (0,003 моль) этил-(3-фенил-1,2,4-оксадиазол-5-ил)нитро(хлорометил)ацетата и 0,8 г (0,008 моль) морфолина элюент хлороформ.
Пример 12.
Этил-[3-морфолино-2-нитро-2-(3 -фенил-1,2,4-оксадиазол-5-ил)]бутаноат (соединение Iм). Получали аналогично соединению Iа из 1,0 г (0,003 моль) этил-(3-фенил-1,2,4-оксадиазол-5-ил)нитро(1-хлороэтил)ацетата и 0,8 г (0,008 моль) морфолина элюент хлороформ.
Способ получения гетарильных производных 2-нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)-этанов общей формулы I где I а,д, и R1=NO2, R2=H; I б,е,к R1=NO2, R2=Me; I в,ж,л R1=CO2Et, R2=H; I е,з,м Rl=CO2Et, R2=Me; I a-r R3 = пиперидинил; I д-з R3 = 1-пирролидинил, I и-м R3 = морфолинил, основанный на реакции нуклеофильного замещения терминального хлора в 2-нитро-1-хлоро-2-(3-фенил-1,2,4-оксадиазол-5-ил)этанах формулы IV 2,5 кратным избытком пиперидина, пирролидина или морфолина, при нагревании и перемешивании в осушенном этаноле и выдерживании при температуре 25°С 2 сут.