Пептидные соединения
Иллюстрации
Показать всеНастоящее изобретение относится к новым пептидным соединениям, содержащим их фармацевтическим композициям, применению указанных соединений для изготовления лекарственного средства, обладающего активностью в отношении рецептора hV1a для лечения связанных с ним состояний, в частности шоковых состояний. Соединения представлены общей формулой (I), которая определена в описании изобретения. 4 н. и 8 з.п. ф-лы, 1 табл.
Реферат
Область изобретения
Настоящее изобретение относится к новым соединениям, содержащим их фармацевтическим композициям, применению указанных соединений для изготовления лекарственного средства для лечения, в частности, шоковых состояний, а также к способу лечения указанных состояний, включающему введение указанных соединений.
Предшествующий уровень техники
Пептидные агонисты вазопрессинового рецептора V1a, такие как терлипрессин, недавно (см., например, O′Brian et al., Lancet 359 (9313): 1209-10, June 4th, 2002) привлекли повышенное внимание в отношении клинического применения при лечении критических заболеваний и состояний, включая шок гиповолемической (например, геморрагической) или вазодилататорной (например, септической) природы, варикозное расширение вен пищевода с кровотечением (BEV), гепаторенальный синдром (HRS), сердечно-легочную реанимацию и индуцированную анестезией гипотензию. Также было показано, что они обладают клинической применимостью в лечении ортостатической гипотензии, индуцированной парацентезом циркуляторной дисфункции, интраоперационной потери крови и потери крови, связанной с обработкой ожога и носовым кровотечением, и для лечения различных глазных заболеваний путем увеличения лакримации/слезообразования.
Задача настоящего изобретения заключается в том, чтобы предложить эффективные соединения, особенно в отношении рецептора V1a человека (hV1a), которые могли бы предоставить альтернативы, например терлипрессину, при лечении критических состояний.
Описание изобретения
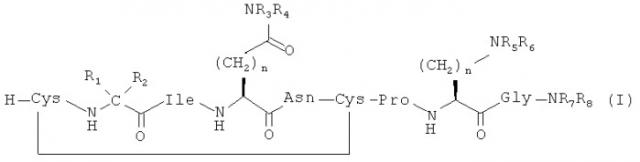
Настоящее изобретение относится к соединениям общей формулы (I):
,
где:
R1 выбран из Н и части алициклической структуры, содержащей от 3 до 8 атомов углерода;
R2 выбран из (СН2)m-Х и части указанной алициклической структуры;
m выбран из 0, 1, 2 и 3;
n выбран из 0, 1, 2, 3 и 4;
p выбран из 2, 3 и 4;
если R1 представляет собой Н, то R2 представляет собой (СН2)m-Х;
если R1 не является Н, то R1 и R2 вместе с α атомом углерода, к которому они присоединены, образуют указанную алициклическую структуру;
если m равен 0, 2 или 3, то Х выбран из С3-8-циклоалкила, С5-8-циклоалкенила и С5-8-циклоалкинила;
если m равен 1, то Х выбран из С3-8-циклоалкила, С5-8-циклоалкенила, С5-8-циклоалкинила, изопропила и трет-бутила;
указанная алициклическая структура, С3-8-циклоалкил, С5-8-циклоалкенил и С5-8-циклоалкинил возможно имеют по меньшей мере один алкильный, O-алкильный или гидроксильный заместитель;
каждый из R3, R4, R5, R6, R7 и R8 независимо выбран из Н, алкила, ОН, групп O-алкил и ОС(O)-алкил;
алкил выбран из С1-6-алкила с неразветвленной цепью и С4-8-алкила с разветвленной цепью и возможно имеет по меньшей мере один гидроксильный заместитель; и
их сольватам и фармацевтически приемлемым солям.
Следует упомянуть, что, например, изопропильная и 2-н-бутильная группы также охвачены выражением "С1-6алкил с неразветвленной цепью", поскольку указанное выражение не затрагивает место связывания рассматриваемой неразветвленной цепи.
C1-6 означает наличие атомов углерода в количестве от одного до шести, включая любое число между этими значениями, и эта номенклатура используется в данном описании изобретения аналогичным образом.
Следующие сокращения использованы в данном описании изобретения:
| AcBuc | 1-аминоциклобутан-1-карбоновая кислота |
| Ala(cPe) | циклопентилаланин |
| Boc | трет-бутоксикарбонил |
| ВОР | гексафторфосфат бензотриазол-1-илокси-трисдиметиламинофосфония |
| Bu | бутил |
| Cha | циклогексилаланин |
| Dbu | 2,4-диаминомасляная кислота |
| DCC | N,N'-дициклогексилкарбодиимид |
| DCHA | дициклогексиламин |
| DCM | дихлорметан |
| DIAD | диизопропил-диазодикарбоксилат |
| DIC | N,N'-диизопропилкарбодиимид |
| DIEA | N,N-диизопропил-N-этиламин |
| DMF | N,N-диметилформамид |
| Fm | 9-флуоренилметил |
| Fmoc | 9-флуоренилметоксикарбонил |
| HOBt | 1-гидроксибензотриазол |
| ВЭЖХ | высокоэффективная жидкостная хроматография |
| i | изо |
| Mmt | 4-метокситритил |
| Mob | пара-метоксибензил |
| МС | масс-спектрометрия |
| Orn | орнитин |
| Ph | фенил |
| Pr | пропил |
| РуВОР | гексафторфосфат бензотриазол-1-илокси-триспирролидинфосфония |
| o-NBS-Cl | 2-нитробензолсульфонилхлорид |
| ОТ | окситоцин |
| Rt | время удерживания |
| t | трет |
| TFA | трифторуксусная кислота |
| TIS | триизопропилсилан |
| TMOF | триметилортоформиат |
| ТРР | трифенилфосфин |
| Trt | тритил |
| VT | вазотоцин, [Ile3]вазопрессин |
| Z | бензилоксикарбонил |
Если не оговорено особо, использовали L-аминокислоты, и придерживались традиционной для аминокислот терминологии.
Примеры фармацевтически приемлемых солей включают соли присоединения кислоты, например соль, образованную путем взаимодействия с галогеноводородными кислотами, такими как соляная кислота, и минеральными кислотами, такими как серная кислота, фосфорная кислота и азотная кислота, а также с алифатическими, алициклическими, ароматическими или гетероциклическими сульфоновыми или карбоновыми кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, янтарная кислота, гликолевая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, аскорбиновая кислота, малеиновая кислота, гидроксималеиновая кислота, пировиноградная кислота, п-гидроксибензойная кислота, памовая кислота, метансульфоновая кислота, этансульфоновая кислота, гидроксиэтансульфоновая кислота, галогенбензолсульфоновая кислота, толуолсульфоновая кислота и нафталинсульфоновая кислота.
В предпочтительных воплощениях R7 и R8 представляют собой Н. Особенно предпочтительно, когда R3 и R4 представляют собой Н.
Также предпочтительно, когда n равен 1 или 2. Алкил обычно выбран из метила, этила, н-пропила, изопропила, трет-бутила и изоамила.
Х предпочтительно выбран из циклопентила и циклогексила.
Указанная алициклическая структура предпочтительно представляет собой циклобутильную структуру.
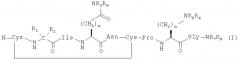
В наиболее предпочтительном воплощении указанное соединение, имеющее формулу I, выбрано из группы, состоящей из:
и
Номер в скобках означает то, как на это соединение ссылаются далее.
Настоящее изобретение также относится к соединению, как оно определено выше, для применения в качестве фармацевтического средства.
Соответственно настоящее изобретение также относится к фармацевтической композиции, содержащей соединение, как оно определено выше, в качестве активного ингредиента вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Фармацевтическая композиция может быть адаптирована для перорального, внутривенного, местного, внутрибрюшинного, назального, трансбуккального, подъязычного или подкожного введения или для введения через дыхательные пути, например в форме аэрозоля или мелкого порошка, суспендированного в воздухе. Таким образом, композиция может быть представлена, например, в форме таблеток, капсул, порошков, микрочастиц, гранул, сиропов, суспензий, растворов, трансдермальных пластырей или суппозиториев.
Следует отметить, что композиция по настоящему изобретению возможно может содержать два или более изображенных выше соединений.
Фармацевтическая композиция по настоящему изобретению возможно может содержать, например, по меньшей мере одно дополнительное вспомогательное вещество, выбранное из разрыхлителя, связывающего вещества, смазывающего вещества, корригента, консерванта, красителя и любой их смеси. Примеры таких и других добавок приведены в "Handbook of Pharmaceutical Excipients"; Ed. A.H.Kibbe, 3rd Ed., American Pharmaceutical Association, USA and Pharmaceutical Press UK, 2000.
Наиболее предпочтительно, фармацевтическая композиция по настоящему изобретению адаптирована для парентерального введения. Она может содержать стерильный водный препарат соединений по изобретению, предпочтительно изотонический крови реципиента. Этот водный препарат может быть приготовлен в соответствии с известными способами с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Иллюстрацией препарата, полученного таким общепринятым способом, является водный препарат Remestype® (терлипрессин). Препарат также может представлять собой стерильные инъецируемые раствор или суспензию в разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Примерами подходящих разбавителей являются вода, раствор Рингера и изотонический раствор хлорида натрия. В качестве растворителя или суспендирующей среды можно использовать стерильные жирные масла. Также можно использовать мягкие жирные масла, в том числе синтетические моно- или диглицериды и жирные кислоты, такие как олеиновая кислота.
Настоящее изобретение также относится к применению соединения, как оно определено выше, для изготовления лекарственного средства для лечения шока гиповолемической или вазодилататорной природы, BEV, HRS, для сердечно-легочной реанимации, для лечения индуцированной анестезией гипотензии, ортостатической гипотензии, индуцированной парацентезом циркуляторной дисфункции, интраоперационной потери крови или потери крови, связанной с обработкой ожога и носовым кровотечением, и для лечения различных глазных заболеваний путем увеличения лакримации/слезообразования.
В еще одном воплощении изобретение относится к способу лечения шока гиповолемической или вазодилататорной природы, BEV, HRS, сердечно-легочной реанимации, лечения индуцированной анестезией гипотензии, ортостатической гипотензии, индуцированной парацентезом циркуляторной дисфункции, интраоперационной потери крови или потери крови, связанной с обработкой ожога и носовым кровотечением, и различных глазных заболеваний путем увеличения лакримации/слезообразования, включающему введение животному, включая человека, терапевтически эффективного количества соединения, как оно определено выше.
Типичная доза соединений по настоящему изобретению находится в широком диапазоне и зависит от различных факторов, таких как индивидуальные потребности каждого пациента и способ введения. Доза, вводимая путем инфузии, обычно находится в диапазоне 0,01-200 мкг/кг массы тела в час. Врач средней квалификации способен оптимизировать дозу в зависимости от сложившейся ситуации.
Производные аминокислот и смолы были приобретены у коммерческих поставщиков (Novabiochem, Bachem, Peptide International и PepTech Corporation). Другие химические вещества и растворители были приобретены в Sigma-Aldrich, Fischer Scientific и VWR.
Представленные здесь соединения синтезировали стандартными способами твердофазной пептидной химии с использованием Fmoc - и Вос-методологии. Если не оговорено особо, все реакции проводили при комнатной температуре. В дополнение к ссылкам, цитированным ранее, следующая стандартная справочная литература обеспечивает дополнительное руководство по общей постановке эксперимента, а также по доступности необходимых исходных материалов и реагентов:
Kates, S.A., Albericio, F., Eds., Solid Phase Synthesis. A Practical Guide, Marcel Dekker, New York, Basel, 2000;
Stewart, J.M., Young, J.D., Solid Phase Synthesis, Pierce Chemical Company, 1984;
Bisello, et al., J. Biol. Chem. 1998, 273, 22498-22505; и
Merrifield, J. Am. Chem. Soc. 1963, 85, 2149-2154.
Чистота синтезированного пептида может быть определена при помощи аналитической ВЭЖХ с обращенной фазой. Структурная целостность пептидов может быть подтверждена с использованием аминокислотного анализа и масс-спектрометрии с электрораспылением.
Пептиды, синтезированные с помощью Fmoc-методологии, расщепляли с использованием раствора TFA/TIS/H2O (96/2/2 об./об./об.), а расщепление в Воc-методологии осуществляли с использованием раствора 90% HF/10% анизола (об./об.). Образования дисульфидного мостика (кольца) достигали окислением линейных пептидов, растворенных в 10%-ной TFA (водн.), йодом. Пептиды очищали при помощи препаративной ВЭЖХ в триэтиламмонийфосфатных буферах (водн.). Окончательно соединения превращали в ацетатные соли с использованием обычной методологии ВЭЖХ. Фракции с чистотой более 97% объединяли и лиофилизировали.
Синтез пептидов с алкилированной по положению 8 боковой цепью (например, соединение 4)
Пептиды конструировали с помощью Fmoc-методологии. Остаток диаминокислоты по положению 8 вводили с кислотолабильной (то есть удаляемой раствором, содержащим 1-2% TFA) защитной группой, такой как метокситритильная (Mmt, см. Barlos, К. et al. в Peptides 1992, Schneider, С.Н, Eberle, A.N., Eds., ESCOM Science Publishers B.V., 1993, pp. 283-284). Для удаления Mmt группы пептид, связанный со смолой, обрабатывали раствором DCM/TIS/TFA (93/5/2 об./об./об.). Восстановительное алкилирование смесью ацетон/NaBH(ОАс)3 позволило получить N-изопропиловый пептид.
Во избежание нежелательного N,N-диалкилирования при восстановительном алкилировании в описанной выше методике, которое может происходить при использовании алкилальдегидов с неразветвленной цепью, был разработан альтернативный способ, при котором после удаления Mmt аминогруппу сначала превращали в производное 2-нитробензолсульфонилхлоридом (o-NBS-Cl, см. Fukuyama, Т.; Jow, С.-К.; Cheung, M. Tetrahedron Lett. 1995, 36, 6373-6374). Получающийся в результате сульфонамид затем алкилировали подходящим спиртом в общепринятых условиях реакции Мицунобу, обычно с использованием TPP/DIAD в 1,2-диметоксиэтане (Mitsunobu, О. Synthesis 1981, 1-28). o-NBS-Cl группу впоследствии удаляли 5%-ным тиофенолятом калия в DMF, после чего от смолы отщепляли пептид.
Синтез пептидов с N-алкилированной по положению 4 боковой цепью
Пептиды конструировали с помощью Boc-методологии. Остаток по положению 4 вводили в последовательность в виде Boc-Asp(OFm)-OH. После конструирования полного пептида удаляли защиту боковой цепи с помощью 30%-ного пиперидина в DMF. Получающуюся в результате свободную карбоксильную группу превращали в целевой амид путем сочетания с соответствующим амином, опосредуемого РуВор или BOP/DIEA. Затем удаляли N-концевую Boc группу с последующими расщеплением при помощи HF, циклизацией и очисткой путем ВЭЖХ.
В Таблице 1 перечислены соединения, полученные по методике, описанной выше, вместе с определенными (см. ниже) ЕС50 (средняя эффективная концентрация), выраженными в наномоль/л. R3, R4, R5, R6, R7 и R8 для всех соединений за исключением соединения 4, в котором R6 является изопропилом, представляют собой Н. Для перечисленных соединений m равен 1, за исключением случая, когда R1 и R2 представляют собой часть алициклической структуры (образованной вместе с α углеродом аминокислоты по положению 2), например 1,1-циклобутила.
| Таблица 1 | ||||||
| Полученные соединения формулы (I) | ||||||
| Заместитель | EC50 | Обозначение | ||||
| R1 | R2 | Х | n | p | ||
| Н | CH2X | циклогексил | 2 | 2 | 0,27 | соединение 1 |
| Н | CH2X | циклопентил | 2 | 2 | 0,80 | соединение 2 |
| 1,1-циклобутил | - | 2 | 2 | 0,94 | соединение 3 | |
| Н | СН2Х | трет-бутил | 2 | 2 | 10,7 | соединение 5 |
| Н | СН2Х | изопропил | 2 | 2 | 12,0 | соединение 6 |
| 1,1-циклобутил | - | 1 | 3 | 7,93 | соединение 7 | |
| Н | СН2Х | циклопентил | 1 | 3 | 7,70 | соединение 8 |
| Н | СН2Х | циклогексил | 1 | 3 | 0,75 | соединение 4 |
| 1,1-циклобутил | - | 1 | 2 | 14,8 | соединение 9 | |
| Н | СН2Х | циклопентил | 1 | 2 | 17,8 | соединение 10 |
| Н | СН2Х | циклогексил | 1 | 3 | 9,93 | соединение 11 |
| Н | СН2Х | циклогексил | 1 | 2 | 2,28 | соединение 12 |
| N/A | 82,1 | терлипрессин |
Следующие ниже подробные примеры предназначены для дополнительной иллюстрации синтеза:
Соединение 4; [Cha2, Asn4, Orn (i-Pr)8]VT:
Использованные производные аминокислот представляли собой Вос-Cys(Trt)-OH, Fmoc-Cha-OH, Fmoc-Ile-OH, Fmoc-Gln(Trt)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Cys(Trt)-OH, Fmoc-Pro-OH, Fmoc-Orn(Mmt)-OH и Fmoc-Gly-OH. Аналитическую ВЭЖХ осуществляли на жидкостном хроматографе Waters 600 с использованием колонки Vydac C18, 5 мкм, 4,6×250 мм, при скорости потока 2 мл/мин. Препаративную ВЭЖХ осуществляли на жидкостном хроматографе Waters 2000 с использованием картриджа Prepak, 47×300 мм, при скорости потока 100 мл/мин. Анализ конечного соединения осуществляли на жидкостном хроматографе 1100 Agilent с использованием колонки Vydac C18, 5 мкм, 2,1×250 мм, при скорости потока 0,3 мл/мин. Масс-спектры регистрировали на спектрометре Finnigan MAT.
На пептидном синтезаторе Applied Biosystems 9050 синтезировали полностью защищенную пептидную смолу, начиная от 0,4 г (0,1 ммоль) смолы Tentagel-S-RAM (Peptides International). Выполняли опосредованные DIC/HOBt одиночные сочетания с 4-кратным избытком производных аминокислот. С использованием 20%-ного пиперидина в DMF удаляли Fmoc группу. После завершения автоматического синтеза смолу переносили в сосуд для ручного синтеза и в течение 2×1,5 часов обрабатывали раствором DCM/TIS/TFA (93/5/2 об./об./об.) (30 мл) для удаления Mmt группы. Смолу тщательно промывали DCM и затем суспендировали в 15 мл смеси 1,2-дихлорэтан/ТМОF (1:1 об./об.). Затем добавляли 0,2 мл ацетона и после этого 0,6 г NаВН(ОАс)3. Суспензию встряхивали в течение ночи, и смолу промывали метанолом, DMF и DCM и сушили в вакууме. Затем смолу обрабатывали в течение 1,5 часов 30 мл раствора TFA/TIS/H2O (96/2/2 об./об./об.) и отфильтровывали. Фильтрат упаривали, и неочищенный линейный пептид осаждали с использованием диэтилового эфира. Осадок сразу же растворяли в 500 мл 10%-ной TFA (водн.), и путем добавления 0,1 М I2 в метаноле к перемешиваемому магнитной мешалкой раствору до тех пор, пока сохранялось желтое окрашивание, окисляли пептид. Избыток йода восстанавливали аскорбиновой кислотой. Затем реакционную смесь охлаждали измельченным льдом и путем добавления концентрированного аммиака (водн.) доводили рН до приблизительно 5. Смесь наносили на ВЭЖХ колонку и очищали с использованием триэтиламмонийфосфатного буфера с рН 5,2. Соединение элюировали с использованием градиента ацетонитрила. Фракции с чистотой, превышающей 97%, объединяли, и получающийся в результате раствор разбавляли 2 объемами воды. Раствор повторно наносили на колонку, которую затем промывали 2 л 0,1 М ацетата аммония (водн.) и уравновешивали 2%-ной уксусной кислотой (водн.). Соединение элюировали с использованием быстрого (3%/мин) градиента ацетонитрила. Фракции, содержащие целевой продукт, объединяли и лиофилизировали. Получали 20,7 мг (20%-ный выход) белого аморфного порошка. ВЭЖХ: Rt=8,2 мин, градиент: 30→50% за 20 мин, поток: 0,3 мл/мин, t=40°C, растворитель А 0,01% TFA (водн.), растворитель В 70% СН3СN, 0,01% TFA (водн.); чистота: 100%; МС (M+H+): вычислено 1026,5, найдено 1026,5.
Соединение 3; [AcBuc2, DBU8]VT:
Использованные производные аминокислот представляли собой Вос-Cys(Mob)-OH, Boc-AcBuc-OH, Boc-Ile-OH, Boc-Gln-OH, Boc-Asn-OH, Boc-Pro-OH, DCHA соль Boc-Dbu(Z)-OH, и Boc-Gly-OH, все они были приобретены в Novabiochem и Bachem. ВЭЖХ и МС операции осуществляли как при синтезе соединения 4.
Вручную синтезировали полностью защищенную пептидную смолу, начиная с 0,6 г (0,4 ммоль) 4-бензгидриламинной смолы (Novabiochem). Осуществляли опосредованные DCC, РуВОР или DIC/HOBt одиночные сочетания с 2,5-кратным избытком производных аминокислот. С использованием 50% TFA в DCM, содержащем 1% м-крезола, удаляли Boc группу. Конечную смолу промывали метанолом, DMF и DCM и сушили в вакууме. Пептид отщепляли от смолы при 0°С в течение 90 минут путем использования 30 мл безводного HF, содержащего 3 мл анизола. HF выпаривали, и неочищенный линейный пептид промывали диэтиловым эфиром. Пептид сразу же растворяли в 200 мл смеси 25% ацетонитрил/10% TFA (водн.) и окисляли, как описано выше. Получающуюся в результате смесь непосредственно наносили на ВЭЖХ колонку и очищали с использованием триэтиламмонийфосфатного буфера при рН 2,3. Если специально не предусмотрено, то последующие стадии были идентичны стадиям из методики получения соединения 4. Получали 80,6 мг (22%-ный выход) белого аморфного порошка. ВЭЖХ: Rt=7,3 мин, градиент: 20→40% В за 20 мин, поток: 0,3 мл/мин, растворитель А 0,01% TFA (водн.), растворитель В 70% СН3СN, 0,01% TFA (водн.); чистота: 99,6%; МС (M+H+): вычислено 928,4, найдено 928,3.
Другие соединения получали аналогичным варьированием этих синтетических методик.
Экспериментальная часть (биологическое тестирование)
Анализ в отношении рецепторов in vitro:
Агонистическую активность соединений в отношении рецептора hV1a определяли в транскрипционном репортерном анализе путем временной трансфекции в клетки НЕК-293 ДНК, экспрессирующей рецептор hV1a, вместе с репортерной ДНК, содержащей промоторные элементы, чувствительные к внутриклеточному кальцию, регулирующие экспрессию люциферазы светлячка.
Дополнительное руководство по проведению этого анализа см. в Boss, V., Talpade, D.J, Murphy, T.J., J. Biol. Chem. 1996, May 3; 271 (18), 10429-10432. Клетки подвергали воздействию серийных разведении соединений, разведенных 10-кратно на дозу, в течение 5 часов, с последующим лизисом клеток, определением люциферазной активности и определением эффективностей соединений и значений EC50 путем нелинейной регрессии. В качестве внутреннего контроля в каждом эксперименте использовали аргинин-вазопрессин (AVP, ЕС50=0,21 нМ), и соединения тестировали в по меньшей мере трех независимых экспериментах.
Результаты испытаний in vitro показаны в таблице 1 выше, включая данные по терлипрессину. Приведенное значение EC50 представляет собой среднее геометрическое, выраженное в наномоль/л (нМ).
Все перечисленные ссылки следует рассматривать в качестве неотъемлемой части настоящего описания.
1. Соединение формулы (I): где R1 выбран из Н и части алициклической структуры, содержащей от 3 до 8 атомов углерода;R2 выбран из (СН2)m-Х и части указанной алициклической структуры;m выбран из 0, 1, 2 и 3;n выбран из 1, 2, 3 и 4;p выбран из 2, 3 и 4;если R1 представляет собой Н, то R2 представляет собой (СН2)m-Х;если R1 не является Н, то R1 и R2 вместе с α атомом углерода, к которому они присоединены, образуют указанную алициклическую структуру;если m равен 0, 2 или 3, то X представляет собой С3-8-циклоалкил;если m равен 1, то X выбран из С3-8-циклоалкила, изопропила или трет-бутила;каждый из R3, R4, R5, R6, R7 и R8 независимо выбран из Н или алкила, выбранного из С1-6-алкила с неразветвленной цепью и С4-8-алкила с разветвленной цепью; и его фармацевтически приемлемые соли.
2. Соединение по п.1, где R7 и R8 представляют собой Н.
3. Соединение по п.1, где R3 и R4 представляют собой Н.
4. Соединение по п.1, где n равен 1 или 2.
5. Соединение по п.1, где алкил выбран из метила, этила, н-пропила, изопропила, трет-бутила и изоамила.
6. Соединение по п.1, где X представляет собой циклопентил или циклогексил.
7. Соединение по п.1, где указанная алициклическая структура представляет собой циклобутильную структуру.
8. Соединение по п.1, выбранное из группы, состоящей из: и .
9. Соединение по любому из пп.1-8 для применения в качестве фармацевтического средства, обладающего активностью в отношении рецептора hV1a.
10. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 в качестве активного ингредиента вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем, где активный ингредиент обладает активностью в отношении рецептора hV1a для лечения связанных с ним состояний.
11. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства, обладающего активностью в отношении рецептора hV1a.
12. Способ модулирования рецепторов hV1a, включающий введение соединения по любому из пп.1-8.