Полипептиды, обладающие антимикробной активностью, и полинуклеотиды, кодирующие их
Иллюстрации
Показать всеИзобретение относится к выделенным полипептидам, обладающим антимикробной активностью, и выделенным полинуклеотидам, кодирующим эти полипептиды, а также к конструкциям нуклеиновой кислоты, векторам и клеткам-хозяевам, содержащим указанные полинуклеотиды. Антимикробная активность полученных полипептидов позволяет применять их в ветеринарии и медицине, а также в кормопроизводстве. 12 н. и 4 з.п. ф-лы, 6 табл.
Реферат
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к выделенным полипептидам, обладающим антимикробной активностью, и к выделенным полинуклеотидам, кодирующим эти полипептиды. Изобретение также относится к конструкциям нуклеиновых кислот, векторам и клеткам-хозяевам, содержащим эти полинуклеотиды, а также к способам получения и применения этих полипептидов.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является получение полипептидов, обладающих улучшенной антимикробной активностью. Эти полипептиды могут проявлять сниженную гемолитическую активность и/или сниженную цитотоксичность. Эти полипептиды также могут демонстрировать пониженную чувствительность к катионам, таким как Ca2+, Mg2+, Na+. Эти полипептиды также могут демонстрировать спектр антимикробного действия, отличный от SEQ ID NO:1.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к полипептиду, обладающему антимикробной активностью, который содержит аминокислотную последовательность, предпочтительно состоит из аминокислотной последовательности, которая по меньшей мере на 80% идентична аминокислотам с 1 по 40 аминокислотной последовательности:
G-X1-G-C-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-C-H-X12-X13-C-X14-X15-X16-X17-X18-X19-X20-G-G-X21-C-X22-X23-X24-X25-X26-X27-C-X28-C-X29;
где
X1=F, L, W или I; предпочтительно X1=F;
X2=N, R, Q, V, G, S, A, K, L, M, D, H или Y; предпочтительно X2=N, R, Q, V, G, S, A, K или Y;
X3=G, R, A или K; предпочтительно X3=G;
X4=P, A, L, V, K или R; предпочтительно X4=P, K или R;
X5=W или R;
X6=D, A, G, K, L, T, N, F, H, M, P, Q, S, C, I, R, V или Y; предпочтительно X6=D, A, G, K, L, T, N, F, H, M, P, Q, S, V или Y;
X7=E, G, A, L, C, Q или S; предпочтительно X7=E, G или S;
X8=D, F, G, N, V, Y, H, K, L, P, S, T, W, I, M, A, C или R; предпочтительно X8=D, F, G, N, V, Y, H, K, L, P, S, T, W, I, M или R;
X9=D или P; предпочтительно X9=D;
X10=M, R, S, V, A, F, G, L, T, Y, W, E или K; предпочтительно X10=M, R, S, V, G, Y, L, F, T, W или K;
X11=Q, R, L, F, G, H, S, A, C, I, K, M, P, T, V, W или Y; предпочтительно X11=Q, R, L, F, G, H, S, K или Y;
X12=N, R, I, Y, V, K, T, Q, S, F, A, W, E или H;
X13=H, A, F, Q, T, V или L; предпочтительно X13=H или L;
X14=K, Q или R; предпочтительно X14=K или R;
X15=S, A, V, N или F;
X16=I, L, M, T, W или V; предпочтительно X16=I, L или V;
X17=K, T или R;
X18=G, H, K, A, P, F, I, Q, R, S, T, Y или N; предпочтительно X18=G, H, R, K или N;
X19=Y, H, K, L, M, N, Q, S, V или R; предпочтительно X19=Y или R;
X20=K, F, H, T, C или R; предпочтительно X20=K или R;
X21=Y, F, R, A, H, L, M, S или W; предпочтительно X21=Y, F, R или W;
X22=A, K, N, Q, T, E, H, I, R, S, V, G или Y; предпочтительно X22=A, K, N, Q, T, S или Y;
X23=K, R или T; предпочтительно X23=K или R;
X24=G, K, Q, E, N, S, T, A или R; предпочтительно X24=G, K, Q, A или R;
X25=G, K, H, W или R; предпочтительно X25=G, K или R;
X26=F, A, H, I, M, V, W, R или L; предпочтительно X26=F или L;
X27=V, L, M, I, K, Q, R или T; предпочтительно X27=V, L, M или T;
X28=K, H, N или R; предпочтительно X28=K или R;
X29=Y, I, YRCG или YR; предпочтительно X29=Y или YR;
и идентичность которой менее 100% аминокислотам с 1 по 40 SEQ ID NO:1.
Настоящее изобретение также относится к конструкциям нуклеиновых кислот, рекомбинантным векторам экспрессии и рекомбинантным клеткам-хозяевам, содержащим эти полинуклеотиды.
Настоящее изобретение также относится к способам получения таких полинуклеотидов, обладающих антимикробной активностью, включающим в себя (a) культивирование рекомбинантной клетки-хозяина, которая содержит конструкцию нуклеиновой кислоты, содержащую полинуклеотид, кодирующий этот полипептид в условиях, способствующих продукции этого полипептида; и (b) извлечение этого полипептида.
Настоящее изобретение также относится к способам применения полипептидов по изобретению.
ОПРЕДЕЛЕНИЯ
Антимикробная активность: термин «антимикробная активность» здесь определяется как активность, способная уничтожать или подавлять рост микробных клеток. В контексте настоящего изобретения термин «антимикробная» означает, что имеет место бактерицидный, и/или бактериостатический, и/или фунгицидный, и/или фунгистатический эффект, и/или вирулицидный эффект, где под термином «бактерицидный» подразумевается способность уничтожать бактериальные клетки. Под термином «бактериостатический» подразумевается способность подавлять бактериальный рост, то есть подавление роста бактериальных клеток. Под термином «фунгицидный» подразумевается способность уничтожать клетки грибов. Под термином «фунгистатический» подразумевается способность подавлять рост грибов, то есть подавлять рост клеток грибов. Под термином «вирулицидный» подразумевается способность инактивировать вирусы. Термин «микробные клетки» означает клетки бактерий или грибов (в том числе дрожжей).
В контексте настоящего изобретения термин «подавление роста микробных клеток» означает, что клетки не находятся в состоянии роста, то есть, что они не способны размножаться.
Для целей настоящего изобретения антимикробную активность можно определить в соответствии со способом, описанным Lehrer et al., Journal of Immunological Methods, Vol. 137 (2) pp. 167-174 (1991). Альтернативно, антимикробную активность можно определить в соответствии с руководствами NCCLS (Национального комитета по клиническим и лабораторным стандартам) от CLSI (Институт клинических и лабораторных стандартов; ранее известный как Национальный комитет по клиническим и лабораторным стандартам).
Полипептиды с антимикробной активностью могут обладать способностью снижать число живых клеток Escherichia coli (DSM 1576) до 1/100 через 24 часа (предпочтительно через 12 часов, более предпочтительно через 8 часов, более предпочтительно через 4 часа, более предпочтительно через 2 часа, наиболее предпочтительно через 1 час, и, в частности, через 30 минут) инкубации при 20°C в водном растворе 25% (мас./мас.); предпочтительно в водном растворе 10% (мас./мас.); более предпочтительно в водном растворе 5% (мас./мас.); еще более предпочтительно в водном растворе 1% (мас./мас.); наиболее предпочтительно в водном растворе 0,5% (мас./мас.); и, в частности, в водном растворе 0,1% (мас./мас.) полипептидов, обладающих антимикробной активностью.
Полипептиды с антимикробной активностью также могут обладать способностью подавлять разрастание Escherichia coli (DSM 1576) в течение 24 часов при 25°C в ростовом субстрате для микробных клеток, при добавлении в концентрации 1000 ppm (частей на миллион); предпочтительно при добавлении в концентрации 500 ppm; более предпочтительно при добавлении в концентрации 250 ppm; еще более предпочтительно при добавлении в концентрации 100 ppm; наиболее предпочтительно при добавлении в концентрации 50 ppm; и, в особенности, при добавлении в концентрации 25 ppm.
Полипептиды с антимикробной активностью могут обладать способностью снижать количество живых клеток Bacillus subtilis (ATCC 6633) до 1/100 через 24 часа (предпочтительно через 12 часов, более предпочтительно через 8 часов, более предпочтительно через 4 часа, более предпочтительно через 2 часа, наиболее предпочтительно через 1 час, и, в особенности, через 30 минут) инкубации при 20°C в водном растворе 25% (мас./мас.); предпочтительно в водном растворе 10% (мас./мас.); более предпочтительно в водном растворе 5% (мас./мас.); еще более предпочтительно в водном растворе 1% (мас./мас.); наиболее предпочтительно в водном растворе 0,5% (мас./мас.); и, в особенности, в водном растворе 0,1% (мас./мас.) полипептидов, обладающих антимикробной активностью.
Полипептиды с антимикробной активностью также обладают способностью подавлять разрастание Bacillus subtilis (ATCC 6633) в течение 24 часов при 25°C в ростовом субстрате для микробных клеток, при добавлении в концентрации 1000 ppm; предпочтительно при добавлении в концентрации 500 ppm; более предпочтительно при добавлении в концентрации 250 ppm; еще более предпочтительно при добавлении в концентрации 100 ppm; наиболее предпочтительно при добавлении в концентрации 50 ppm; и, в особенности, при добавлении в концентрации 25 ppm.
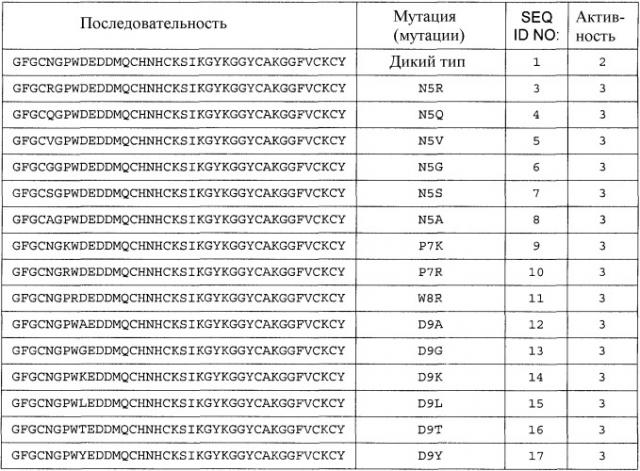
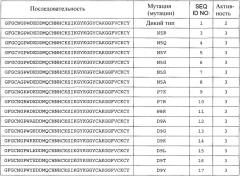
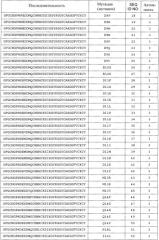
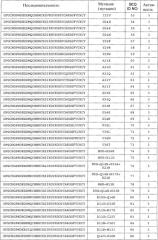
Полипептиды по настоящему изобретению имеют по меньшей мере 20%, предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 90%, наиболее предпочтительно по меньшей мере 95%, и даже еще более предпочтительно по меньшей мере 100% антимикробную активностью полипептида, состоящего из последовательности аминокислот, показанной в виде аминокислот с 1 по 40 любой из последовательностей с SEQ ID NO:3 по SEQ ID NO:225 или любой из последовательностей с SEQ ID NO:226 по SEQ ID NO:251, или любой из последовательностей с SEQ ID NO:252 по SEQ ID NO:274.
Дефенсин: используемый здесь термин «дефенсин» относится к полипептидам, определяемым специалистом в данной области как принадлежащие к антимикробным пептидам класса дефенсинов. Для определения, является ли полипептид по изобретению дефенсином, аминокислотную последовательность предпочтительно сравнивают с профилями скрытой марковской модели (HMM профили) базы данных PFAM, используя широкодоступное программное обеспечение HMMER (смотри Пример 7).
PFAM семейства дефенсинов включают в себя Дефенсин_1 или «дефенсин млекопитающих» (регистрационный номер PF00323), Дефенсин_2 или «дефенсин членистоногих» (регистрационный номер PF01097), Дефенсин_бета или «бета-дефенсин» (регистрационный номер PF00711), Дефенсин_пропеп или «пропептид дефенсина» (регистрационный номер PF00879) и гамма-тионин или «семейство гамма-тионина» (регистрационный номер PF00304).
Дефенсины могут принадлежать классу альфа-дефенсинов, классу бета-дефенсинов, классу тета-дефенсинов, классам дефенсинов насекомых или членистоногих, или классу дефенсинов растений.
В варианте осуществления изобретения аминокислотная последовательность дефенсина по изобретению включает в себя 4, 5, 6, 7 или 8 остатков цистеина, предпочтительно 4, 5 или 6 остатков цистеина, более предпочтительно 4 или 6 остатков цистеина, и наиболее предпочтительно 6 остатков цистеина.
Дефенсины также могут быть синтетическими дефенсинами, имеющими общие характерные признаки дефенсина любого класса.
Примеры таких дефенсинов включают в себя, но не только, α-дефенсин HNP-1 (нейтрофильный пептид человека) HNP-2 и HNP-3; β-дефенсин-12, дрозомицин, гелиомицин, γ1-пуротионин, дефенсин А насекомых и дефенсины, описанные в заявках PCT WO 99/53053, WO 02/06324, WO 02/085934, PCT/DK2005/000725, PCT/DK2005/000735 и PCT/DK2006/000155.
Выделенный полипептид: используемый здесь термин «выделенный полипептид» относится к полипептиду, который является чистым по меньшей мере на 20%, предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 60%, еще более предпочтительно по меньшей мере на 80%, наиболее предпочтительно по меньшей мере на 90%, и даже еще более предпочтительно по меньшей мере на 95%, по данным SDS-PAGE.
По существу чистый полипептид: термин «по существу чистый полипептид» здесь означает полипептидный препарат, который максимально содержит 10%, предпочтительно максимально 8%, более предпочтительно максимально 6%, более предпочтительно максимально 5%, более предпочтительно максимально 4%, максимально 3%, еще более предпочтительно максимально 2%, наиболее предпочтительно максимально 1%, даже еще более предпочтительно максимально 0,5% по массе другого полипептидного вещества, с которым он нативно связан. То есть, следовательно, предпочтительно, чтобы по существу чистый полипептид был чистым по меньшей мере на 92%, предпочтительно по меньшей мере на 94%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 96%, более предпочтительно по меньшей мере на 96%, более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 98%, еще более предпочтительно по меньшей мере на 99%, наиболее предпочтительно по меньшей мере на 99,5%, даже еще более предпочтительно на 100% по массе всего полипептидного вещества, присутствующего в препарате.
Полипептиды по настоящему изобретению предпочтительно находятся по существу в чистой форме. В частности, предпочтительно, чтобы полипептиды были в «преимущественно чистой форме», т.е. чтобы полипептидный препарат был преимущественно свободным от других полипептидных веществ, с которыми он нативно связан. Это можно осуществить, например, путем получения полипептида с помощью хорошо известных рекомбинантных способов или классических способов очистки.
Здесь термин «по существу чистый полипептид» является синонимом терминам «выделенный полипептид» и «полипептид в выделенной форме».
Вариант: термин «вариант» здесь определяется как антимикробный полипептид, содержащий одно или несколько изменений, таких как замены, вставки, делеции и/или усечения одного или нескольких определенных аминокислотных остатков в одном или нескольких определенных положениях полипептида.
Нумерация вариантов: в настоящем изобретении в вариантах антимикробных полипептидов используется определенная нумерация положений аминокислотных остатков. Например, путем выравнивания аминокислотных последовательностей известных антимикробных полипептидов, любому аминокислотному остатку возможно присвоить номер положения аминокислоты в антимикробном полипептиде.
Используя систему нумерации, которая берет начало из аминокислотной последовательности антимикробного полипептида, представленной в SEQ ID NO:1, выровненную с аминокислотной последовательностью ряда других антимикробных полипептидов, возможно указать положение аминокислотного остатка в антимикробном полипептиде в областях структурной гомологии.
Многочисленные выравнивания последовательностей белков могут быть сделаны, например, с использованием «Clustal W» (Thompson, J.D., Higgins, D.G. and Gibson, T.J., 1994, CLUSTAL W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, positions-specific gap penalties and weight matrix choice, Nucleic Acids Research 22: 4673-4680). Многочисленные выравнивания последовательностей ДНК могут быть сделаны с использованием выравнивания белка в качестве матрицы, заменяя аминокислоты соответствующего кодона из ДНК последовательности.
Алгоритмы попарного сравнения последовательностей, принятые повсеместно, приспособлены для выявления совпадений между белковыми последовательностями, которые не отклоняются от участка идентичности последовательности приблизительно на 20-30% (Doolittle, 1992, Protein Sci. 1: 191-200; Brenner et al., 1998, Proc. Natl. Acad. Sci. USA 95, 6073-6078). Однако истинно гомологичные белки с одинаковой укладкой и сходными биологическими функциями зачастую отклонялись к участку, где традиционным, основанным на последовательностях, сравнением не удается обнаружить их родство (Lindahl and Elofsson, 2000, J. Mol. Biol. 295: 613-615). Большая точность поиска, основанного на последовательностях, может быть достигнута с использованием программ поиска, в которых используются вероятностные представления семейств белка (профили) для поисковых баз данных. Например, в программе PSI-BLAST профили генерируются через повторяющийся процесс поиска по базе данных, и эта программа способна выявлять отдаленные гомологи (Atschul et al., 1997, Nucleic Acids Res. 25: 3389-3402). Еще большая точность может быть достигнута, если семейство или суперсемейство для белка, представляющего интерес, имеет одного или нескольких типичных представителей в базах данных белковых структур. В таких программах, как GenTHREADER (Jones 1999, J. Mol. Biol. 287: 797-815; McGuffin and Jones, 2003, Bioinformatics 19: 874-881), используется информация из целого ряда источников (PSI-BLAST, прогнозирование вторичной структуры, профили структурных выравниваний и потенциалы сольватации) в качестве вводимых данных в нейросеть, которая прогнозирует структурную укладку для заданной последовательности. Подобным образом способ по Gough et al., 2000, J. Mol. Biol. 313: 903-919 может быть использован для выравнивания последовательности неизвестной структуры с моделями суперсемейств, которые находятся в базе данных SCOP. Эти выравнивания в свою очередь могут быть использованы для генерации гомологичных моделей для белка, представляющего интерес, и такие модели для точности можно оценивать с использованием разнообразных инструментов, разработанных для этой цели.
Для выведения и получения структурных выравниваний белков известной структуры доступно несколько инструментов и ресурсов. Например, суперсемейства белков SCOP сруктурно выравнивали, и эти выравнивания открыты для доступа и могут быть загружены. Эти выравнивания могут быть использованы для прогноза структурно и функционально соответствующих аминокислотных остатков в белках в пределах одного и того же структурного суперсемейства. Эта информация, помимо информации, полученной от моделирования гомологов и поиска по профилю, может быть использована для прогнозирования, какие остатки должны мутировать при перемещении мутаций, представляющих интерес, от одного белка к близкому или отдаленному гомологу.
В описании различных вариантов антимикробных полипептидов по настоящему изобретению описанная ниже номенклатура приспособлена для простоты приведения ссылки. Во всех случаях используется принятая IUPAC однобуквенная или трехбуквенная аббревиатура аминокислоты.
Для аминокислотной замены используется следующая номенклатура: исходная аминокислота, положение, замещенная аминокислота (аминокислоты). Соответственно, замена треонина аланином в положении 226 обозначается как «T226A»; а замена тирозина на тирозин и аргинин в положении 40 (фактически добавление аргинина после тирозина) обозначается как «Y40YR». Множественные мутации разделяются дополнительными знаками («+»), например, «G205R + S411F», представляя мутации в положениях 205 и 411 замены глицина (G) аргинином (R) и серина (S) фенилаланином (F) соответственно.
Родительский антимикробный полипептид: используемый здесь термин «родительский» антимикробный полипептид означает антимикробный полипептид, с которым были произведены модификации, например замена (замены), вставка (вставки), делеция (делеции) и/или усечение (усечения) для получения вариантов антимикробного полипептида по настоящему изобретению. Этот термин также относится к полипептиду, с которым вариант сравнивают или выравнивают. Родительский полипептид может быть природным (дикого типа) или это может быть даже его вариантом, полученным любым подходящим способом. Например, родительский белок может быть вариантом природного полипептида, аминокислотная последовательность которого была модифицирована или изменена. Родительский полипептид также может быть аллельным вариантом, который представляет собой полипептид, кодируемый любой из двух или нескольких альтернативных форм гена, занимающего тот же хромосомный локус.
Идентичность: родство между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывается критерием «идентичность».
Для целей настоящего изобретения степень идентичности между двумя аминокислотными последовательностями определяется с использованием программы FASTA, включенной в версии 2.0x программного пакета FASTA (смотри W. R. Pearson и D. J. Lipman (1988), «Improved Tools for Biological Sequence Analysis», PNAS 85:2444-2448; и W. R. Pearson (1990) «Rapid and Sensitive Sequence Comparison with FASTP and FASTA», Methods in Enzymology 183:63-98). Используемая матрица выставления баллов представляла собой BLOSUM50, штраф за разрыв составлял -12, штраф за продолжение делеции составлял -2.
Степень идентичности между двумя нуклеотидными последовательностями определяется с использованием того же алгоритма и программного обеспечения, которые описаны выше. Используемая матрица баллов представляла собой матрицу идентичности, штраф за разрыв составлял -16, а штраф за продолжение делеции составлял -4.
Альтернативно, выравнивание двух аминокислотных последовательностей определяется с помощью программы Needle из пакета EMBOSS (http://emboss.org) версии 2.8.0. Программа Needle обеспечивает выполнение алгоритма глобального выравнивания, описанного у Needleman, S. B. и Wunsch, C. D. (1970) J. Mol. Biol. 48, 443-453. Используемая матрица замен представляла собой BLOSUM62, штраф на внесение делеции составляет 10, и штраф на продолжение делеции составляет 0,5. Степень идентичности между аминокислотной последовательностью по настоящему изобретению (такой как аминокислоты с 1 по 40 SEQ ID NO:1) и другой аминокислотной последовательностью вычисляют как число точных соответствий в выравнивании двух последовательностей, разделенное на длину (число аминокислотных остатков) последовательности по настоящему изобретению; или, альтернативно, выходные данные программы Needle, отмеченные «наиболее длинной идентичностью», используют как процент идентичности и вычисляют следующим образом: (идентичные остатки × 100)/(длина выравнивания - число разрывов в выравнивании). Результаты выражают в процентах идентичности.
Полипептидный фрагмент: термин «полипептидный фрагмент» определяется здесь как полипептид, имеющий одну или несколько аминокислот, удаленных с амино- и/или карбоксильного конца SEQ ID NO:2 или последовательностей, гомологичных ей, где этот фрагмент обладает антимикробной активностью.
Субпоследовательность: термин «субпоследовательность» определяется здесь как нуклеотидная последовательность, имеющая один или несколько нуклеотидов, удаленных с 5' и/или 3' конца SEQ ID NO:1 или последовательности, гомологичной ей, где эта субпоследовательность кодирует полипептидный фрагмент, обладающий антимикробной активностью.
Аллельный вариант: термин «аллельный вариант» здесь обозначает любую из двух или более альтернативных форм гена, занимающего тот же хромосомный локус. Аллельный вариант возникает в природе посредством мутации и может в результате приводить к полиморфизму в пределах популяций. Мутации генов могут быть молчащими (без изменения кодируемого полипептида) или могут кодировать полипептиды, имеющие измененные аминокислотные последовательности. Аллельным вариантом полипептида является полипептид, кодируемый аллельным вариантом гена.
По существу чистый полинуклеотид: используемый здесь термин «по существу чистый полинуклеотид» относится к полинуклеотидному препарату, свободному от других посторонних или нежелательных нуклеотидов и в форме, подходящей для использования в системах получения генно-инженерных белков. Следовательно, по существу чистый полинуклеотид максимально содержит 10%, предпочтительно максимально 8%, более предпочтительно максимально 6%, более предпочтительно максимально 5%, более предпочтительно максимально 4%, более предпочтительно максимально 3%, еще более предпочтительно максимально 2%, наиболее предпочтительно максимально 1%, даже еще более предпочтительно максимально 0,5% по массе другого полинуклеотидного вещества, с которым он нативно связан. По существу чистый полинуклеотид, однако, может включать в себя встречающиеся в природе 5' и 3' нетранслируемые области, такие как промоторы и терминаторы. Предпочтительно, чтобы по существу чистый полинуклеотид был чистым по меньшей мере на 90%, предпочтительно по меньшей мере на 92%, более предпочтительно по меньшей мере на 94%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 96%, более предпочтительно по меньшей мере на 97%, еще более предпочтительно по меньшей мере на 98%, наиболее предпочтительно по меньшей мере на 99%, даже еще более предпочтительно по меньшей мере на 99,5% по массе. Полинуклеотиды по настоящему изобретению предпочтительно находятся по существу в чистой форме. В частности, предпочтительно, чтобы полинуклеотиды, описанные здесь, находились в «преимущественно чистой форме», то есть, чтобы полинуклеотидный препарат был по существу свободным от другого полинуклеотидного вещества, с которым он нативно связан. Здесь термин «по существу чистый полинуклеотид» является синонимом терминам «выделенный полинуклеотид» и «полинуклеотид в изолированной форме». Полинуклеотиды могут быть геномными, кДНК, РНК, полусинтетического происхождения или представлять собой любую их комбинацию.
кДНК: термин «кДНК» здесь определяется как молекула ДНК, которая может быть получена путем обратной транскрипции из зрелой, сплайсированной молекулы мРНК из эукариотической клетки. кДНК лишена последовательностей интронов, которые обычно присутствуют в соответствующей геномной ДНК. Исходный, первичный РНК транскрипт является предшественником мРНК, который процессируется серией стадий до того, как предстанет в виде зрелой сплайсированной мРНК. Эти стадии включают в себя удаление интронных последовательностей, с помощью процесса, называемого сплайсингом. кДНК, полученная из мРНК, следовательно, лишена каких-либо интронных последовательностей.
Конструкция нуклеиновой кислоты: используемый здесь термин «конструкция нуклеиновой кислоты» относится к молекуле нуклеиновой кислоты, либо одно-, либо двухцепочечной, которая выделена из природного гена или которая модифицирована, чтобы содержать сегменты нуклеиновых кислот, таким образом, что иначе она не существовала бы в природе. Термин «конструкция нуклеиновой кислоты» является синонимом термину «экспрессионная кассета», когда конструкция нуклеиновой кислоты содержит контрольные последовательности, необходимые для экспрессии кодирующей последовательности по настоящему изобретению.
Контрольная последовательность: термин «контрольная последовательность» определен здесь для включения всех компонентов, которые необходимы или являются благоприятными для экспрессии полинуклеотида, кодирующего полипептид по настоящему изобретению. Каждая контрольная последовательность может быть нативной или чужеродной для нуклеотидной последовательности, кодирующей этот полипептид. Такие контрольные последовательности включают в себя, но не только, лидерную последовательность, последовательность полиаденилирования, последовательность пропептида, промоторную, сигнальную пептидную последовательность и терминатор транскрипции. Минимально контрольные последовательности включают в себя промотор и стоп-сигналы транскрипции и трансляции. Контрольные последовательности могут быть снабжены линкерами с целью введения специфических сайтов рестрикции, облегчающих лигирование контрольных последовательностей с кодирующей областью нуклеотидной последовательности, кодирующей полипептид.
Оперативно связанный: термин «оперативно связанный» здесь означает конфигурацию, в которой контрольная последовательность расположена в соответствующем положении относительно кодирующей полинуклеотидной последовательности, таким образом, что контрольная последовательность направляет экспрессию кодирующей последовательности полипептида.
Кодирующая последовательность: при использовании здесь термин «кодирующая последовательность» означает нуклеотидную последовательность, которая непосредственно определяет аминокислотную последовательность ее белкового продукта. Границы кодирующей последовательности в основном определяются открытой рамкой считывания, которая обычно начинается стартовым кодоном ATG или альтернативными стартовыми кодонами, такими как GTG и TTG. Кодирующая последовательность может представлять собой ДНК, кДНК или рекомбинантную нуклеотидную последовательность.
Экспрессия: термин «экспрессия» включает в себя любую стадию, вовлеченную в продукцию полипептида, включая, но не ограничиваясь, транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
Вектор экспрессии: термин «вектор экспрессии» здесь определяется как линейная или кольцевая молекула ДНК, которая содержит полинуклеотид, кодирующий полипептид по изобретению и которая оперативно связана с дополнительными нуклеотидами, которые обеспечивают ее экспрессию.
Клетка-хозяин: используемый здесь термин «клетка-хозяин» включает в себя клетки любого типа, которые поддаются трансформации, трансфекции, трансдукции и подобному конструкцией нуклеиновой кислоты, содержащей полинуклеотид по настоящему изобретению.
Модификация: термин «модификация» здесь означает любую химическую модификацию полипептида, состоящего из аминокислот с 1 по 40 любой из последовательностей с SEQ ID NO:2 - SEQ ID NO: 225, или любой из последовательностей с SEQ ID NO:226 по SEQ ID NO:251, или любой из последовательностей с SEQ ID NO:252 по SEQ ID NO:274, а также генетические манипуляции с ДНК, кодирующей этот полипептид. Модификация (модификации) могут представлять собой замену (замены), делецию (делеции) и/или вставку (вставки) аминокислот(ы), а также замену (замены) в боковой цепи (боковых цепях) аминокислот; или использование неприродных аминокислот со сходными характеристиками в аминокислотной последовательности. В частности, модификация (модификации) могут представлять собой амидирования, например амидирование С-конца.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Полипептиды, обладающие антимикробной активностью
В первом аспекте настоящее изобретение относится к полипептиду, обладающему антимикробной активностью, который содержит, предпочтительно, состоит из аминокислотной последовательности, которая по меньшей мере на 70% идентична (предпочтительно по меньшей мере на 80% идентична, более предпочтительно по меньшей мере на 85% идентична, еще более предпочтительно по меньшей мере на 90% идентична, еще более предпочтительно по меньшей мере на 95% идентична, наиболее предпочтительно на 97% идентична, и, в частности на 100% идентична) аминокислотам с 1 по 40 аминокислотной последовательности (I):
G-X1-G-C-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-C-H-X12-X13-C-X14-X15-X16-X17-X18-X19-X20-G-G-X21-C-X22-X23-X24-X25-X26-X27-C-X28-C-X29;
где
X1=F, L, W или I; предпочтительно X1=F;
X2=N, R, Q, V, G, S, A, K, L, M, D, H или Y; предпочтительно X2=N, R, Q, V, G, S, A, K или Y; более предпочтительно X2=N, R, S или G;
X3=G, R, A или K; предпочтительно X3=G;
X4=P, A, L, V, K или R; предпочтительно X4=P, K или R;
X5=W или R;
X6=D, A, G, K, L, T, N, F, H, M, P, Q, S, C, I, R, V или Y; предпочтительно X6=D, A, G, K, L, T, N, F, H, M, P, Q, S, V или Y; более предпочтительно X6=D, S, A, G или N;
X7=E, G, A, L, C, Q или S; предпочтительно X7=E, G или S;
X8=D, F, G, N, V, Y, H, K, L, P, S, T, W, I, M, A, C или R; предпочтительно X8=D, F, G, N, V, Y, H, K, L, P, S, T, W, I, M или R; более предпочтительно X8=D, G или N;
X9=D или P; предпочтительно X9=D;
X10=M, R, S, V, A, F, G, L, T, Y, W, E или K; предпочтительно X10=M, R, S, V, G, Y, L, F, T, W или K; более предпочтительно X10=M, L, G или V;
X11=Q, R, L, F, G, H, S, A, C, I, K, M, P, T, V, W или Y; предпочтительно X11=Q, R, L, F, G, H, S, K или Y; более предпочтительно X11=Q, K, R или F;
X12=N, R, I, Y, V, K, T, Q, S, F, A, W, E или H; более предпочтительно X12=N, R, V или Q;
X13=H, A, F, Q, T, V или L; предпочтительно X13=H или L;
X14=K, Q или R; предпочтительно X14=K или R;
X15=S, A, V, N или F;
X16=I, L, M, T, W или V; предпочтительно X16=I, L или V;
X17=K, T или R;
X18=G, H, K, A, P, F, I, Q, R, S, T, Y или N; предпочтительно X18=G, H, R, K или N; более предпочтительно X18=G или R;
X19=Y, H, K, L, M, N, Q, S, V или R; предпочтительно X19=Y или R;
X20=K, F, H, T, C или R; предпочтительно X20=K или R;
X21=Y, F, R, A, H, L, M, S или W; предпочтительно X21=Y, F, R или W;
X22=A, K, N, Q, T, E, H, I, R, S, V, G или Y; предпочтительно X22=A, K, N, Q, T, S или Y; более предпочтительно X22=A, S или T;
X23=K, R или T; предпочтительно X23=K или R;
X24=G, K, Q, E, N, S, T, A или R; предпочтительно X24=G, K, Q, A или R; более предпочтительно X24=G или A;
X25=G, K, H, W или R; предпочтительно X25=G, K или R;
X26=F, A, H, I, M, V, W, R или L; предпочтительно X26=F или L;
X27=V, L, M, I, K, Q, R или T; предпочтительно X27=V, L, M или T; более предпочтительно X27=V или L;
X28=K, H, N или R; предпочтительно X28=K или R;
X29=Y, I, YRCG или YR; предпочтительно X29=Y или YR;
и которая менее чем на 100% идентична аминокислотам с 1 по 40 SEQ ID NO:1.
В варианте осуществления полипептид по изобретению представляет собой полипептид, обладающий антимикробной активностью, который содержит, предпочтительно, состоит из аминокислотной последовательности, которая имеет по меньшей мере 70% идентичность (предпочтительно по меньшей мере 80% идентичность, более предпочтительно по меньшей мере 85% идентичность, еще более предпочтительно по меньшей мере 90% идентичность, еще более предпочтительно по меньшей мере 95% идентичность, наиболее предпочтительно 97% идентичность, и в частности 100% идентичность) аминокислотам с 1 по 40 аминокислотной последовательности (II):
G-F-G-C-X1-G-X2-X3-X4-X5-X6-D-X7-X8-C-H-X9-X10-C-X11-S-X12-X13-X14-X15-X16-G-G-X17-C-X18-K-X19-X20-X21-X22-C-K-C-X23;
где
X1=N, R, Q, V, G, S, A, K или Y; предпочтительно X1=N, R, S или G;
X2=P, K или R;
X3=W или R;
X4=D, A, G, K, L, T, N, F, H, M, P, Q, S, V или Y; предпочтительно X4=D, S, A, G или N;
X5=E, G или S;
X6=D, F, G, N, V, Y, H, K, L, P, S, T, W, I, M или R; предпочтительно X6=D, G или N;
X7=M, R, S, V, G, Y, L, F, T, W или K; предпочтительно X7=M, L, G или V;
X8=Q, R, L, F, G, H, S, K или Y; предпочтительно X8=Q, K, R или F;
X9=N, R, I, Y, V, K, T, S, Q или H; предпочтительно X9=N, R, V или Q;
X10=H или L;
X11=K или R;
X12=I, L или V;
X13=K или R;
X14=G, H, R, K или N; предпочтительно X14=G или R;
X15=Y или R;
X16=K или R;
X17=Y, F, R или W;
X18=A, K, N, Q, T, S или Y; предпочтительно X18=A, S или T;
X19=G, K, Q, A или R; предпочтительно X19=G или A;
X20=G, K или R;
X21=F или L;
X22=V, L, M или T; предпочтительно X22=V или L;
X23=Y или YR;
и которая имеет менее 100% идентичность аминокислотам с 1 по 40 SEQ ID NO:1.
В другом варианте осуществления аминокислотная последовательность (I) и/или (II) имеет 1, 2, 3, 4, 5, 6, 7 или 8 аминокислотных отличий по сравнению с аминокислотной последовательностью SEQ ID NO:1. Предпочтительно 1, 2, 3, 4, 5 или 6; более предпочтительно 1, 2, 3, 4 или 5; еще более предпочтительно 1, 2, 3 или 4; еще более предпочтительно 1, 2 или 3; и наиболее предпочтительно 1 или 2 аминокислотных отличий по сравнению с аминокислотной последовательностью SEQ ID NO:1.
В другом варианте осуществления аминокислотная последовательность (I) и/или (II) имеет по меньшей мере 60% идентичность с аминокислотами с 1 по 40 SEQ ID NO:1, предпочтительно по меньшей мере 65% идентичность, по меньшей мере 70% идентичность, по меньшей мере 75% идентичность, по меньшей мере 80% идентичность, по меньшей мере 85% идентичность, по меньшей мере 90% идентичность, или по меньшей мере 95% идентичность с аминокислотами с 1 по 40 SEQ ID NO:1.
В другом варианте осуществления аминокислотная последовательность (I) и/или (II) имеет 0, 1, 2, 3, 4 или 5 вставок, предпочтительно 0, 1, 2 или 3 вставки, более предпочтительно 0, 1 или 2 вставки; и 0, 1, 2, 3, 4 или 5 делеций, предпочтительно 0, 1, 2 или 3 делеции, более предпочтительно 0, 1 или 2 делеции, по сравнению с SEQ ID NO:1, или любой из SEQ ID NO:3 - SEQ ID NO:225, или любой из SEQ ID NO:226 - SEQ ID NO:251, или любой из SEQ ID NO:252 - SEQ ID NO:274.
В другом варианте осуществления полипептид по изобретению содержит, предпочтительно, состоит из аминокислотной последовательности, которая по меньшей мере на 60% идентична (предпочтительно на 70% идентична, более предпочтительно на 80% идентична, еще более предпочтительно на 85% идентична, еще более предпочтительно на 90% идентична, еще более предпочтительно на 95% идентична, и наиболее предпочтительно на 100% идентична) аминокислотам с 1 по 40 любой из SEQ ID NO:3 - SEQ ID NO:225, или любой из SEQ ID NO:226 - SEQ ID NO:251, или любой из SEQ ID NO:252 - SEQ ID NO:274, предпочтительно любой из SEQ ID NO:3 - SEQ ID NO:117, или любой из SEQ ID NO:226 - SEQ ID NO:251, или любой из SEQ ID NO:252 - SEQ ID NO:274.
Термин «любая из SEQ ID NO:3 - SEQ ID NO:117» означает SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:45, SEQ ID NO:46, SEQ ID NO:47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:50, SEQ ID NO:51, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:56, SEQ ID NO:57, SEQ ID NO:58, SEQ ID NO:59, SEQ ID NO:60, SEQ ID NO:61, SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, S