Способ определения циркулирующих иммунных комплексов
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к иммунологическим и биохимическим методам исследования. Для дифференцированного определения в сыворотке крови уровня циркулирующих иммунных комплексов крупных и мелких размеров дополнительно исследуют осветленную кратким центрифугированием сыворотку крови на основе метода преципитации циркулирующих иммунных комплексов растворами ПЭГ-6000 с конечной концентрацией 4% и 6%. Затем регистрируют результаты методом турбидиметрии с использованием микропланшетного спектрофотометра в двухволновом режиме: основной -340 нм, референс-фильтр - 620 нм. Длительность инкубации при температуре +18-25°С составляет 15 минут. Использование способа позволяет повысить эффективность и надежность определения уровня крупных циркулирующих иммунных комплексов, воспроизводимость результатов, а также дифференцированно измерить уровень ЦИК мелких размеров, которые являются диагностически значимым показателем иммунологической реактивности организма человека при многих видах патологии, сократить объем анализируемых сывороток до 0,06 мл, а длительность инкубации до 15 минут. Способ пригоден для массовых клинических исследований. 2 ил., 1 табл.
Реферат
Изобретение относится к области медицины, а именно иммунологическим и биохимическим методам исследования параметров биологических субстратов, и может быть использовано в клинической лабораторной диагностике и научно-исследовательской работе для определения циркулирующих иммунных комплексов (ЦИК) в сыворотке крови человека.
Образование комплексов антиген-антитело (иммунных комплексов) - естественная иммунологическая реакция здорового организма, направленная на выведение чужеродного антигена и сохранение гомеостаза. При ревматологических, аутоиммунных, аллергических заболеваниях, а также инфекциях различной этиологии и новообразованиях отмечается повышение содержания ЦИК [Константинова Н.А. Иммунные комплексы и повреждение тканей. - М.: Медицина, 1996. - 256 с].
Известны следующие способы определения ЦИК в биологических жидкостях [Касали Р. и др. Иммунные комплексы и повреждение тканей: в кн. «Иммунологические аспекты инфекционных заболеваний». / Под ред. Дж.Дика, пер. с англ. А.С.Апта, В.И.Литвинова. - М: Медицина, 1982. - С.334-384]:
1 тип - антигенспецифические, основанные на выявлении ЦИК с известным антигеном за счет различий между свободным и связанным с антителами антигеном. В настоящее время они не нашли широкого применения, так как в большинстве случаев антиген, входящий в состав ЦИК, неизвестен или трудно определим.
2 тип - антигеннеспецифические методы. Нашли наибольшее распространение в клинических исследованиях и делятся на несколько основных групп:
1. Основанные на биологических свойствах иммунных комплексов.
1.1. Определение ЦИК при взаимодействии с комплементом, в частности общей комплементсвязывающей активности (КСА), реакции с Clq- или C3b-субкомпонентами (классический или альтернативный путь активации комплемента, соответственно) [Константинова Н.А., Лаврентьев В.В., Ковальчук Л.В., Петров Р.В. Определение циркулирующих иммунных комплексов у человека. // Лабораторное дело. - 1982. - №11. - С.673-675; Патент №2343484, G01N 33/50 по Заявке №2005129801/15 от 28.09.2005, опубликовано 10.01.2009 «Способ определения циркулирующих иммунных комплексов»; Патент №2006125176, G01N 33/53, G01N 33/564 по заявке №2006125176/15 от 13.07.2006, опубликовано 10.07.2008 «Способ и набор иммуноферментного определения комплементсвязывающих циркулирующих иммунных комплексов»]. Растворение ЦИК под действием комплемента является очень важным процессом удаления их из организма. Однако определяющим фактором при измерении КСА является размер ЦИК, мелкие ЦИК не солюбилизируются под действием комплемента даже при значительном его избытке в растворе. Присутствие в крови комплексов С3-IgG можно рассматривать как продукт активации комплемента, но не как доказательство наличия ЦИК в крови. IgA и IgE не имеют эффекторных центров для C1q. Недостатком разработанных до настоящего времени тестов, в том числе ИФА, является возможность перекрестного взаимодействия с ДНК, эндотоксином, ревматоидным фактором, C-реактивным белком, различными полисахаридами, что существенно снижает их диагностическую специфичность и чувствительность. Наряду с этим ограничивает их использование и тот факт, что диагностическое значение определения C1q или C3b при определенной патологии различны. Так, в подавляющем большинстве случаев у больных с ревматоидным артритом ЦИК содержат C1q, но не C3b, а при системной красной волчанке наоборот. Кроме того, не всегда активация системы комплемента необходима для развития повреждений, связанных с ЦИК, в частности при гломерулонефрите. А развитие иммунокомплексной патологии может стать следствием дефицита или снижения активности различных компонентов комплемента.
1.2. Определение ЦИК с использованием антииммуноглобулиновых антител, в частности ревматоидного фактора (РФ), позволяет выявить IgG-содержащие ЦИК в довольно широком диапазоне молекулярной массы комплексов. Основным их недостатком является получение ложноположительных результатов при наличии в исследуемом образце агрегированного IgG или собственного РФ.
1.3. Определение ЦИК при взаимодействии с рецепторами различных клеток. Наиболее известен метод с использованием клеток лимфобластной линии (клеток Raji), который позволяет определить небольшие ЦИК, несущие СЗb и отличается высокой чувствительностью и специфичностью, однако, трудоемкость и сложность технологии культивирования клеток ограничивают использование данной группы методов.
2. Методы, основанные на физико-химических свойствах ЦИК. Наибольшее число методов определения ЦИК разработано на основе использования линейного незаряженного полимера полиэтиленгликоля (ПЭГ) с молекулярной массой 6000, которые позволяют определять различные по молекулярной массе и размерам комплексы (прямо пропорционально концентрации ПЭГ), как комплементфиксирующие, так и не связывающие комплемент [Иммунологические методы. / Под ред. Г.Фримеля, пер. с нем. А.П.Тарасова. - М.: Медицина, 1987. - 472 с; Клиническая лабораторная аналитика. Частные аналитические технологии в клинической лаборатории. / Под ред. проф. В.В.Меньшикова. - М.: Лабинформ - РАМЛД, 1999. - 352 с; Клиническая иммунология: учебник для студентов мед. вузов / Под ред. А.В.Караулова. - М.: Медицинское информ. агентство, 1999. - 604 с; Патент №2107299, G01N 33/539 по заявке №94043266/14 от 07.12.1994, опубликовано 20.03.1998 «Способ определения циркулирующих иммунных комплексов в сыворотке крови»]. Показано, что увеличение содержания ЦИК в ПЭГ-преципитате коррелирует с некоторыми клиническими состояниями.
Наиболее близким к предлагаемому изобретению (прототипом) является метод преципитации из сыворотки крови (0,3 мл) комплексов антиген-антитело в 3,75% растворе ПЭГ-6000, приготовленном с использованием 0,1 М боратного буфера (pH 8,4), при комнатной температуре с последующим (через 60 мин) фотометрическим определением плотности преципитата при длине волны 450 нм [Гриневич Ю.А., Алферов А.Н. Определение иммунных комплексов в крови онкологических больных. // Лабораторное дело. - 1981. - №8. - с.493-496].
Недостатком метода является возможность определения концентрации ЦИК преимущественно крупного размера, в то время как наибольшим патогенным эффектом обладают мелкие комплексы. Кроме того, для исследования требуется достаточно большой объем сыворотки, что может иметь значение в частности при обследовании детей. А продолжительность и техническое обеспечение (спектрофотометр с кюветным отделением) метода снижают возможность одновременного исследования до единичных образцов.
Целью предлагаемого изобретения является совершенствование методов ПЭГ-преципитации для разработки скринингового теста определения в сыворотке крови уровня ЦИК как крупных, так и мелких размеров, характеризующегося надежностью, простотой, воспроизводимостью и возможностью широкого применения в клинической лабораторной практике.
Сущность предлагаемого изобретения заключается в том, что дополнительно осветляют сыворотку крови путем краткого центрифугирования, а измерение прироста мутности образца в присутствии ПЭГ с конечной концентрацией 4% для определения крупных ЦИК и 6% - для ЦИК мелких размеров проводят с использованием микропланшетного спектрофотометра в двухволновом режиме: основной - 340 нм, референс-фильтр - 620 нм, при этом длительность инкубации сокращают до 15 минут.
Технический результат заключается в том, что реализация предлагаемого изобретения позволяет, с одной стороны, повысить эффективность и надежность определения уровня крупных циркулирующих иммунных комплексов и воспроизводимость результатов, с другой стороны, - дифференцированно измерить уровень ЦИК мелких размеров, которые являются диагностически значимым показателем иммунологической реактивности организма человека при многих видах патологии. При этом использование предлагаемого способа дает возможность сократить объем анализируемых образцов до 0,06 мл, а длительность инкубации до 15 минут. Предлагаемый способ пригоден для массовых клинических исследований в качестве скринингового теста при выявлении лиц с иммунокомплексной патологией, а также наблюдения за изменением уровня ЦИК в процессе развития заболевания и эффективностью проводимого лечения.
Способ осуществляется следующим образом:
1. Подготовительный этап.
Готовят рабочие растворы: раствор 1 - забуференный физиологический раствор (pH 7,4); раствор 2-8% раствор ПЭГ (8,0 г ПЭГ - 6000+100,0 мл раствора 1); раствор 3-12% раствор ПЭГ (12,0 г ПЭГ - 6000+100,0 мл раствора 1).
Материалом для исследования служит сыворотка крови человека, полученная стандартно из капиллярной или венозной крови. Дополнительно сыворотку осветляют путем центрифугирования при 10000 об./мин в течение 2 мин. Для дальнейших исследований используют супернатант. Сыворотку исследуют в день забора крови, либо сразу замораживают и хранят при температуре не выше -16°C до 3 месяцев. Допускается однократное замораживание-оттаивание проб. Размораживают сыворотку быстро при температуре не выше 30°C. Для анализа требуется 0,06 мл сыворотки.
Перед исследованием все рабочие растворы и образцы сывороток выдерживают при температуре +18-25°C в течение 30 мин. Пробы тщательно перемешивают на вортексе до однородной консистенции.
От соблюдения этих условий зависит точность и воспроизводимость результатов исследования.
2. Ход анализа.
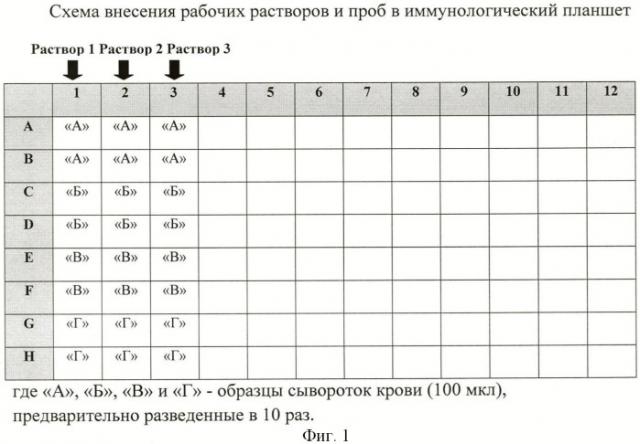
Сыворотки крови (30 мкл) предварительно разводят в 10 раз в растворе 1 (270 мкл), используя отдельный микропланшет (стрипы) для иммунологических исследований с объемом лунок не менее 300 мкл, при этом каждый образец дублируют.
В лунки стандартного 96-луночного планшета (стрипов) для иммунологических исследований вносят по 100 мкл рабочих растворов: во все лунки стрипа 1 - раствор 1; стрипа 2 - раствор 2; стрипа 3 - раствор 3; при необходимости заполняют следующие стрипы в аналогичной последовательности.
Используя восьмиканальный дозатор, в каждый стрип (1, 2, 3, соответственно) добавляют по 100 мкл предварительно разведенных сывороток, как изображено на фиг.1, при этом конечное разведение образца составляет - в 20 раз. Пипетируют содержимое лунок 3-4 раза в направлении от раствора 1 к раствору 3, не допуская образование пузырьков воздуха, и немедленно замечают время инкубации - 15 мин. Оставляют планшет, покрытый крышкой, при температуре +18-25°С.
3. Регистрация и оценка результатов.
Регистрируют данные с помощью микропланшетного спектрофотометра, измеряя оптическую плотность (ОП) в двухволновом режиме: основной - 340 нм, референс-фильтр - 620 нм.
Затем на основании полученных данных ОП рассчитывают уровень крупных и мелких циркулирующих иммунных комплексов (к[ЦИК] и м[ЦИК], соответственно), в усл. ед.:
к[ЦИК]=(ОП ср. р-р 2 - ОП ср. р-р 1)×1000;
м[ЦИК]=(ОП ср. р-р 3 - ОП ср. р-р 1)×1000,
где ОП ср. - среднеарифметическое значение оптической плотности образца.
Уровень ПИК оценивают дифференцированно для крупных и мелких размеров, сравнивая с нормативными показателями, полученными при исследовании предлагаемым способом сывороток первичных доноров крови (n≥30).
Пример конкретного осуществления способа:
У донора крови («А»), пациентов с хроническим гепатитом С (ХГС) («Б»), аутоиммунным гепатитом 2 типа (АИГ-2) («В») и системной красной волчанкой (СКВ) («Г») произвели забор венозной крови в объеме не менее 0,5 мл, из которой общепринятым способом получили сыворотку. Далее пробы дополнительно осветлили путем центрифугирования при 10000 об./мин в течение 2 мин. Полученный супернатант использовали для исследования в тот же день.
Рабочие растворы 1, 2 и 3 выдержали при температуре +18-25°С в течение 30 мин. Пробы тщательно перемешали с использованием вортекса.
Во все лунки стрипа для предварительного разведения сывороток внесли по 270 мкл раствора 1. Далее в первые две лунки добавили по 30 мкл образца сыворотки «А»; в следующие две лунки - образца «Б», затем «В» и после «Г».
Во все лунки рабочего стрипа 1 внесли по 100 мкл раствора 1, стрипа 2 - раствора 2, стрипа 3 - раствора 3. В каждый стрип с использованием восьмиканального дозатора перенесли по 100 мкл предварительно разведенных сывороток и пипетировали 3-4 раза, не допуская образование пузырьков воздуха, в направлении от стрипа 1 к стрипу 3. Оставили на 15 мин при температуре +18-25°С, накрыв крышкой.
Провели учет результатов на микропланшетном спектрофотометре в двухволновом режиме: основой - 340 нм, референс-фильтр - 620 нм.
Получили следующие значения оптической плотности (ОП):
| Образец сыворотки | Ряд | Раствор (стрип) | ||
| 1 | 2 | 3 | ||
| «А» | А | 0.045 | 0.067 | 0.177 |
| В | 0.048 | 0.070 | 0.174 | |
| «Б» | С | 0.070 | 0.079 | 0.276 |
| D | 0.069 | 0.077 | 0.268 | |
| «В» | Е | 0.050 | 0.094 | 0.280 |
| F | 0.054 | 0.091 | 0.283 | |
| «Г» | G | 0.113 | 0.180 | 0.399 |
| Н | 0.118 | 0.191 | 0.378 |
Рассчитали уровень циркулирующих иммунных комплексов, в усл.ед.:
| Образец «А»: | к[ЦИК]=(0.069-0.047)*1000=22; |
| м[ЦИК]=(0.176-0.047)*1000=129. | |
| Образец «Б»: | к[ЦИК]=(0.078-0.070)*1000=8; |
| м[ЦИК]=(0.272-0.070)*1000=202. | |
| Образец «В»: | к[ЦИК]=(0.093-0.052)*1000=41; |
| м[ЦИК]=(0.282-0.052)*1000=230. | |
| Образец «Г»: | к[ЦИК]=(0.186-0.116)*1000=70; |
| м[ЦИК]=(0.389-0.116)*1000=273. |
По данным собственных исследований предлагаемым способом сывороток первичных доноров крови (n=31) верхний допустимый предел нормативных показателей уровня циркулирующих иммунных комплексов составил для к[ЦИК] - 30 усл.ед., м[ЦИК] - 160 усл.ед.
В результате исследования в образцах сывороток крови больных АИГ-2 («В») и СКВ («Г») по сравнению с нормативными значениями выявили повышенное содержание наряду с крупными и мелких циркулирующих иммунных комплексов. А в сыворотке крови больного ХГС («Б») содержание циркулирующих иммунных комплексов по прототипу не превысило нормативный показатель, в то время как уровень ЦИК мелких размеров оказался значительно высоким, что сочеталось с тяжелым клиническим течением инфекции и внепеченочными проявлениями.
Таким образом, дополнительное осветление исследуемых сывороток крови путем краткого центрифугирования и конечное разведение в 20 раз наряду с использованием двухволнового режима измерения обеспечивают оптимальную чувствительность метода, точность и воспроизводимость результатов исследования. Выбор в пользу использования ПЭГ-6000 с конечной концентрацией 4% для выявления высокомолекулярных ЦИК (крупных размеров) и 6% - для наиболее полной преципитации средне- и низкомолекулярных ЦИК (мелких размеров), но, что важно, еще не свободного IgG, обоснован данными собственных исследований молекулярно-массового распределения полученных при различных концентрациях ПЭГ преципитатов ЦИК методом высокоэффективной жидкостной хроматографии. Кроме того, нами применен кинетический тип измерений прироста мутности образцов в процессе ПЭГ-преципитации, который позволил установить, что определение их уровня на основе данных, полученных при измерении по «конечной точке», согласно прототипу через 60 минут, является методически нецелесообразным. Представленные на фиг.2 кинетические кривые процесса ПЭГ-преципитации ЦИК в сыворотке крови в норме и при патологии, свидетельствуют о том, что, с одной стороны, как правило, значения ОП достигают максимальных величин и выходят на «плато» не позднее чем через 15 мин от момента внесения образца в раствор ПЭГ. С другой стороны, в отдельных образцах в интервале более 15 мин, независимо от концентрации ПЭГ, может наблюдаться спонтанная самоагрегация преципитированных ЦИК, что сопровождается просветлением среды, как это происходит в образце «В» (больной АИГ-2 типа), и приводит в итоге к регистрации неадекватных заниженных результатов. Данный феномен может быть обусловлен либо изначально особенностями состава и свойств ЦИК при определенном виде патологии, либо модификацией физико-химических характеристик ЦИК в ПЭГ-преципитате. Следовательно, продолжительность инкубации, не превышающая 15 минут, является оптимальной для получения методически корректных данных определения ЦИК методом ПЭГ-преципитации.
Доступность применения способа обеспечивается широким распространением в учреждениях практического здравоохранения типового оборудования для ИФА-исследований.
Способ разработан и апробирован в лаборатории иммунохимии ФГУН ННИИЭМ им.академика И.Н.Блохиной Роспотребнадзора.
Способ определения циркулирующих иммунных комплексов в сыворотке крови человека путем преципитации их раствором полиэтиленгликоля с молекулярной массой 6000 (ПЭГ-6000) с последующей регистрацией результатов методом турбидиметрии, отличающийся тем, что дополнительно сыворотку крови осветляют кратким центрифугированием, а измерение прироста мутности образца в присутствии раствора ПЭГ с конечной концентрацией 4% для определения крупных ЦИК и 6% - для ЦИК мелких размеров проводят с использованием микропланшетного спектрофотометра в двухволновом режиме (основной - 340 нм, референс-фильтр - 620 нм), при этом длительность инкубации составляет 15 мин.