Имидазохинолиновые соединения
Иллюстрации
Показать всеИзобретение относится к новым производным имидазохинолина или к их фармацевтически приемлемым солям, их таутомерам или фармацевтически приемлемым солям таутомеров, общей формулы I, где R1 представляет собой -NR6R7, -(CH2)mCH=CH(CH2)nR9, -(СН2)mС≡С(СН2)nR9 или -S(O)qR10; R2 представляет собой C1-6алкил или C1-6алкил, замещенный одной группой, выбранной из -ОН и -ОМе; каждый из R4 и R5 независимо представляет собой Н, С6арил-С1алкил или защитную группу; каждый из R6 и R7 независимо представляет собой Н, C1-6алкил, C1-6алкил, замещенный одной группой, выбранной из -ОН и -ОМе, C1-6алкокси-С1-2алкил или -(CH2)mCH=CH(CH2)nR9; каждый R9 независимо представляет собой Н, C1-6алкил, или С6-10арил; каждый R10 независимо представляет собой C1-3алкил или С6-10арил-С1-6алкил; каждое из m и n независимо равно 0 или 1; и каждое q независимо равно 0; при условии, что если R1 представляет собой -S-Me, то R2 не является изобутилом. Также изобретение относится к конкретным соединениям, к способам синтеза соединений формул II, V и XI, которые являются вариантами формулы I, к фармацевтической композиции на основе соединения формулы I и к композиции на основе соединения формулы I и дополнительной иммуногенной композиции или антигена. Технический результат: получены новые производные имидазохинолина, пригодные для модулирования иммунного ответа у субъекта. 7 н. и 30 з.п. ф-лы, 4 ил., 2 табл.
Реферат
Область настоящего изобретения
Изобретение, главным образом, относится к низкомолекулярным иммунопотенциаторам (SMIP), таким как новые имидазохинолиновые соединения, способные стимулировать или модулировать у субъекта иммунный ответ. Изобретение также относится к новым сочетаниям антигенов с иммунопотенциаторами, которые могут быть использованы в вакцинотерапии. В некоторых вариантах выполнения соединения могут быть использованы в качестве иммунотерапевтических средств при пролиферативных заболеваниях, инфекционных заболеваниях, аутоиммунных заболеваниях, аллергиях и/или астме.
Предшествующий уровень техники настоящего изобретения
При быстром росте количества и разнообразия заболеваний и небольшом количестве соответствующих терапевтических методов существует потребность в новом терапевтическом подходе. Такой подход должен быть меньше направлен на конкретные субстраты болезненного состояния и больше на усиление иммунного ответа на заболевание. Со времени открытия пенициллина, нацеленного на специфичные для бактерий клеточные стенки, не характерные для человека, модель современной медицины состояла в уничтожении субстратов болезненного состояния без воздействия на систему-хозяина. К сожалению, немногие терапевтические средства позволяли достигнуть этой задачи и еще более немногие остаются эффективными из-за обусловливающих резистентность мутаций. Применительно к злокачественным опухолям целями терапевтических разработок были положительно регулированные киназы. К сожалению, единственным недавно разработанным лекарственным средством, достигшим цели, является Gleevec, и, вероятно, не только благодаря своей ингибирующей киназы активности. Borg et al. J. Clin. Invest. 114:379-388 (2004).
Многие преимущества достигаются потенциированием иммунного ответа вместо или помимо ингибирования субстрата заболевания (или в противном случае, вызывается значительный ущерб). Одно преимущество является следствием того, что субстраты заболевания и хозяина обычно одинаковы, хотя, возможно, и положительно регулированы в болезненном состоянии. Например, противораковые средства, нацеленные на киназы, могут быть цитотоксичны и могут нарушать клеточные механизмы хозяина наряду с клеточными механизмами злокачественных клеток. Далее, максимальные переносимые дозы (MTD), необходимые для обеспечения эффективности лечения, могут вызывать нежелательные побочные эффекты и даже ослаблять иммунный ответ у пациента. Такие побочные эффекты могут обусловить необходимость прекращения лечения. Наоборот, что касается Gleevec, двойное действие, заключающееся в ингибировании bcr-abl при стимуляции иммунного ответа, вероятно, способствует его эффективности и переносимости, в особенности поскольку NК-клетки, стимулируемые введением Gleevec, независимо участвуют в регрессии опухоли. Такой синергический подход к регрессии злокачественных опухолей крайне эффективен. Альтернативно, цитотоксические средства, подавляющие иммунную систему, могут независимо способствовать болезненному состоянию, поскольку они могут ингибировать отдельные пути, которые могут быть вовлечены в процесс выздоровления.
Другим преимуществом иммунопотенциации является то, что оно создает платформу, не так легко обходимую обусловливающими резистентность мутациями. Если терапевтические цели, такие как конкретный субстрат в вирусном репликоне или киназа злокачественной клеточной линии, настолько поляризованы и специфичны (что может быть необходимо во избежание воздействия на клетки хозяина), одна точечная мутация в субстрате болезненного состояния может придать ему невосприимчивость к лекарственному средству, приводящую к появлению еще более стойких штаммов патогена в следующих поколениях.
Существует потребность в новых способах и механизмах лечения пациентов, страдающих заболеваниями, резистентными к либо не поддающимися должным образом лечению в соответствии со стандартными подходами, использующими средства, нацеленные на механизмы специфичного иммунного ответа в организме.
В патентах США №№4,547,511 и 4,738,971 раскрыты соединения для лечения заболеваний, восприимчивых к средствам, усиливающим клеточный иммунитет. Соединения, раскрытые в этих патентах, характеризуются общей формулой (а):
.
Однако, ни в одном из этих патентов не содержится сведений об использовании соединений формулы(а) в сочетании с антигенами.
В WO 98/55495 и WO 98/16247 описаны иммуностимулирующие олигонуклеотиды и полинуклеотиды. В опубликованной заявке на выдачу патента США №2002/0164341 описаны адъюванты, содержащие неметилированный динуклеотид CpG (CpG ODN) и отличный от нуклеиновой кислоты адъювант. В заявке на выдачу патента США №2002/0197269 описаны композиции, содержащие антиген, антигенный CpG-ODN, и поликатионный полимер. Каждая из этих ссылок включена сюда во всей полноте посредством ссылки и для любых целей считается полностью изложенной в настоящем описании.
В выданных патентах США №№4,689,338, 5,389,640, 5,268,376, 4,929,624, 5,266,575, 5,352,784, 5,494,916, 5,482,936, 5,346,905, 5,395,937, 5,238,944, 5,525,612, 6,083,505 и 6,110,929 и WO 99/29693 раскрыты имидазохинолиновые соединения общей структурной формулы (b) для использования в качестве "модификаторов иммунного ответа":
.
Каждая из этих ссылок включена сюда во всей полноте посредством ссылки и для любых целей считается полностью изложенной в настоящем описании.
В WO 03/097641 раскрыто применение определенных имидазохинолинов и их солей для лечения определенных зависимых от протеинкиназ заболеваний и для производства фармацевтических препаратов для лечения заболеваний.
Иммунный ответ на некоторые антигены, которые иначе слабо антигенны, может быть усилен использованием иммунопотенциаторов, известных как вакцинные адъюванты. Такие адъюванты усиливают иммунный ответ на специфичные антигены и, таким образом, представляют значительный интерес и составляют предмет исследований медицинского сообщества.
Исследования привели к созданию вакцин, содержащих антигенные эпитопы, получить которые ранее не представлялось возможным. Например, доступные в настоящее время вакцины-кандидаты содержат синтетические пептиды, являющиеся миметиками стрептококковых, гонококковых и малярийных антигенов. Эти очищенные антигены, как правило, являются слабыми антигенами, требующими адъювантов для индукции защитного иммунитета. К сожалению, стандартные вакцинные адъюванты обладают рядом недостатков, ограничивающих их общее применение и эффективность. Например, известно, что минеральное масло вызывает раздражение тканей и является потенциально онкогенным. Квасцы, единственный одобренный в Соединенных Штатах адъювант, также вызывают образование гранулем в месте прививки и, кроме того, не индуцируют эффективно клеточный иммунитет. Более того, многие доступные в настоящее время адъюванты имеют ограниченную применимость, поскольку содержат компоненты, не метаболизируемые в организме человека. Кроме того, приготовление большинства адъювантов сложно и может потребовать проведения времязатратных процедур, а в некоторых случаях - использования сложного и дорогостоящего оборудования для приготовления системы вакцины и адъюванта.
Иммунные адъюванты описаны в "Current Status of Immunological Adjuvants", Ann. Rev. Immunol., 1986, 4, pp.369-388, и "Recent Advances in Vaccine Adjuvants and Delivery Systems" Derek T.O'Hagan и Nicholas M.Valiante. См. также патенты США №№4,806,352; 5,026,543 и 5,026,546 для ознакомления с описанием различных вакцинных адъювантов, встречающимся в патентной литературе. Каждая из этих ссылок включена сюда во всей полноте посредством ссылки и для любых целей считается полностью изложенной в настоящем описании.
Были приложены усилия для идентификации новых иммуномодуляторов для использования в качестве адъювантов для вакцин и иммунотерапевтических средств, которые позволили бы преодолеть недостатки и изъяны стандартных иммуномодуляторов. В частности, был бы чрезвычайно желателен адъювантный состав, индуцирующий у человека и домашних животных мощные клеточные и гуморальные иммунные ответы на широкий спектр антигенов, но не вызывающий побочных эффектов, характерных для стандартных адъювантов и других иммуномодуляторов. Эта потребность может быть удовлетворена низкомолекулярными иммунопотенциаторами (SMIP), поскольку ставка на низкомолекулярные соединения позволяет использовать разнообразные соединения для селективного манипулирования иммунным ответом, необходимого для повышения терапевтического индекса иммуномодуляторов.
Существует потребность в новых средствах узкого действия с варьирующими способностями изменения уровней содержания и/или профилей продукции цитокинов иммунокомпетентными клетками человека. Соединения различной структуры зачастую индуцируют желаемый ответ посредством различных механизмов действия или с большей специфичностью к мишени, такой как дендритная клетка, модулируя силу ответа и снижая побочные эффекты после введения пациенту.
Иммуносупрессорный эффект цитостатических веществ сделал их применимыми для терапии аутоиммунных заболеваний, таких как рассеянный склероз, псориаз и некоторые ревматические заболевания. К сожалению, их благоприятный эффект должен перевешивать серьезные побочные эффекты, которые вынуждают использовать слишком низкие дозы. Кроме того, может потребоваться прекращение лечения.
Существует потребность в средствах и/или сочетаниях активных веществ, оказывающих значительно улучшенные цитостатические или цитотоксические эффекты по сравнению со стандартными цитостатическими средствами, например, винкристином, метотрексатом, цисплатином и т.д. При наличии таких средств и сочетаний могут стать доступны такие химиотерапевтические методы, в которых сочетаются повышенная эффективность со значительным ослаблением побочных эффектов и снижением терапевтических доз. Таким образом, такие средства и сочетанные терапевтические схемы способны обеспечить повышение терапевтической эффективности известных цитостатических лекарственных средств. В некоторых вариантах выполнения соединения согласно изобретению используют в сочетании с соединениями, оказывающими значительно улучшенный цитостатический или цитотоксический эффект по сравнению со стандартными цитостатическими средствами, вводимыми отдельно. Кроме того, клеточные линии, невосприимчивые к стандартному химиотерапевтическому лечению, также могут оказаться восприимчивыми к химиотерапии с использованием сочетаний активных веществ.
Настоящее изобретение относится к отдельным терапевтическим и профилактическим средствам для лечения болезненных состояний, характеризующихся другими иммунодефицитами, аномалиями или инфекциями, включая аутоиммунные заболевания и вирусные и бактериальные инфекции, восприимчивые к соединениям, обладающим способностью модулировать цитокины и/или TNF-α, такие как, помимо прочих, рассеянный склероз, болезнь Крона, HIV, HSV и HCV.
Существует потребность в терапевтических средствах с пониженной цитотоксичностью, которые служат для усиления естественных защитных механизмов хозяина от вирусных и бактериальных инфекций или от образования и прогрессирования опухолей. Настоящее изобретение относится к таким терапевтическим средствам и дополнительно обеспечивает другие родственные преимущества.
Краткое изложение сущности настоящего изобретения
Настоящее изобретение относится к новым иммунопотенциаторам, иммуногенным композициям, новым соединениям и фармацевтическим композициям и новым способам введения вакцины путем введения низкомолекулярных иммунопотенциаторов отдельно или в сочетании с антигенами и/или другими агентами. Изобретение дополнительно относится к новым соединениям и фармацевтическим композициям для использования в лечении злокачественных опухолей, предраковых состояний, аутоиммунных заболеваний, инфекционных заболеваний, аллергий и астмы. Изобретение дополнительно относится к применению соединений согласно изобретению в производстве лекарственных препаратов для использования в лечении злокачественных опухолей, предраковых состояний, аутоиммунных заболеваний, аллергий и астмы.
Имидазохинолиновые соединения, применимые в соответствии со способами и в композициях согласно изобретению, недороги в получении и просты для введения. Они обладают потенциалом для более высокой специфичности по сравнению с существующими иммуностимуляторами, обеспечивая таким образом повышенную эффективность и улучшенные профили безопасности.
Как адъюванты имидазохинолиновые соединения могут быть объединены с многочисленными антигенами и системами доставки с получением конечного вакцинного продукта.
Как иммунотерапевтические средства имидазохинолиновые соединения могут быть использованы отдельно или в сочетании с другими лекарственными средствами (например, противовирусными средствами, антибактериальными средствами, другими иммуномодуляторами или, в составе терапевтических вакцин, антигенами) для лечения хронических инфекций, таких как инфекции, вызванные вирусом иммунодефицита человека (HIV), вирусом гепатита С (HCV), вирусом гепатита В (HBV), вирусом простого герпеса (HSV) и Н.pylori, равно как и с лекарственными препаратами для замедления опухолевого роста или модуляции аномальной клеточной пролиферации, связанной с такими заболеваниями, как старческий кератоз, атипические и диспластические невусы или предраковые лентиго.
Имидазохинолиновые соединения согласно настоящему изобретению также нацелены на субстраты болезненного состояния, такие как, например, конкретные киназы, включая, помимо прочих, EGFr, c-Kit, bFGF, Kdr, CHK1, CDK, cdc-2, Akt, PDGF, PI3K, VEGF, PKA, PKB, src, c-Met, Аbl, Ras, RAF и МЕК.
Как иммунотерапевтические средства имидазохинолиновые соединения также могут быть использованы для лечения злокачественных опухолей либо отдельно, либо в сочетании с другими противораковыми терапевтическими средствами (например, химиотерапевтическими средствами, моноклональными антителами (mAb) или другими иммунопотенциаторами). Кроме того, некоторые имидазохинолины, обладающие способностью индуцировать выработку цитокинов типа 1 (например, IL-12, TNF-α и IFN), могут быть использованы для лечения аллергий и/или астмы благодаря их способности направлять иммунный ответ в более доброкачественные исходы. Имидазохинолиновые соединения могут быть использованы, например, для лечения инфекции бациллы Кальметта-Герена (BCG), холеры, чумы, брюшного тифа, инфекции вируса гепатита В, гриппа, инфекции инактивированного полиовируса, инфекции вируса бешенства, кори, эпидемического паротита, краснухи, пероральной инфекции полиовируса, желтой лихорадки, столбняка, дифтерии, инфекции Haemophilus influenzae типа b, менингококковой инфекции и пневмококковой инфекции. Имидазохинолиновые соединения могут быть использованы в количестве, эффективно подавляющем клеточную пролиферацию, для лечения злокачественных опухолей. Имидазохинолиновые соединения также могут быть использованы в количестве, эффективно подавляющем выработку цитокинов Тh2/типа 2, для коррекции аллергических/астматических иммунных ответов.
Некоторые варианты выполнения относятся к способам лечения злокачественных опухолей и/или предраковых состояний. В таких вариантах выполнения одно или несколько противораковых средств объединяют с одним или несколькими имидазохинолиновыми соединениями для замедления опухолевого роста у субъекта. Ряд подходящих противораковых средств предполагается использовать в способах согласно настоящему изобретению, и они более подробно описаны в следующем подробном раскрытии.
Другой вариант выполнения относится к способу ингибирования роста опухолевых клеток у субъекта. Способ предусматривает введение субъекту эффективной дозы сочетания, содержащего, по меньшей мере, один SMIP и моноклональное антитело (mAb). Сочетание более эффективно ингибирует рост таких клеток, чем отдельно вводимое mAb. В некоторых вариантах выполнения способов лечения злокачественных опухолей сочетанием субъекту вводят дополнительное SMIP соединение и/или mAb.
В некоторых вариантах выполнения способов и композиций согласно изобретению имидазохинолиновое соединение выбирают из одного или нескольких соединений из следующего перечня:
N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2,N2-диметил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-этил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-метил-1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-бутил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-бутил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-метил-1-(2-метилпропил)-N2-пентил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-метил-1-(2-метилпропил)-N2-проп-2-енил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
1-(2-метилпропил)-2-[(фенилметил)тио]-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-метилпропил)-2-(пропилтио)-1Н-имидазо[4,5-с]хинолин-4-амин;
2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этанол;
2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этилацетат;
4-амино-1-(2-метилпропил)-1,3-дигидро-2Н-имидазо[4,5-с]хинолин-2-он;
N2-бутил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-бутил-N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2,N2-диметил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
1-{4-амино-2-[метил(пропил)амино]-1Н-имидазо[4,5-с]хинолин-1-ил}-2-метилпропан-2-ол;
1-[4-амино-2-(пропиламино)-1Н-имидазо[4,5-с]хинолин-1-ил]-2-метилпропан-2-ол;
N4,N4-дибензил-1-(2-метокси-2-метмлпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
1-(4-амино-2-пропилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-азетидин-1-илимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-пирролидин-1-илимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-циклопропилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол или
1-(4-амино-2-изобутилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол.
Дополнительные варианты выполнения, способы и композиции, предположительно, применимые в соответствии с настоящим изобретением, раскрыты в заявках на выдачу патента США №10/814,480, 10/762,873, 60/582,654, 10/405,495 и 10/748,071, каждая из которых включена сюда во всей полноте посредством ссылки и для любых целей считается полностью изложенной в настоящем описании.
Раскрыты способы производства соединений и композиций, описанные в настоящем описании, а также применение имидазохинолинов в способах производства лекарственных препаратов для использования в способах согласно изобретению, и предполагается, что они подпадают под объем изобретения.
В каждом варианте выполнения настоящего изобретения соединения, такие как соединения формулы I, могут быть использованы для производства лекарственного препарата для усиления иммунного ответа на антиген.
Другие варианты выполнения относятся к применению соединений согласно изобретению в производстве лекарственного препарата для иммуностимуляции и другого агента, такого как антиген, для одновременного, раздельного или последовательного введения. Другой более конкретный вариант выполнения относится к применению для лечения или профилактики бактериальной или вирусной инфекции. Другой вариант выполнения относится к применению для лечения злокачественных опухолей. Другой вариант выполнения относится к применению для профилактики инфекции вируса гриппа, а антиген представляет собой поверхностный(ые) белок(ки) гемагглютинин и/или нейраминидазу.
Другие варианты выполнения относятся к фармацевтическим препарату или системе, содержащим (а) соединение (такое как соединение формулы I) согласно любому из аспектов/вариантов выполнения, раскрытых в настоящем описании; и (b) антиген, причем первый и второй агенты либо находятся в смеси, либо представляют собой отдельные композиции. В более конкретном варианте выполнения второй агент представляет собой поверхностный(ые) белок(ки) гемагглютинин и/или нейраминидазу. Более конкретно, агенты предназначены для одновременного, раздельного или последовательного введения. Другой более конкретный вариант выполнения относится к применению для профилактики инфекции. Другой вариант выполнения относится к применению для лечения злокачественных опухолей.
Другие варианты выполнения изобретения включают в себя варианты, описанные в следующем подробном раскрытии.
Краткое описание чертежей
На фиг.1 показана зависимость SMIP согласно настоящему изобретению TLR7 (фиг.1А) и TLR8 (фиг.1В).
На фиг.2А показаны результаты мультицитокиновых анализов эффективности SMIP на миеломоноцитарных клетках, ТНР-1.
На фиг.2В показаны результаты мультицитокиновых анализов эффективности SMIP на человеческих РВМС.
На фиг.2С показаны результаты мультицитокиновых анализов эффективности SMIP на мышиных спленоцитах.
На фиг.3 показана относительная расстановка активности SMIP на различных клеточных линиях.
На фиг.4 показана in vivo адъювантная активность соединений из примера 11 и примера 19, а именно, среднее геометрическое титров IgG2a специфичной против gp120 сыворотки через 2 недели после вторичной иммунизации мышей BALB/c, дважды иммунизированных gp120 HIV, введенным в MF59 +/- указанные SMIP (фиг.4А); среднее геометрическое титров IgG1 через 2 недели после вторичной иммунизации (фиг.4В) и ех vivo специфичные против gp120 Т-клеточные ответы селезенок, иссеченных из иммунизированных мышей (фиг.4С).
Подробное раскрытие изобретения
Заявители раскрыли способы стимуляции цитокиновой активности в клетках и иммунотерапевтические средства и/или вакцинные адъюванты, обеспечивающие эффективное лечение заболеваний, таких как заболевания, указанные в настоящем описании и очевидные специалисту в данной области техники.
В одном варианте выполнения изобретение относится к соединению формулы (I):
где
R1 представляет собой -NR6R7, -C(O)R8, -C(O)OR8, -C(O)NR6R7, -(CH2)mCH=CH(CH2)nR9, -(CH2)mC≡C(CH2)nR9 или -S(O)qR10;
R2 представляет собой Н, C1-6алкил, замещенный C1-6алкил, -(CH2)mCH=CH(CH2)nR9, -(CH2)mC≡C(CH2)nR9, -C(O)R8, -C(O)OR8, -C(O)NR6R7 или -S(O)qR10;
каждый R3 независимо представляет собой Н, C1-6алкил, замещенный C1-6алкил, C1-6алкокси, галоген, тригалогенметил, -NR6R7, -C(O)R8, -C(O)OR8 или -C(O)NR6R7;
каждый из R4 и R5 независимо представляет собой Н, C1-6алкил, С6-10арил-C1-6алкил или защитную группу;
каждый из R6 и R7 независимо представляет собой Н, C1-6алкил, замещенный C1-6алкил, C1-6алкокси, C1-6алкокси-C1-6алкил, С6-10арил, С6-10арил-С1-6алкил, С6-10арилокси-С1-6алкил, -(CH2)mCH=CH(CH2)nR9 или -(CH2)mC≡C(CH2)nR9; или
R6 и R7 вместе взятые образуют замещенную или незамещенную гетероциклильную группу;
каждый R8 независимо представляет собой Н, C1-6алкил или замещенный С1-6алкил;
каждый R9 независимо представляет собой Н, С1-6алкил, замещенный C1-6алкил, С2-6алкенил, С6-10арил, -СO2Н, -C(O)O-C1-6алкил или галоген;
каждый R10 независимо представляет собой C1-6алкил, замещенный C1-6алкил, С2-6алкенил, С6-10арил, С6-10арил-C1-6алкил, тригалогенметил или -NR6R7;
каждое из m и n независимо равно 0, 1, 2 или 3;
p равно 0, 1, 2 или 3; и
каждое q независимо равно 0, 1 или 2; или
его фармацевтически приемлемой соли, его таутомеру или фармацевтически приемлемой соли таутомера.
В некоторых вариантах выполнения, если q в составе R1 равно 0, a R10 в составе R1 представляет собой метил, так что если R1 представляет собой -S-Ме, то R2 не является изобутилом.
В другом варианте выполнения каждый из R4 и R5 представляет собой Н. В других вариантах выполнения каждый из R4 и R5 представляет собой Н, а p равно 0.
В другом варианте выполнения каждый из R4 и R5 представляет собой Н, а R1 представляет собой -NR6R7, -S(O)qR10, -C(O)NR6R7, -(CH2)mCH=CH(CH2)nR9 или -(CH2)mC≡C(CH2)nR9.
В другом варианте выполнения каждый из R4 и R5 представляет собой Н, а R1 представляет собой -NR6R7, где R6 и R7 независимо представляют собой Н, незамещенный C1-6алкил или -(СН2)mСН=СН(СН2)nR9.
В другом варианте выполнения R1 представляет собой -NR6R7. В некоторых таких вариантах его выполнения, R6 и R7 в составе R1 независимо выбраны из Н, C1-6алкила или -(СН2)mСН=СН(СН2)nR9. В других вариантах его выполнения C1-6алкил(ы) групп R6 и/или R7 из R1 -NR6R7 независимо выбран(ы) из метила, этила, пропила, н-бутила или н-пентила. В некоторых таких вариантах выполнения R6 и R7 представляют собой соответственно пропил и метил. В других вариантах выполнения R6 представляет собой метил, a R7 представляет собой -(CH2)mCH=CH(CH2)nR9, где m равно 1, n равно 0, a R9 представляет собой Н.
В другом варианте выполнения R1 представляет собой -S(O)qR10. В некоторых таких вариантах его выполнения q и R10 в составе R1 представляют собой соответственно 0 и С1-6алкил, так что R1 представляет собой -SR10, где R10 из -SR10 представляет собой C1-6алкил, так что R1 представляет собой -S-C1-6алкил. В другом варианте выполнения C1-6алкил представляет собой этил, так что R1 представляет собой -S-этил. В другом варианте выполнения С1-6алкил представляет собой -CH2СН2СН3, так что R1 представляет собой -SСН2СH2СН3. В другом варианте выполнения C1-6алкил представляет собой -СН(СН3)2, так что R1 представляет собой -S-СН(СН3)2. В другом варианте выполнения q и R10 в составе R1 представляют собой соответственно 0 и С6-10арил-C1-6алкил, так что R1 представляет собой -S-(С6-10арил-C1-6алкил). В некоторых таких вариантах выполнения R10 представляет собой бензил, так что R1 представляет собой -S-CH2Ph.
В других вариантах выполнения R1 представляет собой -C(O)NR6R7.
В других вариантах выполнения R1 представляет собой -(CH2)mCH=CH(CH2)nR9.
В других вариантах выполнения R1 представляет собой -(CH2)mC≡C(CH2)nR9.
В другом варианте выполнения R2 представляет собой C1-6алкил. В некоторых таких вариантах выполнения R2 представляет собой изобутил.
В других вариантах выполнения m равно 1, n равно 0, a R9 представляет собой Н.
В других вариантах выполнения p равно 0.
В других вариантах выполнения R2 представляет собой замещенный C1-6алкил. В некоторых таких вариантах его выполнения R2 представляет собой -СН2С(СН3)2(ОН). В другом варианте выполнения R2 представляет собой -СН2С(СН3)2NН-SO2СН3.
В других вариантах выполнения R1 представляет собой -S-циклопропил, -S-СН2СН(СН3)2, или -S-СН2СН2СН3.
В других вариантах выполнения R1 представляет собой -S-С3-6циклоалкил.
В других вариантах выполнения R6 и R7 вместе взятые образуют замещенную или незамещенную гетероциклильную группу. Если R6 и R7 вместе взятые образуют замещенную или незамещенную гетероциклильную группу, гетероциклильная группа присоединена к ядру через атом азота.
В других вариантах выполнения указанная гетероциклильная группа выбрана из пиперидинила, пирролидинила, азетидинила или азиридинила. В других вариантах выполнения указанная гетероциклильная группа (образованная R6 и R7) представляет собой морфолинил, тиоморфолинил, пиперазинил, N-метилпиперазинил или полициклический гетероцикл, такой как хинуклидин.
В других вариантах выполнения R6 и R7 вместе взятые образуют замещенную или незамещенную гетероарильную группу, такую как пиррольная, пиразольная, триазольная и пиридоновая группы.
В других вариантах выполнения R1 представляет собой -N(СН3)СН2СН2СН3.
В других вариантах выполнения соединение выбирают из следующего перечня:
1-(4-амино-2-пропилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-азетидин-1-илимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-пирролидин-1-илимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-циклопропилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол или
1-(4-амино-2-изобутилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол.
В других вариантах выполнения соединение формулы I выбирают из группы, состоящей из:
N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2,N2-диметил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-этил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-метил-1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-бутил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-бутил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-метил-1-(2-метилпропил)-N2-пентил-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-метил-1-(2-метилпропил)-N2-проп-2-енил-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
1-(2-метилпропил)-2-[(фенилметил)тио]-1Н-имидазо[4,5-с]хинолин-4-амина;
1-(2-метилпропил)-2-(пропилтио)-1Н-имидазо[4,5-с]хинолин-4-амина;
2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этанола;
2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этилацетата;
4-амино-1-(2-метилпропил)-1,3-дигидро-2Н-имидазо[4,5-с]хинолин-2-она;
N2-бутил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-бутил-N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2,N2-диметил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
1-{4-амино-2-[метил(пропил)амино]-1Н-имидазо[4,5-с]хинолин-1-ил}-2-метилпропан-2-ола;
1-[4-амино-2-(пропиламино)-1Н-имидазо[4,5-с]хинолин-1-ил]-2-метилпропан-2-ола; и
N4,N4-дибензил-1-(2-метокси-2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамина.
В некоторых вариантах выполнения соединение выбирают из одного из следующих соединений:
, , , , , , , , , , , , , , , , , , , или ;
или их фармацевтически приемлемых солей, его таутомеров или фармацевтически приемлемых солей таутомеров.
В некоторых других вариантах выполнения соединение выбирают из одного из следующих соединений:
, , , , ;
или их фармацевтически приемлемых солей, его таутомеров или фармацевтически приемлемых солей таутомеров.
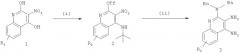
В другом варианте выполнения изобретение относится к способу синтеза соединения формулы (II)
где каждый из R11 и R14 представляет собой C1-6алкил или замещенный C1-6алкил, и каждый из R12 и R13 представляет собой защитную группу, предусматривающему:
(а) взаимодействие соединения формулы (III):
с изотиоцианатом формулы R11NCS, где R11 определен выше, с получением таким образом соединения формулы (IV):
(b) необязательную очистку соединения формулы (IV);
(c) взаимодействие соединения формулы (IV) со сшивающим агентом с получением таким образом соединения формулы (II); и
(d) необязательное удаление защитной группы с соединения формулы (II).
В некоторых вариантах выполнения способа синтеза соединения формулы (II) сшивающий агент представляет собой 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид.
В других вариантах выполнения способа синтеза соединения любой из формул (II-XIV) R12 представляет собой защитную группу, такую как трет-бутоксикарбонил (ВОС), a R13 представляет собой -Н.
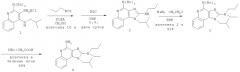
В другом варианте выполнения изобретение относится к способу синтеза соединения формулы (V)
где R14 представляет собой C1-6алкил или замещенный C1-6алкил, a R15 представляет собой С6-10арил-C1-6алкил, предусматривающему:
(а) взаимодействие соединения формулы (III):
где каждый из R12 и R13 представляет собой защитную группу, с дисульфидом углерода с получением таким образом соединения формулы (VI):
(b) необязательную очистку соединения формулы (VI);
(c) взаимодействие соединения формулы (VI) с активированной группой R15 с получением соединения формулы (VIa);
(d) удаление защитной группы с соединения формулы (VIa) с получением таким образом соединения формулы (V).
В другом варианте выполнения изобретение относится к способу синтеза соединения формулы (VII)
где R14 представляет собой C1-6алкил или замещенный C1-6алкил, a R16 представляет собой -C(O)C1-6алкил или -C(O)O-C1-6алкил, предусматривающему:
(а) взаимодействие соединения формулы (VIII):
где каждый из R12 и R13 представляет собой защитную группу, с соединением формулы (IX):
где R17 представляет собой Н или C1-6алкил, с получением таким образом соединения формулы (X):
(b) необязательную очистку соединения формулы (X); и
(c) взаимодействие соединения формулы (X) с катализатором Перлмана, когда R17 представляет собой C1-6алкил, и последующий гидролиз полученного соединения в кислых условиях с получением соединения формулы (VII); или
(d) гидролиз и последующее окисление соединения формулы (X), когда R17 представляет собой Н, и последующее взаимодействие полученного гидролизованного и окисленного соединения с реагентом с получением соединения формулы (VIIa):