Средство, стимулирующее клеточный иммунитет млекопитающих
Иллюстрации
Показать всеИзобретение относится к медицине, ветеринарии и фармацевтической промышленности. Изобретение обеспечивает применение тритерпеновых гликозидов из голотурии Сucumaria okhotensis, выбранных из группы, состоящей из фрондозида А1, охотозида B1, охотозида A1-1, охотозида А2-1 или кукумариозида А2-5 или их смеси, в качестве средства, стимулирующего клеточный иммунитет млекопитающих, а также для приготовления фармацевтической композиции, стимулирующей клеточный иммунитет млекопитающих. Использование изобретения позволяет расширить арсенал средств, стимулирующих клеточный иммунный ответ у млекопитающих. 4 ил., 1 табл., 2 н.п. ф-лы.
Реферат
Изобретение относится к медицине и ветеринарии и касается средств, стимулирующих клеточный иммунный ответ у млекопитающих.
Основная защитная функция иммунной системы относится к сопротивлению против вторжения патогенов, включая вирусы, рикетсии, микоплазмы, бактерии, грибы и паразиты всех типов. Таким образом, усиление иммунного ответа, особенно когда он изначально подавлен, улучшает сопротивляемость к инфицированию или инвазии вышеназванными патогенами. Вторая защитная функция иммунной системы состоит в сопротивлении вживлению инородной ткани. Третья защитная функция включает подавление реакции на собственные ткани с помощью положительных супрессорных механизмов. При аутоиммунных и сходных нарушениях иммунная реактивность направлена на собственные антигены или избыточный, повышенный, и, несомненно, деструктивный иммунный ответ.
В общем, иммунная система включает такие функциональные компоненты, как клеточная иммунная система и гуморальный иммунитет. Иммунитет может быть специфичным или неспецифичным, врожденным и т.д. Основной целью иммунотерапии является коррекция различных иммунодефицитных явлений. Иммуномодуляторы нормализуют функционирование некоторых или всех частей иммунной системы животных с врожденным или приобретенным иммунодефицитом.
Таким образом, биологически активные вещества или физиологически приемлемые композиции на их основе, способные стимулировать иммунную систему млекопитающих или ее отдельные компоненты, могут быть использованы для лечения болезней, связанных с дефектами в иммунной системе и/или увеличивать активность иммунной системы выше нормального уровня.
Важным компонентом клеточного иммунитета являются макрофаги -специальные клетки, способные фагоцитировать, и убивающие разного рода инородные патогены. Известно, что прикрепление макрофагов к подложке и последующее распластывание, является необходимой предпосылкой их функциональной активности. Эти показатели отражают начальную стадию фагоцитоза и поглотительную способность макрофагов, при этом меняются геометрические параметры макрофагов: изменяется общая площадь клеток и периметр, клетки могут вытягиваться и у них изменяются очертания вследствие формирования ламелл и филоподий [Mosser D.M., Edwards J.P. Exploring the full spectrum of macrophage activation // Nat. Rev. Immunol. 2008. V.8, No.12. P.958-969; Martinez F.O., Sica A., Mantovani A., Locati M. Macrophage activation and polarization // Front. Biosci. 2008. V.13. P.453-461].
Лизосомальная активность является одним из важных маркеров физиологического и биохимического статуса макрофагов. Увеличение количества в них внутриклеточных органелл и увеличение размера этих органелл так же, как увеличение кислотности, свидетельствует об активации некоторых клеточных функций и лизосомальных ферментов, а также о подготовке клеток к фагоцитозу и перевариванию поглощенных частиц [Allison A.C., Young M.R. Vital staining and fluorescence microscopy of lysosomes // Lysosomes in Biology and Pathology. V.2. North Holland, Amsterdam, 1969. P.600-628].
Способность генерировать синглетный кислород, перекись водорода и продукты их взаимодействия друг с другом и с NO, так называемый оксидативный взрыв, также важен для макрофагов, чтобы убивать патогенные микроорганизмы. Регистрируемое в данном исследовании превращение дигидрородамина 123 в родамин 123 в клетках отражает выработку мышиными макрофагами Н2О2, O2 и пероксинитрита, который ассоциируется с выработкой оксида азота и образованием НАДФ-оксидазозависимого супероксида. Эти активные формы кислорода являются очень токсичными и необходимы для килинга поглощенных микроорганизмов, их окисления и дезинтеграции [Childs E.W., Udobi K.F., Wood J.G., Hunter F.A., Smalley D.M., Cheung L.Y. In vivo visualization of reactive oxidants and leukocyte-endothelial adherence following hemorrhagic shock // Shock. 2002. V.18. P.423-427]
Таким образом, изучение распластанности и лизосомальной активности макрофагов, а также уровня активных форм кислорода в макрофагах, позволяет достаточно надежно оценивать способность тех или иных биологически активных веществ стимулировать клеточный иммунитет.
В качестве веществ, стимулирующих клеточный иммунитет, привлекают внимание природные соединения морского происхождения, а именно тритерпеновые гликозиды из голотурий. Сапонины или гликозиды, состоящие из углеводной цепи и тритерпенового или стероидного агликона, широко распространены в растениях. Присутствие тритерпеновых гликозидов характерно для большинства голотурий - животных, относящихся к классу Holothurioidea (тип Echinodermata), и для некоторых губок. Тритерпеновые гликозиды голотурий имеют агликоны ланостанового типа, большинство имеет агликоны с 18(20)-лактонами и относится к голостановому типу. Углеводные цепи гликозидов голотурий состоят из двух - шести моносахаридных остатков, включая ксилозу, хиновозу, глюкозу, 3-O-метилглюкозу, и (иногда) 3-O-метилксилозу, 3-O-метилхиновозу, 3-O-метилглюкуроновую кислоты, а также 6-O-ацетилглюкозу. Они могут содержать одну, две или три сульфатных группы. [Stonik V.A., Kalinin V.I., Avilov S.A., Toxins from Sea Cucumbers (Holothuroids): Chemical Structures, Properties, Taxonomic Distribution, Biosynthesis and Evolution // J. Nat. Toxins. 1999. V.8. P.235-248; Kalinin V.I., Silchenko A.S., Avilov S.A., Stonik V.A., Smimov A.V. Sea cucumbers triterpene glycosides, the recent progress in structural elucidation and chemotaxonomy // Phytochemistry Reviews. 2005. V.4, No.2-3. P.221-236; Avilov S.A., Silchenko A.S., Antonov A.S., Kalinin V.I., Kalinovsky A.I., Smimov A.V., Dmitrenok P.S., Evtushenko E.V., Fedorov S.N., Savina A.S., Shubina L.K., Stonik V.A. Synaptosides A and A1, Two Triterpene Glycosides from the Sea Cucumber Synapta maculata Containing 3-O-Methylglucuronic Acid and their Cytotoxic Activity Against Tumor Cells // J. Natural Prod. 2008. V.71, No.4. P.525-531; Antonov A.S., Avilov S.A., Kalinovsky A.I., Anastyuk S.D., Dmitrenok P.S., Evtushenko E.V., Kalinin V.I., Smirnov A.V., Taboada S., Ballesteros M., Avila C., Stonik V.A. Triterpene glycosides from Antarctic sea cucumbers I. Structure of liouvillosides A1, А2, А3, B1 and В2 from the sea cucumber Staurocucumis liouvillei, new procedure for separation of highly polar glycoside fractions and taxonomic revision // J. Nat. Prod. 2008. V.71. P.1677-1685].
Благодаря способности формировать комплекс с 5(6)-ненасыщенными стеринами клеточных мембран, гликозиды обладают широким спектром биологической активности, включая гемолитическую, антигрибковую, цитотоксическую, и многие другие виды мембранотропного действия [Kalinin V.I., Aminin D.L., Avilov S.A., Silchenko A.S., Stonik V.A. Triterpene glycosides from sea cucucmbers (Holothurioidae, Echinodermata), biological activities and functions // Studies in Natural Product Chemistry (Bioactive Natural Products) / Ed. Atta-ur-Rahman. V.35. P.135-196. The Netherlands: Elsevier Science Publisher, 2008].
Иммуномодулирующее действие подробно было изучено лишь для нескольких индивидуальных гликозидов из двух видов промысловых голотурий - дальневосточной голотурии Cucumaria japonica и северо-атлантической голотурии Cucumaria frondosa.
Фрондозид А - моносульфатированный пентаозид из Cucumaria frondosa стимулирует дизосомальную активность макрофагов мыши в дозе 0,2 мкг/мышь и это стимулирование сохраняется свыше 10 дней. Этот гликозид также показал 30% стимулирующее действие на лизосомальную активность в мышиных макрофагах при концентрации 0,1-0,38 мкг/мл. Фрондозид А увеличивает фагоцитоз бактерий Staphylococcus aureus in vitro макрофагами при максимальной эффективной концентрации 0,001 мкг/мл. Фрондозид А стимулирует образование активных форм кислорода (АФК) в макрофагах in vitro при максимальной эффективной концентрации 0,001 мкг/мл. Фрондозид А стимулирует увеличение числа плоских антителообразующих клеток (В-клеток в селезенке) in vivo с максимальным стимулирующим эффектом при концентрации 0,2 мкг/мышь (индекс стимулирования 1,86). Тем не менее, фрондозид А имеет слабое влияние на уровень продукции IgM после иммунизации мышей эритроцитами барана. Фрондозид А не стимулирует выработку иммуноглобулинов в мышах, иммунизированных овальбумином. Таким образом, фрондозид А является стимулятором клеточного иммунитета без существенного воздействия на гуморальный иммунный ответ [Aminin D.L., Agafonova I.G., Kalinin V.I., Silchenko A.S., Avilov S.A, Stonik V.A, Colin P.D., Woodward C. Immunomodulatory properties of frondoside A, a major triterpene glycoside from the North Atlantic commercially harvested sea cucumber Cucumaria frondosa // J. Med. Food. 2008. V.11, No.3. P.443-453].
Тритерпеновые гликозиды из Cucumaria japonica также проявляли ярко выраженные иммуномодулирующие свойства. Внутрибрюшинная инъекция индивидуальных кукумариозидов из С. japonica стимулирует активность интраперитоидальных макрофагов мыши на четвертый день после введения. Инъекция некоторых гликозидов в супернизких дозах от пикограм до нанограм на мышь приводила, как к увеличению числа и объема лизосом, так и их кислотности, что было показано с помощью флюоресцентного зонда акридинового оранжевого [Aminin D.L., Agafonova I.G., Berdyshev E.V., Isachenko E.G., Avilov S.A., Stonik V.A. Immunomodulatory properties of cucumariosides from the edible Far-Eastern holothurian Cucumaria japonica // J. Med. Food. 2001. V.4. P.127-135]. Максимальная активность кукумариозида А2-2 наблюдалась при концентрации 20 нг на мышь, дальнейшее увеличение концентрации не приводило к увеличению активности. Трисульфатированный кукумариозид A7-1 вызывал уменьшение лизосомальной активности в концентрации 0,2 мкг на мышь, причем этот эффект сохранялся при увеличении концентрации до 2 мкг на мышь. Таким образом, это вещество оказалось иммунодепрессантом.
Было изучено действие кукумариозидов А2-2 и А7-1 на лизосомальную активность макрофагов in vitro, а также их влияние на транспорт кальция внутрь этих клеток в иммуномодулирующих дозах [Agafonova I.G., Aminin D.L., Avilov S.A., Stonik V.A. Influence of cucumariosides upon intracellular [Ca2+]j and lysosomal activity of macrophages // J. Agric. Food. Chem. 2003. V.51. P.6982-6986]. Исследование лизосомальной активности макрофагов in vitro с помощью флуоресцентного зонда акридинового оранжевого показало, что моносульфатированный кукумариозид А2-2 вызывал двукратное увеличение лизосомальной активности, которое сопровождалось увеличением числа и размера лизосом, а также повышением их кислотности при максимальной эффективной концентрации 0,02 мкг/мл. В то же время трисульфатированный кукумариозид А7-1 показал очень слабое стимулирование лизосомальной активности при концентрациях меньших, чем 0,1 мкг/мл, а затем в диапазоне концентраций 0,2-2 мкг/мл даже уменьшал лизосомальную активность. Таким образом, данные по активности in vivo вполне коррелировали с данными по активности in vitro.
Вход кальция в клетки макрофагов контролировался по флуоресценции красителя Calcium Green-1/AM. В диапазоне концентраций 0,001-0,1 мкг/мл, сопоставимых с иммуностимулирующими концентрациями in vitro, кукумариозид А2-2 вызывал резкое увеличение концентрации кальция внутри клеток, продолжавшееся в течение 10-60 сек, а затем в течение 50-150 сек уменьшающееся до исходного уровня. Аналогичное действие кукумариозида А7-1 было выражено в значительно меньшей степени. Поскольку стимулирование лизосомальной активности макрофагов происходит при той же самой концентрации гликозида, что и обратимое увеличение внутриклеточной концентрации кальция, вполне возможно, что иммуностимулирующее действие является кальций-зависимым. В то же время механизм, по которому кукумариозид А2-2 инициирует обратимое увеличение кальция при столь малых концентрациях, представляется пока не вполне ясным и возможно отличным от обычного взаимодействия гликозидов голотурий со стеринами мембран с образованием неспецифических ионных каналов и водонаполненных пор.
С целью оптимизации процесса выделения моносульфатированных гликозидов и уменьшения их токсических свойств при получении на их основе иммуностимуляторов в ТИБОХ ДВО РАН был разработан иммуностимулирующий препарат Кумазид, представляющий собой комплекс моносульфатированных гликозидов (преимущественно кукумариозид А2-2 из голотурии Cucumaria japonica) с холестерином в соотношении 1:2. Этот препарат показал сильные иммуностимулирующие свойства, аналогичные таковым для кукумариозида А2-2 [RU 2271820 С1, 20.03.2006; Aminin D.L., Pinegin B.V., Pichugina L.V., Zaporozhets T.S., Agafonova I.G., Boguslavsky V.M., Silchenko A.S., Avilov S.A., Stonik V.A. Immunomodulatory properties of Cumaside // Intern. Immunopharm. 2006. V.6. P.1070-1082].
Таким образом, моносульфатированные гликозиды из С. japonica являются эффективными стимуляторами клеточного иммунитета, влияющими на активность макрофагов, хотя механизм действия этих гликозидов остается не вполне ясным.
В последнее время было показано, что популяции С. japonica, обитающие в северной части Японского и Охотского морей, включая побережья Камчатского полуострова и северных Курильских островов, на самом деле являются эндемичными видами-двойниками, отличающиеся от С. japonica в том числе и по составу тритерпеновых гликозидов [Сильченко А.С., Авилов С.А., Калинин В.И., Стоник В.А., Калиновский А.И., Дмитренок П.С., Степанов В.Г. Моносульфатированные тритерпеновые гликозиды Cucumaria okhotensis Levin et Stepanov - нового вида голотурий из охотского моря // Биоорг. химия. 2007. Т.33, №1. С.81-90.]. Поскольку ранее были подробно изучены иммуномодулирующие свойства лишь немногих голотурий, то поиск иммуностимулирующих гликозидов в других промысловых голотуриях представляется актуальным, а наличие иммуностимулирующих свойств у содержащихся в них гликозидов не очевидным, поскольку эти гликозиды имеют отличия по химической структуре от изученных ранее веществ.
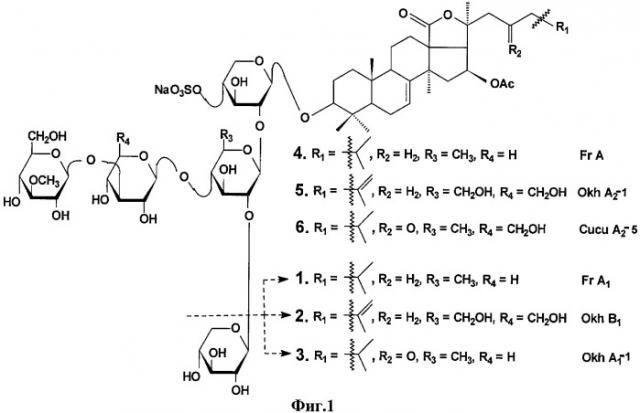
Из охотоморской промысловой голотурии Cucumaria okhotensis была выделена серия тритеперновых гликозидов, включая ряд моносульфатированных - фрондозид A1 (1), охотозид B1 (2), охотозид A1-1 (3), фрондозид А (4), охотозид А2-1 (5), кукумариозид А2-5 (6) (фиг.1) [Сильченко А.С., Авилов С.А., Калинин В.И., Стоник В.А., Калиновский А.И., Дмитренок П.С., Степанов В.Г. Моносульфатированные тритерпеновые гликозиды Cucumaria okhotensis Levin et Stepanov - нового вида голотурий из охотского моря // Биоорг. химия. 2007. Т.33, №1. С.81-90; Silchenko A.S., Avilov S.A., Kalinin V.I., Kalinovsky A.I., Dmitrenok P.S., Fedorov S.N., Stepanov V.G., Dong Z., Stonik V.A. Constituents of the sea cucumber Cucumaria okhotensis. Structures of okhotosides B1-В3 and cytotoxic activities of some glycosides from this species // J. Nat. Prod. 2008. V.71, No.3. P.351-356]. Из этих веществ иммуномодулирующие свойства были известны только для фрондозида А. Для гликозидов 1-3 и 5, 6 авторами в патентной и другой доступной научно-технической литературе каких-либо сведений об их иммуномодулирующем действии не обнаружено.
Задача изобретения - расширение арсенала средств, стимулирующих клеточный иммунный ответ у млекопитающих.
Задача решена применением тритерпеновых гликозидов из промысловой голотурии Cucumaria okhotensis или их смесей в качестве средства, стимулирующего клеточный иммунитет млекопитающих.
Задача решена также применением тритерпеновых гликозидов из промысловой голотурии Cucumaria okhotensis или их смесей для приготовления фармакологической композиции, стимулирующей клеточный иммунитет млекопитающих.
Тритерпеновые гликозиды из С.okhotensis представляют собой фрондозид A1 (1), охотозид B1 (2), охотозид A1-1 (3), охотозид А2-1 (5), кукумариозид А2-5 (6) или их смесь.
Эти соединения получают путем выделения и очистки из природного сырья. Процесс выделения тритерпеновых гликозидов из голотурий является стандартной процедурой [Сильченко А.С., Авилов С.А., Калинин В.И., Стоник В.А., Калиновский А.И., Дмитренок П.С., Степанов В.Г. Моносульфатированные тритерпеновые гликозиды Cucumaria okhotensis Levin et Stepanov - нового вида голотурий из охотского моря // Биоорг. химия. 2007. Т.33, №1. С.81-90; Silchenko A.S., Avilov S.A., Kalinin V.I., Kalinovsky A.I., Dmitrenok P.S., Fedorov S.N., Stepanov V.G., Dong Z., Stonik V.A. Constituents of the sea cucumber Cucumaria okhotensis. Structures of okhotosides В1-B3 and cytotoxic activities of some glycosides from this species // J. Nat. Prod. 2008. V.71, No.3. P.351-356]. Сущность способа заключается в следующем: животных измельчают и экстрагируют дважды горячим этанолом, затем объединенные экстракты упаривают досуха на роторном испарителе и сухой остаток хроматографируют на колонке с тефлоновым порошком или другим гидрофобным носителем, уравновешенным в воде. Неорганические соли и полярные примеси вымывают с колонки водой, а фракцию, содержащую гликозиды, - 50% этанолом в воде. Затем фракцию наносят на колонку с силикагелем; элюент - система хлороформ-этанол-вода (100:100:17).
В результате выделяют две главные фракции: первая содержит моносульфатированные гликозиды, а вторая - более полярные гликозиды. Обе фракции подвергают повторной хроматографии на силикагеле, а затем индивидуальные гликозиды выделяют методом высокоэффективной колоночной хроматографии (HPLC) с использованием обращенно-фазовых колонок. Обычно, после использования метода колоночной хроматографии, получают смесь гликозидов, а уже после использования метода HPLC получают индивидуальные гликозиды.
Для охотозида A1-1 (3) в литературе имеются сведения о его цитотоксических свойствах, оцененных путем определения ингибирования им неспецифической эстеразы лимфоцитов селезенки мыши [Aminin D.L., Silchenko A.S., Avilov S.A., Stepanov V.G., Kalinin V.I. Cytotoxic action of triterpene glycosides from sea cucumbers from the genus Cucumaria on mouse spleen lymphocytes. Inhibition of nonspecific esterase // Nat. Prod. Com. 2009. V.4, No.6. P.773-776]. Однако новое назначение этого вещества, как иммуностимулятора, не вытекает с очевидностью из его цитотоксических свойств и найдено авторами впервые.
Для гликозидов 1-3 и 5, 6 данных о проявляемой ими биологической активности в литературе не обнаружено. Назначение этих веществ в качестве иммуностимуляторов не вытекает с очевидностью из каких-либо предполагаемых их свойств и найдено авторами впервые.
Фармацевтические композиции, стимулирующие клеточный иммунитет млекопитающих, получают, смешивая эффективное количество тритерпеновых гликозидов из голотурий 1-3 и 5, 6 с традиционными фармацевтически или фармакологически приемлемыми наполнителями. Выражение «фармацевтически или фармакологически приемлемый» обозначает молекулярные компоненты и композиции, которые не вызывают негативных, аллергических или иных нежелательных реакций при введении их животному или человеку. Природа наполнителя зависит от способа введения. Например, если желательным является пероральное введение, то может быть выбран твердый наполнитель, тогда как для внутривенного введения может быть использован жидкий солевой раствор.
Технический результат, обеспечиваемый изобретением, заключается в способности фрондозида A1 (1), охотозида B1 (2), охотозида A1-1 (3), охотозида A2-1 (5), кукумариозида А2-5 (6) или их смесей стимулировать клеточный иммунный ответ у млекопитающих, включая человека, а также в возможности использования этих веществ для приготовления фармацевтических композиций, стимулирующих клеточный иммунный ответ у млекопитающих, включая человека.
Изобретение расширяет арсенал средств и фармацевтических композиций, стимулирующих клеточный иммунитет млекопитающих животных.
На фиг.1 представлены структуры моносульфатированных тритерпеновых гликозидов, выделенных из Cucumaria okhotensis - фрондозида A1 (1), охотозида B1 (2), охотозида А1-1 (3), фрондозида А (4), охотозида А2-1 (5), кукумариозида А2-5 (6).
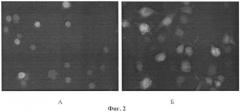
На фиг.2 представлено влияние фрондозида A1 (1) на распластывание перитонеальных макрофагов мыши. Гликозид вводят методом внутрибрюшинной инъекции в объеме 0,5 мл в дозе 0,2 мкг/мышь. На 4-е сутки мышей умерщвляют методом перивисцеральной дислокации, выделяют макрофаги и окрашивают их флуоресцентным зондом 5-карбоксифлуоресцеиндиацетат. А - клетки из контрольных мышей; Б - клетки из мышей, получивших фрондозид A1 в дозе 0,2 мкг/мышь. Аналогичная картина наблюдается и для остальных исследованных гликозидов.
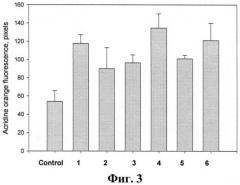
На фиг.3 представлено влияние тритерпеновых гликозидов на лизосомальную активность перитонеальных макрофагов мыши. Гликозиды вводят методом внутрибрюшинной инъекции в объеме 0,5 мл в дозе 0,2 мкг/мышь. На 4-е сутки мышей умерщвляют методом перивисцеральной дислокации, выделяют макрофаги, окрашивают лизосомы акридиновым оранжевым и проводят анализ. Данные представлены как m±se (n=100).
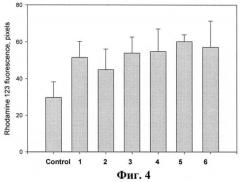
На фиг.4 представлено влияние тритерпеновых гликозидов на формирование активных форм кислорода (АФК) в перитонеальных макрофагах мыши. Гликозиды вводят методом внутрибрюшинной инъекции в объеме 0,5 мл в дозе 0,2 мкг/мышь. На 4-е сутки мышей умерщвляли методом перивисцеральной дислокации, выделяют макрофаги, нагружают клетки зондом дигидролродамин 123 и проводят анализ. Данные представлены как m±se (n=100).
Приготовление фармацевтических композиций иллюстрируется следующими примерами:
Пример 1. Фрондозид A1 в эффективном количестве смешивают с соответствующим количеством смеси крахмала и гипса и прессуют в таблетку.
Пример 2. Фармацевтическую композицию готовят, как описано в примере 1, но в качестве тритерпенового гликозида используют охотозид B1, а в качестве наполнителя - смесь сорбита и стеарата кальция.
Пример 3. Охотозид A1-1 в эффективном количестве смешивают с соответствующим количеством крахмала и помещают в желатиновую капсулу.
Пример 4. Фармацевтическую композицию готовят, как описано в примере 3, но в качестве тритерпенового гликозида используют охотозид А2-1.
Пример 5. Фармацевтическую композицию готовят, как описано в примере 3, но в качестве тритерпенового гликозида используют кукумариозид А2-5.
Пример 6. Смесь гликозидов - фрондозид A1, охотозид B1, охотозид A1-1, охотозид А2-1, кукумариозид А2-5 в эффективных концентрациях растворяют в физрастворе.
Исследование биологической активности
I. Материалы и методы
2. Принятые сокращения
Fr A1 - фрондозид A1; Okh B1 - охотозид B1; Okh A1-1 - охотозид A1-1; Fr A - фрондозид A; Okh А2-1 - охотозид А2-1; Cucu A2-5 - кукумариозид А2-5.
2. Тритерпеновые гликозиды
Была исследована иммуномодулирующая активность серии тритерпеновых гликозидов, полученных из голотурии Cucumaria okhotoensis: фрондозида A1 (1), охотозида B1 (2), охотозида A1-1 (3), охотозида А2-1 (5), кукумариозида A2-5 (6), структуры которых представлены на фиг.1. Все гликозиды были индивидуальны по данным спектроскопии ЯМР 13С. Поскольку иммуномодулирующие свойства фрондозида А (4) уже были ранее известны, то его использовали как положительный контроль.
Индивидуальные соединения растворяли в стерильной дистиллированной воде в концентрации 1 мг/мл (исходная концентрация). Из этой исходной концентрации сделали серию разведений:
1) 40 мкл раствора гликозида добавляли в 960 мкл дистиллированной воды, получали промежуточный раствор с концентрацией гликозида 40 мкг/мл.
2) Из этого раствора отбирали 10 мкл и добавляли в 990 мкл дистиллированной воды и получали конечную концентрацию 0,4 мкг/мл.
Конечное разведение гликозида использовали для инъекции мышам.
3. Определение иммуномодулирующей активности
Для тестирования in vivo использовались мыши линии СВА (самки, вес 20 г). Гликозиды вводили методом внутрибрюшинной инъекции (0,5 мл раствора гликозида в дистиллированной воде). Конечная доза гликозида - 0,2 мкг/мышь. Контрольным мышам вводили дистиллированную воду. Через 4 дня после введения препаратов мышей умерщвляли методом перивисцеральной дислокации и перитонеальные макрофаги выделяли по стандартной методике.
Оценка иммуномодулирующей активности проводилась окраской и локализацией лизосом в макрофагах, определением формирования активных форм кислорода (АФК) в макрофагах и определением распластывания макрофагов (spreading) на внеклеточном матриксе. Для этого использовалась техника молекулярных флуоресцентных зондов и последующий анализ флуоресцентного изображения клеток.
С этой целью 250 мкл перитонеальной жидкости мышей, содержащей макрофаги, помещали на предметное стекло микроскопа и оставляли инкубироваться на 1 час при 37°С. После адгезии макрофагов предметное стекло трижды промывали фосфатно-солевым буферным раствором (ФСБ, рН 7.5). Затем 250 мкл раствора флуоресцентного зонда было по каплям добавлено в клеточный монослой, и клетки инкубировали далее при 37°С.
Для определения лизосомальной активности макрофагов применяли раствор акридинового оранжевого (Calbiochem, 100 мкг/мл в ФСБ), клетки инкубировали в течение 30 мин.
Для оценки формирования АФК применяли раствор дигидрородамина 123 (Sigma, 100 нг/мл в ФСБ, содержащим 0.5 мМ азида натрия), клетки инкубировали в течении 10 мин.
Для определения распластывания макрофагов (spreading) применяли раствор 5-карбоксифлуоресцеиндиацетата (Molecular Probes, 50 мкг/мл в ФСБ), клетки инкубировали в течении 60 мин.
Затем клеточный монослой трижды промывали ФСБ, покровные стекла монтировались на предметном столике флуоресцентного сканирующего устройства, основанного на инвертированном микроскопе Axiovert 200 (Zeiss, Germany). Люминесцентная лампа 75 W Optosource xenon arc lamp и DAC-контролируемый монохроматор Optoscan (Cairn Research Ltd., UK) использовались в качестве источника света для возбуждения флуоресценции при λех=488 нм; фильтр-блок HQ FITC (Chroma Technology Corp., USA) и объектив Fluar 40×/1.3 Oil (Zeiss, Germany) были использованы для визуализации флуоресцентного свечения клеток.
Изображение флуоресценции клеток регистрировалось с помощью цифровой монохромной видеокамеры Hamamatsu Orca-ER C4742-95 (Hamamatsu Photonics K.K., Japan) и передавалось в IBM-совместимый компьютер с интерфейсом Fireware data. Интенсивность флуоресценции случайно выбранных 100 изображений клеток оценивалась с помощью программы AQM Advance 6 (Kinetic Imaging Ltd., UK) и вычислялась по средней интенсивности флуоресценции каждой клетки, выраженной в пикселях. Кроме того, оценивались геометрические параметры клеток (площадь, периметр, максимальная хорда и очертания).
Эксперимент повторяли трижды. Средние значения, стандартную ошибку и стандартные отклонения вычислялись и наносились на график с помощью программы SigmaPlot 3.02 (Jandel Scientific, USA).
II. Результаты исследования биологической активности фрондозида A1 (1), охотозида B1 (2), охотозида A1-1 (3), охотозида А2-1 (5), кукумариозида А2-5 (6) и их обсуждение.
Оценка распластывания макрофагов
Известно, что прикрепление макрофагов к подложке и их последующее распластывание, является необходимой предпосылкой их последующей функциональной активности. Эти показатели отражают начальную стадию фагоцитоза и поглотительную способность макрофагов. При распластывании меняются геометрические параметры макрофагов: изменяется общая площадь клеток и периметр, клетки могут вытягиваться и у них изменяются очертания вследствие формирования ламелл и филоподий [Mosser D.M., Edwards J.P. Exploring the full spectrum of macrophage activation // Nat. Rev. Immunol. 2008. V.8, No.12. P.958-969; Martinez F.O., Sica A., Mantovani A., Locati M. Macrophage activation and polarization. Front. Biosci. 2008. V.13. P.453-461].
Экспериментально было установлено, что исследуемые гликозиды вызывают достоверное повышение всех этих показателей на 4-е сутки после введения мышам. На фиг.2 представлены фотографии перитонеальных макрофагов, выделенных из контрольных и экспериментальных мышей. Хорошо заметно, что макрофаги мышей, получивших гликозид, имеют большие геометрические размеры и их очертания имеют большую неоднородность вследствие усиления распластывания, вытягивания и появления ламелл и филоподий.
Практически все исследуемые гликозиды при однократной внутрибрюшинной инъекции в дозе 0,2 мкг/мышь вызывают достоверное увеличение площади клеток, периметра, максимальной хорды и интегрального показателя очертания клеток. Количественная оценка влияния гликозидов на распластывание макрофагов представлена в таблице. Наиболее эффективными среди исследуемых веществ являются гликозид 1 (фрондозид A1) и гликозид 6 (кукумариозид А2-5). Эти соединения активируют распластывание примерно в 2-2,5 раза по сравнению с контрольными клетками.
Гликозиды вводят методом внутрибрюшинной инъекции в объеме 0,5 мл в дозе 0,2 мкг/мышь. На 4-е сутки мышей умерщвляют методом перивисцеральной дислокации, выделяют макрофаги, окрашивают их флуоресцентным зондом 5-карбоксифлуоресцеиндиацетат и проводят анализ. Данные представлены как m±se (n=100).
| Таблица | ||||
| Влияние тритерпеновых гликозидов на процесс распластывания перитонеальных макрофагов мыши | ||||
| Вещество | Геометрические параметры макрофагов, пиксели | |||
| Площадь | Периметр | Максимальная хорда | Очертания | |
| Контроль | 92,163±13,111 | 80,698±9,484 | 11,050±1,094 | 0,189±0,016 |
| 1 Fr A1 | 239,315±25,444 | 104,849±7,578 | 21,284±1,465 | 0,245±0,012 |
| 2 Okh B1 | 107,989±15,989 | 120,333±8,621 | 14,774±0,863 | 0,075±0.003 |
| 3 Okh A1-l | 154,146±18,282 | 142,343±12,400 | 19,214±1,452 | 0,106±0.007 |
| 4 Fr A | 250,125±33,284 | 128,659±12,240 | 22,472±1,611 | 0,210±0,011 |
| 5 Okh A2-1 | 157,138±22,937 | 88,400±8,956 | 17,493±1,064 | 0,285±0,011 |
| 6 Cucu А2-5 | 229,608±39,828 | 125,411±16,941 | 22,592±2,453 | 0,206±0,014 |
Оценка лизосомальной активности
Лизосомальная активность является одним из важнейших маркеров физиологического и биохимического статуса макрофагов. Увеличение количества внутриклеточных органелл, так же, как и увеличение их размера и закисления, свидетельствует об активации некоторых клеточных функций и лизосомальных ферментов, а также о подготовке клеток к фагоцитозу и перевариванию поглощенных частиц [Allison A.C., Young M.R. Vital staining and fluorescence microscopy of lysosomes // Lysosomes in Biology and Pathology. V.2. North Holland, Amsterdam, 1969. P.600-628; Millot C. Characterization of acidic vesicles in multidrug resistant and sensitive cancer cells by acrydine orange staining and confocal microspectrofluorimetry // J. Histochem. Cytochem. 1997. V.45. P.1255-1259; Zoccarato F, Cavallini L, Alexandre A. The pH-senstitive dye acridine orange as a tool to monitor exocytosis/endocytosis in synaptosomes // J. Neurochem. 1999. V.72. P.625-633].
В экспериментах было показано, что все исследуемые гликозиды при однократном внутрибрюшинном способе применения в дозе 0,2 мг/мышь вызывают достоверное увеличение лизосомальной активности перитонеальных макрофагов, выделенных из мышей на 4-й день после введения препаратов. Наиболее эффективными являются гликозид 1 (фрондозид A1), и гликозид 6 (кукумариозид А2-5) (фиг.3). Эти соединения активируют лизосомальную активность примерно в 1,5-2,5 раза по сравнению с контрольными клетками.
Оценка формирования активных форм кислорода (АФК)
Способность генерировать синглетный кислород, перекись водорода и продукты их взаимодействия друг с другом и с NO, так называемый «кислородный взрыв», также важен для макрофагов, чтобы убивать поглощенные инфекционные микроорганизмы. Регистрируемое в данном исследовании превращение дигидрородамина 123 в родамин 123 в клетках отражает выработку мышиными макрофагами Н2О2, О2, а также пероксинитрита, который ассоциируется с выработкой оксида азота и образованием НАДФ-оксидазозависимого супероксида. Эти активные формы кислорода являются очень токсичными и необходимы для килинга микроорганизмов, их окисления и дезинтеграции [Childs E.W., Udobi K.F., Wood J.G., Hunter F.A., Smalley D.M., Cheung L.Y.. In vivo visualisayion of reactive oxidants and leukocyte-endothelial adherence following hemorrhagic shock// Shock. 2002. V.18. P.423-427; Emmendorffer S.F., Hecht M., Lohman-Mattes M.-L., Roester J.A fast easy method to determine the production of reactive oxygene intermediates by human and murine phagocytes using dihydrorodamine 123 // J. Immunol. Meth. 1990. V.131. P.269-275].
В экспериментах было показано, что все исследуемые гликозиды при однократном внутрибрюшинном способе применения в дозе 0,2 мг/мышь вызывают достоверное увеличение формирования АФК перитонеальных макрофагов, выделенных из мышей на 4-й день после введения препаратов (фиг.4). Все соединения примерно в одинаковой степени активируют лизосомальную активность в 1,3-1,8 раза по сравнению с контрольными клетками.
1. Применение тритерпеновых гликозидов из голотурии Сucumaria okhotensis, выбранных из группы, состоящей из фрондозида А1, охотозида В1, охотозида А1-1, охотозида A2-1 или кукумариозида А2-5 или их смеси, в качестве средства, стимулирующего клеточный иммунитет млекопитающих.
2. Применение тритерпеновых гликозидов из голотурии Сucumaria okhotensis, выбранных из группы, состоящей из фрондозида А1, охотозида B1, охотозида A1-1, охотозида А2-1 или кукумариозида A2-5 или их смеси, для приготовления фармацевтической композиции, стимулирующей клеточный иммунитет млекопитающих.