Плазмидный вектор pe-lc-ltp, штамм бактерии escherichia coli для экспрессии липид-транспортирующих белков чечевицы lens culinaris и способ получения указанных белков
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Описан плазмидный вектор pE-Lc-LTP для экспрессии в клетках Escherichia coli белков Lc-LTP, содержащий ген гибридного полипептида Trx-Lc-LTP, включающего аминокислотную последовательность Lc-LTP, последовательность белка тиоредоксина и аффинную метку. Представлен штамм-продуцент данного гибридного полипептида на основе штамма бактерий E.coli. Предложен способ получения целевого белка Lc-LTP путем экспрессии содержащего его гибридного полипептида Trx-Lc-LTP в клетках указанного штамма, разрушения клеток, аффинной очистки гибридного полипептида Trx-Lc-LTP на металлохелатном носителе, расщепления гибридного белка по сайту, расположенному между последовательностями Lc-LTP и тиоредоксина, и очистки целевого белка Lc-LTP с помощью обращенно-фазовой ВЭЖХ. Изобретение может найти применение в области сельского хозяйства в качестве факторов, повышающих устойчивость растений к инфекциям, и в медицинской практике для диагностики и лечения пищевой аллергии. Изобретение решает задачу повышения эффективности и упрощения технологии получения липид-транспортирующих белков чечевицы Lens culinaris (Lc-LTP). 3 н. и 6 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к области биотехнологии, а именно к получению липид-транспортирующих белков чечевицы Lens culinaris, которые могут найти применение в области сельского хозяйства в качестве факторов, повышающих устойчивость растений к инфекциям, и в медицинской практике для диагностики и лечения пищевой аллергии.
Растительные липид-транспортирующие белки (LTP) представляют собой семейство небольших катионных белков с молекулярной массой около 7 или 9 кДа. Данные белки характеризуются высокой стабильностью, они обладают устойчивостью к химической и тепловой денатурации, а также к действию протеаз. Для пространственной структуры LTP характерно наличие гидрофобной впадины, образованной тремя или четырьмя α-спиралями и длинным С-концевым фрагментом. Установлено, что LTP участвуют во многих биологических процессах в растениях, таких как синтез кутана, эмбриогенез, адаптация к стрессовым условиям окружающей среды, защита растений от фитопатогенов.
Характерным свойством растительных LTP является способность связывания и переноса липидов через биомембраны in vitro. Растительные LTP связывают жирные кислоты с цепью длиной С10-C18, ацильные производные кофермента А, фосфолипиды, липиды кожи, галактолипиды, простагландин B2 и амфотерицин В. Данные белки также осуществляют перенос фосфолипидов через мембраны. Эти свойства растительных LTP делают возможным их применение как лиганд-связывающих белков для создания систем направленной доставки лекарственных и косметических средств.
Растительные LTP обладают антимикробной активностью в отношении как грамположительных, так и грамотрицательных бактерий, а также ингибируют рост широкого спектра фитопатогенных грибов. Данные свойства успешно используют для создания трансгенных растений, несущих гены растительных LTP и обладающих повышенной устойчивостью к заболеваниям.
Представители семейства LTP являются растительными аллергенами, участвующими в развитии аллергических реакций на пыльцу, растительные продукты и латекс. Пищевыми аллергенами являются LTP, выделенные из ряда фруктов (яблоко, персик, слива, вишня, апельсин, виноград и др.), овощей (салат-латук, спаржа, лук, морковь), орехов (фундук, грецкий орех, каштан) и злаков (кукуруза, ячмень). Пыльцевыми аллергенами являются LTP из маслин, сельдерея, арабидопсиса, чернобыльника, турнепсиса и др. В последнее время увеличивается актуальность получения рекомбинантных белковых аллергенов, которые биохимически и иммунологически хорошо охарактеризованы и могут быть использованы для диагностики и лечения аллергии.
Липид-транспортирующие белки чечевицы Lens culinaris (Lc-LTP) (SEQ ID Nos. 1-8) составляют подсемейство липид-транспортирующих белков, выделенных из проращенных семян чечевицы обыкновенной Lens culinaris и подавляющих рост почвенной фитопатогенной бактерии Agrobacterium tumefaciens [Финкина Е.И. и др. (2007) Биохимия, 72(4): 533-43]. Данные белки состоят из 92-93 аминокислотных остатков и содержат восемь остатков цистеина, формирующих четыре дисульфидные связи. Белки-предшественники Lc-LTP 1-8 содержат типичный для растительных LTP сигнальный пептид, состоящий из 24-25 остатков.
Известен способ получения Lc-LTP, заключающийся в гомогенизации проращенных семян чечевицы, экстракции, высаливании белков и нескольких последовательных стадий очистки, включающих гель-фильтрацию, ионообменную и обращенно-фазовую хроматографии [Финкина Е.И. и др. (2007) Биохимия, 72(4): 533-43]. Недостатками данного способа является сложная схема очистки и трудность очистки целевого белка от примеси родственных изоформ.
Изобретение решает задачу расширения ассортимента биологически активных растительных белков и получения липид-транспортирующих белков чечевицы Lens culinaris (Lc-LTP).
Поставленная задача решается за счет конструирования плазмидного вектора pE-Lc-LTP для экспрессии в клетках Escherichia coli белков Lc-LTP, содержащего ген гибридного полипептида Trx-Lc-LTP, включающего аминокислотную последовательность Lc-LTP, последовательность белка тиоредоксина и аффинную метку, создания штамма-продуцента данного гибридного полипептида на основе штамма E.coli путем трансформации его указанным вектором и способа получения целевого белка Lc-LTP путем экспрессии содержащего его гибридного полипептида Trx-Lc-LTP в клетках указанного штамма, разрушения клеток, аффинной очистки гибридного полипептида Trx-Lc-LTP на металлохелатном носителе, расщепления гибридного белка по сайту, расположенному между последовательностями Lc-LTP и тиоредоксина, и очистки целевого белка Lc-LTP с помощью обращенно-фазовой ВЭЖХ.
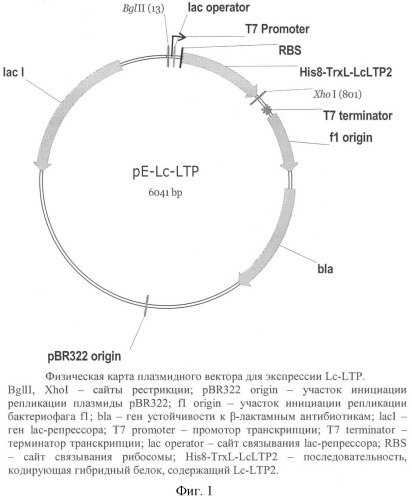
Особенностью предлагаемого вектора pE-Lc-LTP является присутствие в его составе гена, кодирующего один из белков подсемейства липид-транспортирующих белков чечевицы (Lc-LTP). Высокого уровня экспрессии и растворимости Lc-LTP в клетках Е.coli достигают за счет того, что указанный ген кодирует гибридный белок Trx-Lc-LTP, содержащий, наряду с аминокислотной последовательностью белка Lc-LTP, белок тиоредоксин в качестве белка-носителя. С целью дальнейшего высвобождения целевого белка Lc-LTP из молекулы гибридного белка Trx-Lc-LTP между последовательностями Lc-LTP и тиоредоксина вводят, как минимум, один сайт, позволяющий проводить избирательное расщепление гибридного полипептида химическим или ферментативным способом. Сайт для расщепления химическим способом может представлять собой остаток Met (расщепление бромцианом), дипептид Asp-Pro (расщепление кислотным гидролизом при нагревании), дипептид Asn-Gly (расщепление гидроксиламином). Сайт для расщепления ферментативным способом может представлять собой сайт расщепления тромбином, энтерокиназой, фактором Ха, протеазой PreScission, протеазой TEV или протеазой HRV 3С [Amau J. et al. (2006) Protein Expr Purif. 48(1): 1-13].
При расщеплении гибридного белка Trx-Lc-LTP бромцианом целесообразным является использование в качестве партнера для гетерологичной экспрессии модифицированного тиоредоксина А Е.coli, содержащего замену внутреннего остатка метионина на остаток другой аминокислоты, например, на лейцин (M37L). Известно, что подобное незначительное изменение первичной структуры не оказывает влияния на пространственную структуру и свойства тиоредоксина [Rudresh et al. (2002) Protein Eng. 15(8): 627-33]. Отсутствие внутренних остатков метионина в последовательности белка-носителя уменьшает число индивидуальных полипептидных фрагментов, образующихся в результате реакции с бромцианом. В предпочтительном случае расщепление гибридного белка дает всего один побочный продукт, значительно отличающийся по физико-химическим свойствам от целевого белка, что облегчает процесс очистки последнего.
Очистку целевого белка Lc-LTP упрощают за счет включения в состав гибридного полипептида Trx-Lc-LTP аффинной метки - аминокислотной последовательности, позволяющей проводить аффинную очистку гибридного полипептида на сорбентах с иммобилизованными (хелатированными) ионами металлов, т.е. металлохелатную очистку. В качестве такой последовательности обычно используют последовательность из 4-10 остатков гистидина, чаще всего - последовательность из шести остатков гистидина, которая вводится в N-концевую или С-концевую область гибридного белка, либо в область, разделяющую белок-носитель и целевой белок [Terpe K. (2003) Appl Microbiol Biotechnol. 60(5): 523-33]. В качестве аффинной метки для металлохелатной очистки также используют фрагменты HAT и 6×HN [U.S. Pat. No. 7,176,298].
В состав предлагаемого вектора pE-Lc-LTP включают регуляторные элементы, контролирующие экспрессию гибридного белка: промотор для РНК-полимеразы, сайт связывания бактериальной рибосомы, стартовый и стоп-кодоны. В качестве промотора используют природный (lac, Т5, Т7) или искусственный (tac) сайт инициации транскрипции. Для подавления базальной экспрессии гена гибридного белка в его регуляторную область может быть внедрен, как минимум, один сайт связывания lac-репрессора (lac оператор), а в состав вектора - дополнительный ген lac-репрессора (lacI).
В состав предлагаемого вектора pE-Lc-LTP также входят регуляторные элементы, необходимые для его репликации в клетках Е.coli, например, ori (ориджин репликации) плазмиды pBR322, pUC19 или pSC101.
Предлагаемый вектор содержит, как минимум, один маркерный ген, позволяющий проводить отбор клеток, содержащих векторную ДНК, путем выращивания на соответствующей селективной питательной среде. Маркерным геном может быть ген, определяющий устойчивость к антибиотику или семейству антибиотиков, например, к ампициллину (bla), тетрациклину (tet), канамицину (kan), стрептомицину (str) или хлорамфениколу (cat).
Конструирование новой векторной ДНК pE-Lc-LTP, экспрессирующей гибридный белок Trx-Lc-LTP, содержащий последовательность целевого белка Lc-LTP, может быть осуществлено путем лигирования фрагмента плазмиды, содержащего область инициации репликации и маркерный ген, со вставкой, кодирующей ген гибридного белка. Искусственный ген, который кодирует гибридный белок, может быть получен химическим синтезом набора олигонуклеотидных фрагментов с последующей сборкой и амплификацией промежуточных и конечного продуктов при помощи полимеразной цепной реакции (ПЦР). Выбор структуры олигонуклеотидных праймеров для синтеза каждого из структурных элементов (промотора, терминатора, оператора, сайта связывания рибосомы, тиоредоксина, аффинной последовательности, Lc-LTP) основывают на данных по их нуклеотидным последовательностям, доступных из открытых источников (GenBank, EMBL-Bank, DDBJ). Матрицей для амплификации последовательности тиоредоксина служит бактериальный геном, либо плазмида рЕТ-32а(+). Замену метионинового кодона в составе тиоредоксина (M37L) при необходимости осуществляют на стадии сборки методом направленного мутагенеза при помощи ПЦР. Перед лигированием для получения липких концов очищенный ампликон и плазмидный вектор обрабатывают рестриктазами. Продуктами лигазной реакции трансформируют компетентные клетки Е.coli штамма с выключенной системой рекомбинации и рестрикции ДНК, например, DH5α, DH10B или XL1-Blue. Отбор клонов, содержащих плазмидный вектор со вставкой, проводят при помощи ПЦР, а также рестрикционным анализом выделенной векторной ДНК. Правильность сборки конструкции определяют секвенированием векторной ДНК.
Штамм-продуцент гибридного белка Trx-Lc-LTP, содержащего последовательность целевого белка Lc-LTP, получают путем трансформации препаратом векторной ДНК рЕ-Lc-LTP компетентных клеток Е.coli и отбора клонов, обладающих способностью экспрессировать рекомбинантный белок. Наличие и уровень экспрессии рекомбинантного белка контролируют с помощью денатурирующего ПААГ-электрофореза. В качестве родительского штамма для создания штамма-продуцента используют штамм Е.coli, способный осуществлять контролируемую (индуцируемую) транкрипцию и трансляцию гена гибридного белка в составе pE-Lc-LTP. Так, например, штамм-продуцент для экспрессии гибридного белка под контролем промоторов для РНК-полимеразы Е.coli (lac, tac, T5) в комбинации с lac-оператором можно получить на основе штамма, обеспечивающего высокий уровень экспрессии lac-penpeccopa (M15(pREP4), XL I-Blue, JM109). При использовании промотора бактериофага Т7 необходимо использовать штамм, содержащий ген Т7 РНК-полимеразы под контролем lacUV5 промотора, например, BL21(DE3) или BL21(DE3)Origami, либо производить инфекцию штамма фагом-помощником СЕ6, содержащим ген Т7 РНК-полимеразы.
Клетки штамма-продуцента сохраняют культурально-морфологические и физиолого-биохимические признаки родительского штамма Е.coli. Клетки мелкие палочковидной формы, грамотрицательные, 1×3,5 мкм, подвижные, хорошо растут на обычных питательных средах (МПА, МПБ, LB-бульон, LB-агар, минимальная среда с глюкозой). Рост в жидких средах характеризуется ровным помутнением, осадок легко седиментирует. Клетки растут при температуре от 4°С до 42°С при оптимуме рН от 6,8 до 7,5; в качестве источника азота используют как минеральные соли аммония, так и органические соединения аминокислоты, пептон, триптон, дрожжевого экстракта. В качестве источника углерода при росте на минимальной среде используют аминокислоты, глицерин, углеводы.
Штамм-продуцент хранят на чашках и косяках при температуре 4°С, пересевая на свежие среды один раз в месяц, а также при температуре минус 70°С в среде LB с добавлением 10-30% глицерина.
Биосинтез продукта (экспрессию) проводят следующим образом: клетки штамма-продуцента выращивают в питательной среде (например, LB, MBL или М9) с добавлением необходимых селективных агентов (например, 100 мкг/мл ампициллина) при температуре 20-37°С до достижения культурой средней или поздней логарифмической фазы роста, ступенчато увеличивая объем культуральной жидкости путем последовательных пересевов материала, после чего индуцируют синтез белка и инкубируют дополнительно в течение 2-24 часов при температуре 20-37°С. Увеличения выхода рекомбинантного белка достигают с помощью принудительной аэрации культуральной жидкости и культивирования штамма-продуцента на обогащенных питательных средах (например, с добавлением глюкозы, глицерина, дикарбоновых кислот, аминокислот, неорганических солей, в т.ч. содержащих микроэлементы).
Очистка липид-транспортирующего белка Lc-LTP включает следующие обязательные стадии: разрушение клеток, металлохелатную очистку гибридного белка Trx-Lc-LTP, обработку гибридного белка реагентом, расщепляющим его по сайту, введенному между последовательностями тиоредоксина и целевого белка, разделение продуктов реакции и очистку целевого белка Lc-LTP методом обращенно-фазовой ВЭЖХ.
Для очистки клеточного материала от примесей, содержащихся в культуральной жидкости, особенно при выделении белка из клеточной культуры с низкой плотностью, желательным является предварительное концентрирование клеток с помощью центрифугирования или фильтрации. Разрушение (лизис) клеток осуществляют физическим или химическим способом или комбинацией способов, например, с помощью ультразвукового дезинтегратора. Френч-пресса, дезинтегратора Гаулина, с помощью осмотического шока, детергентов, хаотропных агентов, гидролитических ферментов. С целью снижения нагрузки на аффинный сорбент нерастворимые примеси из клеточного лизата могут быть удалены центрифугированием или фильтрацией. Для металлохелатной очистки может быть использован сорбент, содержащий такие хелатирующие группы как иминодиацетат (IDA), нитрилотриацетат (NTA) или карбоксиметиласпартат (СМА, TALON) в комплексе с катионами Ni2+, Со2+ или Cu2+ [Chaga G S. (2001) J Biochem Biophys Methods. 49(1-3): 313-34]. Элюирование гибридного белка проводят, используя градиент рН или концентрации имидазола, либо добавляя в буфер ЭДТА. При необходимости проводят очистку продуктов реакции расщепления гибридного белка с помощью повторной металлохелатной хроматографии. На завершающей стадии может быть проведена повторная очистка целевого белка методом обращенно-фазовой ВЭЖХ.
Идентичность полученного Lc-LTP природному белку устанавливают методами денатурирующего электрофореза в ПААГ, MALDI-времяпролетной масс-спектрометрии, секвенированием N-концевой аминокислотной последовательности по методу Эдмана, тестированием антимикробной активности методом серийных разведении в жидкой питательной среде. Степень очистки определяют методами денатурирующего ПААГ-электрофореза и MALDI-времяпролетной масс-спектрометрии, а также с помощью повторной обращенно-фазовой ВЭЖХ.
На фиг.1 представлена физическая карта рекомбинантного вектора для экспрессии Lc-LTP. На фиг.2 показаны результаты электрофоретического анализа гибридного белка и Lc-LTP на разных стадиях очистки. На фиг.3 представлена хроматограмма очистки Lc-LTP методом обращенно-фазовой ВЭЖХ. На фиг.4 приведен масс-спектр очищенного Lc-LTP2.
Изобретение иллюстрируют следующие примеры.
Пример 1
Конструирование рекомбинантной плазмидной ДНК pE-Lc-LTP для экспрессии Lc-LTP
Нуклеотидную последовательность (SEQ ID No. 9, нуклеотиды 10-807), содержащую промотор транскрипции Т7 РНК-полимеразы, lac-оператор, участок связывания рибосомы и участок, кодирующий гибридный полипептид, содержащий последовательно связанные гистидиновый октамер, тиоредоксин с заменой M37L, сайт расщепления кислотным гидролизом, сайт расщепления бромцианом и Lc-LTP, получают химико-ферментативным синтезом с помощью полимеразной цепной реакции (ПЦР). Олигонуклеотиды, используемые в ПЦР, синтезируют твердофазным фосфоамидитным методом с наращиванием олигонуклеотидной цепи в направлении от 3'-конца к 5'-концу с помощью защищенных фосфамидитов - 5'-диметокситритил-N-ацил-2'-дезоксинуклеозид-3'-O-(β-цианэтилдиизопропиламино)-фосфитов, активированных тетразолом. Фрагмент, кодирующий белок-носитель тиоредоксин (M37L), получают методом ПЦР-амплификации и направленного мутагенеза с помощью ген-специфических праймеров, используя в качестве исходной матрицы плазмиду рЕТ32а(+), содержащую ген тиоредоксина.
Фрагмент, кодирующий зрелый Lc-LTP, получают методом ПЦР, используя в качестве матрицы плазмиду pGEM-T (Promega) с клонированным фрагментом кДНК предшественника изоформы Lc-LTP2. Для получения данной плазмиды из проращенных семян чечевицы Lens culinaris выделяют суммарную РНК, проводят реакцию обратной транскрипции с олиго-dT праймером, после чего проводят быструю амплификацию 3'-концов кДНК Lc-LTP, используя вырожденные ген-специфичные праймеры на консервативный участок, соответствующий сигнальному пептиду Lc-LTP, затем клонируют полученный ампликон в pGEM-T векторе, проводят скрининг клонов и с помощью секвенирования по Сэнгеру находят клон, содержащий искомую плазмиду.
Остальные участки последовательности pE-Lc-LTP получают путем последовательного отжига и элонгации взаимно перекрывающихся олигонуклеотидов, а также отжига, элонгации и амплификации промежуточных продуктов синтеза. На завершающей стадии синтеза последовательность амплифицируют с помощью праймеров, несущих на 5'-концах сайты узнавания рестриктаз BglII и XhoI. Продукт амплификации гидролизуют указанными рестриктазами, очищают электрофорезом в 1,5% агарозном геле, полосу ДНК величиной 790 п.о. выделяют из геля методом электроэлюции в 15% раствор ПЭГ-6000 и лигируют с фрагментом ДНК размером 5,3 тыс. п.о., полученным в результате обработки плазмиды pET31b(+) рестриктазами BglII и XhoI. В результате лигазной реакции образуется кольцевая ковалентно замкнутая ДНК размером 6041 п.о. Продуктами лигазной реакции трансформируют компетентные клетки E.coli DH10B, приготовленные с помощью 0,1 М хлорида кальция. После трансформации суспензию бактерий смешивают с питательной средой LB, растят 1 ч при 37°С и высевают на чашки Петри с LB-агаром, содержащим 50 мкг/мл ампициллина.
Первичный отбор клонов, содержащих нужную плазмиду, осуществляют методом «ПЦР с клонов» с использованием праймеров на плазмидный остов и вставку. Отобранные клоны подращивают в жидкой питательной среде и выделяют плазмидной ДНК, которую анализируют на наличие вставки с помощью рестрикционного анализа. Окончательное строение плазмид, содержащих требуемый фрагмент, подтверждают определением нуклеотидной последовательности секвенированием по Сэнгеру. По данным секвенирования отбирают ту плазмиду, у которой нуклеотидная последовательность лигированной вставки полностью идентична запланированной (фиг.2, SEQ ID No. 9).
Пример 2
Конструирование рекомбинантной плазмидной ДНК pE-Lc-LTP для экспрессии Lc-LTP
Фрагмент ДНК (SEQ ID No. 10, нукюотиды 10-784), содержащий промотор транскрипции Т7 РНК-полимеразы, участок связывания рибосомы и участок, кодирующий гибридный полипептид, содержащий последовательно связанные гистадиновый октамер, тиоредоксин (M37L), сайт расщепления кислотным гидролизом, сайт расщепления бромцианом и Lc-LTP, получают химико-ферментативным синтезом, как описано в примере 1, используя в качестве матрицы для амплификации фрагмента, кодирующего Lc-LTP, плазмиду pGEM-T с клонированным фрагментом кДНК изоформы Lc-LTP4. Продукт амплификации гидролизуют рестриктазами BglII и XhoI, очищают электрофорезом в 1,5% агарозном геле, полосу ДНК величиной 765 п.о. выделяют из геля методом электроэлюции в 15% раствор ПЭГ-6000 и лигируют с фрагментом ДНК размером 3,5 тыс. п о., полученным в результате обработки плазмиды pET20b(+) рестриктазами BglII и XhoI. В результате лигазной реакции образуется кольцевая ковалентно замкнутая ДНК размером 4270 п.о. Дальнейшие операции совершают, как описано в примере 1. Методом секвенирования по Сэнгеру подтверждают соответствие нуклеотидной последовательности полученной конструкции SEQ ID No. 10.
Пример 3
Конструирование рекомбинантной плазмидной ДНК pE-Lc-LTP для экспрессии Lc-LTP
Фрагмент ДНК (SEQ ID No. 11, нуклеотиды 119-743), кодирующий гибридный полипептид, содержащий последовательно связанные тиоредоксин A E.coli, сайт расщепления кислотным гидролизом, сайт расщепления бромцианом и Lc-LTP, получают химико-ферментативным синтезом, как описано в примере 1, используя в качестве матрицы для амплификации фрагмента, кодирующего Lc-LTP, плазмиду pGEM-T с клонированным фрагментом кДНК изоформы Lc-LTP8. Продукт амплификации гидролизуют рестриктазами BamHI и BglII, очищают электрофорезом в 1,5% агарозном геле, полосу ДНК величиной 615 п.о. выделяют из геля методом электроэлюции в 15% раствор ПЭГ-6000 и лигируют с линеаризованной плазмидной ДНК pQE-70 (Qiagen) размером 3,4 тыс. п.о., полученной в результат обработки рестриктазами BamHI и BglII. В результате лигазной реакции образуется кольцевая ковалентно замкнутая ДНК размером 4035 п.о. Дальнейшие операции выполняют, как описано в примере 1. Методом секвенирования по Сэнгеру подтверждают соответствие нуклеотидной последовательности полученной конструкции SEQ ID No. 11.
Пример 4
Получение штамма-продуцента E.coli, вырабатывающего гибридный белок, содержащий Lc-LTP, и определение его продуктивности
Проводят трансформацию клеток Е.coli BL21(DE3) плазмидой pE-Lc-LTP, описанной в примере 1. Бактериологической петлей переносят выросшие колонии в 10 мл жидкой среды LB, содержащей 150 мкг/мл ампициллина, подращивают до оптической плотности OD600 0,7 на термостатируемой качалке со скоростью вращения 200 мин-1 при температуре 37°С, отбирают 0,3 мл культуры для последующего электрофоретического анализа, добавляют индуктор - изопропилтио-β-галактозид до концентрации 0,2 мМ и продолжают инкубацию при температуре 37°С в течение 5 ч, отбирая каждый час пробы по 0,3 мл для определения оптической плотности OD600 и последующего электрофоретического анализа. Равные аликвоты суспензии клеток, отобранных до внесения индуктора и после завершения роста, центрифугируют, отделяют супернатант и анализируют осадок клеток ПААГ-электрофорезом в денатурирующих условиях. Для этого образцы лизируют буфером, содержащим 2% SDS, на водяной бане в течение 5 мин. Электрофорез проводят в 15% SDS-ПААГ. Гель прокрашивают 0,1% кумасси G-250 в присутствии 25% изопропилового спирта по стандартной методике. Появление отчетливой полосы в районе 23 кДа в образцах, отобранных после индукции, свидетельствует о способности штамма синтезировать гибридный полипептид, содержащий Lc-LTP. Относительное содержание рекомбинантного белка, составляющее около 20%, определяют путем сканирования и денситометрического анализа окрашенных гелей.
Пример 5
Получение рекомбинантного липид-транспортирующего белка Lc-LTP
Культивирование клеток штамма-продуцента Eschenchia coli, полученного согласно примеру 4, проводят следующим образом:
Клетки штамма-продуцента выращивают в жидкой среде LB с добавлением 100 мкг/мл ампициллина и 1% глюкозы до достижения культурой оптической плотности OD600 0,7 при температуре 37°С. Индукцию синтеза белка проводят с помощью изопропил-β-D-галактозида в концентрации 1,0 мМ, после чего инкубируют 4 часа при температуре 37°С. Уровень экспрессии гибридного белка, а также содержание гибридного белка и Lc-LTP2 в препарате на разных стадиях очистки определяют с помощью ПААГ-электрофореза в денатурирующих условиях (фиг.2).
По окончании ферментации клетки продуцента гибридного белка (биомассу) отделяют центрифугированием при 4000 g в течение 10 мин, ресуспендируют в буфере А (50 мМ трис-HCl, 0,5 М NaCl, 20 мМ имидазола, рН 7,8, 1 мМ PMSF) и разрушают с помощью ультразвукового гомогенизатора. Полученный лизат центрифугируют при 25000 g в течение 20 мин. Все работы по получению осветленного лизата проводят при температуре 4°С. Очистку гибридного белка, содержащего аффинную октагистидиновую последовательность, осуществляют с помощью металлохелатной хроматографии на препаративной колонке с Ni-NTA агарозой, уравновешенной тем же буфером А. Для этого осветленный лизат наносят на колонку и элюируют связавшийся с носителем гибридный белок буфером В (50 мМ трис-HCl, 0,5 М NaCl, 0,5 М имидазола, рН 7,8). Детектирование ведут при длине волны 280 нм Элюат, содержащий гибридный белок, диализируют относительно воды в течение ночи и лиофильно высушивают.
Очищенный гибридный белок растворяют в 80% трифторуксусной кислоте в концентрации 10 мг/мл, добавляют равную массу бромциана (1 г бромциана на 1 г белка) и выдерживают при температуре 25°С в защищенном от света месте в течение 16 ч. Реакцию останавливают добавлением пятикратного объема деионизированной воды, после чего образец лиофильно высушивают. Процедуру добавления воды и упаривания повторяют трижды.
Продукты реакции растворяют в 80% трифторуксусной кислоте. Нерастворимый осадок отделяют центрифугированием и отбрасывают. Очистку Lc-LTP2 проводят с помощью обращенно-фазовой ВЭЖХ на препаративных колонках в линейном градиенте концентрации ацетонитрила 5-80% в течение 60 мин в присутствии 0,1% ТФУ (фиг.3). Детектирование ведут при длине волны 214 нм. Фракцию, содержащую Lc-LTP2, собирают и лиофильно высушивают.
Для определения N-концевой аминокислогной последовательности Lc-LTP2 применяют автоматическое микросеквенирование на приборе Precise 491 cLC Protein Sequencing System (PE Applied Biosystems). Идентификацию фенилтиогидантоин-производных аминокислот проводят на анализаторе 120А РТН Analyzer (Applied Biosystems). В основе методики автомачического определения аминокислотной последовательности пептидов и белков лежит метод химической деградации полипептидной цепи по методу Эдмана, позволяющий последовательно отщеплять N-концевые аминокислотные остатки в виде фенилтиогидантоинов и идентифицировать отщепленные производные аминокислот методом обращенно-фазовой ВЭЖХ. В результате автоматического микросеквенирования установлена идентичность аминокислотных последовательностей генно-инженерного и природного Lc-LTP2.
Для определения молекулярной массы очищенного белка используют MALDI-времяпролетный масс-спектрометрический анализ на приборе Reflex III (Bruker Daltonics), оснащенном УФ-лазером с длиной волны 336 нм. В качестве матрицы используют 2,5-дигидроксибензойную кислоту в смеси, содержащей 20% ацетонитрил и 0,1% трифторуксусную кислоту. Полученный пик с т/г 9283,416 (фиг.4) соответствует молекулярному иону природного Lc-LTP2 (расчечная молекулярная масса составляет 9282,73 Да).
Пример 6
Тестирование антимикробной активности Lc-LTP
Антибактериальную активность природного и рекомбинантного Lc-LTP2 в отношении Agrobacterium tumefaciens штамма А281 определяют методом серийных разведении в жидкой питательной среде, используя 96-луночные планшеты. Бактериальные клетки культивируют в течение ночи при 30°С на стерильной чашке Петри с LB агаром. Свежую биомассу тест-культуры вносят в 3 мл двукратно разбавленной среды LB (ЅLB), и инкубируют при 30°С на роторной качалке до достижения клетками 1÷1,5 единиц оптической плотности, что соответствует 2·108 клеток/мл. К аликвотам (110 мкл) десятикратно разбавленной экспоненциальной культуры в среде ЅLB добавляют по 10 мкл стерильных растворов белка различной концентрации в 0,1% ТФУ и инкубируют в термостатируемом шейкере при 30°С. Бактериальный рост оценивают микроспектрофотометрически, измеряя оптическую плотность культуры в лунках при 620 нм при помощи планшетного фотометра Multiscan EX (Thermo). В качестве отрицательного контроля используют 0,1% ТФУ. Полученный рекомбинантный Lc-LTP2 ингибирует рост грамотрицательной фитопатогенной бактерии Agrobacterium tumefaciens с той же эффективностью, что и природный белок. В присутствии генно-инженерного или природного Lc-LTP2 в концентрациях 40,5 мкМ по истечении 24 ч наблюдается 50% ингибирование роста бактериальных клеток.
1. Плазмидный вектор рЕ-Lc-LTP для экспрессии в клетках Escherichia coli липид-транспортирующих белков чечевицы Lens culinaris, содержащий ген гибридного полипептида Trx-Lc-LTP, включающего аминокислотную последовательность белка тиоредоксина, аффинную метку, сайт расщепления и последовательность липид-транспортирующего белка Lc-LTP, выбранную из группы последовательностей SEQ ID Nos.1-8, гдеаффинная метка - аминокислотная последовательность, позволяющая проводить аффинную очистку гибридного полипептида на сорбентах с иммобилизованными ионами металлов,сайт расщепления - участок аминокислотной последовательности, расположенный между последовательностями липид-транспортирующего белка Lc-LTP и тиоредоксина, позволяющий проводить частичное расщепление гибридного полипептида химическим или ферментативным способом.
2. Плазмидный вектор по п.1, содержащий в составе гена гибридного полипептида промотор Т5.
3. Плазмидный вектор по п.1, содержащий в составе гена гибридного полипептида промотор Т7.
4. Плазмидный вектор по п.1, где последовательность белка тиоредоксина представляет собой последовательность тиоредоксина A Escherichia coli с заменой внутреннего остатка Met на Leu, а сайт расщепления представляет собой остаток Met.
5. Плазмидный вектор по п.1 с нуклеотидной последовательностью, выбранной из группы последовательностей SEQ ID Nos.9-11.
6. Штамм бактерии Escherichia coli - продуцент гибридного полипептида Trx-Lc-LTP, полученный путем трансформации клеток родительского штамма BL21(DE3) или XLl-Blue плазмидным вектором pE-Lc-LTP.
7. Способ получения липид-транспортирующих белков чечевицы Lens culinaris, включающий экспрессию целевого белка в составе гибридного полипептида Trx-Lc-LTP в штамме-продуценте, полученном путем трансформации клеток родительского штамма бактерии Escherichia coli BL21(DE3) плазмидным вектором pE-Lc-LTP, лизис клеток, аффинную очистку гибридного белка на металлохелатном носителе, расщепление гибридного белка по сайту, расположенному между последовательностями Lc-LTP и тиоредоксина, и очистку целевого липид-транспортирующего белка методом обращенно-фазовой ВЭЖХ.
8. Способ по п.7, где гибридный белок расщепляют бромцианом в кислой среде по остатку Met.
9. Способ по п.7, где гибридный белок расщепляют кислотным гидролизом по связи Asp-Pro.