Новый сконструированный микроорганизм, продуцирующий гомо-янтарную кислоту, и способ получения янтарной кислоты с его применением
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии. Предлагается микроорганизм, продуцирующий гомо-янтарную кислоту, из рода Mannheimia, Actinobacillus или Anaerobiospirillum. Данный микроорганизм был получен путем разрушения гена, кодирующего лактатдегидрогеназу (IdhA), гена, кодирующего фосфотрансацетилазу (pta) и гена, кодирующего ацетаткиназу (ackA), без разрушения гена, кодирующего пируватформатлиазу (pfl). Кроме того, предлагается способ получения данного микроорганизма и способ производства янтарной кислоты с его применением. Предложенный мутантный микроорганизм обладает свойством высокой скорости роста и продуктивности янтарной кислоты при отсутствии или малой продукции других органических кислот, по сравнению с предшествующими штаммами, продуцирующими янтарную кислоту. Данный микроорганизм пригоден для производства янтарной кислоты для промышленного применения. 5 н. и 8 з.п. ф-лы, 7 ил., 2 табл.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к мутантному микроорганизму, выбранному из группы, состоящей из рода Mannheimia, рода Actinobacillus и рода Anaerobiospirillum, продуцирующему гомо-янтарную кислоту, и способу получения гомо-янтарной кислоты с его применением, и более конкретно, к микроорганизму, выбранному из группы, состоящей из рода Mannheimia, рода Actinobacillus и рода Anaerobiospirillum, продуцирующему янтарную кислоту с высокой концентрацией при отсутствии или минимуме выработки других органических кислот в анаэробных условиях, полученному путем разрушения гена, кодирующего лактатдегидрогеназу (ldhA), гена, кодирующего фосфотрансацетилазу (pta), и гена, кодирующего ацетаткиназу (ackA), без разрушения гена, кодирующего пируватформатлиазу (pfl), а также к способу получения янтарной кислоты с его применением.
Предшествующий уровень техники.
Янтарная кислота (НООССН2СН2СООН), дикарбоновая кислота, состоящая из 4 атомов углерода, является органической кислотой, имеющей большое значение и широко применяющейся в качестве сырья в медицине, питании, косметике и химических продуктах других видов промышленности (Zeikus et al., Appl. Microbiol. Biotechnol., 51:545, 1999; Song et al., Enzyme Microbial Technol., 39:352, 2006). В частности, ожидается резкое повышение потребности в янтарной кислоте в качестве основного источника биодеградируемых макромолекул, в связи с недавним резким повышением цен на нефть (Willke et al., Appl. Microbiol. Biotechnol., 66:131, 2004).
Янтарную кислоту можно производить путем химического синтеза и ферментации. Однако основная часть янтарной кислоты для промышленного применения в настоящее время вырабатывается с помощью способов химического синтеза с применением n-бутана и ацетилена, полученных из нефти в качестве сырьевого материала, китайскими химическими компаниями, японскими химическими компаниями и большими химическими компаниями, такими как BASF, DuPont, BP chemical, но только малое количество янтарной кислоты для специального применения, такого как в медицине и т.д., производится способом традиционной микробной ферментации. Вышеуказанные способы химического синтеза связаны с проблемой сброса больших количеств вредных отходов, сточных вод и газа (например, СО и др.), образующихся в способе производства янтарной кислоты. В частности, в качестве основного материала применяется ископаемое топливо с высокой возможностью истощения, и таким образом, имеется срочная потребность в разработке способа получения янтарной кислоты для замены ископаемого топлива альтернативным топливом, таким как возобновляемые ресурсы.
Для преодоления этих проблем, обусловленных способом химического синтеза для получения янтарной кислоты, многими исследователями был проведен интенсивный и обширный анализ продукции янтарной кислоты путем микробной ферментации с применением различных возобновляемых ресурсов. Микроорганизмы, применяемые для продукции янтарной кислоты, варьируют, но в целом могут быть классифицированы как рекомбинантные Escherichia. coli, рубцовые бактерии (Actinobacillus, Bacteroides, Mannheimia, Succinimonas, Succinivibrio, etc.) и Anaerobiospirillum (Song et al., Enzyme Microbial Technol., 39:352, 2006).
При исследованиях продукции янтарной кислоты с применением рекомбинантной E.coli, группой исследователей Чикагского университета были предприняты попытки повысить продукцию янтарной кислоты с помощью получения мутанта AFP111 (АТСС No. 202021), полученного способом манипуляции геном транспорта глюкозы (ptsG) при удалении генов (ldh и pfl), вовлеченных в продукцию молочной кислоты и муравьиной кислоты, у E.coli (Патент США №5770435).
Авторы данного изобретения подвергли амплификации ген яблочного фермента (sfcA), вовлеченный в продукцию янтарной кислоты, у рекомбинантной E.coli, штамм NZN111, у которого удалили гены ldh и pfl, для подавления пировиноградной кислоты, накапливающейся в способе ферментации штамма NZN111, таким образом повышая продукцию янтарной кислоты (Hong et al., Biotechnol. Bioeng., 74:89, 2001). Кроме того, группа исследователей Университета Джорджии сконструировала штамм AFP111/pTrc99A-рус путем экспрессии гена пируваткарбоксилазы (рус) в штамме AFP111, а затем применила этот штамм для продукции янтарной кислоты (Vemuri et al., J. Ind. Microbiol. Biotechnol., 28:325, 2001). Недавно группа исследователей Университета Райса сообщила о конструкции рекомбинантных штаммов E.coli путем манипуляции генами, вовлеченными в пути гликолиза, цикла трикарбоновых кислот и глиоксилатного цикла, чтобы индуцировать продукцию янтарной кислоты в анаэробных условиях (Lin et al., Eng., 7:116, 2005; Lin et al., Biotechnol. Bioeng., 90:775, 2005).
Штамм Actinobacillus и штамм Mannheimia, являющиеся разновидностями рубцовых бактерий, и штамм Anaerobiospirillum, являющиеся другими бактериями, продуцирующими янтарную кислоту, как известно, превосходны в отношении выработки янтарной кислоты, поэтому проводятся активные исследования с этими штаммами. Группа исследователей Мичиганского института биотехнологии (MBI) в Америке открыла штамм Actinobacillus succinogenes 130Z (АТСС No.55618) для разработки способа производства янтарной кислоты и сконструировала различные мутантные штаммы Actinobacillus succinogenes с применением традиционного химического мутагенеза для разработки способа производства и очистки янтарной кислоты (Патент США №5521075; патент США №5168055; патент США №5143834).
Однако способы производства янтарной кислоты с применением микробной ферментации, разработанные до настоящего времени, отличаются низкой продуктивностью менее 2 г/л/ч, и это, в частности, требует больших затрат для отделения и очистки янтарной кислоты, поскольку янтарная кислота вырабатывается вместе с большими количествами различных органических кислот и этанола в виде побочных продуктов до известной степени при ферментации. Хотя вышеупомянутые результаты показали влияние уменьшения молочной кислоты, муравьиной кислоты, уксусной кислоты и этанола в качестве побочных продуктов у некоторых рекомбинантных штаммов, не наблюдается их полной элиминации. В дополнение, в других рекомбинантных мутантных штаммах были некоторые случаи, когда скорость их роста становилась настолько низкой, что продуктивность янтарной кислоты в целом не возрастала. Таким образом, имеется настоятельная потребность в разработке нового штамма, продуцирующего янтарную кислоту, который обладает высокой продуктивностью янтарной кислоты и предотвращает выработку побочных продуктов (Hong et al., Biotechnol. Lett., 22:871, 2000).
Чтобы разработать новый штамм, продуцирующий янтарную кислоту для удовлетворения вышеуказанной потребности, было проведено выделение штамма, обладающего высокой продуктивностью янтарной кислоты, изучение его геномной последовательности, исследование его метаболических характеристик и создание техники генетической манипуляции, требующейся для конструкции рекомбинантного штамма. До настоящего времени, в случае бактерий с высокой продуктивностью янтарной кислоты, была завершена полная геномная последовательность штамма М.succiniciproducens MBEL 55Е (КСТС 0769ВР), но для бактерий, таких как Actinobacillus, Anaerobiospirillum и т.д. об этом еще не сообщалось. Хотя, как сообщалось, были предприняты попытки производства янтарной кислоты путем амплификации гена фосфоенолпируват-карбоксикиназы (pckA) из A.succinogenes и A.succiniciproducens в E.coli (Kim et al., Appl. Environ. Microbiol., 70:1238, 2004; Laivenieks et al., Appl. Environ. Microbiol., 63:2273, 1997), не было попыток разработать рекомбинантный штамм для продукции янтарной кислоты на основе геномной последовательности.
Авторы настоящего изобретения сообщили о том, что выделили М.succiniciproducens MBEL 55E (КСТС0769ВР), продуцирующий янтарную кислоту с высокой эффективностью, от местных корейских коров, исследовали геномную последовательность и охарактеризовали метаболические свойства штамма (Hong et al., Nature Biotechnol., 22:1275, 2004). Также авторы данного изобретения сконструировали бактериальный мутант, M.succiniciproducens LPK (KCTC10558BP), путем разрушения гена, кодирующего лактатдегидрогеназу (ldhA), и гена, кодирующего пируватформатлиазу (pfl), в М.succiniciproducens MBEL 55E (КСТС 0769ВР), являющихся разновидностью рубцовых бактерий, для подавления продукции молочной и муравьиной кислот. В дополнение к этому, авторы данного изобретения сконструировали мутантный M.succiniciproducens LPK7 (КСТС1062ВР) путем разрушения гена фосфотрансацетилазы (pta) и гена ацетаткиназы (ackA) в мутантном штамме M.succiniciproducens LPK, чтобы подавить продукцию уксусной кислоты, для культивирования бактериальных мутантов в анаэробных условиях (WO 05/052135 A1; Lee et al., Appl. Environ. Microbiol. 72:1939, 2006), увеличивая таким образом выработку янтарной кислоты. Однако в случае таких мутантных штаммов, хотя выработка побочных продуктов, муравьиной кислоты и уксусной кислоты, может быть до некоторой степени подавлена, во время ферментации накапливается большое количество пировиноградной кислоты, а больше всего скорость роста штамма становится настолько низкой по сравнению с диким штаммом, что нельзя добиться отличной продуктивности янтарной кислоты.
Тем временем сообщалось, что ген пируватформатлиазы (pfl) участвует в превращении пировиноградной кислоты в ацетил-коэнзим А (ацетил-КоА), таким образом влияя на клеточный рост и перераспределение пировиноградной кислоты (Wolfe, Microbial. Mol. Biol. Rev., 69:12, 2005).
Соответственно авторы данного изобретения предприняли усиленные попытки конструкции мутантного микроорганизма, способного производить гомо-янтарную кислоту с высоким уровнем выхода при минимизации снижения скорости микробного роста и полном подавлении образования различных побочных продуктов, включая пировиноградную кислоту, и разработки способа его ферментации, и в результате сконструировали бактериальный мутантный М.succiniciproducens PALK (KCTC10973BP) путем разрушения гена лактатдегидрогеназы (ldhA), гена фосфотрансацетилазы (pta) и гена ацетаткиназы (ackA) без разрушения гена пируватформатлиазы (pfl) в штамме М.succiniciproducens MBEL 55E (КСТС 0769ВР), являющемся разновидностью рубцовых бактерий, а затем ферментировали мутантный штамм в анаэробных условиях с применением глюкозы и глицерина в качестве источника углерода, и подтвердили, что мутантный штамм может продуцировать в особенности гомо-янтарную кислоту с высоким выходом, таким образом завершая данное изобретение.
Краткое изложение сущности изобретения
Таким образом, задачей данного изобретения является обеспечение мутантного микроорганизма с высокой скоростью роста и продуктивностью янтарной кислоты, производящего только янтарную кислоту с высоким выходом при отсутствии или минимальной продукции других органических кислот во время периода анаэробной ферментации.
Другой задачей данного изобретения является обеспечение способа производства гомо-янтарной кислоты без накопления других побочных продуктов, путем культивирования мутантного микроорганизма с применением глюкозы и глицерина в качестве источников углерода в анаэробных условиях.
Для достижения вышеуказанных задач данное изобретение обеспечивает мутантный микроорганизм, лишенный гена лактатдегидрогеназы (ldhA), гена фосфотрансацетилазы (pta) и гена ацетаткиназы (ackA) при наличии гена пируватформатлиазы (pfl), обладающий свойством продукции только янтарной кислоты при высокой концентрации в анаэробных условиях, в то время как микроорганизм выбран из группы, состоящей из рода Mannheimia, рода Actinobacillus и рода Anaerobiospirillum.
Далее данное изобретение обеспечивает мутантный микроорганизм Mannheimia succiniciproducens PALK (KCTC10973BP), лишенный гена лактатдегидрогеназы (ldhA), гена фосфотрансацетилазы (pta) и гена ацетаткиназы (ackA), при наличии гена пируватформатлиазы (pfl) в М.succiniciproducens, обладающий свойством продукции янтарной кислоты с высокой концентрацией при отсутствии или малой продукции других органических кислот в анаэробных условиях.
Дополнительно данное изобретение обеспечивает способ производства мутантного микроорганизма, включающий этапы: (а) получения мутантного микроорганизма, лишенного гена, кодирующего лактатдегидрогеназу (ldhA), путем разрушения гена, кодирующего лактатдегидрогеназу (ldhA) в геноме продуцирующего янтарную кислоту микроорганизма, выбранного из группы, включающей род Mannheimia, род Actinobacillus и род Anaerobiospirillum, с применением гомологичной рекомбинации; и (b) получения мутантного микроорганизма, лишенного гена, кодирующего лактатдегидрогеназу (ldhA), гена, кодирующего фосфотрансацетилазу (pta), и гена, кодирующего ацетаткиназу (ackA), путем разрушения гена, кодирующего фосфотрансацетилазу (pta), и гена, кодирующего ацетаткиназу (ackA), в геноме мутантного микроорганизма, лишенного гена, кодирующего лактатдегидрогеназу (ldhA), путем гомологичной рекомбинации.
Далее данное изобретение обеспечивает способ производства янтарной кислоты, включающий этапы: культивирования мутантных микроорганизмов в анаэробных условиях; и получения янтарной кислоты из культурального бульона.
Другие характеристики и воплощения данного изобретения разъясняются в следующем подробном описании и прилагаемой формуле.
Краткое описание чертежей
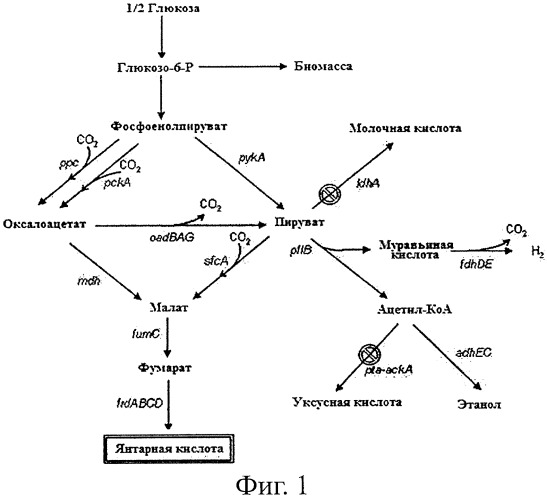
Фиг.1 является схематической диаграммой, показывающей путь выработки янтарной кислоты у мутантного микроорганизма по данному изобретению.
Фиг.2. показывает способ конструирования вектора замещения для разрушения ldhA (pMLKO-sacB) путем гомологичной рекомбинации.
Фиг.3 показывает способ конструирования бактериального мутанта (М.succinicproducens LK) путем разрушения гена ldhA у Mannheimia succiniciproducens MBEL55E путем гомологичной рекомбинации.
Фиг.4 показывает способ конструирования вектора замещения для разрушения pta и ackA (pPTA-sacB) путем гомологичной рекомбинации.
Фиг.5 показывает способ конструирования бактериального мутанта (М.succinicproducens PALK) путем разрушения гена pta-ackA у М.succiniciproducens LK путем гомологичной рекомбинации.
Фиг.6 является фотографией электрофореграммы, показывающей разрушение pta-ackA у М.succiniciproducens PALK, где М представляет маркер 1 кб, линии 1-6 представляют ПЦР-фрагменты (1,1 кб) с применением праймеров, PAU1 и SP1; полосы А-F представляют ПЦР-фрагменты (1,5 кб) с применением праймеров, SP2 и PAD2.
Фиг.7 показывает характеристики культуры предложенного изобретением М.succiniciproducens PALK в анаэробных условиях при насыщении СО2.
Подробное изложение сущности изобретения
В одном аспекте данное изобретение относится к мутантному микроорганизму, лишенному гена лактатдегидрогеназы (ldhA), гена фосфотрансацетилазы (pta) и гена ацетаткиназы (ackA) при наличии гена пируватформатлиазы (pfl), обладающему свойством продукции только янтарной кислоты с высокой концентрацией, при отсутствии или минимальной продукции других органических кислот в анаэробных условиях, где микроорганизм выбран из группы, состоящей из рода Mannheimia, рода Actinobacillus и рода Anaerobiospirillum.
В данном изобретении продуцирующий янтарную кислоту микроорганизм относится к микроорганизму, способному продуцировать чрезвычайно большое количество янтарной кислоты по сравнению с продукцией этанола или других органических кислот, который можно применять в промышленном производстве янтарной кислоты путем ферментации.
Типичные микроорганизмы, продуцирующие янтарную кислоту, включают рубцовые бактерии и другие виды бактерий, вырабатывающих янтарную кислоту, такие как Anaerobiospirillum succiniciproducens. Из частичной генетической информации (16s rRNA), анализа ферментов и результатов ферментации Actinobacillus succinogenes и М.succiniciproducens и тех, что являются видами рубцовых бактерий, Anaerobiospirillum succiniciproducens и различных бактерий, которые известны как продуцирующие янтарную кислоту к настоящему времени, было установлено, что главный путь биосинтеза для производства янтарной кислоты из источника углерода у микроорганизмов, продуцирующих янтарную кислоту, почти идентичен пути биосинтеза для продукции янтарной кислоты у вида Mannheimia, являющегося разновидностью рубцовых бактерий (Таблица 1; Van der Werf et al., Arch Microbiol., 167:332, 1997; Laivenieks et al., Appl. Environ. Microbiol., 63:2273, 1997; Samuelov et al., App. Environ. Microbiol., 65:2260, 1999; Kim et al., Appl. Environ. Microbiol., 70:1238, 2004). Главным образом все рубцовые бактерии и A.succiniciproducens, участвующие в продукции янтарной кислоты, превращают фосфоенолпируват и пируват, С3 соединения, в оксалоацетат и малат, С4 соединения, с помощью CO2-фиксирующего фермента при продукции янтарной кислоты, таким образом производя янтарную кислоту. В дополнение, рубцовые бактерии и А.succiniciproducens вырабатывают уксусную кислоту, муравьиную кислоту и молочную кислоту в качестве побочных продуктов ферментации в анаэробных условиях, позволяя предположить, что все рубцовые бактерии, включая Mannheimia sp. и А.succiniciproducens, имеют тот же самый путь биосинтеза янтарной кислоты.
| Таблица 1 | |
| Продукция янтарной кислоты микроорганизмами. | |
| Штамм | Ссылки |
| Cytophaga succinicans | Anderson et al., J. Bacteriol., 81:130, 1961 |
| Fibrobacter succinogens | Wood et al., J. Cereal. Sci., 19:65, 1994 |
| Ruminococcus flavefaciens | Iannotti et al., Appl. Environ, Microbiol; 43:136, 1973 |
| Succinimonas amylolytica | Bryant, Bacteriol. Rev., 23:125, 1959 |
| Succinivibrio dextrinisolvens | Bryant, Bacteriol. Rev., 23:125, 1959 |
| Actinobacillus succinogenes | Glutter et al., Int. J. Syst. Bacteriol., 49:207, 1999 |
| Mannheimia succiniciproducens | Hong et al., Nature Biotechnol., 22:1275, 2004 |
В данном изобретении продуцирующий янтарную кислоту мутантный микроорганизм с высокой скоростью роста, способный вырабатывать янтарную кислоту с высокой концентрацией при отсутствии или низкой продукции других органических кислот, был сконструирован путем манипуляции геномом микроорганизма, продуцирующего янтарную кислоту. Другими словами, ген лактатдегидрогеназы (ldhA), ген фосфотрансацетилазы (pta) и ген ацетаткиназы (ackA) были разрушены в геномной ДНК М.succiniciproducens MBEL55E (КСТС0769ВР), таким образом был сконструирован бактериальный мутант М.succiniciproducens PALK (KCTC 10973BP), продемонстрировавший высокую скорость роста и вырабатывающий янтарную кислоту с высокой концентрацией, при отсутствии или низкой продукции других органических кислот.
В данном изобретении для разрушения каждого гена применялся способ замещения генов гомологичной рекомбинацией для инактивации, но может применяться любой способ без ограничения, если только он является способом генетической манипуляции, где соответствующий ген может быть модифицирован или удален так, чтобы фермент, кодируемый соответствующим геном, не вырабатывался.
В данном изобретении указанными микроорганизмами, продуцирующими янтарную кислоту, являются бактерии Anaerobiospirillum sp. или рубцовые бактерии, выбранные из группы, состоящей из Mannheimia sp. и Actinobacillus sp.
В данном изобретение мутантный микроорганизм предпочтительно является гомогенным ферментационным штаммом, продуцирующим только янтарную кислоту, при отсутствии или малой выработке других органических кислот в качестве побочных продуктов, причем количество каждой из других органических кислот предпочтительно меньше 1 мас.% от количества продуцируемой янтарной кислоты, а другие органические кислоты предпочтительно являются одной или более органическими кислотами, выбранными из группы, состоящей из молочной кислоты, уксусной кислоты, муравьиной кислоты и пировиноградной кислоты.
В другом аспекте данное изобретение относится к мутанту рубцовых бактерий М.succiniciproducens PALK (KCTC10973BP), лишенному гена лактатдегидрогеназы (ldhA), гена фосфотрансацетилазы (pta) и гена ацетаткиназы (ackA) у М.succiniciproducens, в то время как ген пируватформатлиазы (pfl) сохраняется у М.succiniciproducens, обладающего свойствами продукции янтарной кислоты с высокой концентрацией при отсутствии или малой продукции других органических кислот в анаэробных условиях.
Бактериальный мутант М.succiniciproducens LPK7 (КСТС10626ВР), сконструированный путем разрушения гена, кодирующего лактатдегидрогеназу (ldhA), гена, кодирующего пируватформатлиазу (pfl), гена, кодирующего фосфотрансацетилазу (pta), и гена, кодирующего ацетаткиназу (ackA) в геноме Mannheimia sp., применяли для сравнения продуктивности янтарной кислоты и скорости роста was М.succiniciproducens PALK (KCTC10973BP) по данному изобретению с традиционными бактериальными мутантами. При этом бактериальный мутант М.succiniciproducens LPK7 (КСТС10626ВР) имеет дополнительный разрушенный ген, кодирующий пируватформатлиазу (pfl) в мутантном штамме М.succiniciproducens PALK (KCTC10973BP) в соответствии с данным изобретением (WO 2005/052135; Lee et al., Appl. Environ. Microbiol. 72:1939, 2006).
М.succiniciproducens PALK (KCTC10973BP) по данному изобретению обладает высокой продуктивностью янтарной кислоты и не производит или производит малое количество побочных продуктов, таких как молочная кислота, уксусная кислота, муравьиная кислота и пировиноградная кислота, и таким образом демонстрирует превосходные свойства по сравнению с исходным типом М.succiniciproducens MBEL55E (КСТС0769ВР) по продукции янтарной кислоты, и ранее сконструированным бактериальным мутантом М.succiniciproducens LPK7 (КСТС10626ВР), и может вырабатывать янтарную кислоту с высоким выходом благодаря высокой скорости роста, высокой продуктивности янтарной кислоты и гомо-янтарной кислоты путем предотвращения накопления пировиноградной кислоты, по сравнению с ранее сконструированным бактериальным мутантом М.succiniciproducens LPK7 (КСТС10626ВР).
В еще одном аспекте данное изобретение относится к способу конструирования мутантного микроорганизма, включающему этапы: (а) получения мутантного микроорганизма, лишенного гена, кодирующего лактатдегидрогеназу (ldhA) путем разрушения гена, кодирующего лактатдегидрогеназу (ldhA), в геноме продуцирующего янтарную кислоту микроорганизма, выбранного из группы, состоящей из рода Mannheimia, рода Actinobacillus и рода Anaerobiospirillum, с применением гомологичной рекомбинации; и (b) получения мутантного микроорганизма, лишенного гена, кодирующего лактатдегидрогеназу (ldhA), гена, кодирующего фосфотрансацетилазу (pta), и гена, кодирующего ацетаткиназу (ackA), путем разрушения гена, кодирующего фосфотрансацетилазу (pta), и гена, кодирующего ацетаткиназу (ackA) в геноме мутантного микроорганизма, лишенного гена, кодирующего лактатдегидрогеназу (ldhA), с применением гомологичной рекомбинации.
В данном изобретении гомологичную рекомбинацию на этапе (а) предпочтительно выполняют с применением вектора генетического обмена, содержащего разрушенный ldhA, а гомологичную рекомбинацию на этапе (b) предпочтительно выполняют с применением вектора генетического обмена, содержащего разрушенный pta-ackA.
В данном изобретении вектором генетического обмена, содержащим разрушенный ldhA, предпочтительно является pMLKO-sacB, а вектором генетического обмена, содержащим разрушенный pta-ackA, предпочтительно является pMPKO-sacB.
Данное изобретение также обеспечивает способ производства янтарной кислоты, включающий этапы: культивирования вышеупомянутых микроорганизмов в анаэробных условиях; и извлечения янтарной кислоты из культурального бульона.
В данном изобретении для культуры в качестве источника углерода предпочтительно применяют глюкозу или глицерин, а количество каждой из других органических кислот, вырабатываемых в качестве побочных продуктов, предпочтительно составляет меньше 1 мас.% от количества вырабатываемой янтарной кислоты.
В еще одном аспекте данное изобретение относится к способу получения янтарной кислоты, включающему этапы: культивирования мутантного микроорганизма в анаэробных условиях; и извлечения янтарной кислоты из культурального бульона.
Культивирование мутантного микроорганизма, вырабатывающего янтарную кислоту по данному изобретению, и способ извлечения янтарной кислоты могут выполняться с помощью способов культивирования, известных в обычных способах ферментации и способах отделения и очистки янтарной кислоты.
В данном изобретении для культуры в качестве источника углерода предпочтительно применяют глюкозу или глицерин, а количество каждой из других органических кислот, вырабатываемых в качестве побочных продуктов, предпочтительно составляет меньше 1 мас.% от количества вырабатываемой янтарной кислоты.
Сведения, подтверждающие возможность осуществления изобретения
Данное изобретение далее подробно описано с помощью примеров. Однако для специалистов в данной области техники понятно, что данные примеры приведены только с иллюстративной целью, и данное изобретение не ограничивается примерами.
В частности, следующие примеры иллюстрируют только Mannheimia sp., являющийся организмом, продуцирующим янтарную кислоту, в качестве клетки-хозяина, для удаления генов в соответствии с данным изобретением. Однако специалистам в данной области техники понятно, что мутантный микроорганизм, продуцирующий гомо-янтарную кислоту, может быть получен даже при использовании других видов микроорганизмов, продуцирующих янтарную кислоту.
Пример 1. Конструирование ldhA вектора разрушения (pMLKO-sacB)
Чтобы разрушить ген лактатдегидрогеназы (ldhA) в геноме организма, продуцирующего янтарную кислоту, путем гомологичной рекомбинации, вектор генного обмена сконструировали следующим образом. Во-первых, геномную ДНК М.succiniciproducens MBEL55E (КСТС 0769ВР), в качестве матрицы, подвергали ПЦР с применением праймеров, показанных далее в SEQ ID NO: 1 и SEQ ID NO: 2 внизу, и далее полученный ПЦР фрагмент, содержащий ldhA-гомологичный участок 1 (L1) обрезали с SacI и PstI и вводили в pUC18 вектор (New England Biolabs, Inc., США), таким образом конструируя pUC18-L1.
SEQ ID NO: 1: 5'-CAGTGAAGGAGCTCCGTAACGCATCCGCCG
SEQ ID NO: 2: 5'-CTTTATCGAATCTGCAGGCGGTTTCCAAAA
В дополнение геномную ДНК М.succiniciproducens MBEL55E (КСТС 0769ВР), в качестве матрицы, подвергали ПЦР с применением праймеров, показанных далее в SEQ ID NO: 3 и SEQ ID NO: 4 внизу, а затем полученный ПЦР фрагмент, содержащий ldhA-гомологичный участок 2 (L2), обрезали с PstI и HindIII и вводили в pUC18-L1, таким образом конструируя pUC18-L1-L2.
SEQ ID NO: 3: 5'-GTACTGTAAACTGCAGCTTTCATAGTTAGC
SEQ ID NO: 4: 5'-GCCGAAAGTCAAGCTTGCCGTCGTTTAGTG
Чтобы вставить ген устойчивости к канамицину в качестве селекционного маркера в pUC18-L1-L2, pUC4K вектор (Pharmacia, Германия) обрезали с PstI, и полученный ген устойчивости к канамицину сливали с pUC18-L1-L2 фрагментом с PstI, таким образом конструируя pUC18-L1-KmR-L2. Линкер, указанный далее в SEQ ID NO: 5, был вставлен в pUC18-L1-KmR-L2 фрагмент с SacI, таким образом создав новый XbaI обрезанный участок.
SEQ ID NO: 5: 5'-TCTAGAAGCT
Чтобы вставить sacB ген в pUC18-L1-KmR-L2, в котором вставлен XbaI обрезанный участок, проводили ПЦР на pKmobsacB (Schafer et al., Gene, 145:69, 1994) в качестве матрицы с применением праймеров, указанных далее в SEQ ID NO: 6 и 7. Затем полученный ПЦР фрагмент, содержащий sacB ген, обрезали с XbaI и вставляли в новый XbaI ограничивающий фермент участок pUC18-L1-KmR-L2, в котором был вставлен вышеуказанный XbaI обрезанный участок, таким образом конструируя pMLKO-sacB, вектор обмена для разрушения ldhA гена (Фиг.2).
SEQ ID NO: 6: 5'-GCTCTAGACCTTCTATCGCCTTCTTGACG
SEQ ID NO: 7: 5'-GCTCTAGAGGCTACAAAATCACGGGCGTC
Пример 2. Конструирование М.succiniciproducens LK штамма
Мутантный штамм конструировали путем разрушения ldhA гена в геноме М.succiniciproducens MBEL55E (КСТС0769ВР) с применением pMLKO-sacB, сконструированного в Примере 1 в качестве вектора генетического обмена для разрушения ldhA гена (Фиг.3).
Другими словами, М.succiniciproducens MBEL55E (КСТС0769ВР) помещали на агаровую среду LB с глюкозой, содержащую 10 г/л глюкозы, и культивировали при 37°С в течение 36 часов, for 36 hours. Образовавшуюся колонию инокулировали в 10 мл жидкой среды LB с глюкозой и культивировали в течение 12 часов. 1% культурального бульона, давшего достаточный рост, инокулировали в 100 мл жидкой среды LB с глюкозой и культивировали в инкубаторе при встряхивании при 200 об./мин и 37°С.
Когда культуральный бульон достигал ОП600 примерно 0.3-0.4 спустя 4~5 ч, его центрифугировали при 4°С и 4,500 об/мин в течение 20 минут, чтобы собрать клетки. Затем клетки ресуспендировали в 200 мл 10% раствора глицерина при 4°С. Суспензию центрифугировали при 4°С и 5,500 об/мин в течение 20 минут и собирали клетки. После ресуспендирования и отбора половины вышеуказанного раствора глицерина дважды таким же образом, как в вышеописанном способе, клетки суспендировали в глицерине в объемном отношении 1:1, для получения клеточного концентрата.
Клеточный концентрат, полученный таким образом, смешивали с вектором генетического обмена pMLKO-sacB, сконструированным в Примере 1, а затем pMLKO-sacB вводили в культивируемый М.succiniciproducens MBEL55E (КСТС0769ВР) путем и 200 Ом. 1 мл жидкой среды LB с глюкозой добавляли к pMLKO-sacB-введенному штамму и предварительно культивировали в инкубаторе при встряхивании при 37°С и 200 об/мин в течение одного часа. Культуральный бульон помещали на твердую среду LB с глюкозой, содержащую антибиотик канамицин (конечная концентрация 25 мкг/мл), и культивировали при 37°С в течение 48 часов или больше. Чтобы отобрать колонию только с двойным кроссовером, образовавшиеся колонии наносили на твердую среду LB с сахарозой, содержащую канамицин (25 мкг/мл) и 100 г/л сахарозы. Спустя 24 часа образовавшиеся колонии вновь переносили на ту же самую среду.
Колонии (мутант), сформировавшиеся на среде, культивировали в жидкой среде LB с глюкозой, содержащей антибиотик, а геномную ДНК выделяли из культурального штамма способом, описанным Rochelle et al. (Rochelle et al., FEMS Microbiol. Lett., 100:59, 1992). ПЦР проводили с применением выделенной мутантной геномной ДНК в качестве матрицы, а продукт ПЦР анализировали с помощью электрофореза, чтобы подтвердить разрушение гена ldhA в геномной ДНК.
Чтобы подтвердить разрушение гена ldhA, ПЦР проводили дважды следующим образом. Вначале мутантную геномную ДНК в качестве матрицы подвергали ПЦР с применением праймеров, указанных далее в SEQ ID NO: 8 и SEQ ID NO: 9.
SEQ ID NO: 8: 5'-GACGTTTCCCGTTGAATATGGC (KM1)
SEQ ID NO: 9: 5'-CATTGAGGCGTATTATCAGGAAAC (LU1)
Затем мутантную геномную ДНК в качестве матрицы подвергали ПЦР с применением праймеров, указанных далее в SEQ ID NO: 10 и SEQ ID NO: 11.
SEQ ID NO: 10: 5'-GCAGTTTCATTTGATGCTCGATG (KM2)
SEQ ID NO: 11: 5'-CCTCTTACGATGACGCATCTTTCC (LD2)
ПЦР фрагменты, полученные в двух ПЦР, подвергали гель-электрофорезу для подтверждения разрушения ldhA по его размеру. ПЦР фрагменты геномной ДНК, имеющие разрушенный ldhA, были подтверждены тем фактом, что продукт, полученный при ПЦР с применением праймеров SEQ ID NO: 8 (КМ1) и SEQ ID NO: 9 (LU1), имел размер 1,5 кб, а в то же самое время продукт, полученный при ПЦР с применением праймеров SEQ ID NO: 10 (KM2) и SEQ ID NO: 11 (LU2), имел размер 1,7 кб. Положение каждого праймера показано на Фиг.3.
Мутантный штамм М.succiniciproducens LK был сконструирован путем разрушения гена ldhA в геноме М.succiniciproducens MBEL55E по вышеуказанному способу.
Пример 3. Конструирование вектора генного обмена (pPTA-sacB) для разрушения pta и ackA
Чтобы разрушить pta и ackA в геноме штамма М.succinicproducens LK путем гомологичной рекомбинации, вектор генетического обмена конструировали следующим образом. Вектор pKmobsacB, содержащий ген sacB, в качестве матрицы, подвергали ПЦР с применением праймеров, указанных далее в SEQ ID NO: 12 и SEQ ID NO: 13. Полученный продукт sacB обрезали с PstI и BamHI и вставляли в pUC19 (Stratagene Cloning Systems., США), таким образом конструируя pUC19-sacB (Фиг.4).
SEQ ID NO: 12: 5'-AGCGGATCCCCTTCTATCGCCTTCTTGACG
SEQ ID NO: 13: 5'-GTCCTGCAGGGCTACAAAATCACGGGCGTC
При этом геномную ДНК М.succiniciproducens LK в качестве матрицы подвергали ПЦР с применением праймеров, указанных далее в SEQ ID NO: 14 и SEQ ID NO: 15, и полученный ПЦР фрагмент, содержащий pta-ackA гомологичный участок 1, обрезали с XbaI и BamHI. В дополнение, геномную ДНК М.succiniciproducens LK в качестве матрицы подвергали ПЦР с применением праймеров, указанных далее в SEQ ID NO: 16 и SEQ ID NO: 17, и полученный ПЦР фрагмент, содержащий pta-ackA гомологичный участок 2, обрезали с XbaI и SacI. Затем эти фрагменты были вставлены в BamHI и SacI участок pUC19, таким образом конструируя pUC19-PTA12.
SEQ ID NO: 14: 5'-GCTCTAGATATCCGCAGTATCACTTTCTGCGC
SEQ ID NO: 15: 5'-TCCGCAGTCGGATCCGGGTTAACCGCACAG
SEQ ID NO: 16: 5'-GGGGAGCTCGCTAACTTAGCTTCTAAAGGCCA
TGTTTCC
SEQ ID NO: 17: 5'-GCTCTAGATATCCGGGTCAATATCGCCGCAAC
Чтобы встроить ген устойчивости к стрептомицину (GenBank X02588; SpR) в качестве селективного маркера в pUC19-PTA12, плазмиду pIC156 (Steinmetz et al., Gene, 142:79, 1994), содержащую ген устойчивости к стрептомицину (GenBank X02588), в качестве матрицы, подвергали ПЦР с применением праймеров, указанных далее в SEQ ID NO: 18 и SEQ ID NO: 19, и полученный ПЦР фрагмент, содержащий ген SpR, обрезали с EcoRV и вводили в pUC19-PTA12, таким образом конструируя pUC19-PTA1S2, имеющий ген устойчивости к стрептомицину. Сконструированный pUC19-PTA1S2 обрезали с SacI и BamHI и вводили в вышеуказанный сконструированный pUC19-SacB, таким образом конструируя вектор обмена (pPTA-sacB) для разрушения pta и ackA (Фиг.4).
SEQ ID NO: 18: 5'-GAATTCGAGCTCGCCCGGGGATCGATCCTC
SEQ ID NO: 19: 5'-CCCGGGCCGACAGGCTTTGAAGCATGCAAATGTCAC
Пример 4. Конструирование штамма М.succiniciproducens PALK
Мутантный штамм конструировали путем разрушения гена pta и ackA в геноме М.succiniciproducens LK с применением pPTA-sacB, вектора обмена для разрушения гена фосфотрансацетилазы (pta) и гена ацетаткиназы (ackA), сконструированного в Примере 3 (Фиг.4).
Другими словами, М.succiniciproducens LK, сконструированный в Примере 2, помещали на агаровую среду LB с глюкозой, содержащую 10 г/л глюкозы, и культивировали при 37°С в течение 36 часов. Образовавшуюся колонию инокулировали в 10 мл жидкой среды LB с глюкозой и культивировали в течение 12 часов. 1% культурального бульона, давшего достаточный рост, инокулировали в 100 мл жидкой среды LB с глюкозой и культивировали в инкубаторе при встряхивании при 200 об/мин и 37°С.
Клеточный концентрат собирали из полученного культурального бульона таким же образом, как описано в Примере 2. Собранный клеточный концентрат смешивали с вектором генетического обмена pPTA-sacB, сконструированным в Примере 3, а затем pPTA-sacB вводили в М.succiniciproducens LK путем электропорации при условиях 2,5 кВ, 50 мкФ и 200 Ом. 800 мл жидкой среды LB с глюкозой добавляли к штамму с введенным pPTA-sacB и предварительно культивировали в термостате при 37°С в течение полутора часов. Чтобы индуцировать двойной кроссовер, культуральный бульон помещали на твердую среду TSB-сахарозы (Твердую среду с трипсин-соевым бульоном (Becton, Dickinson and Company), содержащую 100 г/л сахарозы), содержащую антибиотик стрептомицин (конечная концентрация 50 мкг/мл), и культивировали при 37°С в течение 48 часов или больше. Для скрининга колонии с двойным кроссовером образовавшиеся колонии помещали в TSB-сахарозную среду, содержащую 50 мкг/мл стрептомицина и TSB агаровую среду, содержащую 50 мкг/мл ампициллина соответственно, и культивировали при 37°С в течение 12 часов. Затем колонии, образовавшиеся на TSB-сахарозной среде, содержащей 50 мкг/мл стрептомицина, но не образовавшиеся на TSB среде, содержащей 50 мкг/мл ампициллина, отбирали и вновь переносили на TSB-сахарозную среду, содержащую 50 мкг/мл стрептомицина. Образовавшиеся колонии вновь подвергали скринингу с применением стрептомицинсодержащей среды и ампициллинсодержащей среды, а затем колонии, показавшие необходимые результаты, окончательно отбирали. Выделенную мутантную геномную ДНК в качестве матрицы амплифицировали с помощью ПЦР, и продукт ПЦР анализировали с помощью электрофореза, чтобы подтвердить разрушение pta-ackA.
Чтобы подтвердить разрушение pta-ackA, ПЦР проводили дважды следующим образом. Во-первых, мутантную геномную ДНК в качестве матрицы подвергали ПЦР с применением праймеров, указанных далее в SEQ ID NO: 20 и SEQ ID NO: 21. Затем мутантную геномную ДНК в качестве матрицы подвергали ПЦР с применением праймеров, указанных далее в SEQ ID NO: 22 и SEQ ID NO: 23.
SEQ ID NO: 20: 5'-CCTGCAGGCATGCAAGCTTGGGCTGCAGGTCGACTC (SP1)
SEQ ID NO: 21: 5'-GCTGCCAAACAACCGAAAATACCGCAATAAACGGC (PAU1)
SEQ ID NO: 22:
5'-GCATGTAACTTTACTGGATATAGCTAGAAAAGGCATCGGGGAG (SP2)
SEQ ID NO: 23:
5'-GCAACGCGAGGGTCAATACCGAAGGATTTCGCCG (PAD2)
Продукты, полученные в двух ПЦР, подвергали гель-электрофорезу для подтверждения разрушения pta-ackA по его размеру (Фиг.6). Разрушение pta-ackA было подтверждено тем фактом, что продукт, полученный при ПЦР с применением праймеров SEQ ID NO: 20 и SEQ ID NO: 21 (SP1 праймер и PAU1 праймер), имел размер 1,1 кб, и что в то же время продукт, полученный при ПЦР с применением праймеров SEQ ID NO: 22 и SEQ ID NO: 23 (SP2 праймер и PAD2 праймер), имел размер 1,5 кб. Положение каждого праймера показано на Фиг.5.
Мутантный штамм, сконструированный путем разрушения pta-ackA в геноме М.succiniciproducens LK по вышеописанному способу, т.е. мутантный штамм, полученный при разрушении ldhA, pta и ackA в геноме М.succiniciproducens, был назван "М.succiniciproducens PALK" и помещен под инвентарным номером "КСТС10973ВР" 26 июля 2006 в Корейскую Коллекцию Типов Культур (КСТС; 52, Еоеюн-донг, Юсеонг-гу, Даееон-си, Республика Корея), Корейский Исследовательский Институт биологических наук и биотехнологии, являющийся международным депозитарием.
Пример 5. Производство гомо-янтарной кислоты с применением М.succiniciproducens PALK
М.succiniciproducens PALK (KCTC10973BP), сконструированный в Примере 4, помещали в 10 мл композиционной среды, содержащей 5 г/л глюкозы, и культивировали в анаэробных условиях при 39°С в течение 8 часов, а затем вновь переносили в 250 мл композиционной среды, содержащей 5 г/л глюкозы, и культивировали при 39°С. К этому времени в среду в качестве антибиотика добавляли 50 мкг/мл стрептомицина. 250 мл культурального бульона с М.succiniciproducens PALK инокулировали в биореактор, содержащий 2,25 л композиционной среды (1 г/л NaCl, 2 г/л (NH4)2HPO4, 0,02 г/л CaCl2·2H2O, 0,2 г/л MgCl2·6H2O, 8,709 г/л К2НРО4, 0,5 г/л цистеина, 0,5 г/л метионина, 0,5 г/л аланина, 0,5 г/л аспарагина, 0,5 г/л аспараги