Способ получения первичного тугоплавкого металла (варианты)
Иллюстрации
Показать всеГруппа изобретений относится к способам получения первичного тугоплавкого металла. Способ включает нагрев химически активного газа, содержащего газообразный водород. Затем проводят контактирование оксида тугоплавкого металла с указанным нагретым газом в виде частиц пентаоксида тантала для восстановления пентаоксида тантала в виде частиц. При этом массовое соотношение газообразного атомарного водорода и пентаоксида тантала в виде частиц составляет более чем 1,5:1 при температуре от 1900 К до 2900 К с образованием первичного металла тантала. Другой вариант осуществления способа включает нагрев химически активного газа, содержащего газообразный водород. Затем проводят контактирование оксида тугоплавкого металла с указанным нагретым газом в виде частиц оксида ниобия, выбранного из группы, состоящей из диоксида ниобия, пентаоксида ниобия и их комбинации, с указанным нагретым газом для восстановления указанного оксида ниобия в виде частиц. При этом массовое соотношение газообразного водорода и оксида ниобия в виде частиц составляет по меньшей мере 9:1, при температуре от 2100 К до 2700 К с образованием первичного металла ниобия. Технический результат заключается в повышении эффективности получения первичного металла тантала или ниобия за счет проведения процесса в одну стадию. 2 н. 22 з.п. ф-лы, 14 ил., 4 табл.
Реферат
Область изобретения
Данное изобретение относится к технологии производства первичных тугоплавких металлов, более конкретно к способу получения первичного металла тантала.
Предшествующий уровень техники изобретения
Некоторые тугоплавкие металлы, такие как тантал и ниобий, может быть сложно выделить в чистой (или первичной) форме, в частности, из-за термодинамической устойчивости их предшественников, таких как оксиды. Производство первичных тугоплавких металлов желательно, так как они применяются как исходные материалы, из которых могут быть изготовлены аноды конденсатора. Существующие методы получения первичных тугоплавких металлов обычно включают многостадийные процессы, в которых оксид тугоплавкого металла (например, пентаоксид тантала или пентаоксид ниобия) или другой предшественник (например, галогениды тантала) восстанавливаются в одну или две стадии, за которыми следуют дальнейшие стадии рафинирования и очистки. Такие многостадийные процессы обычно приводят к образованию ненужных потоков побочных продуктов.
Исходный материал, из которого металл тантал может быть получен, включает, например, гептафторотанталат калия (K2TaF7), галогениды тантала и пентаоксид тантала. Восстановление гептафторотанталата калия с натрием - это известный старый способ получения металла тантала. Гептафторотанталат калия и небольшую часть натрия запечатывают в металлическую трубку и нагревают до температуры воспламенения, что приводит к образованию твердой массы, которая включает металл тантал, гептафторотанталат калия, натрий и другие побочные продукты. Твердую смесь затем измельчают и выщелачивают разбавленной кислотой для того, чтобы выделить металл тантал, который обычно не совсем чистый.
Металл тантал может также быть получен с помощью следующего способа, в котором расплавленную структуру гептафторотанталата калия восстанавливают в присутствии соли разбавителя (например, хлорида натрия) путем введения расплавленного металла натрия в реактор в условиях постоянного перемешивания. Процесс восстановления расплавленного натрия приводит к образованию твердой массы, содержащей металл тантал, фторид натрия, фторид калия и другие побочные продукты. Твердую массу измельчают и выщелачивают разбавленным раствором кислоты для того, чтобы выделить металл тантал. Обычно, дополнительные стадии процесса, такие как агломерация, должны быть проведены с продуктом, металлом танталом, с целью улучшения физических свойств. Смотрите, например, патент США 2,950,185.
Электролитическое получение тантала включает электролиз расплавленной смеси гептафтортанталата калия, содержащей пентаоксид тантала (Та2О5), при температуре около 700°С в металлическом контейнере. Электролитическое восстановление приводит к формированию твердой массы, содержащей металл тантал, гептафторотанталат калия, оксиды тантала и другие побочные продукты. Твердую массу затем измельчают и выщелачивают разбавленной кислотой для того, чтобы выделить металл тантал, который обычно не совсем чистый. Такие электролитические способы получения металла тантала сейчас обычно не используются в промышленном масштабе.
Другие способы производства тугоплавких металлов, таких как металл тантал, включают восстановление пентаоксида тантала с металлическим кальцием в присутствии хлорида кальция, как описано, например, в патенте США 1,728,941; и восстановление пентаоксида тантала в присутствии силицида, такого как силицид магния, и гидрида, такого как гидрид кальция, как описано, например, в патенте США 2,516,863. Такие другие методы включают сложные стадии и приводят к формированию побочных продуктов, от которых тугоплавкий металл должен быть отделен.
Более современный способ получения тугоплавких металлов, таких как тантал, включает неполное восстановление оксида тугоплавкого металла (например, пентаоксида тантала или пентаоксида ниобия) путем контакта оксида тугоплавкого металла с газообразным восстанавливающим агентом, таким как газообразный магний. Неполностью восстановленный тугоплавкий металл затем выщелачивают, после чего восстанавливают и агломерируют. Смотрите, например, патент США 6,171,363 В1.
Другой современный способ производства тугоплавких металлов, таких как тантал и ниобий, включает сначала прохождение газообразного водорода через порошок оксида тугоплавкого металла (например, пентаоксида тантала), и, таким образом, образование промежуточного продукта - субоксида тугоплавкого металла. На второй стадии субоксид тугоплавкого металла восстанавливают путем контакта с восстанавливающим газообразным агентом (например, газообразный магнием). Почти полностью восстановленный тугоплавкий металл затем выщелачивают, после чего восстанавливают и агломерируют. Смотри, например, патент США 6,558,447 B1.
Последующие способы получения тугоплавких металлов включают введение галогенида тугоплавкого металла (например, пентахлорида тантала) или алкоксида тугоплавкого металла (например, алкоксида тантала) в плазму, образованную из газообразного водорода. Такие плазменные способы приводят к образованию нежелательных побочных продуктов, таких как коррозионные газообразные галогениды водорода (например, газообразный хлорид водорода), и газообразных алканолы. Плазменные способы на основе галогенида тугоплавкого металла подробно описываются, например, в патентах США 3,211,548, 3,748,106 и 6,689,187 B2. Плазменные способы на основе алкоксида тугоплавкого металла подробно описываются, например, в патенте США 5,711,783. Патент США 5,972,065 раскрывает очистку тантала с помощью плазменного дугового плавления. В способе согласно патенту США 5,972,065 порошок металла тантала помещают в сосуд и текущий поток плазмы, образованной из водорода или гелия, пропускают через порошок металла тантала.
Европейская патентная заявка ЕР 1 066 899 А2 раскрывает способ получения высокоочищенных сферических частиц металлов, таких как тантал и ниобий. Способ, раскрытый в европейской патентной заявке ЕР 1 066 899 А2, включает введение порошка тантала в плазму, образованную из газообразного водорода. Температура плазмы, как раскрыто в европейской патентной заявке ЕР 1 066 899 А2, составляет от 5000 К до 10000 К.
Было бы желательно разработать способы получения, по существу, чистых тугоплавких металлов, таких как первичные тугоплавкие металлы, которые не включают многочисленные стадии процесса и предпочтительно включают только одну стадию восстановления. Было бы также желательно, чтобы такие, вновь разработанные, способы получения тугоплавкого металла использовали промышленное сырье, которое легко доступно и сравнительно безопасно при переработке; и, по меньшей мере, сводили к минимуму образование нежелательных побочных продуктов, которые должны быть отделены и/или в других случая далее обработаны.
Краткое содержание сущности изобретения
Согласно настоящему изобретению обеспечивается способ получения первичного тугоплавкого металла, который может быть выполнен, по существу, в одну стадию и приводит к образованию побочного продукта, содержащего, по существу, воду, при этом данный способ включает:
(a) нагревание газа, содержащего химически активный газ, причем указанный химически активный газ содержит газообразный водород, и, таким образом, формирование нагретого газа, имеющего температурный интервал; и
(b) контактирование оксида тугоплавкого металла в виде частиц с указанным нагретым газом, где
(i) указанный температурный интервал указанного нагретого газа и
(ii) массовое отношение газообразного водорода указанного нагретого газа к указанному оксиду тугоплавкого металла в виде частиц
каждый выбираются таким образом, что
указанный нагретый газ содержит атомарный водород,
указанный оксид тугоплавкого металла является, по существу, термодинамически устойчивым, и
указанный оксид тугоплавкого металла восстанавливается с помощью атомарного водорода на стадии (b),
и таким образом образование указанного первичного тугоплавкого металла.
Согласно настоящему изобретению обеспечивается также способ получения первичного металла тантала, предусматривающий:
(a) нагревание газа, содержащего химически активный газ, причем указанный химически активный газ содержит газообразный водород, и, таким образом, формирование нагретого газа; и
(b) контактирование пентаоксида тантала в виде частиц с указанным нагретым газом при температуре от 1900 К (градусы Кельвин) до 2900 К, и, таким образом, восстановление указанного пентаоксида тантала в виде частиц и образование первичного металла тантала;
где газообразный водород указанного нагретого газа и указанный пентаоксид тантала в виде частиц, реагирующий с указанным нагретым газом, имеют массовое соотношение газообразного водорода и пентаоксида тантала в виде частиц более чем 1,5:1.
В соответствии с данным изобретением также обеспечивается способ получения первичного металла ниобия, предусматривающий:
(a) нагревание газа, содержащего химически активный газ, причем указанный химически активный газ содержит газообразный водород, и, таким образом, образование нагретого газа; и
(b) контактирование оксида ниобия в виде частиц, выбранного из группы, состоящей из диоксида ниобия, пентаоксида ниобия и их комбинаций, с указанным нагретым газом при температуре от 2100 К до 2700 К и, таким образом, восстановление указанного оксида ниобия в виде частиц и образование первичного металла ниобия;
где газообразный водород указанного нагретого газа и указанный оксид ниобия в виде частиц, контактирующий с указанным нагретым газом, имеют массовое соотношение газообразного водорода и оксида ниобия в виде частиц, по меньшей мере, 9:1.
Признаки, характеризующие данное изобретение, подробно указываются в формуле изобретения, которая прилагается и составляет часть данного раскрытия. Эти и другие признаки изобретения, преимущества его применения и специфические объекты, полученные при его применении, будут более понятны из последующего детального описания и прилагающихся чертежей.
Если не указано иное, все цифры или выражения, такие как выражающие конструктивные размеры, композиционные количества, условия обработки и т.д., указанные в описании и формуле изобретения, понимаются как модифицированные во всех случаях посредством термина "около".
Краткое описание чертежей
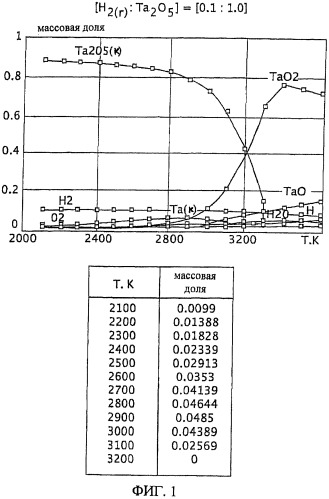
Фиг.1 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 0,1:1,0, Фиг.1 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
Фиг.2 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 0,25:1,0, Фиг.2 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
Фиг.3 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 0,4:1,0, Фиг.3 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
Фиг.4 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала к 0,7:1,0, Фиг.4 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
Фиг.5 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 1,0:1,0, Фиг.5 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
Фиг.6 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 1,5:1,0, Фиг.6 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
Фиг.7 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 2,3:1,0, Фиг.7 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
Фиг.8 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 4,0:1,0, Фиг.8 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
Фиг.9 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 9,0:1,0, Фиг.9 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
Фиг.10 является графическим изображением процентного выхода тантала как функции от температуры для трех отдельных массовых соотношений газообразного водорода к пентаоксиду тантала;
Фиг.11 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла ниобия, при массовом соотношении газообразного водорода и пентаоксида ниобия 2,3:1,0, Фиг.11 также включает таблицу массовой доли конденсированного первичного металла ниобия (Nb(к)) как функции от температуры, на основе которой строится часть графика;
Фиг.12 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла ниобия, при массовом соотношении газообразного водорода и пентаоксида ниобия 4.0:1,0, Фиг. 12 также включает таблицу массовой доли конденсированного первичного металла ниобия (Nb(к)) как функции от температуры, на основе которой строится часть графика;
Фиг.13 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла ниобия, при массовом соотношении газообразного водорода и пентаоксида ниобия 9,0:1,0, Фиг.13 также включает таблицу массовой доли конденсированного первичного металла ниобия (Nb(к)) как функции от температуры, на основе которой строится часть графика; и
Фиг.14 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла ниобия, при массовом соотношении газообразного водорода и пентаоксида ниобия 9,0:1,0, Фиг.13 также включает таблицу массовой доли конденсированного первичного металла ниобия (Nb(к)) как функции от температуры, на основе которой строится часть графика;
На Фиг.1-14 аналогичные цифры и обозначения означают одни и те же элементы и признаки.
Подробное описание изобретения
Используемый здесь и в формуле изобретения термин «атомарный водород» означает газообразный одноатомный водород (то есть, Н(г) или Н), то есть не в ионной форме (например, газообразный катион водорода, Н+ (г) или Н+). Используемый здесь термин «газообразный водород» означает газообразный молекулярный (двухатомный) водород (то есть, H2(г) или Н2).
Газ, который нагревают и с которым контактирует загружаемый материал оксида тугоплавкого металла по способу настоящего изобретения, включает химически активный газ, который содержит газообразный водород. При необходимости, химически активный газ может дополнительно содержать другие химически активные компоненты, такие как алканы (например, метан, этан, пропан, бутан и их комбинации). Если химически активный газ содержит химически активные компоненты, отличные от водорода (например, метан), то эти другие химически активные компоненты обычно представлены в незначительном количестве (например, в количествах менее чем, или равных, 49 мас.%, основываясь на общей массе химически активного газа). Химически активный газ может включать: водород в количестве от 51 до 99 мас.%, от 60 до 85 мас.% или от 70 до 80 мас.%; и химически активный компонент, отличный от водорода (например, метан), в количестве от 1 до 49 мас.%, от 15 до 40 мас.% или от 20 до 30 мас.%, причем массовые проценты приведены по отношению к общей массе химически активного газа. Предпочтительно, чтобы химически активный газ содержал по существу 100 мас.% газообразного водорода.
Газ, который нагревают и с которым контактирует подаваемый материал оксида тугоплавкого металла, по способу настоящего изобретения может при необходимости дополнительно содержать инертный газ. Инертный газ может быть выбран, например, из одного или более инертных газов VIII группы периодической таблицы элементов. VIII группа элементов, из которой инертный газ может быть выбран, включает неон, аргон, криптон, ксенон и их комбинации. Предпочтительным инертным газом является аргон. Если инертный газ присутствует, то газ (подаваемый газ), который нагревают и с которым контактирует оксид тугоплавкого металла, обычно включает: от 20 до 50 мас.% химически активного газа, от 25 до 40 мас.% химически активного газа; и от 50 до 80 мас.% инертного газа, от 60 до 75 мас.% инертного газа, причем массовые проценты приведены по отношению к общей массе подаваемого газа. Инертный газ типично используется как носитель для химически активного газа. Когда способ данного изобретения проводится посредством плазмы, газ (подаваемый газ) обычно включает инертный газ, такой как аргон, как будет далее подробно рассмотрено здесь.
Способ данного изобретения включает выбор как температурного режима нагретого газа, так и массового соотношения газообразного водорода и загружаемого материала оксида тугоплавкого металла в виде частиц, с которым контактирует нагретый газ. Эти параметры выбирают так, что: нагретый газ содержит атомарный водород, загружаемый материал оксида тугоплавкого металла является, по существу, термодинамически устойчивым; и загружаемый материал оксида тугоплавкого металла восстанавливается с помощью атомарного водорода. Предпочтительно, чтобы загружаемый материал оксида тугоплавкого металла, по существу, полностью восстанавливался атомарным водородом во время контакта с нагретым газом.
Выбор температурного диапазона нагретого газа и массового соотношения газообразного водорода и оксида тугоплавкого металла в виде частиц не является очевидным действием, и не был известен ранее. С целью демонстрации образование первичного металла тантала путем восстановления пентаоксида тантала атомарным водородом будет рассмотрено ниже. Металл тантал имеет точку плавления приблизительно 3000°С. Исходя из этого, температуры нагретого газа, которые ниже и отчасти выше точки плавления тантала, представляют интерес с точки зрения минимизации затрат энергии, в зависимости от того, является ли образование расплавленного металла тантала желательным.
Образование первичного металла тантала путем восстановления пентаоксида тантала молекулярным водородом (то есть, Н2(г)), не является термодинамически благоприятным для температурного интервала от 1000°С до 3600°С. Следующее общее уравнение реакции (I) отображает восстановление пентаоксида тантала молекулярным водородом,
Общее уравнение реакции (I) было термодинамически проанализировано с помощью метода минимизации энергии Гиббса, использующего компьютерную программу, приобретенную коммерческим путем у Outokwnpu Research Oy, Финляндия, под именем HSC Chemistry 5.1.
В целях общей ссылки, если значения стандартной свободной энергии Гиббса (например, AG значения) отрицательны, то считают, что химическая реакция по уравнению (I) благоприятна, и, следовательно, равновесие смещено в правую сторону уравнения, и связанная с ним константа равновесие составляет более чем 1,0. Соответственно, если значения стандартной свободной энергии Гиббса положительны, реакция является менее благоприятной или неблагоприятной (в зависимости от величины положительного значения) и, следовательно, равновесие смещено в левую сторону уравнения, и связанная константа равновесия составляет менее чем 1,0. Нулевое значение стандартной свободной энергии Гиббса соответствует константе равновесия, равной 1,0.
Значения стандартной свободной энергии Гиббса рассчитывают, используя следующее общее уравнение.
ΔG=-(R)×(T)×Ln(K)
В вышеприведенном уравнении символ "R" означает газовую постоянную (универсальную газовую постоянную); "Т" означает температуру в градусах Кельвин; и "К" является константой равновесия.
Более подробно результаты компьютерного анализа методом минимизации энергии Гиббса для уравнения химической реакции (I) при использовании программного обеспечения HSC Chemistry 5.1 представлены в таблице 1.
| Таблица 1 | |||||
| Т(°С) | ΔН(ккал) | ΔS (кал/К) | ΔG (ккал) | К | Log(K) |
| 1000 | 183.192 | 30.237 | 144.695 | 1.44Е-25 | -24.841 |
| 1200 | 180.121 | 27.995 | 138.88 | 2.48Е-21 | -20.605 |
| 1400 | 177.272 | 26.18 | 133.469 | 3.67Е-18 | -17.435 |
| 1600 | 174.665 | 24.707 | 128.385 | 1.05Е-15 | -14.981 |
| 1800 | 143.425 | 9.475 | 123.782 | 8.91Е-14 | -13.05 |
| 2000 | 139.131 | 7.497 | 122.089 | 1.82Е-12 | -11.739 |
| 2200 | 135.046 | 5.774 | 120.766 | 2.12Е-11 | -10.673 |
| 2400 | 131.152 | 4.259 | 119.766 | 1.61Е-10 | -9.793 |
| 2600 | 127.476 | 2.933 | 119.049 | 8.78Е-10 | -9.056 |
| 2800 | 124.071 | 1.787 | 118.58 | 3.68Е-09 | -8.434 |
| 3000 | 121.117 | 0.854 | 118.321 | 1.26Е-08 | -7.901 |
| 3200 | 132.27 | 4.279 | 117.409 | 4.09Е-08 | -7.389 |
| 3400 | 128.231 | 3.148 | 116.668 | 1.14Е-07 | -6.942 |
| 3600 | 124.225 | 2.086 | 116.146 | 2.79Е-07 | -6.554 |
Результаты, собранные в таблице 1, показывают, что восстановление пентаоксида тантала с помощью молекулярного водорода и образование первичного металла тантала, как представлено общим уравнением реакции (I), не является термодинамически благоприятным для температурного интервала от 1000°С до 3600°С. В частности необходимо отметить, что значения ΔG в таблице 1 являются положительными и большими величинами (свыше 100 ккал) для рассмотренного температурного интервала, то есть равновесие в уравнении химической реакции (I) смещено в левую сторону - сторону реагентов, противоположно правой стороне - стороне их продуктов. По существу, восстановление пентаоксида тантала
невозможно в температурном интервале от 1000°С до 3600°С.
Символы в таблице 1 и последующих таблицах означают: Т означает температуру; Н означает энтальпию; S означает энтропию; G означает стандартную свободную энергию Гиббса; и К означает константу равновесия, относящуюся к уравнению реакции.
Восстановление пентаоксида тантала атомарным водородом представлено следующим уравнением реакции (II),
Результаты компьютерного анализа методом минимизации энергии Гиббса для уравнения реакции (II), использующего программное обеспечение HSC Chemistry 5.1, представлены в последующей таблице 2.
| Таблица 2 | |||||
| Т(°С) | ДН(ккал) | ΔS (кал/К) | ΔG (ккал) | К | Log(K) |
| 1000 | -351.548 | -108.756 | -213.086 | 3.82Е+36 | 36.581 |
| 1200 | -356.938 | -112.691 | -190.927 | 2.13Е+28 | 28.327 |
| 1400 | -361.932 | -115.873 | -168.059 | 9.00Е+21 | 21.954 |
| 1600 | -366.515 | -118.462 | -144.617 | 7.49Е+16 | 16.875 |
| 1800 | -399.569 | -134.615 | -120.492 | 5.05Е+12 | 12.703 |
| 2000 | -405.521 | -137.357 | -93.288 | 9.33Е+08 | 8.97 |
| 2200 | -411.115 | -139.717 | -65.575 | 6.24Е+05 | 5.795 |
| 2400 | -416.376 | -141.763 | -37.422 | 1.15Е+03 | 3.06 |
| 2600 | -421.282 | -143.534 | -8.888 | 4.74Е+00 | 0.676 |
| 2800 | -425.79 | -145.051 | 19.975 | 3.80Е-02 | -1.421 |
| 3000 | -429.726 | -146.293 | 49.114 | 5.25Е-04 | -3.28 |
| 3200 | -419.439 | -143.126 | 77.659 | 1.30Е-05 | -4.887 |
| 3400 | -424.237 | -144.469 | 106.42 | 4.65Е-07 | -6.332 |
| 3600 | -428.902 | -145.706 | 135.44 | 2.28Е-08 | -7.643 |
Результаты, представленные в таблице 2, показывают, что образование первичного металла тантала путем восстановления пентаоксида тантала атомарным водородом является термодинамически возможным при температурах меньше или равных около 3000°С и более благоприятным при температурах менее или равных 2800°С. Для температурного интервала от 1000°С до 2600°С значения ΔG в таблице 2 являются отрицательными, таким образом, указывая на смещение константы равновесия в уравнении реакции (II) в правую сторону (сторону продуктов) уравнения (то есть, в сторону образования первичного металла тантала). При температурах от 2800°С до 3000°С, несмотря на то, что значения стандартной свободной энергии Гиббса положительны, они являются настолько маленькими величинами, что тантал образуется. В общем, результаты таблицы 2, сами по себе, показывают, что восстановление пентаоксида тантала атомарным водородом является более благоприятным и должно проводиться при температуре менее или равной 2600°С.
Однако образование ионного водорода (который способен восстанавливать пентаоксид тантала) при температурном интервале от 1000°С до 3000°С является термодинамически невозможным. Кроме того, образование атомарного водорода, возможное при температурах выше или равных 2000°С, становится осуществимым только при температурах выше или равных 3000°С, как будет далее подробно рассмотрено.
Образование атомарного водорода представлено следующим общим уравнением реакции (III),
Общая реакция, представленная общим уравнением (III), подверглась компьютерному анализу методом минимизации энергии Гиббса, использующему программное обеспечение HSC Chemistry 5.1, результаты которого представлены в следующей таблице 3.
| Таблица 3 | |||||
| Т(°С) | ΔН (ккал) | ΔS (кал/К) | ΔG (ккал) | К | Log(K) |
| 1000 | 106.948 | 27.799 | 71.556 | 5.20Е-13 | -12.284 |
| 1200 | 107.412 | 28.137 | 65.961 | 1.64Е-10 | -9.787 |
| 1400 | 107.841 | 28.411 | 60.306 | 1.33Е-08 | -7.878 |
| 1600 | 108.236 | 28.634 | 54.601 | 4.26Е-07 | -6.371 |
| 1800 | 108.599 | 28.818 | 48.855 | 7.07Е-06 | -5.151 |
| 2000 | 108.93 | 28.971 | 43.075 | 7.22Е-05 | -4.142 |
| 2200 | 109.232 | 29.098 | 37.268 | 5.09Е-04 | -3.294 |
| 2400 | 109.505 | 29.204 | 31.438 | 2.69Е-03 | -2.57 |
| 2600 | 109.752 | 29.293 | 25.587 | 1.13Е-02 | -1.947 |
| 2800 | 109.972 | 29.368 | 19.721 | 3.96Е-02 | -1.403 |
| 3000 | 110.168 | 29.43 | 13.841 | 1.19Е-01 | -0.924 |
| 3200 | 110.342 | 29.481 | 7.95 | 3.16Е-01 | -0.5 |
| 3400 | 110.494 | 29.523 | 2.049 | 7.55Е-01 | -0.122 |
| 3600 | 110.625 | 29.558 | -3.859 | 1.65Е+00 | 0.218 |
Из совокупности данных в таблице 3 можно увидеть, что стандартная свободная энергия Гиббса при образовании атомарного водорода является положительной для всего интервала температур от 1000°С до 3400°С, и становится отрицательной при температуре 3600°С. Константа равновесия (К) для общего уравнения (III) представлена следующим уравнением.
К=(РН(г))2/(РH2(г))
Символ "РН(г)" относится к парциальному давлению атомарного водорода, и символ "РН2(г)" относится к парциальному давлению молекулярного водорода. Предполагая объемный процент газообразного водорода равным 100% по объему и парциальное давление газообразного водорода равным 1 атм, можно провести оценку объемного процента атомарного водорода как квадратного корня из константы равновесия при конкретной температуре. Например, при температуре 2000°С процентный объем атомарного водорода составляет около 1%, тогда как объемный процент молекулярного водорода соответственно составляет около 99%. При температуре 2200°С процентный объем атомарного водорода составляет около 2%, тогда как объемный процент молекулярного водорода соответственно составляет около 98%.
При температуре 2400°С процентный объем атомарного водорода составляет около 10%, тогда как объемный процент молекулярного водорода соответственно составляет около 90%. По существу, образование атомарного водорода не является достаточно осуществимым при температуре менее 2000°С. При температуре от 2000°С до 2800°С образование атомарного водорода является осуществимым, но в нежелательно малом количестве. Результаты, собранные в таблице 3, показывают, что температуры, равные или превышающие 3000°С, требуются для благоприятного образования атомарного водорода. При непоказанных в таблице 3 температурах выше 4000°С равновесие в уравнении (III) по большей части смещается вправо (то есть, по существу, весь молекулярный водород превращается в атомарный водород).
Образование ионного водорода представлено следующим общим уравнением реакции (IV),
Компьютерный анализ методом минимизации энергии Гиббса для уравнения реакции (IV) был проведен при использовании программного обеспечения HSC Chemistry 5.1, и полученные из него результаты представлены в следующей таблице 4.
| Таблица 4 | |||||
| Т(°С) | ΔН ккал | ΔS кал/К | ΔG ккал | К | Log(K) |
| 1000 | 744.03 | 66.45 | 659.429 | 6.20Е-114 | -113.208 |
| 1200 | 746.017 | 67.899 | 645.991 | 1.43Е-96 | -95.8447 |
| 1400 | 748.004 | 69.164 | 632.282 | 2.53Е-83 | -82.5969 |
| 1600 | 749.991 | 70.286 | 618.335 | 7.08Е-73 | -72.15 |
| 1800 | 751.978 | 71.294 | 604.175 | 2.01 Е-64 | -63.6968 |
| 2000 | 753.966 | 72.209 | 589.823 | 1.94Е-57 | -56.7122 |
| 2200 | 755.953 | 73.047 | 575.296 | 1.44Е-51 | -50.8416 |
| 2400 | 757.94 | 73.82 | 560.609 | 1.45Е-46 | -45.8386 |
| 2600 | 759.927 | 74.537 | 545.772 | З.ОЗЕ-42 | -41.5186 |
| 2800 | 761.914 | 75.205 | 530.797 | 1.77Е-38 | -37.752 |
| 3000 | 763.902 | 75.832 | 515.693 | 3.67Е-35 | -34.4353 |
| 3200 | 765.889 | 76.421 | 500.467 | 3.20Е-32 | -31.4949 |
| 3400 | 767.876 | 76.977 | 485.127 | 1.36Е-29 | -28.8665 |
| 3600 | 769.863 | 77.504 | 469.678 | 3.13Е-27 | -26.5045 |
Результаты таблицы 4 ясно показывают, что образование ионного водорода при температурном интервале от 1000°C до 3600°С не является благоприятным с точки зрения термодинамики, так как значения стандартной свободной энергии Гиббса являются положительными и достаточно большими для всего этого температурного интервала. Хотя это не показано в таблице 4, но ионный водород не образуется в достаточном количестве при температуре ниже приблизительно 10000°С.
Термодинамический анализ уравнений реакции с (I) по (IV), как представлено в таблицах (1)-(4), дал расходящиеся показания, касательно температур, при которых пентаоксид тантала будет соответствующим образом восстанавливаться атомарным водородом с образованием металла тантала. В частности, термодинамический анализ уравнения реакции (II), как представлено в таблице (2), показывает, что восстановление пентаоксида тантала атомарным водородом является термодинамически возможным при температурах менее или равных 2600°С. Однако термодинамический анализ уравнения реакции (III), как представлено в таблице 3, показывает, что температуры более или равные 3000°С требуются для образования достаточных количеств атомарного водорода. По существу, если взять вместе уравнения (II) и (III) и термодинамические данные таблиц (2) и (3), то оказывается, что восстановление пентаоксида тантала стехиометрическим количеством атомарного водорода (то есть, при массовом отношении газообразного водорода к пентаоксиду тантала 0,02: 1,0) практически неосуществимо при температурах менее 3000°С.
Было обнаружено, что этот барьер, связанный с термодинамически неблагоприятным образованием атомарного водорода при температуре менее 3000°С, можно преодолеть путем тщательного выбора, как (i) температурного интервала, при котором газообразный водород (то есть, молекулярный газообразный водород) нагревается, так и (ii) массового соотношения газообразного водорода к оксиду тугоплавкого металла. С целью демонстрации выбор этих условий будет рассмотрен на примере восстановления пентаоксида тантала (Та2О5) с образованием первичного металла тантала (Та).
При последующем рассмотрении были исследованы температурные интервалы от приблизительно 1900 К до 3600 К или от приблизительно 2100 К до 3600 К. Следующие девять массовых (или весовых) отношений газообразного водорода к пентаоксиду тантала были исследованы для этого температурного интервала: 0,1:1,0; 0,25:1,0; 0,4:1,0; 0,7:1,0; 1:1,0; 1,5:1,0; 2,3:1,0; 4:1,0; и 9:1,0. Перечисленные массовые соотношения были проанализированы с помощью метода минимизации энергии Гиббса, используя компьютерную программу, которая была приобретена коммерческим путем у Б.Г.Трусова, Москва, Россия, под названием TERRA. С помощью анализа, использующего компьютерную программу TERRA, были получены графики равновесных массовых долей различных компонентов и продуктов реакции, связанных с реакционной системой, включающей пентаоксид тантала и газообразный водород в качестве реагентов, как функций от температуры. Кроме того, равновесные массовые доли следующих побочных продуктов также показаны на графиках: диоксида тантала (ТаO2(г)); и монооксида тантала (ТаO(г)), которые образуются в результате термического разложения пентаоксида тантала, как представлено на следующем уравнении реакции (V).
Графики зависимости массовой доли от температуры для восстановления пентаоксида тантала представлены на Фиг.1-9. На графиках Фиг. с 1-9 формулы Та2O5(к) и Та(к) относятся к связанным конденсированным образованиям. На Фиг.1-9 символ "Н" относится к газообразному атомарному водороду. На Фиг.1-9 все вещества без подстрочного индекса (к) являются газообразными веществами. Также на Фиг.1-9 включены таблицы равновесной массовой доли первичного металла тантала для температурного интервала от 2100 К до 3200 К при общем давлении 0,1 МПа.
При массовом (весовом) отношении газообразного водорода к пентаоксиду тантала 0,1:1,0 образование первичного металла тантала относительно низкое (имеющее значение максимальной массовой доли 0,049 при температуре 2900 К). Смотрите график и таблицу на Фиг.1. Кроме того, при температуре 2900 К количество образованного газообразного диоксида тантала (TaO2) является, по существу, нежелательно равнозначным максимальному количеству образованного первичного металла тантала при этой температуре. Как далее будет рассмотрено здесь, образование субоксидов загружаемого оксида тугоплавкого металла (например, газообразных ТаО и ТаО2 в случае пентаоксида тантала) является обычно нежелательным, особенно если субоксиды не восстанавливаются атомарным водородом.
Степень образования первичного металла тантала при массовом соотношении газообразного водорода и пентаоксида тантала 0,25:1,0 выше, чем при массовом соотношении 0,1:1,0 (например, имеется максимум массовой доли 0,097 при температуре 2900 К). Смотрите график и таблицу на Фиг.2. Однако при температуре 2900 К количество образованного газообразного диоксида тантала является, по существу, нежелательно равнозначным максимальному количеству образованного первичного металла тантала при этой температуре.
Массовые отно