Способ левосторонней гемигепатэктомии
Иллюстрации
Показать всеИзобретение относится к хирургии и может быть применимо для левосторонней гемигепатэктомии. Рассекают пузырную пластинку. Расслаивают ткани по линии перехода капсулы печени в брюшину гепатодуоденальной связки вначале по верхнему (правому) краю левой долевой ножки на 1 см вправо от левой границы 4-го сегмента печени. По нижнему (левому) краю левой долевой ножки сразу над аранциевым протоком расслаивают капсулу печени, обнажают воротную пластинку левой долевой ножки. Отслаивают паренхиму печени от воротной пластинки по задней поверхности левой долевой ножки и выполняют обход левой долевой ножки. Проводят тесьму вокруг левой долевой ножки. Вводят в канал между левой долевой глиссоновой ножкой и паренхимой печени браншу раскрытой кассеты аппарата, расширяя канал для проведения кассеты посредством противотяги долевой ножки за тесьму. Производят аппаратное прошивание и пересечение долевой ножки. Рассекают листок брюшины между нижним краем левой печеночной вены у ее устья и аранциевым протоком. Производят поочередную отслойку паренхимы печени от левой печеночной вены с медиальной и латеральной сторон, формируя таким образом канал между тканью печени и левой печеночной веной у ее устья, через который проводят тесьму. Вводят в канал между левой печеночной веной и паренхимой печени браншу раскрытой кассеты аппарата, расширяя канал для проведения кассеты посредством противотяги левой печеночной вены за тесьму. Производят аппаратное прошивание и пересечение левой печеночной вены. Выполняют левостороннюю гемигепатэктомию. Способ позволяет избежать ишемии печени, уменьшить травматичность, сократить время операции. 3 ил.
Реферат
Изобретение относится к медицине, а именно - к абдоминальной хирургии, в частности - к хирургической гепатологии.
Целью изобретения является снижение травматичности, повышение надежности, снижение временных затрат при выделении и пересечении глиссоновых ножек в воротах печени при сегментарных и больших анатомических резекциях печени.
Резекция печени остается единственной операцией, которая может обеспечить радикальное лечение как при первичных, так и при метастатических опухолях печени [Redaelli C.A., Wagner N., Krähenbühl L., et al. Liver Surgery in the Era of Tissue-preserving Resections: Early and Late Outcome in Patients with Primary and Secondary Hepatic Tumors // World J. Surg. 2002. V.26. P.1126-1132. Jiao L., Williamson R., Habib N. Radiofrequency comes of age in liver surgery: ablative technique and adjunct to resection //НРБ. 2003. V.5. №1. P.3-5].
Известен способ экстракапсулярного выделения сосудисто-секреторных ножек печени, впервые описанный в нашей стране B.C. Шапкиным в 1967 г. [Шапкин B.C. Резекция печени (хирургическая анатомия и техника операций). М.: Медицина. 1967. С.159-162]. Основной идеей доступа к сосудисто-секреторным ножкам является отказ от раздельной диссекции сосудисто-секреторных элементов, входящих в состав долевых и секторальных ножек печени, за счет выделения этих ножек без вскрытия покрывающей их глиссоновой капсулы. Преимуществами данной методики являются быстрота и легкость выделения долевых ножек, а также лучшая доступность секторальных ножек по сравнению с изолированной диссекцией долевых и секторальных ветвей воротной вены и печеночной артерии.
Известен метод выделения сосудисто-секреторных элементов печени ad massam, разработанный в 1986 г. Э.И.Гальпериным и соавт. [Гальперин Э.И., Мочалов A.M. Пальцевое чреспеченочное выделение сосудисто-секреторных ножек долей и сегментов при анатомических резекциях печени // Хирургия. 1986. №7.]. Однако, несмотря на очевидные преимущества перед другими видами доступов к афферентным сосудам печени, указанные способы не лишены недостатков, поскольку предполагают рассечение печени и даже дигитоклазию с целью достижения глиссоновых ножек.
Несмотря на дальнейшее развитие этих методик и отказ в большинстве случаев от дигитоклазии, в настоящее время рассечение печени считается неизбежным у больных с закрытыми воротами и промежуточным типом ворот печени. Техника достижения глиссоновых ножек, предполагающая разрезы паренхимы печени, описывается в современных руководствах под редакцией ведущих хирургов-гепатологов. Основными недостатками разрезов паренхимы печени и, тем более, ее пальцевого разрушения, является кровотечение, возникающее из травмируемых мелких притоков печеночных вен, а также высокий риск повреждения более крупных притоков средней печеночной вены, что мы наблюдали в нашей клинике до применения новой методики, а также при разработке ее в эксперименте. В таких ситуациях для достижения гемостаза нередко приходится прибегать к глубокому прошиванию паренхимы печени, что удлиняет время операции и не лишено риска повреждения магистральных сосудисто-секреторных элементов.
В связи с этим нами разработан в эксперименте и внедрен в клинику метод атравматического выделения долевых и секторальных глиссоновых ножек печени, позволяющий без разрезов капсулы печени и разрушения ее паренхимы выделять глиссоновы ножки при помощи диссекторов различной кривизны. Отсутствие необходимости выполнения разрезов паренхимы печени и дигитоклазии является принципиальным отличием предлагаемой нами методики от существующих способов воротного доступа с выделением глиссоновых ножек без диссекции на составляющие их сосудисто-секреторные элементы.
Одним из принципиальных вопросов, который с нашей точки зрения, позволяет решить предлагаемый способ, является возможность экстрапаренхиматозного выделения глиссоновых ножек при любом типе ворот печени, в том числе в условиях закрытых ворот. В нашем опыте, как экспериментальном, где в большинстве случаев методика отрабатывалась в условиях закрытого типа ворот на фоне выраженного жирового гепатоза, так и при клиническом освоении методики долевые и секторальные глиссоновы ножки были выделены без необходимости выполнения разрезов паренхимы печени.
Выделение глиссоновых ножек создает условия для их атравматического и быстрого пересечения при помощи степлеров. В отличие от существующих в настоящее время методик применения степлеров для аппаратного прошивания и пересечения глиссоновых ножек наша методика не предполагает выполнения предварительных разрезов паренхимы печени, ни, тем более, разделения паренхимы печени для подведения кассеты аппарата к глиссоновой ножке и выполняется атравматично внепеченочным доступом. Кроме рассечения печени некоторые авторы используют прием Прингла на этапе выделения глиссоновых ножек и подведения к ним аппарата, в чем нет необходимости при использовании нашей методики [Figueras J., Lopez-Ben S., Lladó L., et al. Hilar Dissection versus the “Glissonean” Approach and Stapling of the Pedicle for Major Hepatectomies: a Prospective, Randomized Trial. Ann Surg. 2003. 238. P.111-119].
Второй составляющей предлагаемой нами методики является атравматическая управляемая изоляция эфферентного кровотока, а именно магистральных печеночных вен в кавальных воротах печени.
Хотя пережатие гепатодуоденальной связки уменьшает кровопотерю во время резекции печени, этот прием не влияет на кровотечение из печеночных вен, которые чаще всего являются основным источником кровопотери при резекциях печени [Weber S., Jarnagin W.R., Blumgart L.H. Techniques of Hepatic Resection. In: Chamberlain R.S., Blumgart L.H. Hepatobiliary Surgery. 2003. Landes Bioscience. Georgetown, Texas, U.S.A. P.203].
Прекращение кровотока по печеночным венам позволяет избежать массивной кровопотери при резекции печени по поводу очаговых образований центральных (4, 5, 8) и задних (2, 7, 8) сегментов, когда плоскость резекции проходит в непосредственной близости или через магистральные печеночные вены или их крупные притоки. Традиционным способом, позволяющим избежать массивной кровопотери в таких ситуациях, считается полная сосудистая изоляция печени, сочетающая прием Прингла (пережатие гепатодуоденальной связки) с выключением из кровотока нижней полой вены за счет ее пережатия в над- и подпеченочных сегментах [Blumgart, L. Н. Surgery of the Liver and Biliary Tract // New York: Churchill Livingstone. 2006. Fourth Edition. V.2. P.1422. Habib N, Zografos G, Dalla Serra G et al. Liver resection with total vascular exclusion for malignant tumors. Br J Surg 1994; 81:1181-4]. Отрицательной стороной данного метода является резкое уменьшение притока крови к сердцу и падение сердечного выброса за счет пережатия нижней полой вены.
Раздельное выделение и пережатие печеночных вен в сочетании с селективным пережатием правой или левой долевой глиссоновой ножки позволяет селективно выключать из кровотока правую или левую половину печени, сохраняя таким образом кровоток в контрлатеральной половине печени, что в, свою очередь, позволяет избежать приема Прингла и связанных с ним тепловой ишемии всего органа, венозного полнокровия органов брюшной полости и гемодинамических расстройств. При сочетании изолированного пережатия печеночных вен с приемом Прингла возможна полная сосудистая изоляция печени без прерывания кровотока по нижней полой вене. Особенностью данной методики является ее атравматичность за счет выделения печеночных вен без разрезов паренхимы печени, что также позволяет избежать кровотечения из притоков указанных вен, нередко впадающих в непосредственной близости от устья, но в пределах паренхимы печени.
Способ осуществляют следующим образом: выполняют лапаротомию J-разрезом, мобилизацию левой доли печени, холецистэктомию. Для выделения левой долевой глиссоновой ножки в воротах печени рассекают пузырную пластинку, расслаивают ткани по линии перехода брюшины гепатодуоденальной связки в капсулу печени по верхнему (правому) краю левой долевой ножки на 1 см вправо от левой границы 4-го сегмента печени, затем по нижнему (левому) краю левой долевой ножки сразу над аранциевым протоком обнажают воротную пластинку левой долевой ножки. Диссектором прецизионно отслаивают паренхиму печени от воротной пластинки по задней поверхности левой долевой ножки и выполняют обход левой долевой ножки, затем обратным движением диссектора проводят вокруг ножки тесьму. В канал между левой долевой глиссоновой ножкой и паренхимой печени вводят браншу раскрытой кассеты аппарата, расширяя канал для проведения кассеты посредством противотяги долевой ножки за тесьму, производят аппаратное прошивание и пересечение долевой ножки. Следующим этапом накладывают турникет на устье левой печеночной вены, для чего рассекают листок брюшины между нижним краем левой печеночной вены у ее устья и аранциевым протоком, диссектором производят поочередную прецизионную отслойку паренхимы печени от ствола указанной печеночной вены с медиальной и латеральной сторон, формируя таким образом канал между тканью печени и левой печеночной веной, через который обратным движением диссектора проводят турникет вокруг левой печеночной вены. В канал между левой печеночной веной и паренхимой печени вводят браншу раскрытой кассеты аппарата, расширяя канал для проведения кассеты посредством противотяги левой печеночной вены за тесьму, производят аппаратное прошивание и пересечение левой печеночной вены. Рассекают паренхиму печени вдоль междолевой щели и выполняют левостороннюю гемигепатэктомию. Завершают гемостаз.
Клинический пример. Больная Д., 70 лет, поступила в Институт хирургии 12.11.2008 г. с диагнозом: «Метастазы рака сигмовидной кишки в левую долю печени с прорастанием в двенадцатиперстную кишку и левую долевую ножку mT4NoMo. Состояние после левосторонней гемиколэктомии, резекции 3, 5, 6, 7 сегментов печени по поводу аденокарциномы T3NoM1 в июле 2004 г. Состояние после атипичной резекции 3, 4, 5-сегментов печени, холецистэктомии 17.04.2006 г. Пароксизмальная форма фибрилляции предсердий». Больная дважды оперирована по поводу метастатического поражения печени. Во время настоящей госпитализации в результате обследования (УЗИ, СКТ, МРТ органов брюшной полости) выявлена опухоль 3 см в диаметре, расположенная в 4-ом сегменте с переходом на 3-й сегмент печени вблизи печеночных ворот. Оперирована в плановом порядке 18.11.2008 г. После лапаротомии J-разрезом и разделения сращений выявлено врастание опухоли левой доли печени в переднюю стенку двенадцатиперстной кишки. Резекция двенадцатиперстной кишки. Мобилизовали левую долю печени, выполнили холецистэктомию. Рассекли пузырную пластинку, после чего расслоили ткани по линии перехода брюшины гепатодуоденальной связки в капсулу печени по верхнему краю левой долевой ножки на 1 см вправо от левой границы 4-го сегмента печени, затем по нижнему краю левой долевой ножки сразу над аранциевым протоком, в результате чего обнажили воротную пластинку левой долевой ножки. Диссектором прецизионно отслоили паренхиму печени от воротной пластинки по задней поверхности левой долевой ножки и выполнили обход левой долевой ножки с последующим взятием на турникет левой долевой ножки обратным движением диссектора. В канал между левой долевой глиссоновой ножкой и паренхимой печени ввели браншу раскрытой кассеты аппарата, расширяя канал для проведения кассеты посредством противотяги долевой ножки за тесьму, и произвели аппаратное прошивание с последующим пересечением долевой ножки. Следующим этапом провели турникет вокруг устья левой печеночной вены, для чего вначале рассекли листок брюшины между нижним краем левой печеночной вены у ее устья и аранциевым протоком, затем диссектором прецизионно отслоили паренхиму печени от ствола левой печеночной вены поочередную с медиальной и латеральной сторон, сформировав таким образом канал между тканью печени и левой печеночной веной, через который обратным движением диссектора провели тесьму турникета. В канал между левой печеночной веной и паренхимой печени ввели браншу раскрытой кассеты аппарата, расширяя канал для проведения кассеты посредством противотяги левой печеночной вены за тесьму, и произвели аппаратное прошивание с последующим пересечением левой печеночной вены. Рассекли паренхиму печени вдоль междолевой щели и удалили левую долю печени (2, 3, 4 сегменты). Завершили гемостаз. Атравматическое выделение левой долевой ножки позволило выявить инвазию в нее опухоли и обеспечить достаточный для радикальности операции отступ от края опухоли. Время операции - 280 мин. Гепатодуоденальная связка не пережималась. Кровопотеря - 1000 мл. Из компонентов донорской крови переливалась только свежезамороженная плазма. Гладкое течение послеоперационного периода. Выписана на 17-е сутки после операции.
С применением данной методики оперировано 4 больных по поводу метастазов колоректального рака и гепатоцеллюлярного рака (группа №1). Для сравнения мы использовали группу из 13 больных с метастазами колоректального рака (группа №2).
Учитывая, что на конечный результат операции помимо указанного приема могут оказывать влияние многие другие факторы, мы провели сравнение длительности этапа выделения и разделения воротных элементов при левосторонней гемигепатэктомии. В первой группе указанный этап проводился по описанной выше методике с выделением и пересечением левой долевой ножки. Во второй группе выполнялась раздельная диссекция воротных элементов с выделением, пересечением и лигированием (ушиванием) только левых долевых структур (воротная вена, артерия, печеночных проток). Длительность этапа выделения глиссоновых ножек, их степлерного прошивания и пересечения составил в среднем 11±3 мин, в то время как средняя длительность раздельной диссекции сосудисто-секреторных элементов правой доли печени в глиссоновых воротах печени составила 24±8 мин. Разница достоверна (р<0.05). Мы не наблюдали осложнений, связанных со степлерным способом обработки глиссоновых ножек.
Длительность всей операции не отличалась в обеих группах (р=0.223) и составила в группе №1 - 283±15 мин (270-300 мин), в группе №2 - 292±57 мин в (180-390 мин). Также не получено достоверных отличий и по величине интраоперационной кровопотери (р=0.981), которая в группе №1 составила 1000±200 мл (800-1200 мл), в группе №2 - 1508±984 мл (300-4000 мл). Прием Прингла использован в 10 случаях из 13 в группе №2 и не применялся в группе №1.
В группе №2 из 13 больных живы только два пациента (15 и 46 мес. после операции). Медиана выживаемости составила 14 мес. Годичная выживаемость составила 54%, 3-летняя - 12%. В 1-ой группе сроки наблюдения составили 2-15 мес. Все пациенты живы, данных за рецидив болезни нет.
Таким образом, предлагаемый нами способ обеспечивает полную сосудистую изоляцию левой доли печени без необходимости пережатия гепатодуоденальной связки. Степлерное прошивание и пересечение глиссоновых ножек и печеночных вен в сочетании с их атравматическим выделением представляется безопасным, технически более простым по сравнению с методом раздельной диссекции воротных сосудисто-секреторных элементов, что позволяет производить этот этап операции с меньшей затратой времени. Данные преимущества позволили избежать тепловой ишемии всего органа и улучшить результаты операции.
Краткое описание чертежей
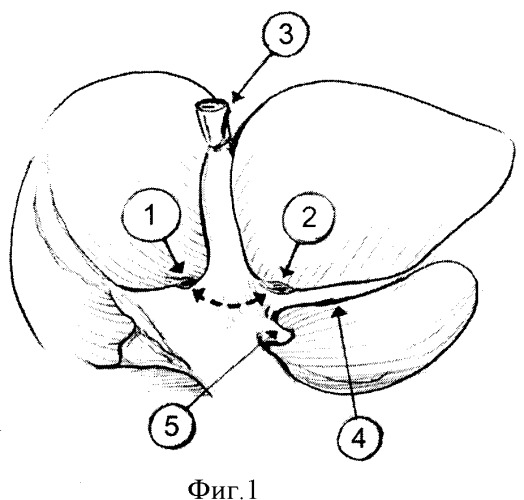
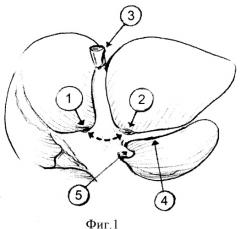
На фиг.1 изображены отверстия для циркулярного обхода левой долевой ножки. Верхнее (правое) отверстие (1) формировали по верхнему (правому) краю левой долевой ножки на 1 см вправо от левой границы 4-го сегмента печени. Нижнее (левое) отверстие (2) - по нижнему (левому) краю левой долевой ножки сразу над аранциевым протоком (4). Пунктирной линией обозначен ход формируемого канала между паренхимой печени и левой долевой ножкой. Культя круглой связки печени (3). Левая спигелева вена (5).
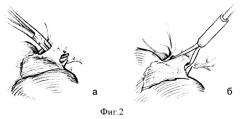
На фиг.2 изображено выделение (а) и взятие на турникет (б) общего ствола средней и левой печеночных вен.
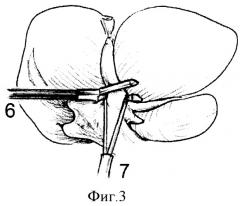
На фиг.3 изображено проведение в канал между левой долевой глиссоновой ножкой и паренхимой печени бранши раскрытой кассеты аппарата (6), которое осуществляют, расширяя канал посредством противотяги долевой ножки за тесьму (7). После проведения бранши кассеты производят аппаратное прошивание и пересечение долевой ножки.
Способ левосторонней гемигепатэктомии, включающий лапаротомию J-образным разрезом, мобилизацию левой доли печени, холецистэктомию, выделение и пересечение глиссоновых ножек, удаление левой доли печени, отличающийся тем, что для выделения глиссоновых ножек рассекают пузырную пластинку, затем расслаивают ткани по линии перехода капсулы печени в брюшину гепатодуоденальной связки вначале по верхнему (правому) краю левой долевой ножки на 1 см вправо от левой границы 4-го сегмента печени, затем по нижнему (левому) краю левой долевой ножки сразу над аранциевым протоком расслаивают капсулу печени, обнажают воротную пластинку левой долевой ножки, диссектором прецизионно отслаивают паренхиму печени от воротной пластинки по задней поверхности левой долевой ножки и выполняют обход левой долевой ножки, обратным движением диссектора проводят тесьму вокруг левой долевой ножки, в канал между левой долевой глиссоновой ножкой и паренхимой печени вводят браншу раскрытой кассеты аппарата, расширяя канал для проведения кассеты посредством противотяги долевой ножки за тесьму, производят аппаратное прошивание и пересечение долевой ножки, рассекают листок брюшины между нижним краем левой печеночной вены у ее устья и аранциевым протоком, диссектором производят поочередную прецизионную отслойку паренхимы печени от левой печеночной вены с медиальной и латеральной сторон, формируя таким образом канал между тканью печени и левой печеночной веной у ее устья, через который обратным движением диссектора проводят тесьму, в канал между левой печеночной веной и паренхимой печени вводят браншу раскрытой кассеты аппарата, расширяя канал для проведения кассеты посредством противотяги левой печеночной вены за тесьму, производят аппаратное прошивание и пересечение левой печеночной вены, выполняют левостороннюю гемигепатэктомию.